Взаимодействие аминов с металлами
Обновлено: 17.05.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Строение аминовАтом азота находится в состоянии sp 3 -гибридизации, поэтому молекула имеет форму тетраэдра. Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований. Классификация аминовПо количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины. По типу радикалов амины делят на алифатические, ароматические и смешанные. Номенклатура аминов
При наличии одинаковых радикалов используют приставки ди и три.
В этом случае аминогруппа указывается в названии приставкой амино-:
Например, N-метиланилин: Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце. Изомерия аминовДля аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов. Изомерия углеродного скелетаДля аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Изомерия положения аминогруппыДля аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Изомерия между типами аминов
Физические свойства аминовПри обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества. Первичные и вторичные амины образуют слабые межмолекулярные водородные связи: Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой. Амины также способны к образованию водородных связей с водой: Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются. Химические свойства аминовАммиак :NH3
1. Основные свойства аминов
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота: Это приводит к усилению основных свойств.
1.1. Взаимодействие с водойВ водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотамиАмины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот): При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солямиАмины способны осаждать гидроксиды тяжелых металлов из водных растворов.
2. Окисление аминовАмины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотойПервичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминовПервичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина. Особенности анилинаАнилин С6H5-NH2 – это ароматический амин.
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
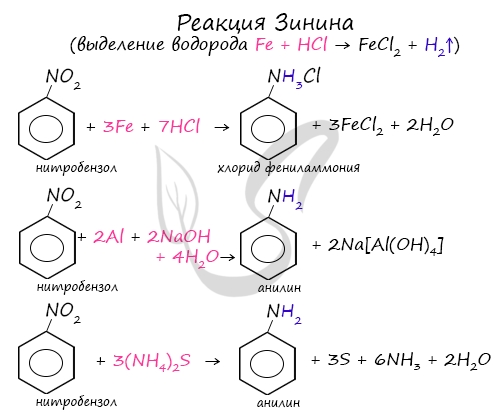
Получение аминовВосстановление нитросоединенийПервичные амины можно получить восстановлением нитросоединений.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины. Восстановлением нитробензола получают анилин.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи: Алкилирование аммиака и аминовПри взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин. Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитриловТаким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе: .Соли аминов
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей): Понравилось это:18 комментариевДобавить вашГде получение аминов , там 2) Реакция Зинина слева написано R как радикал, а справа (после равно) уже метиламин, почему метиламин справа, а слева просто R? Разве Зинин не анилин получил этим способом? Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония. Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном? Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет. Здравствуйте! Не показано взаимодействие аминов со спиртами. Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования. R3N + RCl = R4N(+)Cl(-) По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр. Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение. спасибо, отличная идея! для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть На ЕГЭ пока оптической изомерии нет. Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет. что значит «дальнейшее»? у триметиламина — и так уже нет N-H связей, может вы имели в виду протонированный триметил-амин (скажем) солянокислый, что в форме соли он останется третичным амином например до момента щелочного депротонирования(высвобождения основания амина) АминокислотыПриродные аминокислоты можно разделить на следующие основные группы: Номенклатура аминокислот
Физические свойства аминокислотАминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток. Получение аминокислот
Химические свойства аминокислот
1. Кислотно-основные свойства аминокислот
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2). 1.1. Взаимодействие с металлами и щелочамиКак кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:
По аминогруппе аминокислоты реагируют с кислотами:
2. Взаимодействие с азотистой кислотойАминокислоты способны реагировать с азотистой кислотой.
3. Взаимодействие с аминамиАминокислоты способны реагировать с аминами, образуя соли или амиды. 4. ЭтерификацияАминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
5. ДекарбоксилированиеПротекает при нагревании аминокислот с щелочами или при нагревании.
6. Межмолекулярное взаимодействие аминокислотПри взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью. 3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы. По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на Общие особенности строения аминовТакже как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра: По этой причине у аминов как и у аммиака существенно выражены основные свойства. Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания: Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н + . Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует. Химические свойства предельных аминовКак уже было сказано, амины обратимо реагируют с водой: Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований: Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств. Основные свойства предельных аминов увеличиваются в ряду. Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H + . Взаимодействие с кислотамиКак свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли: Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной: Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония: 2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например: Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином: Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов. Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота: Взаимодействие с галогеналканамиПримечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином: 1) Алкилирование аммиака галогеналканами: В случае недостатка аммиака вместо амина получается его соль: 2) Восстановление металлами (до водорода в ряду активности) в кислой среде: с последующей обработкой раствора щелочью для высвобождения свободного амина: 3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины: Химические свойства анилинаАнилин – тривиальное название аминобензола, имеющего формулу: Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной. Взаимодействие анилина с кислотамиАнилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония: Взаимодействие анилина с галогенамиКак уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина: Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений. Взаимодействие анилина с азотистой кислотойАнилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается. Реакции алкилирования анилинаС помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины: Получение анилина1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей: 2. Далее полученную соль обрабатывают щелочью для высвобождения анилина: В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности. Реакция хлорбензола с аммиаком: Химические свойства аминокислотАминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы. Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы. Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум. Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот. Кислотные свойства аминокислотОбразование солей с щелочами и карбонатами щелочных металловЭтерификация аминокислотАминокислоты могут вступать в реакцию этерификации со спиртами: Основные свойства аминокислот1. Образование солей при взаимодействии с кислотами 2. Взаимодействие с азотистой кислотой Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами 4. Взаимодействие аминокислот друг с другом Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH- При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину: Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина: Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей. Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон: Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс. Образование внутренних солей аминокислот в водном раствореВ водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов): Получение аминокислот1) Реакция хлорпроизводных карбоновых кислот с аммиаком: 2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей. АминыАмины - органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа - NH2.
Классификация аминовПо числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций. Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминовНазвания аминов формируются путем добавления суффикса "амин" к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке. Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
ПолучениеВ основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна - нейлон.
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминовКак и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет. В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент "N=C".
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ. Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Читайте также:
|