Взаимодействие аммиака с металлами
Обновлено: 19.04.2024
Урок проходит в форме обсуждения и исследования с использованием проблемного подхода на основе личностно-ориентированного обучения. Форма организации познавательной деятельности обучающихся парная и индивидуальная.
Методы работы. Диалогические, экспериментально-исследовательские.
- любознательность и интерес к химической науке, наблюдательность, логическое мышление, умение анализировать свою деятельность, делать выводы из наблюдаемых явлений, познавательные способности;
- навыки проведения химического эксперимента, исследовательские навыки,
- умения прогнозирования;
- развить умения работать с дополнительными источниками, ПК для получения и обработки информации, работать в паре.
Формирование навыков поведения обучающихся в коллективном и индивидуальном учебном труде, воспитание экологической культуры; бережного отношения к здоровью как ценности для человека, привычки соблюдать правила безопасности при проведении исследовательских работ, умение слушать сверстников.
- Правила обращения с аммиачной водой;
- правила оказания первой помощи при отравлении аммиаком;
- владеть информацией об экологических проблемах, связанных с авариями при производстве и транспортировке аммиака, и на производствах, использующих аммиак;
- уметь экспериментально распознавать аммиак;
- писать химические формулы и уравнения реакций с участием аммиака и аммиачной воды;
Оборудование: Таблица растворимости веществ, периодическая система химических элементов Д.И.Менделеева, ПК, проектор, экран, телевизор с DVD, использование мультимедиа презентаций Power Point учителя и обучающихся заранее подготовленных к уроку, набор реактивов: раствор аммиака, 25% раствор соляной кислоты, индикаторы фенолфталеин и универсальный индикатор, раствор сульфата меди (II ), раствор гидроксида натрия, раствор серной кислоты, лабораторная посуда.
ХОД УРОКА
1. Организационный момент урока. Цели и задачи урока.
2. Психологический настрой. Слово учителя.
Начиная изучение новой темы, обратимся к истории.
История произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. Как вы думаете, что это был за газ? Почему были от его действия такие последствия? Идёт обсуждение. Сегодня на уроке мы докажем, что газ аммиак не только опасный, но и необходимый.
3.1. Ученик 1. Из истории химических имён. (Приложение. Презентация слайд №3)
3.2. Учитель. Рассмотрим строение молекулы этого соединения.
Аммиак среди соединений азота является летучим водородным соединением. В свободном состоянии он нигде не встречается. Образует соли, в которых выступает в роли щелочного металла. У всех в домашних аптечках обязательно есть его водный раствор – нашатырный спирт. Его химическая формула NH3 В молекуле содержится один атом азота и три атом водорода. Рассмотрим строение атома азота. На последней оболочке у него пять валентных электронов. Схема строения атома азота выглядит так:
Электронная формула атома водорода 1S 1 .
Электронная формула атома азота имеет вид: 1S 2 2S 2 2P 3 .
У атома водорода один не спаренный электрон. Так как каждый атом стремится завершить свою последнюю оболочку для этого атому азоту необходимо принять три электрона, а атому водорода необходим ещё один электрон, поэтому между атомом азота и водорода образуется в молекуле аммиака три одинаковые ковалентные полярные связи с помощью общих электронных пар. Связи будут полярные потому, что соединяются разные атомы неметаллов, и так как атом азота более электроотрицателен, он будет сильнее к себе притягивать общие электронные пары. Будет происходить смещение электронов в сторону азота. Образование в молекуле аммиака трёх ковалентных полярных связей N - H можно посмотреть на схеме. У азота валентность – III, степень окисления равна –3. В пространстве молекула аммиака будет иметь форму пирамиды.
На атоме азота появится отрицательный заряд, а на атомах водорода положительный. Поэтому молекулы аммиака будут притягиваться друг к другу, и между ними будет устанавливаться ещё и водородная связь. Она обозначается тремя точками. (Приложение слайд №9). Присутствие водородной связи в молекуле аммиака объясняет его растворение в воде, и лёгкое сжижение этого газа. (Приложение. Презентация слайд №4-10)
Учитель: Давайте спрогнозируем свойства аммиака на основании строения его молекулы. В какие химические реакции может вступать аммиак благодаря наличию не поделённой электронной пары на атоме азота и трём КПС? В ходе обсуждения обучающиеся приходят к выводу.
Наличие не поделённой электронной пары на атоме азота и присутствие трёх полярных ковалентных связей в молекуле аммиака будет способствовать тому, что он будет вступать в реакции присоединения протона водорода Н+, то есть реагировать с водой и с растворами кислот, веществами, имеющие протоны водорода.
Исходя из низшей степени окисления атома азота (-3) аммиак будет проявлять только восстановительные свойства в окислительно-восстановительных реакциях.
3.3. Физические свойства аммиака. Определение запаха нашатырного спирта.
(Приложение №2). Ученик 2. Демонстрирует и рассказывает заранее подготовленный ученик.
(Приложение презентация слайд 12,13).
Действие аммиака на организм. Ученик №3
3.4. Учитель: Рассмотрим химические свойства аммиака по плану:
*Взаимодействие с водой. Действие водного раствора аммиака на индикаторы.
*Взаимодействие с кислотами
*Взаимодействие с нерастворимым основанием с образованием комплексной соли.
(Приложение. Презентация на слайде №14)
Ученик 3. Нашатырный спирт. Это спирт?
Нашатырный спирт назван спиртом неправильно. Его так называют в быту. Он не относится к классу спиртов, так как спирты – это органические вещества, а нашатырный спирт относится к неорганическим соединениям. Химики называют это соединение гидроксид аммония – это водный раствор газа аммиака NH3. Спирты не изменяют окраску индикаторов и не обладают щелочными свойствами.
Исследуем, как действует нашатырный спирт, то есть водный раствор аммиака на индикатор фенолфталеин и на универсальный индикатор.
Опыт №1. Делают все обучающиеся в парах. (Инструкция. Приложение №4)
О чём свидетельствует окраска индикатора? Ответ обучающихся.
Это говорит о том, что раствор нашатырного спирта обладает щелочной реакцией. На основании изученных свойств спрогнозируем применение аммиачной воды.
Применение нашатырного спирта. Ученик 4.
Нагревание раствора нашатырного спирта. Ученик 5. Демонстрация опыта(ученик заранее подготовлен).
А как будет вести себя раствор аммиака при нагревании?
При нагревании нашатырного спирта газ аммиак очень быстро улетучится и раствор обесцветится а влажная бумага фенолфталеина, поднесённая к отверстию пробирки станет малиновой.
Налить в пробирку раствор аммиака, добавить каплю фенолфталеина и нагревать на спиртовке, до появления обесцвечивания.
Разобрать, используя слайд №17 Презентации донорно-акцепторный механизм образования иона аммония.
Вывод: раствор аммиака обладает основными свойствами, которые будут проявляться в том, что в химических реакциях, аммиак будет присоединять протон водорода, а значит будет вступать в реакцию с водой и кислотами.
Посмотрим процесс растворения аммиака в воде (диск DVD Электронные уроки. “Соединения азота”. Опыт “Фонтан”).
(Приложение. Презентация. Слайд № 15-18)
Реакция аммиака с кислотами. “ Дым без огня” Химические свойства аммиака.
Ученик 6. (Ученик заранее подготовлен).
Аммиак реагирует с кислотами. Например, рассмотрим реакцию взаимодействия аммиака с соляной кислотой. При этом образуются соль, которая называется хлорид аммония, а ещё её называют нашатырь. Её формула NH4Cl. Этот опыт называется дым без огня. Как известно дыма без огня не бывает, но только не в химии. Если смочить две стеклянные палочки, одну раствором аммиака, а другую концентрированной соляной кислотой НCl, то появится белый дым, образованный солью хлоридом аммония, или нашатырём.
Нашатырь представляет из себя твёрдое белое кристаллическое вещество, которое применяется при паянии для очистки поверхности металлов от оксидной плёнки и хорошо пристаёт припой.
Запишем уравнение этой реакции: (Приложение. Презентация. Слайд19)
Взаимодействие аммиака с кислотами. Ученик 7. (Приложение. Презентация. Слайд19)
Аммиак легко реагирует не только с соляной кислотой (ученик подготовлен заранее).
Давайте проверим, а будет ли реагировать аммиак с разбавленной серной кислотой. Проделаем вместе такой опыт. Налить в пробирку 1 мл нашатырного спирта, который является водным раствором аммиака и добавим фенолфталеин. Произойдет окрашивание раствора в малиновый цвет, который говорит о том, что аммиак обладает щелочными свойствами, а теперь прильём раствор серной кислоты, формула которой H2SO4.
Раствор обесцвечивается. Это говорит о том, что произошла химическая реакция, образовалась соль аммиака, которая называется сульфат аммония. Запишем уравнение реакции:
Итак можно сделать вывод, что раствор аммиака, называемый аммиачной водой, проявляет свойства неорганических оснований, реагируя с кислотами с образованием солей, образуя ион аммония NH4 + . Этот ион ведет себя подобно иону металлов и стоит в таблице растворимости вместе с ионами металлов.
Вывод: Растворение аммиака в воде и в кислотах – процесс химический, в основе которого лежит способность молекул аммиака связывать ионы водорода. Причина этого – наличие у атома азота свободной электронной пары, которая “перетягивает” протон водорода из молекул воды и кислоты.
Рассмотрим окислительно-восстановительные реакции аммиака.
Реакции окисления аммиака могут протекать двумя способами:
1. В отсутствии катализатора.
2. В присутствии катализатора
Вывод: Аммиак не горит на воздухе, но в чистом кислороде или в присутствии катализатора аммиак хорошо окисляется.
Как хороший восстановитель взаимодействует с оксидом меди. (Составить дома уравнение).
Учитель. (Приложение №4, презентация слайд №22). Будет ли реагировать водный раствор аммиака с нерастворимым основанием. Выполняем задание №4 с Инструкции. Водный раствор аммиака может образовать окрашенное соединение, которое является комплексной солью.
Запишем уравнение химической реакции. Смотрим слайд №22.
В эту реакцию аммиак вступает за счёт того, что у атома азота есть не поделённая электронная пара. Эта реакция является особенной, так как основание с основанием не должно реагировать.
Способы получения аммиака в лаборатории и в промышленности . (см Презентацию слайд №23,24).
3.5. Просмотр диска DVD запись, выполнения эксперимента получения аммиака в лаборатории обучающимися старших классов на занятиях химического кружка “Химик-теоретик и практик”. Получение аммиака в промышленности обучающиеся изучают самостоятельно дома.
На основании изученных свойств спрогнозируем применение аммиака и его водного раствора.
3.6. Применение аммиака. Ученик 8. (Приложение к уроку№5. Презентация. Слайд №25-27).
Аммиак в медицине. Ученик 9. (Приложение к уроку №6)
4. Закрепление знаний. Что узнали? (На столах карточки с двумя уровнями заданий.)
Обучающиеся отвечают сразу на карточках, выбирая свой уровень.
1) Аммиак ____________ растворяется в воде.
2) Раствор аммиака в воде называют ___________ водой или ___________ спиртом.
3) Под действием аммиака влажная фенолфталеиновая бумажка меняет свою окраску на ________________.
4) При взаимодействии аммиака с концентрированной соляной кислотой образуется вещество в виде клубов белого дыма, называемого _______________.
5) Аммиак в реакциях проявляет ______________ свойства.
6) На каких свойствах аммиака основаны методы борьбы с его утечкой?
7) На каких свойствах аммиака основано его применение в медицине, в холодильных установках?
1)Молекула аммиака имеет неподелённую электронную пару:
А. Одну. Б. Две. В. Три. Г. Пять.
2) Какое вещество является восстановителем в реакции
А. Аммиак Б. Кислород В. Азот Г. Вода
3) Аммиак не взаимодействует с:
А. Серной кислотой Б. Соляной кислотой В. Гидроксидом натрия Г. Водой
4) Установите соответствие:
| Свойства азота | Химические уравнения реакций |
| 1. Реакции, связанные с изменением степени окисления азота. | А. NH3 + H2O NH4OH Б. 2NH3 N2 + 3H2 В. 4NH3 + 3O2 = 2N2 +6H2O Г. NH3 + HCl = NH4Cl |
| 2. Реакции, связанные с образованием ковалентной связи по донорно-акцепторному механизму. |
5) Составить уравнение химической реакции аммиака с азотной кислотой HNO3.
6) Почему окрашенная в аммиаке фенолфталеиновая бумажка со временем обесцвечивается? Составьте соответствующие уравнения реакций.
Карточки сдаются учителю.
5. Рефлексия.
Составление синквейна. Обучающиеся зачитывают несколько синквейнов про аммиак.
Аммиак какой из каждого пункта плана изучения темы 5 слов или определений.
Аммиак: получение и свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:

Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :

У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:

Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:

Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония: получение и химические свойства
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Аммиак. Отгаданные загадки
Будет ли аммиак реагировать с металлами? У атома азота в этом соединении формально восемь внешних электронов (пять своих и три оттянуты от атомов водорода), а металлы стремятся свои валентные электроны отдать. С одной стороны, атому азота уже некуда их принять. С другой – в аммиаке есть атомы водорода, частично обедненные электронами, т. е. имеющие возможность принять их.
Известно, что активные металлы вытесняют водород из воды, а чем аммиак хуже? Ну только разве тем, что аммиак газообразен при температурах выше его точки кипения, равной –33,4 °С. Соответственно газ NH3 рассредоточен в пространстве, и требуется дополнительный подогрев, чтобы реакция пошла. Именно накаливанием металлов в атмосфере аммиака чаще всего и получают нитриды. (Нитриды – это соединения, состоящие из двух элементов, один из которых азот, причем атомы азота имеют в этом соединении отрицательный заряд.) Например:
2. Реакции с неметаллами.
Формальная степень окисления азота в аммиаке –3. Следовательно, аммиак может реагировать с кислородом (и другими окислителями!), увеличивая при этом степень окисления азота, т. е. отдавая электроны. Однако на пути к положительным степеням окисления находится нулевая – простое вещество азот, как мы уже выяснили, необычайно устойчиво.
Можно предположить, что при реакции аммиака с кислородом будут образовываться азот и вода. Именно так и происходит в действительности. Следует добавить, что аммиак горит только в чистом кислороде, а не на воздухе:
Как быть, если надо получить из аммиака оксиды азота? Вспомним о катализаторах – веществах, которые ускоряют реакцию или меняют ее направление. Катализаторы используют и при получении оксидов азота из аммиака и кислорода. Реакцию каталитического окисления проводят на металлической платине:
Интересна реакция аммиака с другим простым веществом – озоном, более агрессивным окислителем, чем кислород. Озон переводит азот из степени окисления –3 в степень окисления +5. Но не весь! В результате получается нитрат аммония:
3. Реакция с водой.
Мы уже говорили о хорошей растворимости аммиака в воде. Но почему фенолфталеин становится в таком растворе малиновым? Загадка?
Попробуем разобраться, откуда появилась в растворе щелочная среда. Для начала вспомним теорию электролитической диссоциации. В водных растворах все ионы и молекулы гидратированы – окружены «шубой» из молекул воды, сориентированных соответствующим образом: к атомам водорода потянулись «кислородные половинки», а к атому азота – «водородная половинка» (рис. 5).
Рис. 5. Аммиак в воде:
атом азота – черный шар; атомы кислорода – большие белые шары; атомы водорода – малые белые шары
В какой-то момент образовалась конструкция Н3N•••НОН. Далее, известно, что вода слабо, но диссоциирует по реакции:
Поскольку электроотрицательность кислорода больше, чем азота, связь кислорода с водородом полярнее, чем связь азота с водородом. Можно предположить, что равновесие в реакции диссоциации гидратированной молекулы аммиака будет больше смещено в сторону образования ионов (по сравнению с водой):
В растворе появляется весьма ощутимый избыток ионов ОН – , и фенолфталеин сигнализирует об этом малиновой окраской. Стоит подчеркнуть, что все эти реакции обратимые. Поэтому вместе со щелочной реакцией среды (правая часть уравнения) растворы аммиака обладают еще и характерным запахом аммиака, выделяющегося из раствора (левая часть уравнения), и заметным количеством нестойкого гидратированного молекулярного аммиака (это подтверждается, например, реакциями образования аммиачных комплексов с ионами металлов).
4. Реакции с кислотами.
Как слабое, но все же основание, водный раствор аммиака реагирует с кислотами с образованием соли и воды:
Соли аммония, подобно солям натрия и калия, хорошо растворяются в воде, но при этом частично гидролизуются:
С кислотами реагирует и газообразный аммиак, причем не только с растворами, но и с газообразными кислотами. В лабораториях, в которых работают с растворами соляной кислоты и аммиака, постоянно появляется белый налет на окружающих предметах. Даже небольших количеств аммиака и хлороводорода в воздухе достаточно для протекания реакции:
5. Реакции со щелочами.
Газообразный аммиак со щелочами не реагирует. А вот водный раствор аммиака «откликается» на добавление щелочи. Поскольку при растворении аммиака в воде протекает обратимая реакция образования иона аммония и гидроксид-иона, то добавление последнего в раствор смещает равновесие, растворимость аммиака уменьшается (а интенсивность запаха соответственно увеличивается):
NН4OH + NaOH = NH3 + H2O + NaOH.
Физические свойства аммиака в цифрах
Молярная масса M(NH3) = 17 г/моль. Температура плавления равна –78 °C, температура кипения –33 °С. Плотность газообразного аммиака при нормальных условиях (0 °С, 1 атм) 0,771 г/л (аммиак легче воздуха почти в два раза). Растворимость при атмосферном давлении и 0 °С около 90 л (!) газа в 100 г воды, при 20 °С – 65 л в 100 г воды.
При сравнении физических свойств аммиака и азота в первую очередь обращает на себя внимание температура кипения. Почему у аммиака она настолько выше? У азота – почти –200 °С, а у аммиака – только –33 °С. Загадка? Попробуем отгадать.
Для начала сопоставим температуры кипения соединений с водородом элементов V, VI и VII групп главных подгрупп периодической системы (рис. 6).
Рис. 6. Графики зависимости температур кипения
водородных соединений элементов V( · ), VI( C )и VII( Д ) групп
главных подгрупп от номера периода (массы атома)
Если экстраполировать графики такой зависимости, можно оценить, какими должны бы быть эти температуры, исходя из общей закономерности. Из графика видно, что аммиак, вода и фтороводород имеют аномально высокие температуры кипения: аммиак – примерно на 50 °С выше «теоретической», фтороводород – на 100 °С, а вода – на 160 °С. Во-первых, видно, что аммиак не одинок, а во-вторых, вспоминается, что у азота, кислорода и фтора самая высокая электроотрицательность. Значит, и связи этих элементов с водородом самые полярные. Водород в таких соединениях почти без электрона и поэтому сильно притягивается к неподеленным парам электронов, которые есть и у азота, и у кислорода, и у фтора. Образуются водородные связи. Они, конечно, слабее обычных ковалентных связей, но их много. И это «много» многое значит.
Водородные связи играют в природе огромную роль. Например, спираль из двух молекул ДНК образуется только за счет водородных связей. Такие связи сравнительно легко разрываются, когда происходит считывание информации с определенного участка ДНК. Когда водородных связей много, получается крепкое связывание в целом.
В заключение стоит сказать, что связь водорода с фтором полярнее, чем связь азота с водородом, и соответственно притяжение сильнее, а температура кипения HF выше, чем NH3. У воды же самая высокая температура кипения из этой троицы, потому что молекулы воды образуют водородные связи сразу «двумя руками» – две неподеленные пары электронов и два атома водорода в каждой молекуле! Аммиак и фтороводород по своему строению «однорукие».
Химические свойства аммиака (дополнение)
Аммиак сам по себе устойчив и разлагается только при очень высоких температурах. Но если проводить нагревание в присутствии обыкновенного железа, он разлагается на азот и водород при значительно более низких температурах. Интересно, что при каталитическом разложении небольшая часть аммиака всегда остается в смеси газов, независимо от времени и температуры проведения реакции. Именно этот факт подсказал ученым мысль о возможности связывания атмосферного азота через аммиак. Действительно, логично предположить, что разложение аммиака – процесс обратимый, тогда изменением условий и подбором катализатора можно сместить процесс в сторону образования аммиака до такой степени, что это станет выгодно для его промышленного получения.
Еще немного о реакциях аммиака с простыми веществами. Интересны реакции аммиака с галогенами. Йод не может изменить степень окисления азота! Он просто сам диспропорционирует:
Нитрид йода (по названию понятно, что у йода в этом соединении степень окисления положительная), или иначе йодистый азот, в сухом виде разлагается со взрывом даже от простого сотрясения.
Бром и хлор могут отнять у азота только по три электрона, переведя в простое вещество. И только фтору под силу перевалить через эту сверхустойчивую нулевую степень окисления азота. Получается трифторид. И это максимально возможный, просто потому, что у атомов второго периода нет «запасных» орбиталей. Не бывает поэтому и пятивалентного азота!
Жидкий аммиак – хороший растворитель. Реакции в жидком аммиаке идут по тем же законам, что и в воде, а вот растворимость в воде и в жидком аммиаке у соединений различная. Например, реакция
в воде идет в сторону образования нерастворимого бромида серебра, а в жидком аммиаке – в сторону образования нерастворимого бромида бария.
Из жидкого аммиака, как и из воды, активные металлы вытесняют водород. Например, реакция с цезием протекает за несколько минут:
А вот аналогичная реакция с натрием протекает значительно дольше. При этом образуется сольватированный электрон! (Сольватация – процесс, аналогичный гидратации, только в других растворителях.)
Экологические свойства аммиака
Аммиак – активное и «едкое» соединение (едкость кислот и щелочей проявляется в том, что большие количества ионов Н + или ОН – разъедают живую ткань растений, животных и, естественно, человека; впрочем, неживую «ткань» они тоже разъедают). Однако если заменить в аммиаке один, два или все три атома водорода на органические радикалы, то «едкость» существенно снижается, а основные свойства остаются. Такие соединения выполняют в живой природе функции оснований.
Животные и человек используют уже приготовленные растениями азотсодержащие органические соединения, поэтому для нас с вами аммиак, безусловно, яд. При попадании на кожу концентрированный раствор аммиака вызывает химические ожоги, при вдыхании большого количества аммиака может наступить отек легких – реакция организма на вдыхание почти всех едких веществ.
Однако, как и многие другие яды, в малых дозах аммиак оказывает положительное влияние на организм: 10%-й раствор аммиака в воде используют в медицине для стимуляции дыхания (его не пьют, конечно, а просто дают понюхать), центральной нервной системы и т. п.
В больших количествах аммиак вреден и для растений. Но в небольших количествах он им необходим. Ведь без азота, и в частности без аммиака, не построить те органические соединения, которые потом превращаются в растительные белки, а в дальнейшем – в белки животных. Большим количествам газообразного аммиака растения противостоят по-разному. Некоторые стараются прекратить ему доступ внутрь (например, закрывают устьица на листьях). Другие растения перерабатывают аммиак с помощью соответствующих ферментов в нитрат-ионы, которые для растений не ядовиты, тем самым запасая ценный для своего развития элемент.
Химические свойства аммиака
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков.
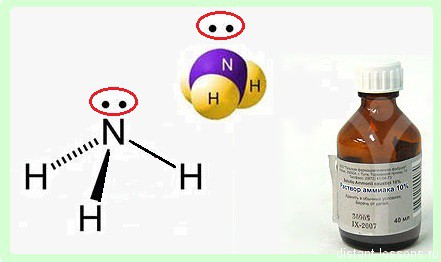
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи
В больших количествах токсичен для человека.
Интересными химическими свойствами молекула аммиака обязана атому азота — p-элемент элемент 2-го периода V группы периодической системы имеет на внешнем энергетическом уровне 5 электронов.
На 3 ковалентных связи с водородом расходуются 3 электрона. 2 остаются. Эти 2 неспаренных электрона образуют неподеленную электронную пару.
Именно эта свободная неподеленная пара электронов определяет многие химические свойства аммиака.
— у аммиака есть неподеленная электронная пара, а у иона водорода есть абсолютно свободная орбиталь;
- молекула аммиака полярна — отрицательный заряд двух электронов и положительный — от трех водородов, поэтому вещество хорошо растворимо в воде, более того, водный раствор аммиака — широко известный «нашатырный спирт» — жидкость с очень характерным запахом
Формулу такого раствора часто записывают вот в таком виде:
NH4OH — гидроксид аммония. Т.к. азот притягивает к себе водород из воды, то по химическим свойствам аммиак — слабое основание, т.е. очень слабо диссоциирует на NH4 + (ион аммония) и OH — — гидроксид-ион.
- соответственно, водород «любит» все, что содержит водород, например, кислоты:
NH3 + HСl → NH4Cl — хлорид аммония
- к химическим свойствам аммиака относится и вытеснение металлов из водных растворов солей:
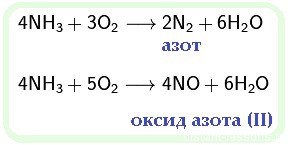
- к химическим свойствам аммиака относятся и реакции окисления:
(аммиак окисляется до азота)
В чистом кислороде он сгорает бледно-желтым пламенем:
- аммиак не восстанавливается, т.к. атом азота находится в низшей (№ группы-8) степени окисления;
Качественные реакции на аммиак:
- изменение окраски индикатора в водном растворе аммиака (щелочная среда):
лакмус — становится синим,
фенолфталеин — малиновым,
метиловый-оранжевый — желтым;
- если к пробирке с раствором NH3 (NH3•H2O или NH4OH) поднести палочку, смоченную в концентрированной соляной кислоте HCl – будет выделяться видимый белый дым – образуется хлорид аммония (NH4Cl);

Свойства солей аммония:
- кристаллическая решетка;
- в растворе диссоциируют:
- подвергаются гидролизу с образованием кислой среды:
гидролиз по катиону:
гидролиз по катиону и аниону:
- свойства солей аммония соответствуют свойствам всех других солей — взаимодействие с основаниями, другими солями и кислотами. Главные условия протекания таких реакций до конца — образование газа, осадка или малодиссоциирующего вещества;
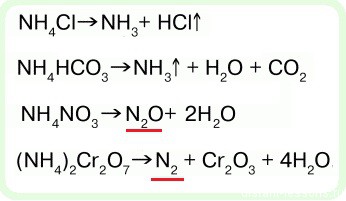
- важное химическое свойство солей аммония — разложение при нагревании:
Последняя реакция — разложение бихромата аммония часто используется в заданиях С3 ЕГЭ по химии (химический эксперимент), так что стоит ее выучить.
Химические свойства аммиака обусловлены строением молекулы, т.е. электронной конфигурацией атома азота. Т.к. в заданиях ГИА и ЕГЭ уделяется много внимания как самому аммиаку, так и его соединениям, то эту тему надо знать хорошо.
Читайте также:
