Взаимодействие атомов металлов между собой
Обновлено: 16.05.2024
МЕТАЛЛЫ (от греч. metallon-первоначально, шахта, копи), в-ва, обладающие в обычных условиях характерными, металлическими, свойствами-высокими электрич. проводимостью и теплопроводностью, отрицат. температурным коэф. электрич. проводимости, способностью хорошо отражать световые волны (блеск), пластичностью. К металлам относятся как собственно металлы (простые в-ва), так и их сплавы, металлические соединения, в т.ч. интерметаллиды. Иногда металлами наз. все в-ва, обладающие теми или иными металлич. св-вами, напр. т. наз. "синтетические" металлы (см. Интеркалаты), металлы органические.
Ранее характерными признаками металлов считались блеск, пластичность и ковкость - "светлое тело, которое ковать можно" (М. В. Ломоносов). Но металлич. блеском обладают и нек-рые неметаллы, напр. иод. Известны хрупкие металлы, хотя мн. из них в результате тщательной очистки получены в пластичном состоянии. В настоящее время важнейшим признаком металлов признается отрицат. температурный коэф. электрич. проводимости, т.е. понижение электрич. проводимости с ростом т-ры. Из 109 элементов в периодич. системе 86 относят к металлам. Граница между металлами и неметаллами в периодич. таблице (в ее длинном варианте) проводится по диагонали от В до At. О нек-рых элементах, напр. Ge, Sb, нет единого мнения, все же правильнее считать Ge неметаллом, т.к. он обладает полупроводниковыми св-вами, a Sb-металлом, хотя по физ. св-вам сурьма -полуметалл.
Олово существует как в металлической (b-Sn), в полупроводниковой (a-Sn) модификации. С др. стороны, у Ge, Si, P и нек-рых др. неметаллов при высоких давлениях обнаружены модификации с металлич. проводимостью. Можно предположить, что при достаточно высоких давлениях все в-ва могут приобретать металлич. св-ва. Поэтому вопрос об отнесении того или иного элемента к металлам или неметаллам следует, по-видимому, решать на основании рассмотрения не только физ. св-в простого в-ва, но и его хим. св-в. Иногда для элементов, лежащих на границе между металлами и неметаллами, применяют термин "полуметаллы", хотя этот термин в химии теперь не рекомендуется.
В металлах существует металлическая связь, характеризующаяся тем, что кристаллич. решетка образована положит. ионами, тогда как валентные электроны делокализованы по всему пространству решетки. Металлы можно представить в виде остова из положит. ионов, погруженного в "электронный газ", к-рый компенсирует силы взаимного отталкивания положит. ионов. Энергия этих делокализованных электронов-электронов проводимости - отвечает зоне проводимости. Согласно зонной теории, у металлов отсутствует запрещенная зона между валентной зоной и зоной проводимости (см. Твердое тело).
В кристаллах металлов атомы ионизированы лишь частично и часть валентных электронов остается связанной, в результате возможно появление частично ковалентных связей между соседними атомами. Прочность связи в кристаллич. структуре металлов характеризуется энтальпией атомизации, к-рая меняется от 61,4 кДж/молъ у Hg до 850 кДж/моль у W. Макс. энтальпия атомизации характерна для металлов рядов Nb-Ru и Hf-Ir. Относящиеся к ним металлы отличаются макс. т-рами плавления и высокой мех. прочностью.
Классификация металлов.Все металлы делятся на четыре группы (см. форзац): s-металлы (все s-элементы, кроме Н и Не), р-металлы (элементы гр. IIIа, кроме В, а также Sn, Рb, Sb, Bi, Ро), d-металлы и f-металлы, к-рые объединяются под назв. "переходных" (см. Переходные элементы). Металлы первых двух групп иногда наз. "простыми". Из этих групп выделяются нек-рые более узкие группы: из s-металлов- щелочные металлы и щелочноземельные элементы, из d-металлов- платиновые металлы. Группа редкоземельных элементов включает как d-, так и f-металлы (подгруппа Sc и лантаноиды).
Существует также, хотя и не общепринятая, техн. классификация металлов. В известной мере она перекликается с геохимическими классификациями элементов. Обычно выделяют след. группы: черные металлы (Fe); тяжелые цветные металлы - Сu, Pb, Zn, Ni и Sn (к этой группе примыкают т.наз. малые, или младшие, металлы - Со, Sb, Bi, Hg, Cd, нек-рые из них иногда относят к редким металлам); легкие металлы (с плотностью менее 5 г/см 3 )-Аl, Mg, Ca и т.д.; драгоценные металлы-Au, Ag и платиновые металлы; легирующие (или ферросплавные) металлы - Mn, Cr, W, Mo, Nb, V и др.; редкие металлы (см. Редкие элементы), разбиваемые в свою очередь на неск. групп; радиоактивные металлы-U, Th, Pu и др.
Кристаллическая структура.Большинство металлов кристаллизуется в одном из трех структурных типов (см. Металлические кристаллы), а именно-в кубич. и гексагoн. плот-нейших упаковках (см. Плотная упаковка)или в объем-ноцентрированной кубич. решетке. В плотнейших упаковках каждый атом на равных расстояниях имеет 12 ближайших соседей. В объемноцентрированной кубич. решетке у каждого атома 8 равноудаленных соседей, еще 6 соседей расположены на большем (на 15%) расстоянии. Поэтому ко-ординац. число в этой структуре считают равным 14 (8 + 6). Межатомные расстояния в кристаллич. структуре металлов характеризуются металлич. радиусом (см. Атомные радиусы).
При обычных условиях щелочные металлы, а также Ва, Ra, элементы подгрупп V и Сr кристаллизуются в объемно-центрированной кубич. решетке типа a-Fe. Плотнейшая кубич. упаковка (гранецентрированная кубич. решетка) типа Си характерна для Al, Ni, металлов подгруппы Сu, платиновых металлов (кроме Ru и Os) и т. д. В гексагoн. плотнейшей упаковке типа Mg кристаллизуются Be, Са, Sr, Zn, Cd, Co, Ru, Os, элементы подгрупп Ti и Sc, мн. РЗЭ. Более сложными являются структуры разл. модификаций Мn, Ра, U, трансурановых элементов.
Многие металлы претерпевают при изменении т-ры или давления полиморфные превращения. Металлы, к-рые при низких т-рах образуют плотнейшие упаковки, напр. Са, La, Zr,часто имеют высокотемпературные модификации с объемноцентрированной кубич. структурой.
При плавлении металлы сохраняют свои электрич., тепловые и оптич. св-ва. Вблизи т-ры плавления в жидких металлах наблюдается примерно такой же ближний порядок, как и в кристаллических металлах. С повышением т-ры ближний порядок нарушается вплоть до полного разупорядочения.
Физические свойства.Физ. св-ва металлов меняются в очень широких пределах. Так, т-ра плавления изменяется от - 38,87 °С (Hg) до 3380 °С (W), плотность - от 0,531 г/см 3 (Li) до 22,5 г/см 3 (Os). Уд. электрич. сопротивление р при 25 °С имеет значения от 1,63 (Ag) до 140 (Мn) мкОм . см. Сопротивление движению электронов (рассеяние электронов) возникает вследствие нарушения кристаллич. решетки из-за теплового движения атомов, а также дефектов (вакансий, дислокаций, примесных атомов). Мерой его является длина своб. пробега электрона. При комнатной т-ре она равна ~ 10 -6 см у металлов обычной чистоты и ~ 10 -2 см у высокочистых. Температурный коэф. р (в интервале 0-100°С) меняется в пределах 1,0 . 10 -3 (Hg)-9,0 . 10 -3 К -1 (Be). При гелиевых т-рах (4,2 К) р практически не зависит от т-ры (rост). Его измерение используют для характеристики чистоты и совершенства кристаллов металла. Чем больше отношение r273/r4,2, тем чище металл. В монокристаллах высокой чистоты оно достигает 10 4 -10 5 . Нек-рые металлы при низких т-рах становятся сверхпроводниками, при этом критич. т-ра у чистых металлов от сотых долей до 9 К.
У металлов наблюдается термоэлектронная эмиссия (способность испускать электроны при высокой т-ре). Эмиссия электронов возникает также под действием электромагн. излучения в видимой и УФ областях спектра (фотоэлектронная эмиссия), внеш. электрич. поля высокой напряженности (туннельная, или автоэлектронная, эмиссия), при бомбардировке пов-сти металлов электронами (вторичная электронная эмиссия) или ионами (ионно-электронная эмиссия), при взаимод. пов-сти металла с плазмой (взрывная электронная эмиссия). Перепад т-ры вызывает в металлах появление электрич. тока (термоэдс).
Теплопроводность металлов обусловлена в осн. движением электронов, поэтому уд. коэф. теплопроводности ( /(s•Т) = L = 2,45•10 -8 Вт•Ом/К 2 (закон Видемана-Франца). Уд. коэф. теплопроводности металлов имеет значения от 425 (для Ag) до 8,41 (для Bi) Вт/(м-К).
Температурный коэф. линейного расширения металлов в интервале 0-100°С имеет значения от 4,57 . 10 -6 (для Os) до 10 -4 K -1 (для Sr). Согласно эмпирич. правилу Грюнайзена, относит. увеличение объема металла в интервале от О К до т-ры плавления приблизительно равно 0,06. Поэтому температурный коэф. объемного расширения у тугоплавких металлов меньше, чем у легкоплавких.
У большинства металлов магн. восприимчивость по абс. величине сравнительно мала (~ 10 -9 ) и слабо зависит от т-ры. Среди металлов есть диамагнетики, напр. Bi (Излучения оптич. диапазона почти полностью отражаются пов-стью металлов, вследствие чего они непрозрачны и обладают характерным металлическим блеском (порошки мн. металлов матовые). Нек-рые металлы, например Аu в виде тонкой фольги, просвечивают. Отраженный от поверхности металлов плоскополяризованный свет становится эллиптически поляризованным.
Для использования металлов в качестве конструкц. материалов важнейшее значение имеет сочетание мех. св-в - пластичности и вязкости с значит. прочностью, твердостью и упругостью. Эти св-ва зависят не только от состава (чистоты металла), но и от совершенства кристаллич. решетки (наличия дефектов) и структуры, определяемых предварительной термич. и мех. обработкой образца.
Мех. св-ва реальных металлов определяются наличием дефектов, в первую очередь дислокаций, т. к. перемещение дислокаций по плоскостям кристаллич. решетки с наиб. плотной упаковкой является осн. механизмом пластич. деформации металлов. Взаимод. дислокаций с др. дефектами увеличивает сопротивление пластич. деформации. В процессе деформации число дислокаций растет, соотв. растет и сопротивление деформации (деформац. упрочнение, или наклеп). Напряженное состояние и наклеп после деформации ликвидируются при отжиге. Рост напряжений в местах "сгущения" дислокаций вызывает зарождение трещин - очагов разрушения. Важнейшая характеристика мех. св-в металлов-модуль упругости Е (модуль Юнга). Предел текучести, т. е. сопротивление пластич. деформации, 10 -3 -10 -4 Е.
Химические свойства.Металлы обладают низкими значениями первого потенциала ионизации и сродства к электрону. Вследствие этого в хим. р-циях они выступают как доноры электронов (восстановители), а в соед. и их р-рах образуют положительно заряженные ионы (в большинстве случаев аквакатионы). Электроотрицательности атомов металлов ниже электроотрицательностей атомов неметаллов. Металлы могут входить в состав сложных анионов, напр. МnО - 4, или ацидокомплексов, напр. [Fe(CN)6] 4- , однако в них атомы металлов всегда являются центрами положит. заряда. Только для нек-рых металлов, находящихся на границе с неметаллами, таких, как Sn, Po, Sb и т.п., известны соед., напр. гидриды, в к-рых металлы имеют формально отрицат. степень окисления. Но во всех этих соед. хим. связь ковалентная.
Способность металлов к окислению меняется в очень широких пределах. Большинство металлов окисляется кислородом воздуха уже при обычной т-ре, однако скорость и механизм р-ции очень сильно зависят от природы металлов. В большинстве случаев при этом образуются оксиды, а у щелочных металлов, кроме Li,-пepоксиды. Устойчивость металлов на воздухе определяется св-вами образующегося оксида, в частности отношением молярных объемов Vокс/VM.. Если Vокс/VМ > 1, на металлах образуется защитная пленка, предохраняющая металлы от дальнейшего окисления. Такая пленка характерна, напр., для Al, Ti, Сr, к-рые устойчивы на воздухе, хотя и обладают высокой активностью. Металлы, для к-рых это отношение меньше 1 (напр., щелочные), на воздухе неустойчивы.
С N2 реагирует ряд металлов, напр. Li при обычной т-ре , a Mg, Zr, Hf, Ti-при нагревании. Мн. металлы активно взаимод. с Н2, галогенами, халькогенами. Все металлы, чьи стандартные электродные потенциалы отрицательнее, чем —0,413 В, окисляются водой с выделением Н2. Щелочные и щел.-зем. металлы реагируют с водой при обычных т-рах, а такие металлы, как Zn или Fe, реагируют с водяным паром при высоких т-рах. С р-рами щелочей взаимод. металлы, образующие р-римые анионные гидроксокомплексы (Be, Zn, Al, Ga, Sn).
Большинство металлов окисляется теми или иными к-тами. Металлы, имеющие отрицат. стандартные электродные потенциалы, т.е. стоящие в электрохимическом ряду напряжений до водорода, окисляются ионами Н + и растворяются поэтому при действии неокисляющих к-т (соляная или разб. H2SO4), если не образуются нер-римые продукты. Р-ции способствует образование анионных комплексов. Азотная к-та, даже разбавленная, окисляет мн. металлы. При этом, если ионы металлов устойчивы в низших степенях окисления, образуются ка-тионные комплексы, если в высших, как в случае, напр., Re,-анионные (ReO - 4 ). Нек-рые металлы реагируют с разб. HNO3 и H2SO4 с образованием катионных комплексов и пас-сивируются в конц. р-рах этих к-т. Для растворения малоактивных металлв, напр. Аu или Pt, используют смеси, содержащие окислитель и поставщик лигандов для образования р-римых комплексов, таких, как, напр., царская водка или смесь HNO3 с HF.
О взаимод, металлов со средой, ведущем к разрушению металлов, см. в ст. Коррозия металлов.
Важная характеристика металлич. элементов-их способность образовывать основные оксиды и соотв. гидроксиды. У металлов главных подгрупп периодич. системы основность оксидов и гидроксидов растет сверху вниз, в побочных подгруппах (кроме I - III) - обратная зависимость. По периодам и рядам с ростом порядкового номера элемента основность убывает. У металлов, имеющих неск. степеней окисления, как d- и f-металлы, с ростом степени окисления основность оксидов уменьшается и высшие оксиды имеют кислотный характер.
Получение металлов.Извлечение металлов из прир. сырья и др. источников - область металлургии. Можно отметить двоякий характер технологии металлов. Технология железа, тяжелых цветных металлов, а также малых металлов и большинства рассеянных элементов (халькофильных элементов) имеет "металлур-гич." характер. Это означает, что конечный продукт получают без предварит. выделения к.-л. чистого соединения, что обусловлено сравнит. легкостью восстановления до металлов как пирометаллургич. (см. Пирометаллургия), так и гидроме-таллургич. (электролиз р-ров, цементация и т.п.; см. Гидрометаллургия)путем.
Иной характер имеет технология легких, а также редких металлы (литофильных элементов). Это связано с трудностями их получения в своб. состоянии. Для этих металлов технология разбивается четко на два этапа - получение чистого соед., напр. Аl2О3, и получение металла из этого соединения. Сами металлы в произ-ве их соед. обычно не используют. Поэтому можно сказать, что технология этих металлов имеет более "химический" характер.
Способность металлов к взаимному растворению с образованием при кристаллизации твердых растворов и интерметал-лидов, разнообразным фазовым превращениям дает возможность получения большого числа сплавов, отличающихся разл. структурой и самыми разнообразными сочетаниями св-в. В совр. технике применяют св. 30 000 разл. сплавов - легкоплавких и тугоплавких, очень твердых и пластичных, с большой и малой электрич. проводимостью, ферромагнитных и др. В сплавах ныне используют практически все известные металлы (кроме искусственно полученных трансплутониевых элементов). Мера использования в значит. степени определяется доступностью металла-содержанием в земной коре, а также степенью концентрирования в месторождениях и трудностью получения. Использование сплавов (бронзовый век) было одним из важнейших этапов становления человеческой цивилизации. И в настоящее время сплавы-важнейшие конструкционные материалы. В последние годы наблюдается тенденция нек-рого снижения роли железа и увеличение использования легких металлов (Al, Mg) и наиб. доступных редких металлов (Ti, Nb, Zr).
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ, хим. связь, обусловленная взаимод. электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентными электронами металла зон энергетич. уровней (см. Твердое тело), наз. зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать металлическая связь можно только в рамках квантовой механики, качественно образование металлической связи можно понять исходя из представлений о ковалентной связи.
При сближении двух атомов металла, напр. Li, образуется ковалентная связь, при этом происходит расщепление каждого энергетич. уровня валентного электрона на два. Когда N атомов Li образуют кристаллич. решетку, перекрывание электронных облаков соседних атомов приводит к тому, что каждый энергетич. уровень валентного электрона расщепляется на N уровней, расстояния между к-рыми из-за большой величины N настолько малы, что их совокупность может считаться практически непрерывной зоной энергетич. уровней, имеющей конечную ширину. Поскольку каждый атом участвует в образовании большего числа связей, чем, напр., в двухатомной молекуле при том же числе валентных электронов, то минимум энергии системы (или максимум энергии связи) достигается при расстояниях больших, чем в случае двухцентровой связи в молекуле. Межатомные расстояния в металлах заметно больше, чем в соед. с ковалентной связью (металлич. радиус атомов всегда больше ковалентного радиуса), а координац. число (число ближайших соседей) в кристаллич. решетках металлов обычно 8 или больше 8. Для наиб. часто встречающихся кристаллич. структур координац. числа равны 8 (объемноцентрир. кубич.), 12 (гранецентрир. кубическая и гексаген. плотно-упакованная). Расчеты параметров металлич. решеток с использованием ковалентных радиусов дают заниженные результаты. Так, расстояние между атомами Li в молекуле Li2 (ковалентная связь) равно 0,267 нм, в металле Li-0,304 нм. Каждый атом Li в металле имеет 8 ближайших соседей, а на расстоянии, в 2 до 2,9 . 10 -19 Дж для кристаллич. Li.
Во мн. металлах металлическая связь между атомами включает вклады ионной или ковалентной составляющей. Особенности металлической связи у каждого металла м. б. связаны, напр., с электростатич. отталкиванием ионов друг от друга с учетом распределения электрич. зарядовое них, с вкладом в образование связи электронов внутр. незаполненных оболочек переходных металлов, с корреляцией движения электронов в электронном газе и нек-рыми др. причинами.
Металлическая связь характерна не только для металлов и их сплавов, но и для металлических соединений (см. также Интерметал-лиды), она сохраняется не только в твердых кристаллах, но и в расплавах и в аморфном состоянии.
Лекция по Химии на тему: "Металлическая химическая связь"
Металлическая связь это тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Металлы – это химические элементы с низкой электроотрицательностью, поэтому они легко отдают свои валентные электроны. Если рядом с элементом металлом находится неметалл, то электроны от атома металла переходят к неметаллу. Такой тип связи называется ионный (рис. 1).

В случае простых веществ металлов или их сплавов, ситуация меняется.
При образовании молекул электронные орбитали металлов не остаются неизменными. Они взаимодействуют между собой, образуя новую молекулярную орбиталь. В зависимости от состава и строения соединения, молекулярные орбитали могут быть как близки к совокупности атомных орбиталей, так и значительно от них отличаться. При взаимодействии электронных орбиталей атомов металла образуются молекулярные орбитали. Такие, что валентные электроны атома металла, могут свободно перемещаться по этим молекулярным орбиталям. Не происходит полное разделение, заряда, т. е. металл – это не совокупность катионов и плавающих вокруг электронов. Но это и не совокупность атомов, которые иногда переходят в катионную форму и передают свой электрон другому катиону. Реальная ситуация – это совокупность двух этих крайних вариантов.

Рис. 2 Металлической кристаллическая решетка
Сущность образования металлической связи состоит в следующем: атомы металлов отдают наружные электроны, и некоторые из них превращаются в положительно заряженные ионы. Оторвавшиеся от атомов электроны относительно свободно перемещаются между возникшими положительными ионами металлов. Между этими частицами возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы в металлической решетке (рис. 2).
Наличие металлической связи обуславливает физические свойства металлов:
· Тепло и электропроводность
Пластичность – это способность материала легко деформироваться под действием механической нагрузки. Металлическая связь реализуется между всеми атомами металла одновременно, поэтому при механическом воздействии на металл не разрываются конкретные связи, а только меняется положение атома. Атомы металла, не связанные жесткими связями между собой, могут как бы скользить по слою электронного газа, как это происходит при скольжении одного стекла по другому с прослойкой воды между ними. Благодаря этому металлы можно легко деформировать или раскатывать в тонкую фольгу. Наиболее пластичные металлы – чистое золото, серебро и медь. Все эти металлы встречаются в природе в самородном виде в той или иной степени чистоты. Рис. 3.

Рис. 3. Металлы, встречающиеся в природе в самородном виде
Из них, особенно из золота, изготавливаются различные украшения. Благодаря своей удивительной пластичности, золото применяется при отделке дворцов. Из него можно раскатать фольгу толщиной всего 3 . 10 -3 мм. Она называется сусальное золото, наносится на гипсовые, лепные украшения или другие предметы.
Тепло- и электропроводность . Лучше всего электрический ток проводят медь, серебро, золото и алюминий. Но так как золото и серебро – дорогие металлы, то для изготовления кабелей используются более дешевые медь и алюминий. Самыми плохими электрическими проводниками являются марганец, свинец, ртуть и вольфрам. У вольфрама электрическое сопротивление столь велико, что при прохождении электрического тока он начинает светиться. Это свойство используется при изготовлении ламп накаливания.
Температура тела – это мера энергии составляющих его атомов или молекул. Электронный газ металла может довольно быстро передавать избыточную энергию с одного иона или атома к другому. Температура металла быстро выравнивается по всему объёму, даже если нагревание идет с одной стороны. Это наблюдается, например, если опустить металлическую ложку в чай.
Металлический блеск. Блеск – это способность тела отражать световые лучи. Высокой световой отражательной способностью обладают серебро, алюминий и палладий. Поэтому именно эти металлы наносят тонким слоем на поверхность стекла при изготовлении фар, прожекторов и зеркал.
Приложение №1
ТЕСТ по теме: Металлическая химическая связь
1. Металлическая связь образуют
a) атомы различных неметаллов
b) атомы металлов
c) атомы одинаковых неметаллов
d) атомы металлов и атомов неметаллов
2. У атомов металлов на внешнем уровне находится
a) от 2 до 3 электронов
b) от 4 до 5 электронов
c) от 1 до 3 электронов
d) от 2 до 4 электронов
3. Расположите химические элементы в порядке возрастания металлических свойств
4. Расположите химические элементы в порядке убывания металлических свойств
5. "Электронный газ" это
a) электроны внешнего энергетического уровня
b) валентные электроны
c) неспаренные электроны в атоме
d) свободные электроны в кристалле металла
6. Определите вид химической связи в веществах
1) литий; 2) аммиак; 3) хлор 4) хлорид бария
b) ковалентная неполярная
c) ковалентная полярная
7. Сходство металлической связи с ионной в
a) обобществлении электронов
b) образовании свободных атомов
c) образовании ионов
d) образовании электронов
8. Сходство ковалентной и металлической связи в
a) образовании свободных атомов
b) образовании ионов
c) образовании электронов
d) обобществлении электронов
9. Металлическая связь обуславливает следующие физические свойства (выберите 3 правильных ответа)
a) высокая электропроводность
Приложение №2
Кроссворд по теме: Металлическая связь


Вопросы:
Лекция 15. Общие химические свойства металлов
С химической точки зрения металл – это элемент, который во всех соединениях проявляет положительную степень окисления.Из известных в настоящее время 109 элементов 86 являются металлами. Основной отличительной особенностью металлов является наличие в конденсированном состоянии свободных, не связных с определенным атомом электронов. Эти электроны способны перемещаться по всему объему тела. Наличие свободных электронов определяет всю совокупность свойств металлов. В твердом состоянии большинство металлов имеет кристаллическую высокосимметричную структуру одного из типов: кубическую объемноцентрированную, кубическую гранецентрированную или гексагональную плотноупакованную (рис. 1).
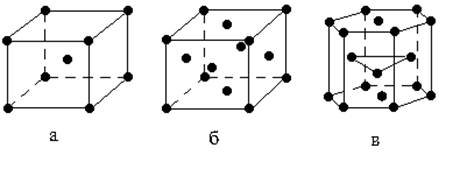
Рис. 1. Типичная структура кристалла металлов: а – кубическая объемноцентрированная; б–кубическая гранецентрированная; в – плотная гексагональная
Существует техническая классификация металлов. Обычно выделяют следующие группы: черные металлы (Fe); тяжелые цветные металлы(Cu, Pb, Zn, Ni, Sn, Co, Sb, Bi, Hg, Cd), легкие металлы с плотностью менее 5 г/см 3 (Al, Mg, Ca и т.д.), драгоценные металлы (Au, Ag и платиновые металлы) и редкие металлы (Be, Sc, In, Ge и некоторые другие).
В химии металлы классифицируются по их месту в периодической системе элементов. Различают металлы главных и побочных подгрупп. Металлы главных подгрупп называют непереходными. Эти металлы характеризуются тем, что в их атомах происходит последовательное заполнение s– и p– электронных оболочек.
Типичными металлами являются s–элементы (щелочные Li, Na, K, Rb, Cs, Fr и щелочноземельные Be, Mg, Ca, Sr, Ba, Ra металлы). Данные металлы расположены в Iа и IIа подгруппах (т. е., в главных подгруппах I и II групп). Этим металлам отвечает конфигурация валентных электронных оболочек ns 1 или ns 2 (n – главное квантовое число). Для данных металлов характерно:
а) металлы имеют на внешнем уровне 1 – 2 электрона, поэтому проявляют постоянные степени окисления +1, +2;
б) оксиды этих элементов носят основной характер (исключение –бериллий, т.к. малый радиус иона придает ему амфотерные свойства);
в) гидриды имеют солеобразный характер и образуют ионные кристаллы;
г) возбуждение электронных подуровней возможно только у металлов IIА группы с последующей sp–гибридизацией орбиталей.
К p–металлам относятся элементы IIIа (Al, Ga, In, Tl), IVа (Ge, Sn, Pb), Vа (Sb, Bi) и VIа (Ро) групп с главными квантовыми числами 3, 4, 5, 6. Данным металлам отвечает конфигурация валентных электронных оболочек ns 2 p z (z может принимать значение от 1 до 4 и равно номеру группы минус 2). Для данных металлов характерно:
а) образование химических связей осуществляется s – и p–электронами в процессе их возбуждения и гибридизации (sp–и spd), однако сверху вниз по группам способность к гибридизации падает;
б) оксиды p– металлов амфотерные или кислотные (основные оксиды только у In и Tl);
в) гидриды p–металлов имеют полимерный характер (AlH3)n или газообразный (SnH4 ,PbH4 и т. д.), что подтверждает сходство с неметаллами, открывающими эти группы.
В атомах металлов побочных подгрупп, называемых переходными металлами, происходит застраивание d– и f– оболочек, в соответствии с чем их делят на d–группу и две f–группы лантаноиды и актиноиды.
К переходным металлам относят 37 элементов d–группы и 28 металлов f–группы. К металлам d–группы относят элементы Ib (Cu, Ag, Au), IIb (Zn, Cd, Hg), IIIb (Sc, Y, La, Ac), IVb (Ti, Zr, Hf, Db), Vb (V, Nb, Ta, Jl), VIb (Cr, Mo, W, Rf), VIIb (Mn, Tc, Re, Bh) и VIII групп (Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Rt, Hn, Mt, Db, Jl, Rf, Bh, Hn, Mt). Этим элементам отвечает конфигурация 3d z 4s 2 . Исключения составляют некоторые атомы, в том числе атомы хрома с полузаполненной 3d 5 –оболочкой (3d 5 4s 1 ) и меди – с полностью заполненной 3d 10 –оболочкой (3d 10 4s 1 ). Эти элементы обладают некоторыми общими свойствами:
1. все они образуют сплавы между собой и другими металлами;
2. наличие частично заполненных электронных оболочек обусловливает способность d–металлов образовывать парамагнитные соединения;
3. в химических реакциях они проявляют переменную валентность (за немногими исключениями), а их ионы и соединения, как правило, окрашены;
4. в химических соединениях d–элементы электроположительны. "Благородные" металлы, обладая высоким положительным значением стандартного электродного потенциала (Е>0), взаимодействуют с кислотами необычным образом;
5. ионы d–металлов имеют вакантные атомные орбитали валентного уровня (ns, np, (n–1) d), поэтому они проявляют акцепторные свойства, выступая в качестве центрального иона в координационных (комплексных) соединениях.
Химические свойства элементов определяются их положением в Периодической системе элементов Менделеева. Так, металлические свойства сверху вниз в группе возрастают, что обусловлено уменьшением силы взаимодействия между валентными электронами и ядром вследствие увеличения радиуса атома и за счет возрастания экранирования электронами, расположенными на внутренних атомных орбиталях. Это приводит к облегчению ионизации атома. В периоде металлические свойства уменьшаются слева направо, т.к. это связано с увеличением заряда ядра и тем самым с увеличением прочности связи валентных электронов с ядром.
В химическом отношении атомы всех металлов характеризуются сравнительной легкостью отдачи валентных электронов (т.е. малой величиной энергии ионизации) и низким значением сродства к электрону (т.е. малой способностью удерживать избыточные электроны). Как следствие этого низкое значение электроотрицательности, т.е., способность образовывать только положительно заряженные ионы и проявлять в своих соединениях только положительную степень окисления. В связи с этим металлы в свободном состоянии являются восстановителями.
Восстановительная способность разных металлов неодинакова. Для реакций в водных растворах она определяется значением стандартного электродного потенциала металла (т.е. положением металла в ряду напряжений) и концентрацией (активностью) его ионов в растворе.
Взаимодействие металлов с элементарными окислителями (F2, Cl2, O2, N2, S и т.д.). Например, реакция с кислородом, как правило, протекает следующим образом
где n – валентность металла.
Взаимодействие металлов с водой. Металлы, обладающие стандартным потенциалом менее –2,71 В, вытесняют водород из воды на холоде с образованием гидроксидов металлов и водорода. Металлы со стандартным потенциалом от –2,7 до –1,23 В вытесняют водород из воды при нагревании
Остальные металлы с водой не реагируют.
Взаимодействие с щелочами. С щелочами могут реагировать металлы, дающие амфотерные оксиды, и металлы, обладающие высокими степенями окисления, в присутствии сильного окислителя. В первом случае металлы образуют анионы своих кислот. Так, реакция взаимодействия алюминия с щелочью запишется уравнением
в котором, лигандом является ион гидроксида. Во втором случае образуются соли, например K2CrO4 .
Взаимодействие металлов с кислотами. С кислотами металлы реагируют различно в зависимости от численного значения стандартного электродного потенциала (Е) (т.е. от положения металла в ряду напряжения) и окислительных свойств кислоты:
· в растворах галогеноводородов и разбавленной серной кислоты окислителем является только ион Н + , и поэтому с этими кислотами взаимодействуют металлы, стандартный потенциал которых меньше стандартного потенциала водорода:
Me + 2n H + = Me n+ + n H2;
· концентрированная серная кислота растворяет почти все металлы независимо от положения их в ряду стандартных электродных потенциалов (кроме Au и Pt). Водород при этом не выделяется, т.к. функцию окислителя в кислоте выполняет cульфат–ион (SO4 2– ). В зависимости от концентрации и условий проведения опыта cульфат–ион восстанавливается до различных продуктов. Так, цинк в зависимости от концентрации серной кислоты и температуры реагирует следующим образом:
– при очень высокой температуре 4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S +4H2O;
· в разбавленной и концентрированной азотной кислоте функцию окислителя выполняет нитрат–ион (NO3 – ), поэтому продукты восстановления зависят от степени разбавления азотной кислоты и активности металлов. В зависимости от концентрации кислоты, металла (величины его стандартного электродного потенциала) и условий проведения опыта нитрат–ион восстанавливается до различных продуктов. Так, кальций в зависимости от концентрации азотной кислоты реагирует следующим образом:
Концентрированная азотная кислота не реагирует (пассивирует) с железом, алюминием, хромом, платиной и некоторвми другими металлами.
Взаимодействие металлов друг с другом. При высоких температурах металлы способны реагировать друг с другом с образованием сплавов. Сплавы могут быть твердыми растворами и химическими (интерметаллическими) соединениями (Mg2Pb, SnSb, Na3Sb8, Na2K и др.).
Свойства металлического хрома (…3d 5 4s 1 ). Простое вещество хром представляет собой блестящий на изломе серебристый металл, который хорошо проводит электрический ток, имеет высокую температуру плавления (1890°С) и кипения (2430°С), большую твердость (в присутствии примесей, очень чистый хром мягок) и плотность (7,2 г/см 3 ).
При обычной температуре хром устойчив к действию элементарных окислителей и воде благодаря плотной окисной пленке. При высоких температурах хром взаимодействует с кислородом и другими окислителями.
Cr + Cl2(газ) ® CrCl3 (малиновый цвет)
С металлами при сплавлении хром образует интерметаллиды (FeCr2, CrMn3). При 600°С хром взаимодействует с парами воды:
В электрохимическом отношении металлический хром близок к железу:. Поэтому он может растворяться в неокисляющих (по аниону) минеральных кислотах, таких как галогеноводородные:
Сr + 2HCl ® CrCl2(голубой цвет) + H2.
На воздухе идет быстро следующая стадия:
Окисляющие (по аниону) минеральные кислоты растворяют хром до трехвалентного состояния:
В случае с HNO3(конц) происходит пассивация хрома – на поверхности образуется прочная пленка оксида – и металл не реагирует с кислотой. (Пассивный хром имеет высокий окислительно-восстановительный потенциал = + 1,3 В.)
Основная область применения хрома – металлургия: создание хромистых сталей. Так, в инструментальную сталь вводят 3 – 4% хрома, шарикоподшипниковая сталь содержит 0,5 – 1,5% хрома, в нержавеющей стали (один из вариантов): 18 – 25% хрома, 6 – 10% никеля, < 0,14% углерода, ~0,8% титана, остальное – железо.
Свойства металлического железа (…3d 6 4s 2 ). Железо – белый блестящий металл. Образует несколько кристаллических модификаций, устойчивых в определенном температурном интервале.
Химические свойства металлического железа определяются его положением в ряду напряжений металлов: .
При нагревании в атмосфере сухого воздуха железо окисляется:
В зависимости от условий и от активности неметаллов железо может образовывать металлоподобные (Fe3C, Fe3Si, Fe4N), солеподобные (FeCl2, FeS) соединения и твердые растворы (с C, Si, N, B, P, H).
В воде железо интенсивно корродирует:
При недостатке кислорода образуется смешанный оксид Fe3O4:
Разбавленная соляная, серная и азотная кислоты растворяют железо до двухвалентного иона:
Более концентрированная азотная и горячая концентрированная серная кислоты окисляют железо до трехвалентного состояния (выделяются NO и SO2 соответственно):
Очень концентрированная азотная кислота (плотность 1,4 г/см3) и серная (олеум) пассивируют железо, образуя на поверхности металла оксидные пленки.
Железо используют для получения железоуглеродистых сплавов. Велико биологическое значение железа, т.к. оно – составная часть гемоглобина крови. В организме человека содержится около 3 г железа.
Химические свойства металлического цинка (…3d 10 4s 2 ). Цинк – синевато-белый, пластичный и тягучий металл, но выше 200°С становится хрупким. Во влажном воздухе он покрывается защитной пленкой основной соли ZnCO3×3Zn(OH)2 или ZnO и дальнейшего окисления не происходит. При высоких температурах взаимодействует:
Исходя из величин стандартных электродных потенциалов, цинк вытесняет кадмий, который является его электронным аналогом, из солей: Cd 2+ + Zn ® Cd + Zn 2+ .
Благодаря амфотерности гидроокиси цинка металлический цинк способен растворяться в щелочах:
В разбавленных кислотах:
В концентрированных кислотах:
Значительная часть цинка расходуется для цинкования железных и стальных изделий. Широкое промышленное использование имеют сплавы цинка с медью (нейзильбер, латунь). Цинк широко используется при изготовлении гальванических элементов.
Химические свойства металлической меди (…3d 10 4s 1 ). Металлическая медь кристаллизуется в кубической гранецентрированной кристаллической решетке. Это ковкий мягкий, вязкий металл розового цвета с температурой плавления 1083°С. Медь находится на втором месте после серебра по электро- и теплопроводности, что обусловливает значение меди для развития науки и техники.
Медь реагирует с поверхности с кислородом воздуха при комнатной температуре, цвет поверхности становится темнее, а в присутствии CO2, SO2 и паров воды покрывается зеленоватой пленкой основных солей (CuOH)2CO3, (CuOH)2SO4.
Медь непосредственно соединяется с кислородом, галогенами, серой:
В присутствии кислорода металлическая медь взаимодействует с раствором аммиака при обычной температуре:
Находясь в ряду напряжений после водорода , медь не вытесняет его из разбавленных соляной и серной кислот. Однако в присутствии кислорода воздуха медь растворяется в этих кислотах:
Окисляющие кислоты растворяют медь с переходом ее в двухвалентное состояние:
Со щелочами медь не взаимодействует.
С солями более активных металлов медь взаимодействует, и эта окислительно-восстановительная реакция лежит в основе некоторых гальванических элементов:
Cu SO4 + Zn® Zn SO4 + Cu; E о = 1,1 B
Mg + CuCl2 ® MgCl2 + Cu; E о = 1,75 B.
Медь образует с другими металлами большое число интерметаллических соединений. Наибольшую известность и ценность имеют сплавы: латунь Cu–Zn (18 – 40% Zn), бронза Cu–Sn (колокольная – 20% Sn), инструментальная бронза Cu–Zn–Sn (11% Zn, 3 – 8% Sn), мельхиор Cu–Ni–Mn–Fe (68% Cu, 30% Ni, 1% Mn, 1% Fe).
Нахождение металлов в природе и способы получения.Вследствие высокой химической активности, металлы в природе находятся в виде различных соединений, и только малоактивные (благородные) металл – платина, золото и т.п. – встречаются в самородном (свободном) состоянии.
Наиболее распространенными природными соединениями металлов являются оксиды (гематит Fe2O3, магнетит Fe3O4, куприт Cu2O, корунд Al2O3, пиролюзит MnO2 и др.), сульфиды (галенит PbS, сфалерит ZnS, халькопирит CuFeS, киноварь HgS и т.д.), а также соли кислородосодержащих кислот (карбонаты, силикаты, фосфаты и сульфаты). Щелочные и щелочноземельные металлы встречаются преимущественно в виде галогенидов (фторидов или хлоридов).
Основная масса металлов получается путем переработки полезного ископаемого – руды. Поскольку металлы, входящие в состав руд находятся в окисленном состоянии, то их получение осуществляется путем реакции восстановления. Предварительно руду очищают от пустой породы
Образовавшийся концентрат оксида металла очищают от воды, а сульфиды, для удобства последующей переработки, переводят в оксиды путем обжига, например:
Для разделения элементов полиметаллических руд пользуются методом хлорирования. При обработке руд хлором в присутствии восстановителя образуются хлориды различных металлов, которые вследствие значительной и различной летучести могут быть легко отделены друг от друга.
Восстановление металлов в промышленности осуществляется посредством различных процессов. Процесс восстановления безводных соединений металлов при высоких температурах называют пирометаллургией. В качестве восстановителей используют металлы, более активные, чем получаемый, либо углерод. В первом случае говорят о металлотермии, во втором – карботермии, например:
Особое значение углерод приобрел как восстановитель железа. Углерод для восстановления металлов применяется обычно в виде кокса.
Процесс восстановления металлов из водных растворов их солей относится к области гидрометаллургии. Получение металлов осуществляется при обычных температурах, причем в качестве восстановителей могут быть использованы сравнительно активные металлы или электроны катода при электролизе. Электролизом водных растворов солей могут быть получены только сравнительно малоактивные металлы, расположенные в ряду напряжений (стандартных электродных потенциалов) непосредственно перед водородом или после него. Активные металлы – щелочные, щелочноземельные, алюминий и некоторые другие, получают электролизом расплава солей.
Взаимодействие металлов с простыми веществами — неметаллами
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s-элементы I и II групп (исключение — водород), все d- и f - элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
♦ небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
♦ малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
♦ сравнительно слабая связь валентных электронов с ядром;
♦ низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. металлы - восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Me n + + пе - = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1).Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блески непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см 3 ): Na, Са, Mg, Al, Ti — и тяжелые (плотность больше 5 г/см 3 ): Zn, Cr, Sn, Mn, Ni, Сu, Ag, Pb, Hg, Аи, W, Os -самый тяжелый;
2). по значению температуры плавления — на легкоплавкие (tпл < 1000 °С): Hg, Na, Sn, Pb, Zn, Mg, Al, Ca, Ag — и тугоплавкие (tпл > 1000 °C): Au, Cu, Mn, Ni, Fe, Ti, Cr, Os, W - самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей (Fe, Со, Ni);
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях (Al, Cr, Ti);
в) диамагнитные — не притягиваются к магниту (Sn, Сu, Bi).
Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me - пе - = Me п+ (окисление)
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
Взаимодействие металлов с простыми веществами — неметаллами
Металлы при определенных условиях взаимодействуют с неметаллами, например с кислородом образуют оксиды:
Из щелочных металлов только литий сгорает на воздухе с образованием оксида:
Основной продукт окисления натрия — пероксид:
При горении других щелочных металлов образуются супероксиды, например:
Оксиды натрия и калия могут быть получены при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
На реакции пероксида натрия с оксидом углерода (1V) основана регенерация воздуха в изолированных помещениях (например, на подводных лодках):
При нагревании металлы реагируют с другими неметаллами:
| Mg + Br2 = MgBr2 | 4А1 + 3С = А14С3 |
| бромид | карбид |
| магния | алюминия |
| 2А1 + N2 = 2A1N | 3Fe + С = Fe3C |
| нитрид | карбид |
| алюминия | железа |
| 3Са + 2Р = Са3Р2 | Са + 2С = СаС2 |
| фосфид | карбид |
| кальция | кальция |
| Сu + S = CuS | 2Mg + Si = Mg2Si |
| сульфид | силицид |
Если металл проявляет переменную степень окисления, то активные неметаллы (фтор, хлор, бром, кислород) окисляют его до более высокой степени окисления, в которой он образует устойчивое в данных условиях соединение, а менее активные — до более низкой степени окисления. Так, железо проявляет в соединениях степени окисления +2 и +3 (иногда +6), из них +3 наиболее устойчива. В связи с этим при взаимодействии железа с хлором, бромом оно окисляется до степени окисления +3, а при взаимодействии с серой или иодом — до степени окисления +2:
2Fe + ЗС12 = 2 FeCl3 Fe + S = FeS
Щелочные и щелочно-земельные металлы при нагревании вступают в реакцию с водородом, образуя гидриды. Атомы водорода в данных соединениях имеют отрицательную степень окисления:
Гидриды представляют собой кристаллические тугоплавкие солеобразные вещества белого цвета. Они активные восстановители за счет водорода в минимальной степени окисления (-1). Так, гидриды горят в атмосфере хлора, кислорода, энергично разлагаются водой с образованием щелочи и выделением водорода:
Гидриды применяют для получения водорода в полевых условиях (для водородной сварки), восстановления металлов из ихоксидов, а также в органическом синтезе.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Читайте также:
