Взаимодействие галогеналканов с металлическим натрием реакция вюрца
Обновлено: 17.05.2024
РЕАКЦИЯ ВЮРЦА – химическая реакция, позволяющая получать простейшие органические соединения – предельные углеводороды.
Сама реакция Вюрца заключается в конденсации алкилгалогенидов под действием металлического Na, Li или реже K:
2RHal + 2Na ® R–R + 2NaHal.
Иногда ее трактуют как взаимодействие RNa или RLi с R'Hal.
Реакция была открыта французским химиком-органиком Шарлем Вюрцем (Wurtz Charles (1817–1884) в 1855 при попытке получения этилнатрия из хлористого этила и металлического натрия.
Несмотря на то, что реакция Вюрца приводит к образованию новой углерод-углеродной связи, она нечасто применяется в органическом синтезе. В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы, и, как видно из приведенной схемы, для получения заданного углеводорода следует брать только один алкилгалогенид, так как при конденсации двух алкилгалогенидов получается смесь всех трех возможных продуктов сочетания. Поэтому если используется алкилгалогенид и натрий, реакцией Вюрца можно получить только углеводороды с четным количеством атомов углерода. Наиболее успешно реакция Вюрца протекает с первичными алкилйодидами. Очень низкие выходы целевого продукта получают при использовании метода Вюрца для вторичных алкилгалогенидов. Реакцию обычно проводят в диэтиловом эфире. Использование углеводородов в качестве растворителей уменьшает селективность реакции.
Однако если использовать заранее приготовленное металлоорганическое соединение, например алкиллитий, то можно получить и несимметричные продукты конденсации:
RLi + R'Hal ® R – R' + LiHal
В обоих случаях реакция сопровождается образованием большого количества побочных продуктов за счет побочных процессов. Это иллюстрирует пример взаимодействия этиллития с 2-бромоктаном:
В этом случае 3-метилнонан и ряд побочных продуктов в указанных молярных соотношениях образуются как продукт реакции Вюрца.
Кроме натрия, в реакции Вюрца использовались такие металлы, как серебро, цинк, железо, медь и индий.
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций для построения карбоциклических систем. Так из 1,3-дибромпропана под действием металлического цинка и йодида натрия (в качестве промотора реакции) может быть получен циклопропан:
Можно построить и другие напряженные карбоциклические системы. Например, из 1,3-дибромадамантана, используя натрий-калиевый сплав, может быть получен 1,3-дегидроадамантан:
А взаимодействие 1-бром-3-хлор-циклобутана с натрием приводит к бициклобутану:
Известен ряд разновидностей реакции Вюрца, получивших свои собственные названия. Это реакция Вюрца – Фиттига и реакция Ульмана. Первая заключается в конденсации алкил- и арилгалогенида под действием натрия с образованием алкилароматического производного. В случае реакции Ульмана в конденсацию обычно вводят арилйодиды, а вместо натрия используют свежеприготовленную медь, эта реакция позволяет с высоким выходом получать различные биарильные производные, в том числе, и несимметричные, содержащие заместитель в одном из ароматических ядер:
Как полагают, механизм реакции Вюрца состоит из двух основных стадий:
1) образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
RHal + 2Na ® R–Na + NaHal,
2) взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
RHal + R–Na ® RR + NaHal.
В зависимости от природы R и условий проведения реакции вторая стадия процесса может протекать по ионному либо по радикальному механизму.
Вацуро К.В., Мищенко Г.Л. Именные реакции в органической химии. М., 1976
Шабаров Ю.С. Курс органической химии. М., Химия, 1998
Этан: способы получения и свойства
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :

При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:

Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода |
Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
2. Дегидрирование этана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, п ри дегидрировании этана образуются этилен или ацетилен:  |
3. Окисление этана
Этан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Этан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С.
Получение этана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии пропионата натрия с гидроксидом натрия при сплавлении образуется этан и карбонат натрия:
CH3–CH2 –COONa + NaOH → CH3–CH2 –H + Na2CO3
3. Гидрирование алкенов и алкинов
Этан можно получить из этилена или ацетилена:
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить этан:
5. Получение этана в промышленности
В промышленности этан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы.
Взаимодействие галогеналканов с металлическим натрием реакция вюрца
Реакция Вюрца — конденсация алкилгалогенидов под действием Na (реже — Li или К) с образованием предельных углеводородов.
Реакция Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (галогеналканы).
Легче реакция происходит с алкилиодидами и алкилбромидами, труднее – с алкилхлоридами.
В результате образуется алкан с более сложной углеродной цепью.
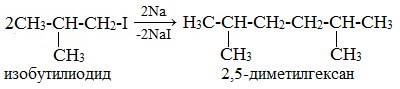
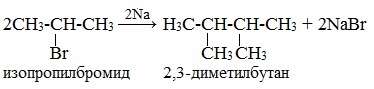
Реакцию обычно проводят в диэтиловом эфире.
В процессе реакции Вюрца происходит удвоение углеводородного скелета молекулы и образуется насыщенный углеводород (алкан). Эта реакция находит ограниченное применение, поскольку таким путем можно получать только симметричные алканы.
В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы (например, гептаконтана C70H142).
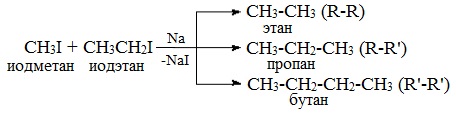
Реакцию используют для получения углеводородов с четным числом С-атомов. Если ввести в реакцию два различных галогеналкана, то образуется смесь трех продуктов.
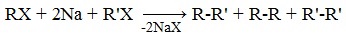
Например, при взаимодействии метил- и этилиодидов с натрием наряду с пропаном образуется этан и бутан:
Эта реакция была открыта французким химиком Ш. Вюрцем в 1855 г. при попытке получения этилнатрия из хлористого этила и металлического натрия.
В 1864г. немецкий химик Р. Фиттиг предложил реакцию, подобную реакции Вюрца, для синтеза жирноароматических углеводородов (реакция Вюрца-Фиттига).
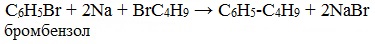
Реакция Вюрца используется для первичных алкилгалогенидов. Для вторичных алкилгалогенидов не имеет практического значения, т.к выход целевого продукта составляет всего 10-15%.
Реакцию Вюрца невозможно использовать для третичных алкилгалогенидов, т.к. вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом.
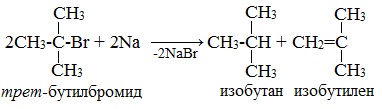
Внутримолекулярная реакция Вюрца
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций. Этим путем можно получать циклоалканы заданного строения.
При взаимодействии 1,4-дибромбутана с металлическим натрием можно получить циклобутан:
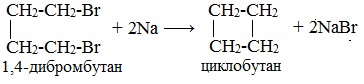
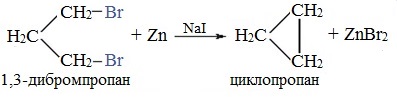
Из 1,3-дибромпропана под действием металлического цинка и йодида натрия, как активатора, может быть получен циклопропан:
Алканы выделяют из природных источников (природный и попутный газ, нефть, каменный уголь).
Газообразные алканы получают из природного и попутных нефтяных газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск — природный битум.
Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (80-97%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дня болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным или рудничным газом.
В промышленности
1. Получение алканов из природных источников (нефть, природный газ)
2. Синтезом на основе водяного газа из оксида углерода (II) и водорода можно получить метан:
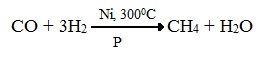
3. Синтезом из водяного газа (СО+Н2) получают смесь алканов:
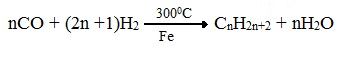
В лаборатории
1. Метан можно получить синтезом из простых веществ при нагревании, повышенном давлении в присутствии катализатора (Ni):
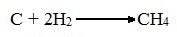
2. Гидролиз карбида алюминия (получение метана)


3. Взаимодействие карбида алюминия с сильными кислотами
5. Каталитическое гидрирование (+Н2) непредельных углеводородов
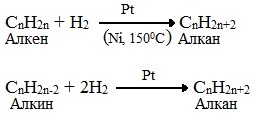
6. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:
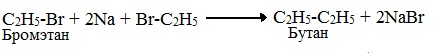
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:
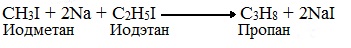
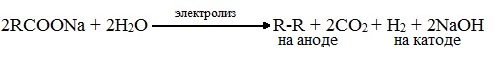
7. Электролиз растворов солей карбоновых кислот (реакция Кольбе)
Теги: Алканы
Юрий, спасибо) Исправила)
Добрый день, спасибо за материал и за труд, но есть неточность в реакции Дюма — от щелочи переходит протон, а у вас показано, что остается ОН целиком.
Гидрирование или восстановление алкилгалогенидов
При каталитическом гидрировании в присутствии палладия алкилгалогениды превращаются в алканы.
Алканы также получают восстановлением алкилгалогенидов металлом в кислоте.
Иодалканы могут быть легко восстановлены в запаянной ампуле с иодистоводородной кислотой.
Реакция галогеналканов с натрием (реакция Вюрца)
Реакция Вюрца позволяет получить углеводород с большим числом атомов углерода, чем в исходном соединении.
Она пригодна для синтеза только симметричных алканов с использованием первичных(!) алкилгалогенидов. В случае использования в качестве исходных соединений различных галогеналканов в результате реакции получается смесь трех углеводородов:
Эту смесь приходится разделять, что не всегда возможно.
Вместо натрия в этой реакции могут быть использованы и другие металлы, например магний, цинк, литий.
Синтез Кольбе - электролиз натриевых или калиевых солей карбоновых кислот
Электролиз натриевых или калиевых солей карбоновых кислот приводит также к получению симметричных углеводородов.
Алкены
Углеводороды состава СnН2n с открытой цепью, содержащие одну двойную связь, называются алкенами. Простейшим углеводородом этого ряда является этилен СН2=СН2. Атом углерода в этилене находится в sp 2 -гибридном состоянии (тригональный углерод). За счет трех гибридизованных орбиталей каждый атом углерода образует три s-связи: одну - с соседним атомом углерода, две - с двумя атомами водорода. Боковое перекрывания двух 2р-орбиталей атомов углерода дает p-связь и делает невозможным вращение вокруг s-связи углерод-углерод. Этим обусловлено явление геометрической изомерии.
Геометрические изомеры (состав и способ связывания атомов одинаков, расположение групп и атомов в пространстве различно). Для названия этих изомеров используется Е, Z-номенклатура. При этом возможно использование классических цис-и транс-обозначений для определения пространственного расположения одинаковых или сходных групп относительно плоскости сравнения.
| Одинаковые по старшинству группы расположены по разные стороны от плоскости двойной связи. В этом соединении два метильных радикала находятся в цис-положении. | Одинаковые по старшинству группы расположены по одну сторону от плоскости двойной связи. В этом соединении два метильных радикала находятся в транс-положении. |
Относительное старшинство заместителей при каждом атоме углерода с двойной связью определяется по атомному номеру: Н (атомный номер - 1) - младший, С (атомный номер - 6) - старший заместитель; если атомы при углероде с двойной связью одинаковы, то рассматривается старшинство последующих атомов: - СН3 (последующие атомы - Н, Н, Н) - младший заместитель; -СН(СН3)2 (последующие атомы - Н, С, С) - старший заместитель.
Химические свойства
Функциональной группой в алкенах является двойная связь С=С. Характерная реакция двойной углерод-углеродной связи - электрофильное присоединение (электрофил - любящий электроны). При этом происходит разрыв менее прочной p-связи и образование вместо нее двух более прочных s-связей.
Реакция электрофильного присоединения протекает в две стадии:
I стадия - медленная, присоединение электрофила Е Å с образованием карбокатиона.
II стадия - быстрая, присоединение нуклеофила Nu (нуклеофил - любящий ядро).
По такому механизму протекает реакция присоединения галогеноводородов НСl, НВr, НI. Порядок увеличения реакционной способности галогеноводородов по отношению к алкенам совпадает с порядком увеличения их кислотности: НСl < HBr < HI.
Для присоединения воды к алкенам необходим катализатор - сильная минеральная кислота, которая дает протон Н Å - электрофил, а нуклеофилом является вода (Н2О) за счет неподеленной пары электронов на атоме кислорода. Подобным образом с алкенами реагирует спирт (RОH), который также имеет неподеленную электронную пару на атоме кислорода. В реакции с серной кислотой быстрая стадия - взаимодействие с нуклеофилом — ОSO2OH.
Присоединению хлора и брома, молекулы которых неполярны, предшествует поляризация
Под влиянием электронного облака двойной углерод-углеродной связи изменяется распределение электронной плотности в молекуле галогена. В первой медленной стадии присоединяется электрофил Br + , во второй - нуклеофил Br — .
Частицы, присоединяющиеся в медленной и быстрой стадиях электрофильного присоединения, приведены в таблице 2.1.
Реакции электрофильного присоединения
| Реакции присоединения | |||||
| Реагент | галогенов | галоген- водородов | воды | спиртов | серной кислоты |
| Электрофил | Cl + Br + | H + | H + | H + | H + |
| Нуклеофил | Cl — Br — | Cl — , Br — , I — | Н2O | ROH | — ОSO2OH |
Электрофильное присоединение к алкенам происходит через стадию образования более устойчивого карбокатиона (правило Марковникова). Ряд устойчивости карбокатионов:
Читайте также:
