Взаимодействие марганцовки с металлами
Обновлено: 19.05.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Марганец, цинк и сереброСодержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Получают марганец алюминотермией, восстановлением коксом, электролизом. MnO2 + C = (t) Mn + CO
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка. При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды. Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот. Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II) Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II). При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II). Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV). Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит. При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+ Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II). Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.
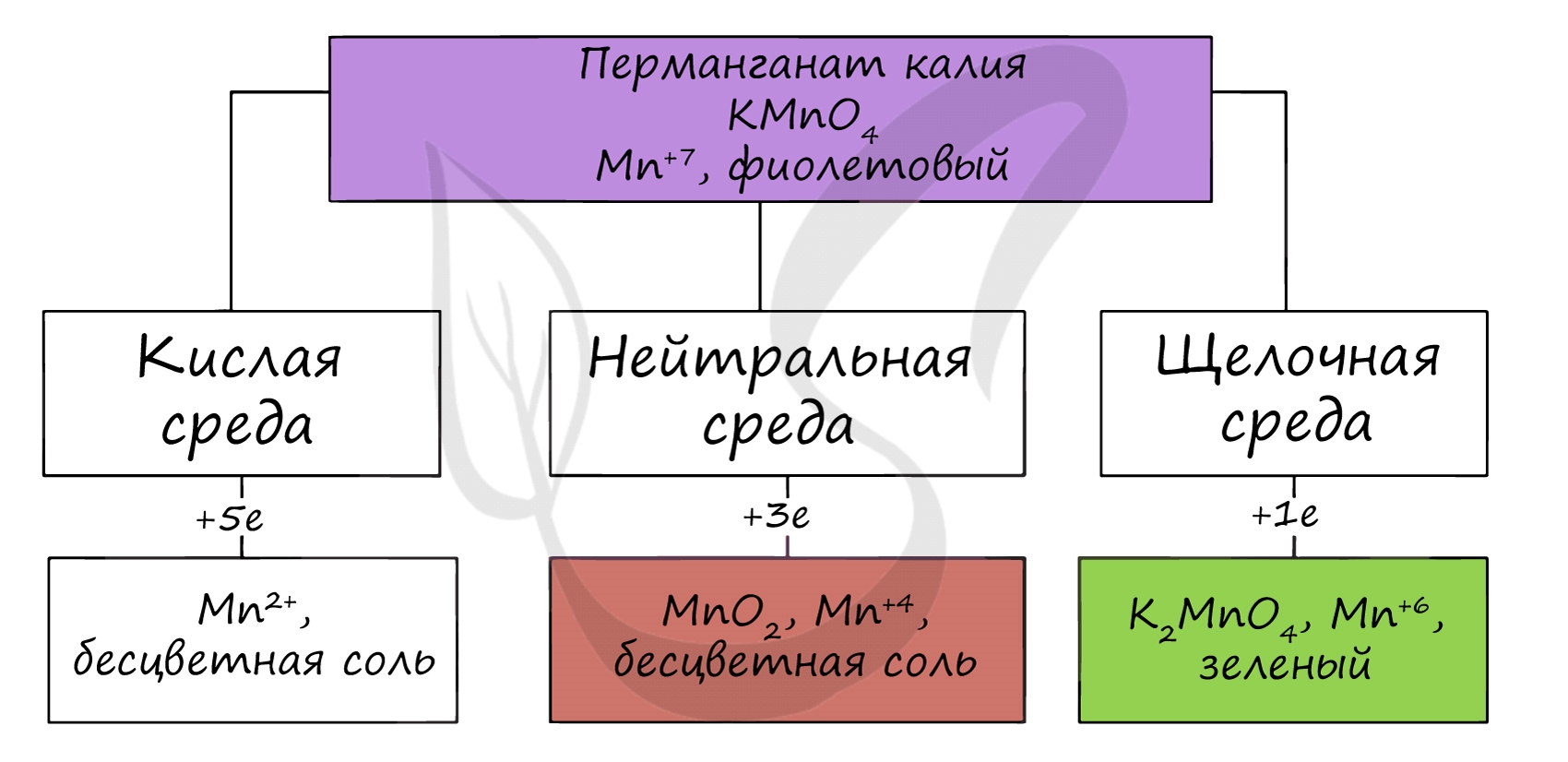
В реакциях с щелочами марганец переходит в СО +6, в кислой среде - принимает СО +2. MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда - щелочная)
Соединения марганца (VI) - MnO3, H2MnO4 - неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли - манганаты, окрашивающие раствор в зеленый цвет. Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
Соединения марганца (VII) - неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 - проявляют кислотные свойства. Соли марганцовой кислоты - перманганаты. В различных средах - кислотной, нейтральной и щелочной - марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами. При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты - перманганаты. Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II). В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение. При нагревании перманганата калия (в быту - марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой. В кислой среде марганец принимает наиболее устойчивую (для кислой среды) - Mn 2+ , в щелочной - Mn 6+ . Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke - зубец. С древнейших времен известен сплав меди с цинком - латунь.
Для цинка характерна постоянная степень окисления +2.
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2. ZnO + C = (t) Zn + CO ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород. Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия) Соединения цинка (II) Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка. Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами. ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия) Комплексные соли образуются в растворе, при прокаливании они не образуются. ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия) Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями. Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями. При прокаливании комплексные соли распадаются, вода испаряется. СереброДрагоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра. Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами. Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра - аммиачным раствором оксида серебра. Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты. Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. § 17. СОЕДИНЕНИЯ МАРГАНЦАПрименение и токсичность соединений марганца. Соединения марганца относятся к веществам, которые в ряде случаев являются причиной отравлений. Эти соединения применяются в технике и медицине. Оксид марганца (IV), так называемый пиролюзит, находится в природе. Он является полезным ископаемым, применяемым для получения металлического марганца и его солей. При перемалывании пиролюзита на мельницах образуется пыль, которая через легкие может проникать в организм людей и вызывать отравления. Оксид марганца (IV) используется как добавка к некоторым видам сталей, для обесцвечивания стекломассы, при изготовлении линолеума и некоторых лаков. В технике применяются некоторые соли марганца для изготовления красок. Перманганат калия является окислителем. Он применяется в медицине как дезинфицирующее средство. Отмечены случаи применения перманганата калия для криминальных абортов. Некоторые соли марганца применяются в химических лабораториях как реактивы. Марганец в незначительных количествах содержится в клетках и тканях организма (см. табл. 7). Соединения марганца относятся к числу сильных протоплаз-матических ядов. Они действуют на центральную нервную систему, вызывая в ней органические изменения, поражают почки, легкие, органы кровообращения и т. д. При использовании концентрированных растворов перманганата калия для полоскания горла может наступить отек слизистых оболочек рта и глотки. Прием внутрь концентрированных растворов соединений марганца может быть причиной перфорации желудка. Соединения марганца могут вызвать отек голосовых связок и т. д. При попадании концентрированных растворов соединений марганца в матку, влагалище, мочевой пузырь может появиться угроза перитонита. Соединения марганца накапливаются в печени. Они выделяются из организма через пищевой канал и с мочой. При патолого-анатомическом вскрытии трупов лиц, умерших в результате отравления соединениями марганца, отмечаются ожоги слизистых оболочек в различных участках пищевого канала, напоминающие ожоги, вызванные едкими щелочами. Обнаруживаются дегенеративные изменения в некоторых паренхиматозных органах. Исследование минерализатов на наличие соединений марганца Ионы марганца, содержащиеся в минерализатах, определяют при помощи реакций с периодатом калия и персульфатом аммония. После окисления ионов марганца этими реактивами образуются перманганат-ионы, имеющие фиолетовую окраску. Обе реакции являются специфичными для обнаружения ионов марганца, так как катионы других металлов при окислении указанными реактивами не дают фиолетовой окраски. Реакция с периодатом калия КIO 4. При взаимодействии ионов марганца с периодатом калия образуется темно-красный осадок. Образование этого осадка происходит главным образом в сильно разбавленных растворах соединений марганца. В присутствии фосфатов не образуется этот осадок, а происходит окисление ионов марганца Mn 2+ до MnO 4 - : Выполнение реакции. В пробирку вносят 1 мл минерализата, 4 мл воды, 1 мл насыщенного раствора дигидрофосфата натрия и 0,2 г периодата калия. После нагревания пробирки на кипящей водяной бане в течение 20 мин при наличии ионов марганца в минерализате раствор приобретает красно-фиолетовую или розовую окраску. Предел обнаружения: 0,1 мкг марганца в 1 мл. Граница обнаружения: 0,02 мг марганца в 100 г биологического материала. Реакция с персульфатом аммония. В зависимости от условий выполнения реакции персульфат аммония может окислять ионы марганца с образованием различных соединений. При кипячении в кислой среде без катализаторов персульфат аммония окисляет ионы марганца до марганцовистой кислоты Н 2 MnO 4 : Ионы железа (III), которые могут быть в минерализатах в больших количествах, затрудняют распознавание окраски перманганатионов. Для маскировки ионов железа прибавляют фосфаты, которые с ионами железа образуют бесцветный комплекс [Fe(РО 4 ) 2 ] 3- . На протекание реакции персульфата с ионами марганца влияет рН среды. Эта реакция хорошо протекает в 3 н. кислоте. При недостаточной кислотности образуется темно-бурый осадок марганцовистой кислоты Н 2 MnO 4, а при большом избытке кислоты может происходить восстановление перманганат-ионов персульфатом: Выполнение реакции. В пробирку вносят 1 мл минерализата, 4 мл воды, 1 мл насыщенного раствора дигидрофосфата натрия. Смесь нагревают на кипящей водяной бане в течение 5—6 мин. К горячему раствору прибавляют 1 каплю 10%-го раствора нитрата серебра и 0,5 г персульфата аммония. Смесь енова нагревают в течение нескольких минут (до разложения избытка персульфата). При наличии ионов марганца в минерализате появляется красно-фиолетовая или розовая окраска. Предел обнаружения: 0,1 мкг марганца в 1 мл. Граница обнаружения: 0,1 мг марганца в 100 г биологического материала. AcetylЧитайте также:
|