Взаимодействие металлов с солями и кислотами
Обновлено: 17.05.2024
1) С кислородом большинство металлов образует оксиды – амфотерные и основные:
Щелочные металлы, за исключением лития, образуют пероксиды:
2) С галогенами металлы образуют соли галогеноводородных кислот, например,
3) С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1.
4) С серой металлы образуют сульфиды – соли сероводородной кислоты:
5) С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании:
6) С углеродом образуются карбиды:
7) С фосфором – фосфиды:
8) Металлы могут взаимодействовать между собой, образуя интерметаллические соединения:
9) Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.
Электродные потенциалы металлов
Стандартный электродный потенциал — это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н + и ионов испытуемого металла Me n+ равны 1 моль-ион/л при стандартных условиях.
Ряд стандартных электродных потенциалов служит для сравнительной характеристики свойств атомов и ионов металлов в растворе.
Взаимодействие металлов с солями
При взаимодействии металлов с солями происходит реакция замещения: электроны от атомов замещающего – более активного металла переходят к ионам замещаемого – менее активного металла. То сеть происходит замещение металла металлом в солях. Данные реакции не обратимы: если металл А вытесняет металл В из раствора солей, то металл В не будет вытеснять металл А из раствора солей. В порядке убывания химической активности, проявляемой в реакциях вытеснения металлов друг друга из водных растворов их солей, металлы располагаются в электрохимическом ряду напряжений (активности) металлов.
Металлы, расположенные в этом ряду левее, более активны и способны вытеснять следующие за ними металлы из растворов солей. В электрохимический ряд напряжений металлов включён водород, как единственный неметалл, разделяющий с металлами общее свойство — образовывать положительно заряженные ионы. Поэтому водород замещает некоторые металлы в их солях и сам может замещаться многими металлами в кислотах, например:
Металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют его из растворов многих кислот (соляной, серной и др.) , а все следующие за ним, например, медь не вытесняют.
Взаимодействие металлов с кислотами
Все реакции неорганической кислоты с металлом приводят к образованию солей. Исключением является, пожалуй, лишь реакция благородного металла с царской водкой, смесью соляной и азотной кислоты. Любое другое взаимодействие кислот с металлами приводит к образованию соли. В случае если кислота не является ни серной концентрированной, ни азотной, то в качестве продукта выщепляется молекулярный водород.

Взаимодействие металлов с основаниями
Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды(Al, Zn, Cr и др.)
2Al+2KOH+2H2O=2KAlO2+3H2
Zn+2NaOH=Na2ZnO2+H2
Коррозия металлов, виды коррозии, борьба с коррозией.
Коррозией называют разрушение металла под воздействием окружающей среды.
Виды коррозии.
В зависимости от механизма процесса разрушения металла коррозия может быть химической и электрохимической.
Химическая коррозия возникает при действии на металл сухих газов или жидкостей органического происхождения, которые не являются электролитами. Примером химической коррозии служит окисление металла при высоких температурах, в результате чего на его поверхности возникает продукт окисления – окалина. Данный вид коррозии встречается редко.
Электрохимическая коррозия образуется в результате воздействия на металл электролитов (растворов кислот, щелочей и солей
В зависимости от характера окружающей среды электрохимическая коррозия может быть: атмосферной, подводной, почвенной, вызванной блуждающими токами.
Существуют различные методы защиты металлов от коррозии:
Лакокрасочные покрытия – наиболее распространенный вид антикоррозионной защиты металла. В качестве пленкообразующих материалов используют нитроэмали, нефтяные, каменноугольные и синтетические лаки, краски на основе растительных масел и др. Образующаяся при покрытии на поверхностях конструкций плотная пленка изолирует металл от воздействия окружающей его влажной среды.
Неметаллические покрытия довольно разнообразны. К ним относят эмалирование, покрытие стеклом, цементно-казеиновым составом, листовым пластиком и плитками, напыление пластмасс.
Металлические покрытия наносят на металлы гальваническим, химическим, горячим, металлизацией и другими способами.
При гальваническом способе защиты на поверхности металла путем электролитического осаждения из раствора солей металлов создается тонкий защитный слой какого-либо металла. Химическая обработка поверхности металла – изделия погружают в ванну с расплавленным защитным металлом.
Металлизация – распространенный способ защиты металлов в строительстве. Он состоит в нанесении сжатым воздухом тончайшего слоя распыленного расплавленного металла.
При защите легированием в металл вводят легирующие элементы, повышающие сопротивление сплава коррозии. Защита от огня.
Для защиты металлоконструкций наиболее перспективны вспучивающиеся покрытия или краски на основе полимерных связующих, которые при воздействии огня образуют закоксовавшийся вспененный расплав, препят-ствующий нагреву металла.
Для повышения предела огнестойкости (600 °С) металлических, в том числе алюминиевых, конструкций применяют также асбестоцементные, асбестоперлитовые, асбестовермикулитовые покрытия, наносимые пневмонапылением.
Новый вид огнезащиты – фосфатное покрытие толщиной 20-30 мм, представляющее собой стойкую (при 1000 °С) монолитную легкую массу.
Традиционные способы увеличения предела огнестойкости, использование облицовок и штукатурок из несгораемых огнезащитных материалов (кирпича, пустотелой керамики, гипсовых плит, растворов и др.).
Вопрос 11.
Типы химических реакций. Окислительно-восстановительные реакции: реакции межмолекулярного, внутримолекулярного окисления-восстановления, реакции самоокисления самовосстановления. Методы электронного и электронно-ионного баланса.
ТИПЫ КЛАССИФИКАЦИИ РЕАКЦИИ:
| По числу веществ и образующихся веществ | По изменению степени окисления атомов | |
| Без изменения степени окисления | С изменением степени окисления | |
| СОЕДИНЕНИЯ A + B = AB Из нескольких простых или сложных веществ образуется одно сложное | CaO+H2O=Ca(OH)2 PbO+SiO2=PbSiO3 | H2+Cl2=2HCl 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| РАЗЛОЖЕНИЯ AB = A + B Из сложного вещества образуется несколько простых или сложных веществ | Cu(OH)2=CuO+H2O CaCO3=CaO+CO2 NH4Cl=NH3+HCl | 4HNO3=2H2O+4NO2+O2 4KClO3=3KClO4+KCl |
| ЗАМЕЩЕНИЯ A + BC =AC + B Атом простого вещества замещает один из атомов сложного | CuSO4+Fe=FeSO4+Cu 2KBr+Cl2=2KCl+Br2 | |
| ОБМЕНА AB + CD = AD + CB Сложные вещества обмениваются своими составными частями | AgNO3+KBr =AgBr NaOH+HCl=NaCl+H2O |
По тепловому эффекту:
| Экзотермические реакции (теплота выделяется) | Эндотермические реакции (теплота поглощается) |
| 4Al+3O2 = 2Al2O3+Q | N2+O2 2NO-Q |
По присутствию других веществ:
| Каталитические ( протекают в присутствии катализаторов-веществ, ускоряющих реакцию) | Некаталитические |
| SO2+O2 SO3 | 2NO+O2 = 2NO2 |
Окислительно-восстановительными называют реакции, происходящие с изменением степеней окисления элементов, входящих в состав взаимодействующих веществ.
Степенью окисления атома в молекуле называют условный заряд, возникающий при смещении электронной пары к более электроотрицательному атому. Степень окисления подсчитывают, исходя из того, что сумма степеней окисления всех атомов в молекуле вещества равна нулю.
Окислитель присоединяет электроны и при этом восстанавливается (понижает свою степень окисления). Вещества, в состав которых входят элементы с максимальной степенью окисления, всегда являются окислителями.
Восстановитель отдает электроны и при этом окисляется (повышает свою степень окисления). Вещества, содержащие элементы с минимальной степенью окисления всегда являются восстановителями.
Таким образом, в окислительно-восстановительных реакциях происходит следующий процесс: окислитель(I) + восстановитель(II) ⇆ восстановитель(I) + окислитель(II)
Если в состав вещества входят элементы с промежуточной степенью окисления, то такие вещества могут проявлять как окислительные, так и восстановительные свойства.
Для составления уравнений окислительно-восстановительных реакций нужно знать окислительно-восстановительные свойства исходных веществ, на основании которых устанавливают состав продуктов реакции.
Если известна схема реакции (исходные вещества и продукты), то остается расставить стехиометрические коэффициенты. Для этой цели применяют методы электронного баланса и ионно-электронный.
Для реакций, протекающих в растворах, чаще всего используют ионно-электронный метод, сущность которого заключается в том, что для составления полуреакций процессов окисления и восстановления берут реально существующие в растворе ионы.
Для составления реакций окисления-восстановления следует:
1. Учитывать, в какой среде протекает окислительно- восстановительная реакция.
2. Написать уравнение реакции в молекулярной и ионной форме.
3. Выбрать ионы или молекулы, в которых элементы меняют степень окисления, т.е. выбрать окислитель и восстановитель.
4. Уравнять количество элементов в правовой и левой частях (в кислой среде при наличие кислорода он уравнивается молекулой воды, в щелочной кислород уравнивается удвоенным количеством гидроксильных групп, в нейтральной среде – слева только вода).
5. Уравнять количество зарядов в правой и левой частях путем добавления или отнятия электронов.
6.Уравнять число электронов, отданных восстановителем и принятых окислителем.
7. Сложить уравнения полуреакций с учетом найденных коэффициентов. Сократить одноименные ионы и молекулы, встречающиеся в обеих частях уравнения.
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
1. Взаимодействие металлов с неметаллами.
а) Взаимодействие металлов с водородом.
С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
Например:
Образуются нестехиометрические соединения с ионной кристаллической структурой.
б) Взаимодействие металлов с кислородом.
Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
Пример:
в) Взаимодействие металлов с галогенами.
Все металлы реагируют с галогенами с образованием галогенидов.
Пример:
В основном это ионные соединения: MeHaln
г) Взаимодействие металлов с азотом.
С азотом взаимодействуют щелочные и щелочноземельные металлы.
д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды. Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой.
С водой реагируют металлы, имеющие более отрицательный потенциал, чем окислительно-восстановительный потенциал воды.
Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей.
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей.
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
1 Zn 0 + 4OH – – 2e = [Zn(OH)4] 2– окисление
Zn 0 – восстановитель
1 2H2O + 2e = H2 + 2OH – восстановление
Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
5. Взаимодействие металлов с кислотами.
Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
По активности металлы условно делятся на активные, средней активности и малоактивные.
Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H + . При взаимодействии с металлами выделяется кислород (H2↑). С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
H2S↑ – c активными металлами
H2SO4 +6е S 0 ↓ – с металлами средней активности
SO2↑ – c малоактивными металлами
HNO3 +4,5e N2O, N2 – с металлами средней активности
NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe 2+ , Cr → Cr 2+ . При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe 3+ , Cr → Cr 3+ , при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Общие химические свойства металлов
В химических реакциях металлы выступают в роли восстановителейи повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.

В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
Общие химические свойства металлов
1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
- с азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании;
- с серой металлы образуют сульфиды – соли сероводородной кислоты;
- с водородом самые активные металлы образуют ионные гидриды (бинарные соединения, в которых водород имеет степень окисления -1);
- с кислородом большинство металлов образует оксиды – амфотерные и основные. Основной продукт горения натрия - пероксид Na2O2; а калий и цезий горят с образованием надпероксидов MeO2.
2) Следует обратить внимание на особенности взаимодействие металлов с водой:
- Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:Ca+2H2O=Ca(OH)2+H2↑
- Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
- Металлы средней активности окисляются водой при нагревании до оксида:
- Неактивные металлы (Au, Ag, Pt) - не реагируют с водой.
→[Li……Mg]MOH+H2↑ активные металлы (до Al)
H2O+M→[Al……PbMxOy+H2↑ среднеактивные металлы (от Al до H), только при нагревании
→[Bi……Au]≠ неактивные металлы (после Н)
Более подробно взаимодействие металлов с водой рассмотрено в темах, посвященных химии отдельных групп.
3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода:
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли и водорода в этих реакциях выделяется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему "Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металлас оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде. Металл вытесняет из соли только более слабый металл.
Например, для вытеснения меди из водного раствора сульфата меди подходит железо,
но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Химические свойства кислот
От производства лекарств до приготовления пищи — кислоты помогают человеку во многих областях жизни. В этом материале мы рассмотрим типичные свойства и реакции кислот с другими химическими веществами.
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами.
Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
Реакция не проходит
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
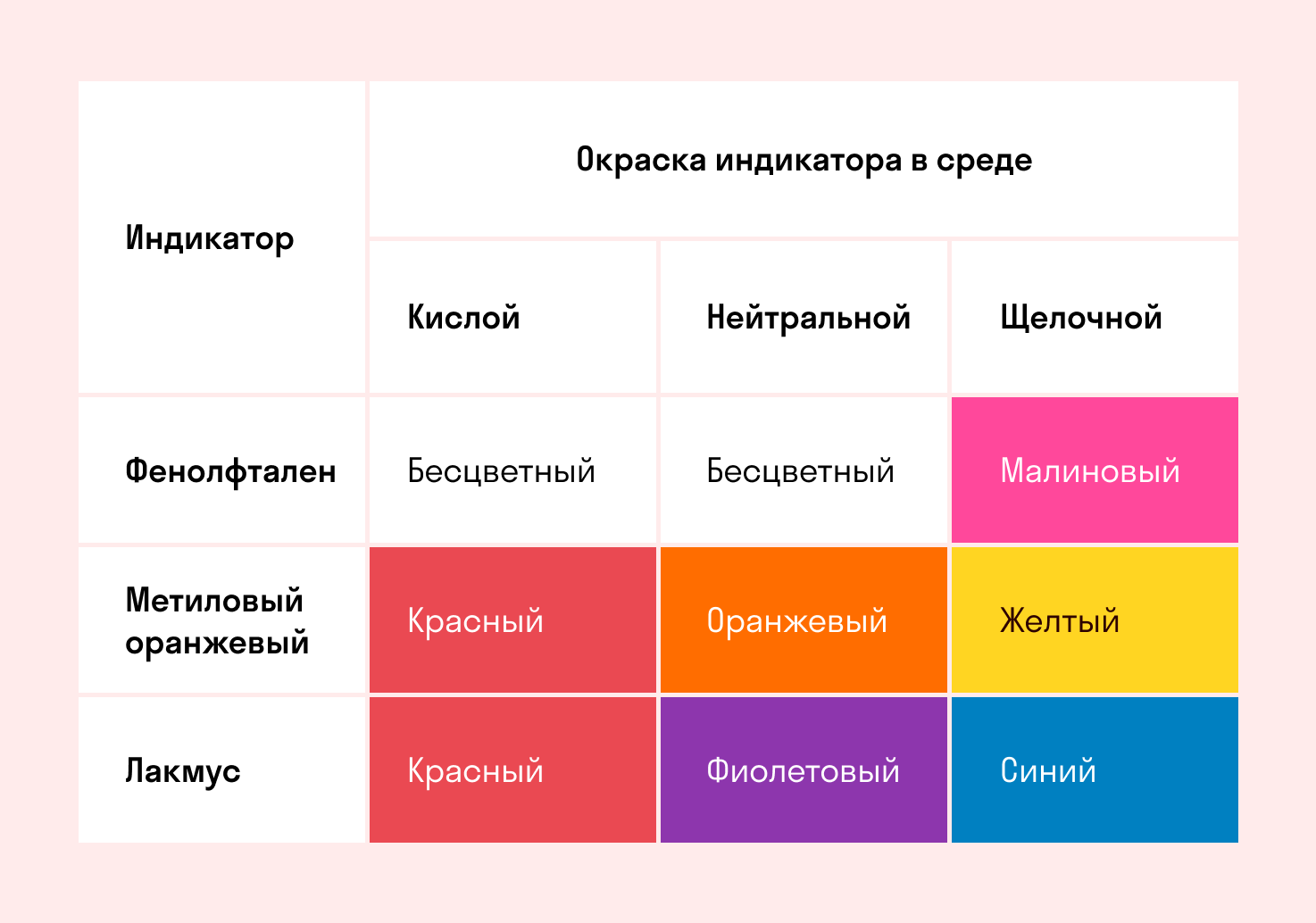
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Читайте также:
