Взаимодействие металлов со средой
Обновлено: 13.05.2024
Разнообразные жидкие и газообразные среды по механизму их контактного взаимодействия с твердыми телами могут быть разделены на четыре группы:
Примечание: одна и та же среда может быть физически, химически и электрохимически активной по отношению к одному конструкционному материалу и инертной к другому.
Механизм контактного взаимодействия физически-активных сред с конструкционными материалами основан на явлениях адсорбции среды на поверхности материала или ее абсорбции (поглощении) объемом материала, приводящих к изменению прочности и деформационных свойств этого материала. Подобные среды получили название сорбционно-активные.
Силы протяжения поверхностных молекул, атомов и ионов твердых тел, подобно поверхностным молекулам жидкости, не уравновешены притяжением молекул другой фазы, и результирующая сила направлена внутрь твердого тела. Вследствие этого твердые тела, так же как и жидкости, обладают определенным запасом свободной поверхностной энергии и стремятся уменьшить величину этой энергии до минимального при данных условиях значения. Этим объясняется способность твердых теладсорбировать газы и жидкости; при этом твердое тело является сорбентом, а вещество поглощаемое — сорбтивом.
Адсорбцией называется поглощение поверхностью твердого тела молекул, атомов и ионов другого вещества, находящихся в окружающей среде.
Протекание этого поверхностного процесса связано с изменением свободной поверхностной энергии. Мерой свободной поверхностной энергии единицы поверхности является поверхностное натяжение. В результате адсорбции жидких или газообразных веществ уменьшается поверхностное натяжение твердого тела. Вещество, уменьшающее поверхностное натяжение, называется поверхностно-активным.
Адсорбция происходитза счет сил межмолекулярного притяжения (ван-дер-ваальсовых), сопровождается небольшим положительным тепловым эффектом и является обратимым процессом. Ее обычно называют физической адсорбцией. В ряде случаев адсорбция сопровождается образованием поверхностных химических соединений, на образование которых нужно затратить энергию активации; такой вид адсорбции называется активированной. Этот вид адсорбции может быть необратимым. Скорость физической адсорбции при всех температурах достаточно велика и на гладкой поверхности протекает почти мгновенно, в то время как скорость активированной адсорбции резко увеличивается с повышением температуры. Поэтому при низких температурах происходит в основном физическая адсорбция, а при высоких - активированная.
Наиболее активное молекулярное взаимодействие происходит при контакте полярных веществ с полярным материалом поверхности твердого тела и неполярных веществ с неполярным материалом поверхности, т. е. когда полярность сорбтива и сорбента одинакова. Поскольку смачиваемость поверхности твердого тела жидкостью является показателем молекулярного взаимодействия жидкости и твердого тела, то адсорбционное взаимодействие на плохо смачиваемой поверхности твердого тела будет низкое и наоборот при хорошей смачиваемости достаточно высокое. Явление смачивания заключается в том, что капля жидкости, помещенная на поверхность твердого тела, растекается. Угол Θ, образуемый поверхностью растекающейся капли с поверхностью твердого тела, называется краевым углом. Условие равновесия капли
Из уравнения видно, что cosΘ является мерой избирательного смачивания, т. е. мерой полярности.
Твердое тело смачивают только тс жидкости, для которых cos Θ >0, т. е. Θ 1.2< Θ1.3, т. е. которые понижают поверхностное натяжение данного твердого тела на границе с воздухом. В случае смачивания молекулы жидкости испытывают сильное притяжение со стороны твердого тела, и жидкость растекается.
Наоборот, если силы притяжения между молекулами жидкости и твердого тела значительно меньше, чем между молекулами жидкости, то жидкость не смачивает поверхности.
Процесс объемного поглощения твердым телом жидкости или газа получил название абсорбция. В результате абсорбции уменьшается меж молекулярное взаимодействие в твердом теле, обусловленное более активным молекулярным взаимодействием сорбента и сорбтива. Примером абсорбции может служить поглощение металлом водорода, полимером водной среды и т. п. Следствием абсорбции полимером жидких сред является его набухание или растворение, что приводит к изменению прочности и деформационных свойств.
При объемном поглощении среды твердым телом может происходить химическое взаимодействие сорбтива с сорбентом. Подобный процесс сорбции получил название хемосорбция.
Механизм контактного взаимодействия химически-активных: сред с конструкционными материалами основан на их химическом взаимодействии по реакции Me + хМе х, приводящем к изменению состава и физических свойств этого материала. По отношению к металлам подобный процесс получил название химической коррозии, характеризующейся разрушением металла вследствие его непосредственной реакции со средой - неэлектролитом. Например, коррозия металлов, вызванная действием таких газов, как СО, Cl2, NH3, H2S, Н2, CO2, перегретый водяной пар или жидких неэлектролитов, например, нефти, продуктов ее переработки, расплавленной среды, органических соединений.
В результате взаимодействия ионов металла с кислородом на поверхности металла возникает оксидная пленка, скорость роста которой характеризует скорость коррозии и зависит от скорости химической реакции взаимодействия, скорости диффузии реагирующих веществ через пленку, скорости удаления продуктов реакции. При диффузии атомов металла сквозь пленку зоной роста будет внешняя поверхность пленки. Наоборот, если сквозь пленку диффундирует главным образом окислитель (кислород), то зоной роста пленки будет граница между пленкой и металлом. При соизмеримых скоростях встречной диффузии металла и кислорода зона роста пленки будет находиться внутри самой пленки. В связи с тем, что радиусы ионов металла заметно меньше радиуса иона кислорода, подвижность металлических ионов выше и зона роста смещается преимущественно к поверхности пленки.
Образующиеся на поверхности металла пленки тормозят коррозию.
Защитная способность этих пленок в значительной мере определяется их сплошностью. Показателем сплошности пленки служит отношение объема образующегося оксида или другого какого-либо соединения (Vокс) к объему израсходованного на образование оксида металла (Vмет), т.е. α = Vокс/ Vмет.
· Ориентировочно можно считать, что достаточно хорошими защитными свойствами обладают пленки при соблюдении условия
· При α>2,5 пленка теряет свои защитные свойства вследствие отслаивания и растрескивания, вызываемых внутренними напряжениями из-за разности удельных объемов оксидов и металла.
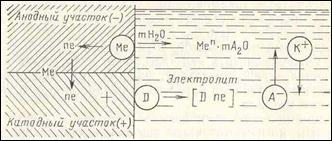
К электрохимически-активным средам относятся среды, обладающие свойствами электролита. Электрохимическая активность этих сред проявляется преимущественно при контакте с металлами и сплавами и обусловливает протекание электрохимической коррозии, представляющей собой самопроизвольный процесс разрушения металлов в электролитически проводящей среде, при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала. Разрушение металла в этом случае является результатом работы коррозионных элементов на отдельных участках поверхности металла, образующихся вследствие электрохимической гетерогенности этой поверхности.
Основными причинами электрохимической гетерогенности поверхности, обусловливающими образование на ней анодных и катодных участков, являются наличие различных примесейв металле, анизотропность кристаллической решетки, присутствие окислов и загрязнений на поверхности металла, неравномерное напряженное состояние в микрообъемах металла и др. Закономерности электрохимического поведения металлов определяются их химическим составом, составом электролита, и внешними условиями протекания процесса. В зависимости от этого возможны разные виды анодных и катодных реакций.
Наиболее типичными катодными реакциями являются восстановление водорода и кислорода.
Среды, вызывающие химическую и электрохимическую коррозию металлов исплавов, получили название коррозионно-активные среды.
К радиационно-активным средам относятся среды, в процессе распада которых образующиеся элементарные частицы (нейтроны, протоны, дейтроны и др.) воздействуют на кристаллическую решетку конструкционного материала, вызывая изменения структуры и механических свойств, особенно в совокупности с воздействием высоких температур.
Интенсивность разрушения металлов в условиях радиации зависит от радиолизного эффекта, обусловленного изменением химического потенциала окружающей среды в результате ее радиолиза свойств металла и свойств защитной пленки на его поверхности. Основными составляющими радиоактивного излучения являются: нейтроны, протоны, дейтроны, β - частицы (тяжелые частицы), γ - частицы, α - излучение (легкие частицы).
Химические свойства металлов
Общие представления о химической устойчивости металлов. Металлы и их сплавы – важнейшие конструкционные материалы. Чтобы иметь представление о химической устойчивости этих материалов, необходимо знать свойства металлов, их поведение в различных средах. Химические свойства металлов объясняются следующими особенностями.
Все металлы – восстановители, что обусловлено строением их атомов. Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо – атомы металлов характеризуются низкими энергиями ионизации и близким к нулю или отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей и превращаясь в положительные ионы и, как правило, не способны присоединять электроны – проявлять окислительные свойства.
Все металлы по восстановительным свойствам разделены на три группы:
1) активные металлы (в «Ряду напряжений» находятся от Li до Al включительно);
2) металлы средней активности (в ряду напряжений находятся от Al до H2);
3) малоактивные металлы (в ряду напряжений стоят после водорода).
Будучи восстановителями, металлы могут взаимодействовать с окислителями. Важнейшим окислителем, входящим в состав воздуха, является кислород. С кислородом взаимодействуют почти все металлы, кроме Ag, Au, Hg и платиновых металлов, причём щелочные и щелочноземельные взаимодействуют очень активно, так что уже при обычной температуре рубидий и цезий самовозгораются:
Хотя процессы взаимодействия других металлов с кислородом протекают менее активно, их окисление всегда термодинамически выгодно, т.к. сопровождается уменьшением свободной энергии Гиббса. Образующиеся при этом оксиды во многих случаях придают химическую устойчивость изделиям из металла.
Термодинамическая возможность реакции металла с тем или иным окислителем определяется условием или ЭДС реакции (Е = jо - jв ) положительна. Сравнение ряда потенциалов окислителей:
| F2/2F | Cl2/2Cl | Br2/2Br | O2/OH | H2O, H/H2 |
| +2,87 | +1,356 | +1,087 | +1,23 (рН=0) | 0,0 (рН=0) |
| +0,82 (рН=7) | -0,41 (рН=7) |
с электродными потенциалами металлов позволяет сделать следующие выводы. Все металлы окисляются фтором и могут окисляться хлором. Большинство металлов (кроме платины и золота) могут окисляться бромом и кислородом в кислой среде. В нейтральной среде кислород не может окислять золото, платиновые металлы, ртуть, серебро. Ионы водорода в кислой среде могут окислять многие металлы, кроме платиновых, ртути, золота, серебра, меди, рения, сурьмы и висмута. Реальная возможность окисления того или иного металла определяется не только термодинамикой, но и кинетикой процесса. Взаимодействие многих металлов с окислителями тормозится пассивными пленками на поверхности металлов.
Взаимодействие металлов с водой. Окислителем в этом случае является катион водорода (ион гидроксония Н3О+), присутствующий в результате равновесной реакции Н2О D Н+ + ОН.
Для того чтобы выяснить, какие металлы окисляются катионами водорода, концентрация которых обусловлена диссоциацией молекул воды, необходимо определить окислительно-востановительный потенциал водородного электрода в воде. При 25 о С и рН = 7 , Е = . ЭДС реакции будет положительна (Е > 0), если < - 0,41В. Значит, все металлы, имеющие стандартный электродный потенциал меньший, чем – 0,41В (в «Ряду напряжений» стоят до кадмия включительно), могут окисляться катионами водорода, т.е. восстанавливать водород из воды.
Чтобы процесс мог протекать до конца, необходимо, чтобы образующиеся гидроксиды Me(OH)n были растворимы в воде. В противном случае, вследствие образования малорастворимых оснований, покрывающих металл, реакция практически прекращается.
2Na + 2H2O ® 2 Na + + H2 + 2OH.
Процесс термодинамически возможен, т.к. < - 0,41B, но из-за образования малорастворимого Zn(OH)2, предохраняющего цинк от воздействия воды, практически не идёт.
Процесс термодинамически не возможен, т.к. > - 0,41B.
Приведённые выше расчёты указывают лишь на возможность осуществления процесса, а не на обязательное его протекание. В действительности существуют ограничения, которые препятствуют реализации такой возможности, а иногда полностью её исключают. Например, пассивацию поверхности металла малорастворимым соединением, в частности основанием, мы уже рассмотрели. На возможность реального осуществления реакции влияет реальное состояние поверхности (наличие оксидных плёнок). Так, в соответствии с электродными потенциалами металлы Be, Mg, Al, Ti и др. должны взаимодействовать с водой (восстанавливать катионы водорода из воды). Однако оксидные поверхностные слои, не растворимые в воде, исключают возможность такого взаимодействия. Нерастворимость TiO2 ни в воде, ни в разбавленных растворах кислот и щелочей обусловливает высокую химическую пассивность титана.
Взаимодействие металлов с растворами щелочей. Только амфотерные металлы Be, Al, Zn, Pb, Sn могут взаимодействовать с растворами щелочей по ионно-молекулярной схеме:
где n, m – степень окисления металла и заряд комплексного иона, соответственно.
В качестве примера рассмотрим взаимодействие бериллия с раствором гидроксида натрия. Схема процесса:
в-ль ок-ль продукт продукт
Схемы полуреакций и ионно-молекулярное уравнение:
1 Be + 4OH– 2eˉ = [Be(OH)4] 2-
Для определения металлов, восстанавливающих водород из щелочных растворов, т.е. для расчёта ЭДС реакции нельзя пользоваться потенциалами окислительно-восстановительных систем , т.к. металл, окисляясь, переходит в значительно более сложный ион – [Me(OH)n] m - . В подобных случаях надо рассматривать потенциал системы [Me(OH)n] m - /Ме.
Кроме того, концентрация [H + ] в щелочном растворе зависит от концентрации щелочи. Например, для 1М раствора NaOH [OH] = 1 моль/л; при 25 0 С [H + ] = = 10 -14 моль/л. Отсюда .
Взаимодействие металлов с растворами кислот.Минеральные кислоты HCl, H3PO4, H2SO4 разбавленная и др., за исключением HNO3 любой концентрации и H2SO4 концентрированной, являются окислителями металлов за счёт катионов водорода.
Для перечисленных кислот взаимодействие с металлами идёт по схеме:
Ме + 2Н + ® Ме n + + H2
Определим ЭДС данной ОВР в общем виде в стандартных условиях:
Чтобы металл мог восстанавливать катионы Н + до Н2 при взаимодействии с перечисленными минеральными кислотами, необходимо, чтобы его стандартный электродный потенциал был меньше нуля вольт и образующаяся соль была растворимой в воде (реакция будет идти до конца; в противном случае поверхность металла запассивируется).
, процесс термодинамически возможен.
1 Zn – 2eˉ = Zn 2+
Zn + 2H + = Zn 2+ + H2
, процесс возможен, но образующаяся в начальный момент малорастворимая соль PbSO4 покрывает металл пассивирующей солевой плёнкой и реакция практически прекращается.
Особенности взаимодействия металлов с растворами азотной кислоты. В азотной кислоте сильным окислителем является нитрат- ион NO, поэтому при её взаимодействии с металлами водород Н2 не выделяется, а протекает восстановление NO. Каким будет продукт восстановления - зависит от концентрации кислоты и активности металла.
Чем активнее металл и чем меньше концентрация кислоты, тем в большей степени восстанавливается азот (понижается его степень окисления). Азотная кислота как сильный окислитель окисляет металлы до высоких степеней окисления, взаимодействует со всеми металлами, стоящими в «Ряду напряжений», по серебро включительно.
В зависимости от концентрации кислоты и активности металла получаются следующие продукты:
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
1. Взаимодействие металлов с неметаллами.
а) Взаимодействие металлов с водородом.
С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
Например:
Образуются нестехиометрические соединения с ионной кристаллической структурой.
б) Взаимодействие металлов с кислородом.
Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
Пример:
в) Взаимодействие металлов с галогенами.
Все металлы реагируют с галогенами с образованием галогенидов.
Пример:
В основном это ионные соединения: MeHaln
г) Взаимодействие металлов с азотом.
С азотом взаимодействуют щелочные и щелочноземельные металлы.
д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды. Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой.
С водой реагируют металлы, имеющие более отрицательный потенциал, чем окислительно-восстановительный потенциал воды.
Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей.
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей.
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
1 Zn 0 + 4OH – – 2e = [Zn(OH)4] 2– окисление
Zn 0 – восстановитель
1 2H2O + 2e = H2 + 2OH – восстановление
Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
5. Взаимодействие металлов с кислотами.
Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
По активности металлы условно делятся на активные, средней активности и малоактивные.
Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H + . При взаимодействии с металлами выделяется кислород (H2↑). С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
H2S↑ – c активными металлами
H2SO4 +6е S 0 ↓ – с металлами средней активности
SO2↑ – c малоактивными металлами
HNO3 +4,5e N2O, N2 – с металлами средней активности
NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe 2+ , Cr → Cr 2+ . При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe 3+ , Cr → Cr 3+ , при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Коррозия металлов

Всякое явление или процесс вокруг нас связан с химией. Скажем, ржавление железа. Хоть раз в жизни вы наверняка задумывались, почему одни металлы ржавеют и разрушаются, а другие — нет. И что такого особенного в нержавеющей стали, что этот процесс ей нипочем? Обо всем это мы и поговорим в сегодняшней статье.
Коротко о главном
Коррозия металлов или ржавление в химии — это явление, которое возникает из-за взаимодействия металлической пластинки с веществами окружающей среды (кислородом воздуха или кислотами, с которыми может реагировать металлическое изделие).
Обычно окисляются металлы, включая железо, которые находятся левее водорода в ряду напряжений.

Чаще всего встречаются химическая и электрохимическая коррозии. Чтобы понять, чем они отличаются друг от друга, давайте сравним их по нескольким критериям в таблице ниже.
Таблица 1. Сравнение химической и электрохимической коррозии металлов
Признаки сравнения
Химическая коррозия
Электрохимическая коррозия
Разрушение металлов в из-за взаимодействия с газами или растворами, которые не проводят электрический ток
Разрушение металла, при котором возникает электрический ток в воде или среде другого электролита
При контакте железа с цинком коррозии подвергается цинк:
Zn 0 - 2e - = Zn 2+ .
Защитить металл от коррозии можно по-разному: покрытием защитными материалами, электрохимическими методами, шлифованием и т. д. Далее — подробно обо всем этом.
Что такое коррозия
Коррозия — это самопроизвольное разрушение элементов, чаще всего металлов, под действием химического или физико-химического влияния окружающей среды.
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии. Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама. Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Виды коррозии металлов
Химическая коррозия
Химическая коррозия — это процесс разрушения металла, который связан с реакцией между металлом и коррозионной средой.
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
газовая коррозия — металл корродирует под воздействием различных газов при высоких температурах;
коррозия в жидкостях — неэлектролитах.
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород. В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла, которое протекает при его взаимодействии с окружающей средой электролита.
Этот вид коррозии считают наиболее распространенным. Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики. Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
Гомогенный механизм электрохимической коррозии
Гетерогенный механизм электрохимической коррозии
Поверхность металла рассматривается как однородный слой.
У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке.
Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов.
Неоднородность можно наблюдать при наличии в сплаве каких-либо включений.
Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса.
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Как защитить металлы от коррозии
От коррозии можно и нужно защищаться. Чтобы уберечь металлы от этой реакции, их покрывают защитными материалами, обрабатывают электрохимическими методами, шлифованием и т. д. Рассмотрим все эти способы подробнее.
Способ № 1. Защитные покрытия.
Для защиты от коррозии металлические изделия покрывают другим металлом, т. е. производят никелирование, хромирование, цинкование, лужение и т. д. Еще один вариант защиты — покрыть поверхность металла специальными лаками, красками, эмалями.
Способ № 2. Легирование.
Легирование — это введение добавок, которые образуют защитный слой на поверхности металла. Например, при легировании железа хромом и никелем получают нержавеющую сталь.
Способ № 3. Протекторная защита.
Протекторная защита — это способ уберечь металл от коррозии, при котором металлическое изделие соединяют с более активным металлом. Этот второй металл в итоге и разрушается в первую очередь.
Способ № 4. Электрохимическая защита.
Чтобы защитить металлы от электрохимической коррозии, нейтрализуют ток, который возникает при ней. Это делают с помощью постоянного тока, который пропускают в обратном направлении.
Способ № 5. Изменение состава среды путем добавления ингибиторов.
Для защиты от коррозии используют специальные средства, которые ее замедляют — ингибиторы. Они изменяют состояние поверхности металла — образуют труднорастворимые соединения с катионами металла. Защитные слои, образованные ингибиторами, всегда тоньше наносимых покрытий.
Способ № 6. Замена корродирующего металла на другие материалы: керамику и пластмассу.
Способ № 7. Шлифование поверхностей изделия.
Проверьте себя
Что такое коррозия?
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
Гидроксид железа Fe(OH)3 называют:
Что является причиной возникновения коррозии?
Чем отличаются химический и электрохимический типы коррозии?
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их. Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!
Читайте также:
