Взаимодействие растворов солей с металлами лабораторная работа
Обновлено: 14.05.2024
1. Исследуйте, с какими из предложенных веществ (медь, цинк, карбонат калия, сульфат калия, нитрат серебра, хлорид бария) взаимодействует соляная кислота (или раствор серной кислоты). Результаты исследования занесите в таблицу.
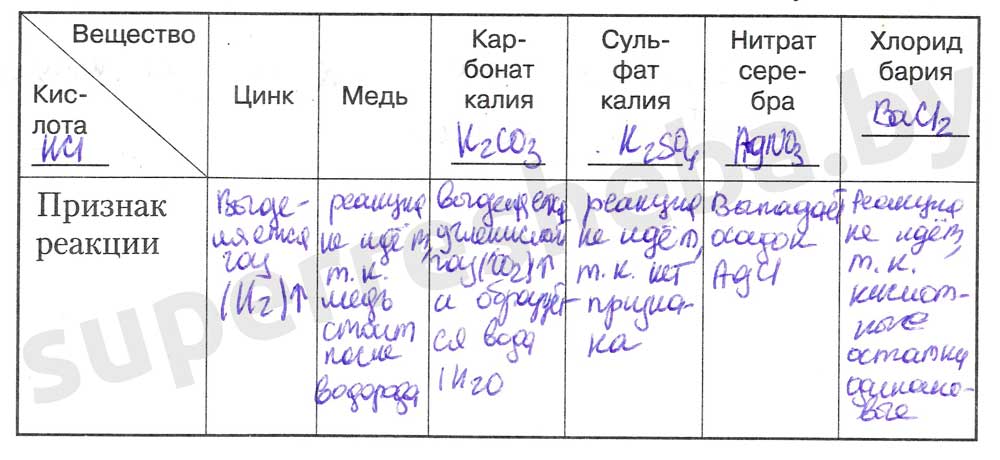
2. Составьте уравнения химических реакций в молекулярном и ионном виде.

Задание 2. Реакция нейтрализации.
1. Как изменилась концентрация ионов водорода в растворе после добавления гидроксида натрия?
После добавления гидроксида натрия концентрация H + \mathrm H + уменьшилась.
Удалось ли вам нейтрализовать кислоту?
В избытке осталась: ЩЕЛОЧЬ
2.Если в избытке осталась кислота, то попробуйте нейтрализовать ее еще одной порцией щелочи и опять определите p H \mathrm p H раствора ( < 7 \mathrm < 7 ).
После реакции индикаторная бумага изменила цвет на красный, следовательно, кислота в избытке.
3.Составьте уравнение химической реакции в молекулярном и ионном виде.

Реакция нейтрализации - взаимодействие сильной кислоты и сильной щелочи между собой с образованием соли и малодиссоциирующего вещества (воды).
Задание 1. Взаимодействие щелочей с солями.
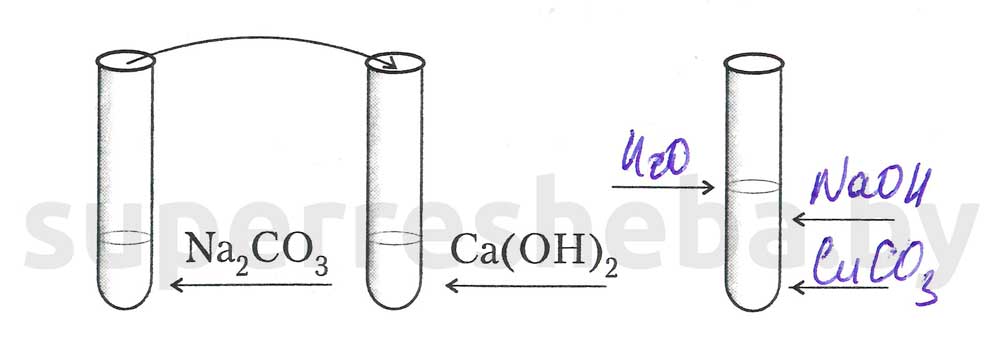
2.Составьте уравнение химической реакции в молекулярном и ионном виде.

Задание 2. Взаимодействие щелочей с солями с образованием нерастворимых оснований.
1.В пробирку с раствором хлорида железа (III) по каплям прибавляйте раствор гидроксида натрия до появления признаков реакции, которые отметьте на рисунке, укажите формулы веществ над стрелочками.
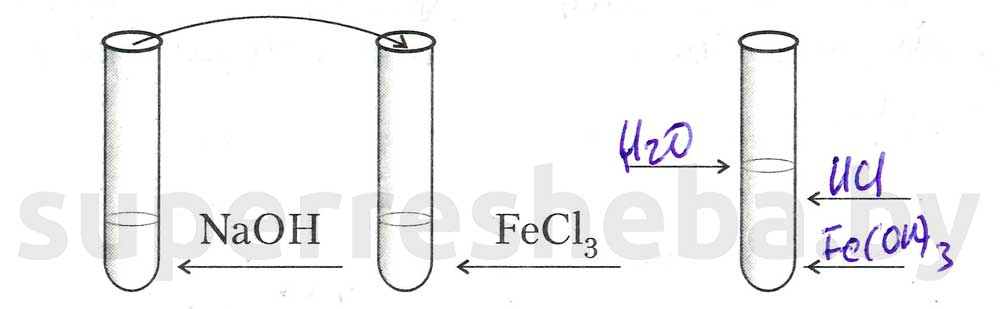

3.Сделайте вывод о свойствах щелочей как электролитов с учетом результатов выполнения заданий по изучению свойств кислот
С точки зрения теории электролитической диссоциации свойства щелочей обусловлены наличием в их растворах гидроксид-ионов O H − \mathrm O H − .
Задание. Взаимодействие солей со сложными веществами.
1.Дополните фразы, вставив пропущенные слова, формулы веществ или ионов.
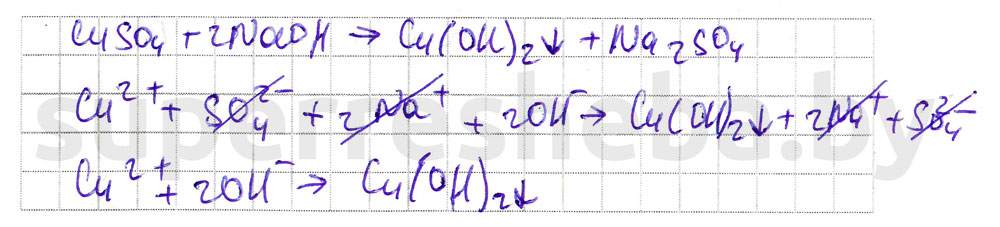
Дополните фразы, вставив пропущенные слова, формулы веществ или ионов.
3.Составьте уравнения химических реакций в молекулярном и ионном виде.
Соли (как электролиты) взаимодействуют с металлами, кислотами, солью и щелочами.
В итоге образуются новые соли, основания, кислоты.
Эти реакции относятся к реакциям ионного обмена.
Соли вступают в ОВР.
Изучение взаимодействия металлов с растворами кислот и солей (практическая работа по химии)

Данная работа является методическим сопровождением к учебному занятию по химии в рамках совершенствования ЗУН по химии в контексте изучения темы "Металлы".Работа включает технологическую карту занятия и инструктивную карту - справку для студентов.В качестве направляющих элементов в работу включены цели занятия,методы и приёмы обучения,а так же комплексно-методическое обеспечение,обозначены тип и форма занятия,детализирован ход занятия.
Просмотр содержимого документа
«Изучение взаимодействия металлов с растворами кислот и солей (практическая работа по химии)»
ТЕХНОЛОГИЧЕСКСЯ КАРТА ЗАНЯТИЯ
Преподаватель
Глухоедова Е.П.
Группа
Тема урока :
Изучение взаимодействия металлов с растворами кислот и солей.
Тип урока :
Урок совершенствования ЗУН.
Форма урока:
Цели урока:
Образовательные
-используя внутри и межпредметные связи, лабораторный эксперимент, совершенствовать знания о способности металлов взаимодействовать с растворами кислот и солей;
- определить взаимосвязи химических свойств металлов со строением их атомов.
Развивающие
- формирование навыков анализировать и делать выводы на основеконкретного химического эксперимента;
- формирование научного типа мышления, владения химической терминологией;
- продолжить развитие навыков составления реакций ионного обмена и ОВР на примере химических свйств металлов;
- продолжить формирование у учащихся способности к самостоятельной образовательной, учебно-исследовательской деятельности, навыков разрешения проблем.
Воспитательные
- продолжить формирование умения продуктивно общаться и взаимодействовать со сверстниками в процессе совместной деятельности; а также формирование навыков аккуратного ведения лабораторного журнала.
Методы и приёмы обучения:
Комплексно-методическое обеспечение:
Методы словесной передачи и слухового восприятия информации (приемы: лекция, беседа);
Методы наглядной передачи и зрительного восприятия информации (приемы: наблюдение, демонстрация);
Методы контроля (приемы: фронтальный опрос, самостоятельная работа).
Периодическая таблица химических элементов Д.И. Менделеева,ряд активности металлов;
Саенко О.Е. Химия для колледжей: учебник. – Ростов-на- Дону: Феникс, 2014г.
Ход занятия
Задачи данного этапа урока
Деятельность преподавателя
Деятельность учащихся
I. Организационный этап 2-3 мин
Мотивация к активной познавательной деятельности
Приветствие. Выявление отсутствующих.
Записывают тему урока .
II. Актуализация знаний 10-15 мин
Используя межпредметные связи (физика), сформировать представление о зависимости физических свойств металлов от их строения.
- формирование научного типа мышления, владения химической терминологией.
Прежде чем изучать химические свойства металлов, давайте вспомним закономерности в строении атомов металлов и общие физические свойства металлов.
Преподаватель раздает по одному тексту с вопросами на каждый ряд. В каждом тексте по 4 вопроса (на 4 группы) Задача – ответить на предложенные вопросы.
Задание 1-й группы (ряда) – закончить данные предложения.
Задание 2-й группы (ряда) – ответить на предложенные вопросы
Задание 3-й группы (ряда) – ответить на предложенные вопросы
- Благодаря металлической связи и металлической кристаллической решетке, металлы обладают общими физическими свойствами. Перечислите эти свойства.
Учащиеся в паре, отвечают на свой вопрос, передают ответ вперёд, первая парта зачитывает ответы ответы.
Отвечают на вопросы:
1. Если провести диагональ в ПСХЭ Д. И. Менделеева от бора к астату, то в левом нижнем углу будут находиться …(металлы)
2. У металлов на внешнем энергетическом уровне находится небольшое количество электронов
(1-2, реже 3-4 электрона)
3. Радиус атомов металлов сравнительно (большой).
4. Металлические свойства с увеличением порядкового номера в периодах ослабевают, а в группах сверху вниз усиливаются.
1. Тип химической связи в металлах? (металлическая) соответственно тип кристаллической решетки в металлах называется (металлической).
2.Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (Свободные электроны)
3.Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия называется (Пластичность)
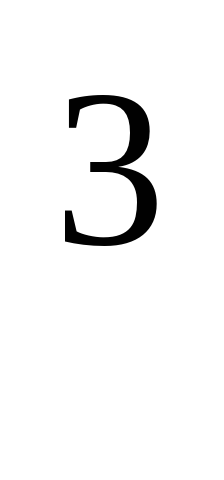
4.Какую плотность имеют легкие металлы ? (Плотность менее 5 г/см).Самый легкий металл? (Литий)
1.Металлическая связь обусловлена наличием (свободных) электронов.
2.Лучшие проводники электричества среди металлов? (Серебро, медь)
3.Какую температуру плавления имеют тугоплавкие металлы?
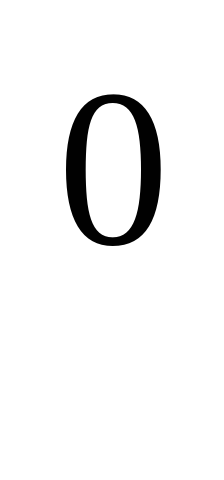
( Т плавл. более 1000С). Самый тугоплавкий металл? (Вольфрам).
4. Свойство поверхностью металла отражать световые лучи называется? (Металлический блеск)
Фронтально перечисляют основные физические свойства металлов.
III. Совершенствование знаний, умений и навыков ( в рамках проведения практической работы)- основной этап урока 35-45мин
ание навыков наблюдения и описания химических реакций с помощью естественного (русского, родного) языка и языка химии.
- формирование навыков проводить химический эксперимент
- формирование навыков описания свойств металлов на основе наблюдений за их превращениями;
- формирование навыков анализировать и делать выводы.
-формирование навыков составления уравнений реакций, подтверждающих химические свойства металлов
Учитель проговаривает основные задачи урока (принцип целеполагания):
Мы должны к заключению урока:
-знать общие химические свойства металлов;
-уметь записывать уравнения реакций, характеризующие особые химические свойства металлов;
-наблюдать, анализировать и прогнозировать химический эксперимент;
-получить навыки осуществления цепочек хим. превращений.
Часть 1. Экспериментальный этап
Преподаватель демонстрирует видеоэксперименты особенности взаимодействия различных металлов с кислотами и солями. ,характеризующие реакции взаимодействия
Опыт №1. Взаимодействие металлов с кислотами
Опыт №2. Взаимодействие металлов с растворами солей
Часть 2. Этап первичного применения полученных ЗУН
Групповая работа
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1.Анализируют ход опыта, делают выводы.
2.Описывают предложенный эксперимент.
3.Записывают в бланках уравнения соответствующих реакций.
4.Решают проблему, поясняя: с учетом правил по положению металлов в ряду напряжений:
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H2 Cu Hg Ag Pt Au
1.Активность металлов определяется по способности их вытеснять водород из состава кислот в зависимости от местонахождения металла в ряду (работа с таблицей «Электрохимический ряд напряжений металлов»).
с учетом правил по положению металлов в ряду напряжения
2.Наиболее активные металлы вытесняют менее активные из их солей (работа с таблицей «Электрохимический ряд напряжений металлов»).
Запись уравнений химических реакций согласно предложенной схеме- работа на месте, фронтально у доски
IV. Закрепление и обобщение полученных знаний. 10-15мин
- формирование навыков применять полученные знания, анализировать и делать выводы
V. Подведение итогов (рефлексия)
4-5 минут
- формирование навыков анализировать и делать выводы, подводить итоги
На этапе закрепления студентам предлагается выполнение индивидуальной работы по изучению химических свойств металлов.
Индивидуальные задания:
Вариант 1
Вариант 2
Фронтальная беседа, приём-кубик Блума
Выполнение работы по изучению химических свойств металлов с использованием инструкций (выполнение индивидуального задания на бланке)
Ответы на вопросы преподавателя в игровой форме.
VI. Домашнее задание. 3-5 мин
- продолжить формирование у учащихся способности к самостоятельной образовательной, деятельности.
Пояснения к домашнему заданию:
1.Подготовить отчёт по работе
2.ЗАПОМНИТЬ! Химические свойства металлов
3. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения,разберите по выбору одно уравнение с позиции ОВР, одно с позиции РИО.:
Приложения.
Приложение 1. Задания для групп.
Приложение 2. Инструктивная карта практической работы.
Приложение 1.
Закончите фразу:
Дайте ответ на вопрос:
2.Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (Свободные электроны)
2.Лучшие проводники электричества среди металлов? (Серебро, медь)
Приложение 2.
Практическая работа № 8 (инструктивная карта)
Тема: Изучение взаимодействия металлов с растворами кислот и солей.
Цель: (студент формулирует самостоятельно)
Оборудование: инструктивные карты
Часть 1
Опыт №1. Взаимодействие металлов с кислотами
Реактивы и оборудование: Магний, Аl (гранулы), железо , Zn (гранулы), 40%-ый раствор НCl; пробирки.
В три пронумерованные пробирки нальем 3 мл 40%-го раствора НCl и поместим в каждую гранулы магния, железа и алюминия, соответственно. В маленький кристаллизатор нальём небольшое количество 40%-го раствора НCl .
- в пробирке с магнием:
- в пробирке с железом:
- в пробирке с алюминием:
Проблема: все взятые металлы активны, однако они по-разному реагируют с водой?
Вывод по опыту:
Опыт №2. Взаимодействие металлов с растворами солей
Реактивы и оборудование: Zn (гранулы), Fe (железный гвоздь), (40%-ый раствор сульфата железа (II), пробирки.
В пробирку № 1 прильём раствор медного купороса (раствор СuSO4·5Н2О) объёмом 5 мл и добавим кусочек железа (железный гвоздь). В пробирку № 2 прильём раствор медного купороса (раствор СuSO4·5Н2О) объёмом 5 мл и добавим гранулу цинка.
Проблема:Все предложенные опыты – это опыты с использованием металла и соли другого металла, напишите уравнения реакции согласно предлож. эксперименту. Опишите наблюдения.
В колбе № 1: СuSO4 + Fe →
В колбе № 2: СuSO4 + Zn →
Часть 2
Задание 1. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Индивидуальные задания:
Задание на дом:
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения,разберите по выбору одно уравнение с позиции ОВР, одно с позиции РИО.:
Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей

Учебная цель: обобщить знания о металлах и их свойствах.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- строение атомов металлов и неметаллов, как это отражается на их окислительно-восстановительных свойства;
- понятие металлической связи; типы кристаллических решеток разных металлов;
- зависимость физических свойств металлов от их строения;
- распространенность металлов в природе в зависимости от их активности.
Обучающийся должен уметь:
- характеризировать металлы малых и больших периодов по их положению в периодической системе Д.И. Менделеева;
- устанавливать связь между строением веществ и их свойствами.
Просмотр содержимого документа
«Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей»
Задачи практического занятия:
Закрепить теоретические знания о свойствах металлов.
Ответить на вопросы для закрепления теоретического материала.
Выполнить практические задачи.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Габриелян О.С. и др. Естествознание. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
Периодическая система химических элементов им. Д.И. Менделеева;
Ряд стандартных электродных потенциалов Е 0 ;
Типы кристаллических решеток металлов.
Ряд напряженности металлов.
Тетрадь для практических и контрольных работ.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Металлы – группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение. По плотности металлы разделяют на легкие (до 3000 кг/м 3 ) и тяжелые (от 6000 кг/м 3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К). Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е 0 (приложение 4).
Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
Металлы взаимодействуют с неметаллами (обычно при нагревании):
Названия бинарных соединений металлов с неметаллами оканчиваются на -ид. Чем более электроотрицателен элемент, тем он сильнее окисляет металл. Например, железо в реакции соединения с хлором окисляется до степени окисления +3, а с серой до +2.
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям. При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.
Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.
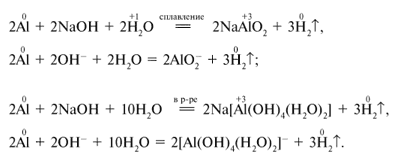
Более активные металлы вытесняют менее активные из растворов их солей.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла.
В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
Вопросы для закрепления теоретического материала к практическому занятию
Перечислить общие физические свойства металлов.
Что называется кристаллической решеткой, какие типы кристаллических решеток характерны для металлов?
Какие способы получения металлов Вы знаете?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Отчитаться о выполненной работе преподавателю.
Напишите уравнение реакции взаимодействия металла с кислотой
алюминий + серная кислота
железо + соляная кислота
Образец решения задания № 1
Напишите управление реакции цинка с соляной кислотой.
Алгоритм решения
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) до водорода вытесняют его из кислоты, поэтому уравнение реакции цинка с соляной кислотой имеет вид:
В результате реакции выделяется газ (H2) водород.
Напишите уравнение реакции замещения при взаимодействии металла с солью другого металла
алюминий + железный купорос
железо + медный купорос
Образец решения задания № 2
Напишите уравнение реакции замещения при взаимодействии цинка с медным купоросом.
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) левее вытесняют металлы из их солей, которые стоят правее, поэтому уравнение реакции цинка с медным купоросом имеет вид:
В результате реакции выделяется металлическая медь (красный осадок).
Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится.
Магний оксид магния хлорид магния гидроксид магния сульфат магния
Медь оксид меди сульфат меди гидроксид меди оксид меди
Образец решения задания № 3
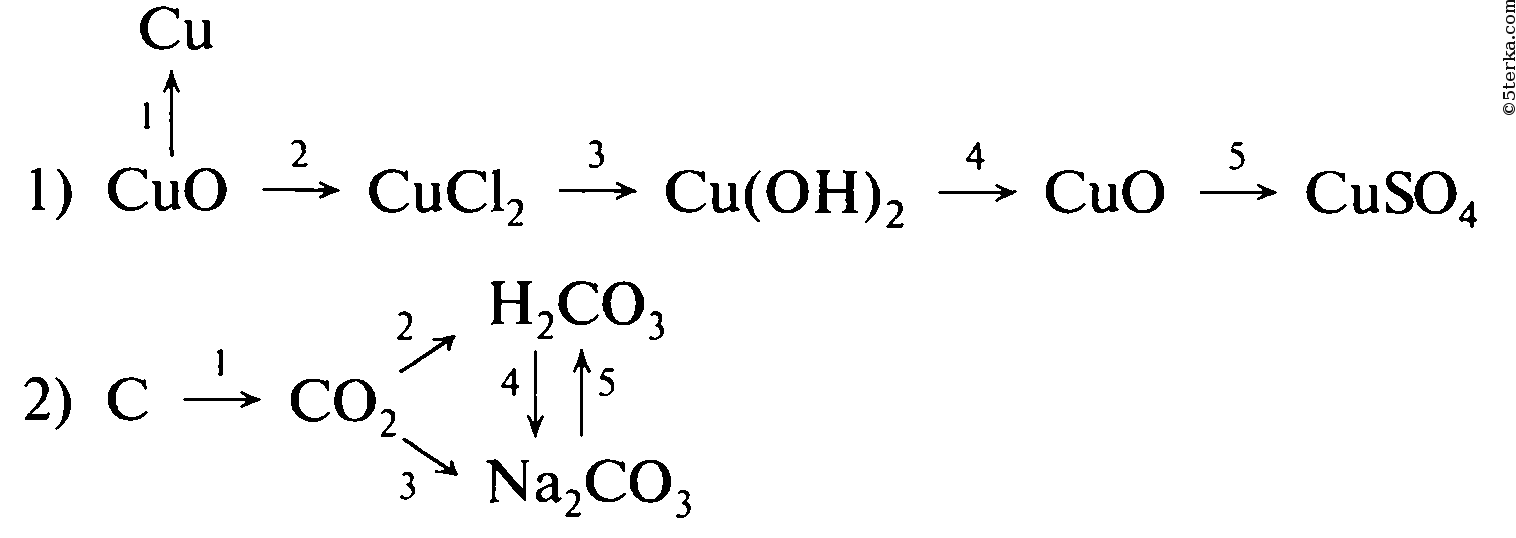
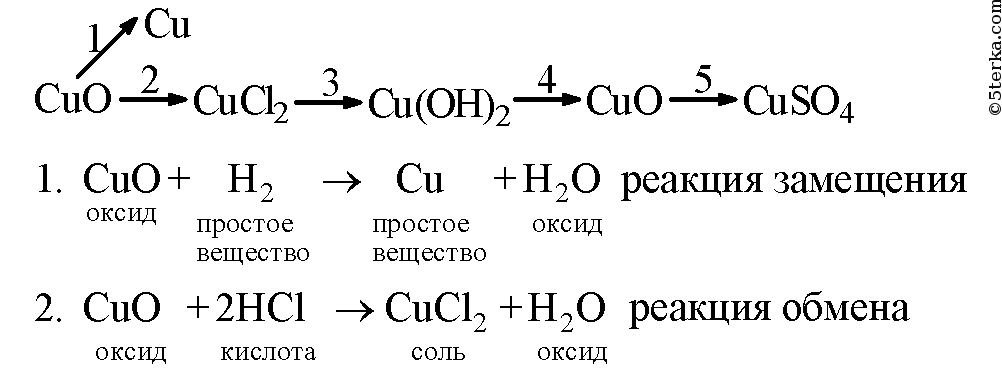
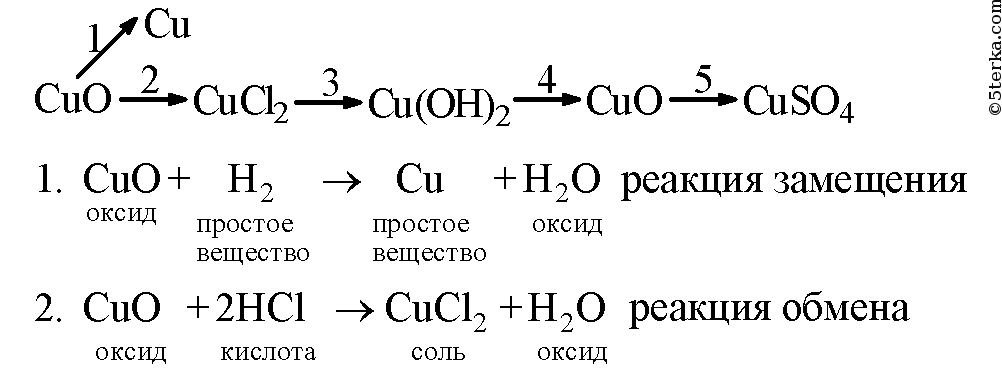
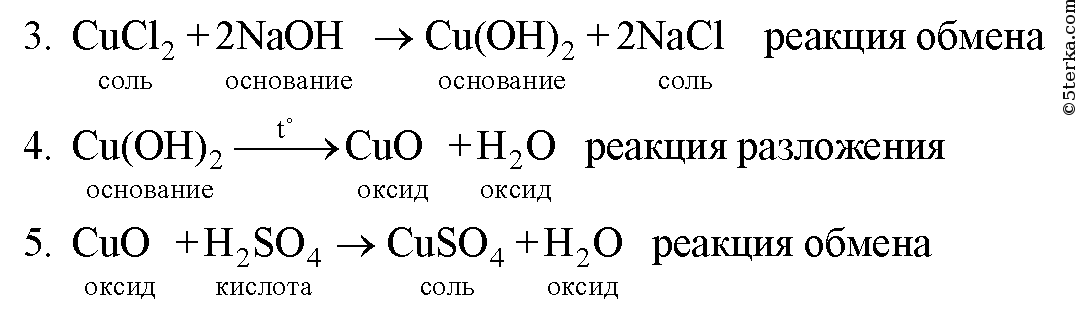
Вопросы для контроля
Перечислите основные химические свойства металлов?
Какую валентность проявляют металлы: натрий, цинк, серебро, медь, кальций, магний, железо, хром?
Запишите, где в вашей профессии и в жизни применяются металлы.
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
Практ. 2
Читайте также:
