Взаимодействие сероводородной кислоты с металлами
Обновлено: 28.09.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Кислоты. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью: Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ). По растворимости в воде кислоты можно поделить на растворимые и нерастворимые . Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые) . Подробно про классификацию кислот можно прочитать здесь.
Получение кислот1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота. кислотный оксид + вода = кислота Например , оксид серы (VI) реагирует с водой с образованием серной кислоты: При этом оксид кремния (IV) с водой не реагирует: 2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты. Неметалл + водород = бескислородная кислота Например , хлор реагирует с водородом: H2 0 + Cl2 0 → 2 H + Cl — 3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз. Например , электролиз раствора сульфата меди (II): 4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную. Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой. 5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями. Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты: Химические свойства кислот1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично. Например , соляная кислота диссоциирует почти полностью: HCl → H + + Cl – Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония: HCl + H2O → H3O + + Cl – Многоосновные кислоты диссоциируют cтупенчато. Например , сернистая кислота диссоциирует в две ступени: HSO3 – ↔ H + + SO3 2– 2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот. 3. Кислоты реагируют с основаниями и основными оксидами . С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты. нерастворимое основание + растворимая кислота = соль + вода основный оксид + растворимая кислота = соль + вода Например , гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой: При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой. С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода: щёлочь(избыток)+ кислота = средняя соль + вода щёлочь + многоосновная кислота(избыток) = кислая соль + вода Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты. При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1. При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты: В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами. Растворимая кислота + амфотерный оксид = соль + вода Растворимая кислота + амфотерный гидроксид = соль + вода Например , уксусная кислота взаимодействует с гидроксидом алюминия:
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.). Например , йодоводород можно окислить хлоридом меди (II): 4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0 6. Кислоты взаимодействуют с солями. Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит . Такие реакции протекают по механизму ионного обмена. Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например , соляная кислота взаимодействует с нитратом серебра в растворе: Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 — Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей . Например , карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная): 7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей. кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода Например , гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды: KHCO3 + HCl → KCl + CO2 + H2O Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия: При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей. Например , гидроксокарбонат меди (II) растворяется в серной кислоте: Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли. Например , гидроксохлорид алюминия взаимодействует с соляной кислотой: Al (OH) Cl2 + HCl → AlCl3 + H2O 8. Кислоты взаимодействуют с металлами. При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному. К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI и др. Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород: минеральная кислота + металл = соль + H2↑ Например , железо взаимодействует с соляной кислотой с образованием хлорида железа (II): Fe + 2 H + Cl → Fe +2 Cl2 + H2 0 Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции . Я настоятельно рекомендую выучить их наизусть. 9. Некоторые кислоты разлагаются при нагревании. Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания: Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании: AcetylХимия сероводорода
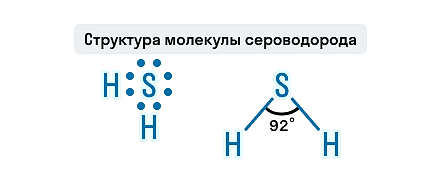
Чтобы сдать ОГЭ в 9-м классе, нужно знать, что такое сероводород, и помнить его химические свойства. Давайте узнаем, что это за вещество, как его получают и в какие реакции оно вступает. О чем эта статья: Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S. Строение и физические свойства сероводородаСероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит. Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа. Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора. Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода. Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни. Способы получения сероводородаСероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов. При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород: Практический способ получения сероводорода — действие разбавленных кислот на сульфиды: Полный гидролиз, в результате которого выделяется газ и выпадает осадок: Сероводород можно получить путем нагревания смеси парафина и серы: Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы: Химические свойства сероводородаГорениеНа воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях: Полное горение. Продукты реакции — диоксид серы и вода: Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета: Растворимость в водеСероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется. Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени: Свойства кислотТак как раствор сероводорода является кислотой, то для него характерны свойства кислот: изменение цвета индикатора — лакмус становится розовым в растворе сероводорода; взаимодействие с активными металлами: раствор сероводорода реагирует с основными оксидами: взаимодействие со щелочами: сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид: Взаимодействие с аммиакомРаствор сероводородной кислоты взаимодействует с аммиаком: Окисление металловСероводород может окислять малоактивные металлы в присутствии кислорода: Реакции с галогенамиСероводород вступает в реакции с галогенами: Качественные реакцииКачественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода: Восстановительные свойстваВ молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя. При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя: в реакции с бромной водой наблюдается обесцвечивание раствора: окисление сероводорода подкисленным раствором перманганата калия: сероводород в кислой среде реагирует с дихроматом калия: взаимодействие с кислотами-окислителями (HNO3, H2SO4): Вопросы для самопроверкиОхарактеризуйте физические свойства сульфида водорода. Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов? Схеме превращений S −2 → S +4 соответствует уравнение: Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2. Верны ли следующие суждения? А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые. Читайте также:
|