Взаимодействие шлака и металла
Обновлено: 19.05.2024
Шлаки представляют собой жидкие минеральные фазы, отделяющие зеркало металла от непосредственного действия газовой атмосферы. Шлаки не изолируют металл от окружающей газовой среды, а только заменяют непосредственное взаимодействие диффузионным. Нерез шлак могут диффундировать газы или металлы (ш'виде своих низших оксидов) на границу раздела с газами, там окисляться и, возвращаясь к металлу, передавать захваченный кислород. Так, железо, обладающее переменной степенью окисления, может переносить кислород по следующей схеме (в круглых скобках — компоненты шлака):
6 (FeO) + 02-r2(Fe304)
Металл 6[FeO] 2Fe 8[FeO]
Взаимодействие шлаковой фазы с металлом полностью зависит от ее состава, обычно сложного, и температуры. Равновесие между компонентами шлаковой и металлической фаз и возможность возникновения окислительно-восстановительных процессов определяются обобщенно законом распределения (см. п. 8.4). Активное взаимодействие шлака и металла при высоких температурах сварочного процесса приводит к изменению состава металла шва и это необходимо учитывать при разработке технологии сварки.
По типу взаимодействия с металлической ванной шлаки разделяются на окислительные и восстановительные. Например, если обозначить [FeO] концентрацию оксида в металле, a (FeO) — в шлаке, то можно написать выражение закона распределения:
LFe0= [FeO]/(FeO) =f(T). (9.60)
Если LFeo - (FeO) > [FeO], то шлак будет окислительным, и, наоборот, если LFe0* (FeO)
Значение Z, Feo зависит не только от температуры, но и от состава шлака и определяется обычно экспериментально. Для сварки употребляют только восстановительные шлаки и при производстве сварочных флюсов для автоматической сварки их тщательно раскисляют, а содержание FeO, S и Р строго регламентируется ГОСТом.
ГЛАВНЫЕ КОМПОНЕНТЫ ШЛАКОВЫХ СИСТЕМ
Составы шлаковых многокомпонентных фаз варьируются в широких пределах в зависимости от того, какие металлы или сплавы подвергаются процессу сварки. Так, алюмосиликатные флюсы, т. е. заранее приготовленные шлаки, удовлетворяющие процессам сварки сталей, непригодны для сварки титана или алюминия, так как эти металлы могут восстанавливать компоненты шлака и тем самым изменять состав металла шва. Поэтому компоненты шлаковых фаз должны обладать достаточно высокой термодинамической устойчивостью.
Главные компоненты шлаковых фаз по своему химическому характеру распределяются следующим образом:
(вещества в скобках очень редко входят в состав шлаков, а Р2О5 и В2О3 могут входить в состав шлаков только при сварке медных сплавов).
По своему составу сварочные шлаки можно разделить на алюмосиликатные, которые очень широко применяются при сварке сталей, и бескислородные, или фторидные, имеющие применение при сварке цветных металлов, например титановых сплавов.
Алюмосиликатные шлаки. В состав этих шлаков входят Si02. AI2O3 и основные оксиды.
Диоксид кремния Si02: ДЯ°= —910,9 кДж/моль (кварц); температура плавления Тпл= 1983 К - Имеет шесть полиморфных превращений в зависимости от температуры и условий кристаллизации: а-, р-кварц а-, p-тридимит а-, p-кристобаллит жидкость. При быстром охлаждении жидкого диоксида кремния получается кварцевое стекло. Шлаки с большим содержанием Si02 дают в изломе стекловидную структуру и обладают хорошими технологическими свойствами (формирование шва, отделяемость шлака). Диоксид кремния образует многочисленные соединения с участием оксидов металлов — соли. Солеобразование Si02 можно рассматривать как взаимодействие нейтральных молекул или как образование регулярного ионного раствора (см. п. 8.4), так как жидкий шлак проводит электрический ток и представляет собой электролит.
Молекулярные комплексы с оксидом кальция образуются по следующим реакциям:
CaO-t-2SiC>2~* (СаО) (Si02)2-*CaSi20s;
СаО + БіОг—(СаО) (Si02) —CaSi03 (метасиликат); 3Ca0+2Si02—(СаО)з (Si02)2—Ca3Si207;
2Ca0 + Si02—(CaO)2 (Si02)-vCa2Si04 (ортосиликат).
Другие основные оксиды (FeO; MnO; MgO) дают аналогичные полисиликаты, но соли кальция наиболее устойчивы, так как обладают меньшим обобщенным потенциалом (см. п. 8.4).
Состав комплексных ионов и их строение будут меняться в зависимости от соотношения числа ионов 02~ и молекул Si02, т. е. от состава шлака. Ниже приведены составы соединений для различного числа ионов О2-, приходящихся на одну молекулу Si02
Число ионов О2- 0,5 0,75 1 1,5 2,0
Соединение. . Са2++ ЗСа2+-|- Са2+-|- ЗСа2+-|- 2Са2++
+[Si205]2- +[Si40„]6- +[Si03l2-* +[Si207]6- +[Si04]4-
2Si02^Si4+ + Si0j-; 3Si02^Si4+ + 2Si032^,
но вообще этот процесс энергетически маловероятен. Солеоб - разование в результате реакции между оксидом кальция и кремнеземом можно проследить по диаграмме плавкости СаО—Si02, приведенной на рис. 9.32.
Солеобразование в системе Si02—А1203 можно проследить по диаграмме плавкости (рис. 9.33); главное соединение — муллит ЗА1203• 2Si02 или Al6Si20i3.
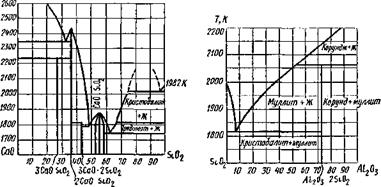
Рис 9 32 Диаграмма плавкости си - Рис 9 33 Диаграмма плавкости
стемы СаО — S1O2 (массовые доли) системы S1O2—AI2O3 (массовые
Диоксид титана ТЮ2:ДЯ° = — 943 кДж/моль; температура плавления 7’Ш1=2115 К. Образует две формы кристаллов — рутил и анатаз. Термодинамическая устойчивость ТЮ2, несмотря на низкое значение ДЯ°, меньше, чем у Si02, так как он может восстанавливаться в свои более низкие оксиды, оставаясь при этом окислителем:
Ті02-* Ті 3О5—Ті203—ТЮ.
Создание окислительной среды без восстановления до чистого Ті широко применяется в сварочной технике (рутиловые электроды). Солеобразование диоксида титана в основном напоминает солеобразование диоксида кремния, но Ті — элемент 4 периода периодической системы Д. И. Менделеева, его гибридные орбитали менее устойчивы и способность образовывать комплексные ионы [TiOt]4- выражена тоже значительно слабее. Типичными солями для него будут метатитанаты:
FeO + Ti02—FeTiCh (ильменит);
СаО + ТіОг-^СаТЮз (перовскит);
ВаО + ТЮ2-*ВаТЮз (метатитанат бария),
последний обладает значительным пьезоэффектом. С позиций теории регулярных ионных растворов процесс солеобразования можно представить следующим образом:
Таким образом, диоксид титана представляет собой кислотный оксид, но его активность солеобразования ниже, чем у Si02.
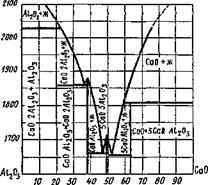
Рис 9 34 Диаграмма плавкости системы СаО—АЬОз (массовые доли)
Полуторный оксид алюминия А1203: А Н° —
= — 1675 кДж/моль; температура плавления Гпл=
= 2323 К. Оксид в виде а-корунда обладает высокой термодинамической устойчивостью и не гидратируется.
В шлаках А120з ведет себя как амфотерный оксид, образуя соли с Si02 (муллит), и реагирует с основными оксидами, образуя комплексные анионы:
анион метаалюминатов А120з + 02_—
анион ортоалюминатов АЬОзН-302~-*2[АЮ3]3_.
Процессы солеобразования можно проследить по бинарной диаграмме плавкости системы СаО—А120з (рис. 9.34).
Полуторный оксид хрома Сг203, присутствовавший в шлаках при сварке хромоникелевых сталей, изоморфен корунду и образует с ним твердые растворы, окрашивая их в розовый цвет.
Основные оксиды, присутствующие в сварочных шлаках и флюсах — это СаО, MgO; FeO, МпО, иногда присутствует NiO. Эти оксиды служат источником ионов О2-, которые связывают оксиды Si02, Ті02 и А120з в сложные анионы и понижают этим их химическую активность. У этих оксидов различная термодинамическая устойчивость и эффективные потенциалы ионов, влияющие на процессы их диссоциации.
Нейтральные компоненты шлаковых фаз представляют собой обычно фториды активных металлов, обладающие высокой термодинамической устойчивостью. В ряде случаев их совместные системы могут использоваться как бескислородные или фторид - ные шлаки.
Флюорит CaF2:A Н° = —1214,6 кДж/моль; 7’njl= 1673 К; Гкип=2773 К. В воде почти не растворим, не гидратируется. Флюорит образует легкоплавкие эвтектики со многими веществами, за что и получил русское название «плавиковый шпат». В сварочной металлургии он применяется очень широко и позволяет регулировать не только температуру, но и вязкость и поверхностное натяжение шлаков, что очень важно для металлургической обработки сварочной ванны.
Флюорит CaF2 хорошо диссоциирует на ионы в расплаве:
и его можно характеризовать как «основной» компонент, так как он тоже связывает, но в летучие соединения, молекулы Si02 и ТЮ2:
1) 2CaF2 + Si02^±2Ca0 + SiF4t;
2) 2CaF2 + Ti(W2CaO + TiF*t.
Эти реакции, равновесие которых значительно сдвинуто в сторону образования летучих соединений уже при 1000 К обогащают атмосферу дуги фторидами, которые частично связывают водород и уменьшают его поступление в металл шва из газовой фазы:
3) SiF4 + 2H20^Si02+4HFt;
4) SiF4 + H2O^SiOF2 + 2HFf.
Фтористый водород более устойчив, чем, например, радикал ОН*, получающийся при диссоциации водяного пара: 2Н20^ ^Н2 + 20Н*.
На основе флюорита CaF2 готовят флюсы для сварки деталей больших толщин из титановых сплавов, так как при реакциях е высокоактивным титаном загрязнения металла практически не происходит: Ti-)-2CaF2^:TiF4t +2Caf (температура кипения кальция 1755 К).
В шлаковых галидных системах используются еще такие га - лиды, как CaF2 (АН°= — 1230 кДж/моль; 7^= 1633 К; 7’кип = = 2773 К), NaF (ДН°=-573,6 кДж/моль; 7ПЛ=1265 К; Ткяа= = 1973 К), KF (ДН°=-567,4 кДж/моль, Гпл=1130 К, Ткш= = 1773 К), а также КС1 и NaCl, которые вводят в состав шлаков для регулирования температуры плавления, электропроводности и вязкости шлаковых систем.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ШЛАКОВ
Ранее упоминалось, что теория шлаковых фаз была основана на образовании молекулярных комплексов, построенных из оксидов различного типа. Эта теория в основном дает правильные результаты, но бывают значительные отклонения, указывающие на то, что молярные (или массовые) доли веществ не отражают истинных активных концентраций. Это вполне понятно, так как в многокомпонентном растворе различные компоненты влияют друг на друга, при этом коэффициенты активности приобретают различные значения
Теория молекулярных комплексов всегда давала правильные результаты (полуколичественно) и позволяла прогнозировать процессы взаимодействия металла со шлаком.
Развитая в трудах О. А. Есина и его школы (Свердловск) теория регулярных ионных растворов, учитывающая энергетическое различие ионов (энергия смешения) и образование комплексных анионов Si*0/~ в результате захвата молекулами SiCb ионов О2-, позволила теоретически определить взаимодействие между ионами и дала метод расчета коэффициентов активностей компонентов исходя из основных положений статистической термодинамики. Основы этой теории изложены в монографии
В. А. Кожеурова «Термодинамика металлургических шлаков» и в ряде последующих работ. Основной вывод из этой теории— возможность вычисления энергии Гиббса для всей системы регулярного ионного раствора.
При различных массовых соотношениях одних и тех же компонентов шлак может быть или основным, или кислым. Если основной шлак содержит до 10% Si02, то можно пренебречь ком - плексообразованием Si*Ofi - и ограничиться только расчетом энергий взаимодействия ионов между собой. В этом случае получаем совершенный ионный раствор (СИР). Но если шлак кислый и содержит много комплексных ионов SixO/“, то нужно также учитывать энергию и энтропию образовавшихся комплексов, т. е. рассматривать шлак как регулярный ионный раствор (РИР).
Недостаток достоверных данных сильно затрудняет точные расчеты, так как термодинамические данные, полученные из рассмотрения бинарных диаграмм состояния, переносить на многокомпонентные системы можно лишь условно. Тем не менее расчеты по этой системе уже нашли применение в сварочной металлургии для определения основности шлаков В и активностей" наиболее важных компонентов шлаковых фаз (Si02; МпО).
Физические свойства сварочных шлаковых систем. Температура плавления сварочных шлаков должна быть, как правило, ниже, чем температура кристаллизации свариваемого металла. Температура плавления в сложных системах представляет собой функцию состава и определяется соответствующими диаграммами плавкости (состав — свойство). Сплавы силикатов и алюмосиликатов обладают способностью к переохлаждению и образованию стекловидных шлаков, а это обстоятельство осложняет задачу экспериментального исследования.
Рис. 9.35. Треугольник составов тернарной системы (Гиббс)
Рис. 9 36. Схематический вид диаграммы плавкости системы СаО— Si02—АЬОз
Ранее были показаны двойные диаграммы плавкости систем компонентов шлака: Si02—СаО (рис. 9.32), А120з — Si02
(рис. 9.33), АЬОз—СаО (рис. 9.34).
Диаграмма плавкости существенно осложнится, если эти три компонента будут присутствовать одновременно в шлаковой системе — могут возникнуть не только двойные, но и тройные соединения — алюмосиликаты:
анортит CaAl2Si20e (АН°=—4223,9 кДж/моль), геленит Ca2Al2Si07 (ДН° = — 3986,9 кДж/моль), которые тоже будут образовывать растворы и эвтектики с другими компонентами сплава.
Для трехкомпонентной (тернарной) системы диаграммы плавкости будет уже объемной: вместо оси составов, на которой можно задать состав двухкомпонентной системы, состав будет определяться треугольником Гиббса (рис. 9.35). Стороны правильного треугольника будут представлять собой оси составов бинарных сплавов, а медианы, совпадающие с биссектрисами и высотами, будут показывать содержания данного компонента в тернарном сплаве. Оси температур — перпендикуляры, восставленные из вершин треугольника. Общий схематический вид диаграммы плавкости системы СаО—А1203— Si02 приведен на рис. 9.36 в виде волнистой поверхности с глубокими впадинами эвтектик.
Однако пользоваться такой диаграммой невозможно. Тогда проводят изотермы, представляющие собой плоскости, параллельные основанию, и проектируют кривые сечений на треугольник Гиббса с соответствующим обозначением температур. Треугольник Гиббса с горизонталями приведен на рис. 9.37. Экспериментальное исследование такой диаграммы плавкости очень трудоемко и пригодно только для трехкомпонентных шлаков. Такого же типа диаграммы плавкости построены для систем MgO— А120з—Si02; МпО—Si02—А1203; FeO—МпО—Si02 и др, встрсча-
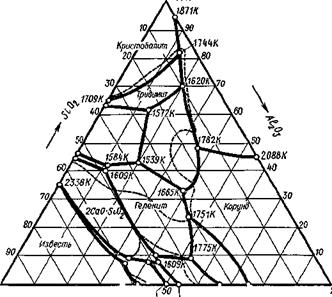
~Щ ' 60 т ТО Г 80 90 ШЪК
18028 ШОК 16858 18718 1989К
Рис. 9.37. Треугольник Гиббса с нанесенными горизонталями ющихся в системах сварочных флюсов и металлургических шлаков.
Так как реальные сварочные флюсы многокомпоненты (см. с. 348), то для них построить диаграммы плавкости в трехмерном пространстве нельзя и в этом случае строят тройные диаграммы плавкости, полагая содержание остальных компонентов постоянным. Так, введение CaF2 в систему СаО—А120з—Si02 понизит температуры плавления в системе и тогда, считая массовую долю CaF2 постоянной (5 или 10%), вновь строят тройную диаграмму.
Диаграммы плавкости для сварочных флюсов приведены, например, в работе Н. Н. Потапова. Аналогичным образом строят диаграммы плавкости и для фторидных флюсов. Подбор необходимой температуры плавления сварочного шлака осуществляют изменением его состава (чаще всего изменяя содержание
Вязкость шлаков прежде всего должна удовлетворять технологии сварки, так как от ее значения зависят условия формирования сварочного шва, интенсивность металлургических реакций на границе металл — шлак, отделение шлаковых включений от металла (экзогенные включения); особенно высокие требования предъявляются к вязкости шлаков при сварке в вертикальном и потолочном положениях. Вязкость зависит от температуры и
строения жидкости, т. е. от взаимодеист - вия частиц, ее составляющих. Особенно сильно это проявляется для расплавов, или ионных растворов (см. п 8.3). Ионные растворы, образованные элементарными ионами, такими, как Са2+, Na+; Mg2+; Fe2+; Мп2+; F-; О2-, обладают малой вязкостью, резко меняющей свое значение в момент кристаллизации — «короткие шлаки». Это характерно для так называемых основных шлаков (см. п. 9.4).
Рис 9 38 Изменение вязкости «длинных» (1) и «коротких»
Ионные растворы, содержащие большое количество ионов типа Si*OJ~, или S1O2, склонного к полимеризации (тетраэдры [S1O4]4-), обладают повышенной вязкостью при высоких температурах и медленно меняют ее в процессе затвердевания, сопровождающегося значительным переохлаждением Такие системы называются «длинными шлаками». На рис. 9. 38 приведены кривые изменения вязкости в зависимости от температуры для основных шлаков, содержащих большое количество элементарных ионов «коротких», и для кислых шлаков, содержащих значительное количество ионов SixOJ - («длинных»).
Значение вязкости тесно связано с электропроводимостью ионных растворов:
где т) — вязкость; р, — электропроводимость.
Таким образом, для определения температур затвердевания шлаковых систем можно использовать электрические измерения, Вязкость расплавленных сварочных шлаков при температурах существования сварочной ванны не должна превышать 0,2.. 0,4 Па-с.
Поверхностное натяжение жидкости зависит от температуры и от природы жидкости или ее состава, если жидкость представляет собой раствор.
о —А (Гкрит— Т), (9.63)
где Ткрит—критическая температура данного вещества; Т — текущая температура; А — постоянная.
Из закона Этвеши следует, что при критической температуре на границе жидкость — пар поверхностное натяжение обращается в нуль.
Для жидких металлов и шлаковых систем критические условия неизвестны, но снижение поверхностного натяжения при увеличении температуры наблюдалось многими исследователями.
Поверхностная энергия зависит от неуравновешенных сил, действующих между частицами жидкости (среда большой плотности), и частицами газа или паров жидкости, взаимодействующих с поверхностью (среда малой плотности).
Таким образом, граница раздела обладает свободной энергией
Уравнение (9.64) также указывает на снижение поверхностной энергии с повышением температуры.
Так как при стремлении к равновесию AGnoB—►О, то этот процесс может быть осуществлен двумя путями:
1) уменьшение площади поверхности раздела, например, вследствие роста зерна при рекристаллизации или в зоне термического влияния при сварке, а также при слиянии мелких капель в более крупные;
2) снижение сг в результате адсорбции на границе раздела частиц из газовой фазы или из жидкого раствора.
Если молекулы из жидкого раствора адсорбируются в пограничном слое, то поверхностное натяжение снижается и вещество считается поверхностно-активным (ПАВ):
Если Сі < со и (Тр_р >Очист, то вещество будет поверхностно-инак - тивным.
Как показал В. К. Семенченко, в шлаковых системах поверхностные слои будут обогащены ионами с высоким обобщенным потенциалом, что подтверждается также работами С. Б. Якобашвили.
Значения поверхностных энергий в зависимости от строения жидких веществ изменяются в очень широких пределах (табл. 9.6).
Поверхностное натяжение алюмосиликатных шлаков в зависимости от состава колеблется в пределах 0,3. 0,45 Дж/м2, а галидных шлаков — 0,15. 0,2 Дж/м.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛА СО ШЛАКОМ
При расплавлении сварочного флюса, электродного покрытия, сердечника порошковой проволоки образуется шлак. Основное назначение сварочного шлака — изоляция расплавленного металла от воздуха. Однако флюсы, покрытия и т. п. выполняют и другие не менее важные функции — стабилизируют дугу, способствуют формированию шва, осуществляют металлургическую обработку расплавленного металла — его раскисление и легирование. Кроме того, шлаки часто содержат окислы и другие компоненты, способные взаимодействовать с металлом. Поэтому понимание металлургических реакций, протекающих между металлом и шлаком, имеет большое значение для правильной организации сварочного процесса.
Окислительное действие компонентов сварочных материалов. Сварочные материалы (флюсы, покрытия и т. п.) содержат по ряду причин окислы, карбонаты и другие компоненты, способные
ОКИСЛЯТЬ металл. 10. Потери легирующих элементов
Окислительное действие некоторых наиболее часто встречающихся компонентов сварочных материалов характеризуется данными табл., 10, в которой приведены потери (1 — г]) углерода, марганца, кремния и хрома из проволоки Св-18ХГСА (0,21% С; 1,08% Мп;
1,0% Si; 1,05% Сг) при сварке электродами с покрытиями, составленными из одного компонента и с силикатом
натрия в качестве связующего; отно —
сйтельная масса покрытия kn — 0,3.
Опыт иллюстрирует сильное окислительное действие окислов железа (гематита), различное поведение марганца и кремния, особенно наглядно проявляющееся при изменении относительной массы покрытия ka (рис. 19). Заметные потери марганца при нейтральном покрытии из плавикового шпата по всей вероятности объясняются наличием повышенного количества еиликата натрия (вводимого во избежание растрескивания покрытия при сушке). Увеличение потерь (уменьшение коэффициента перехода г)) с увеличением относительной массы шлака х, косвенно характеризуемой относительной массой покрытий kn, объясняется рядом причин.
Во-первых, от х зависят равновесные концентрации реагентов. Роль этого фактора покажем на примере реакции окисления — восстановления марганца. Распределение марганца между шлаком и металлом
КП(Х)…………….. 0,5 0,1 0,2 0,5 1,0
[% Мп]р. .0,34 0,23 0,15 0,135 0,12
Уменьшение равновесной концентрации с ростом kn, увеличивая разность с — ср, должно привести к увеличению скорости реакции согласно уравнению (2) и соответственно к увеличению потерь марганца.
Во-вторых, с возрастанием ka увеличивается поверхность контакта металл— шлак как на стадии электрода (за счет удлинения втулки из нерасплавившегося
Рис. 19. Зависимость коэффициентов перехода г) марганца и кремния от относительной массы покрытия: а — плавиковый шпат: б — 20% плавикового шпата и 80% мрамора; в — мрамор; г — рутил; д — кварцевый песок; е — гематит
покрытия), так отчасти и в ванне (за счет удлинения дуги, увеличения ее мощности и размеров ванны).
В-третьих, с увеличением kn уменьшается степень изменения состава шлака в процессе сварки вследствие перехода в него окислов, образующихся при сварке.
В случае сильно окисленного шлака с увеличением kn увеличивается его окислительная способность (больше содержится Fe2Os) (табл. 11).
Большое значение имеет также смачивание шлаком расплавленного металла. Однако этот вопрос изучен весьма мало.
Окисление примесей металла сопровождается увеличением содержания кислорода, как это показано в качестве примера на рис. 20.
Большое практическое значение имеет система мрамор — плавиковый шпат (СаС03—CaF2), широко применяемая в сварочных материалах (электродных покрытиях, керамических флюсах и т. п.). Окисление металла мрамором зависит от количества С02, образующейся при диссоциации мрамора, условий контакта С02 с расплавленным металлом и химических свойств шлака.
Рис. 20. Зависимость содержания кислорода от относи — С увеличением СаС03 увеличивается рс0 тельной массы покрытия, и основность шлака (CaO/Si02). По отношению Покрытие из 20% плавико — к кремнию оба эти фактора действуют одинаково, вого шпата и 80^ мрамора
способствуя окислению кремния (уменьшению
коэффициента перехода г]), а по отношению к марганцу — в противоположные стороны: рост рсо увеличивает окисление, рост основности — уменьшает его,
что приводит к образованию максимума на кривых для марганца (рис. 21). Окислительное действие компонентов покрытий и флюсов вызвало применение безокислительных покрытий, не содержащих окислов железа и карбонатов, и без — кислородных флюсов на основе плавикового шпата. Эти материалы применяются
главным образом для сварки специальной стали и металлов, обладающих большим сродством к кислороду.
Влияние основности шлака. Рассмотрим подробнее вопрос о роли основности шлака (отношения CaO/Si02).
Переход марганца и кремния при постоянной концентрации окислителя (мрамора) в покрытии электродов но при изменяющейся основности, показан на рис. 22.
Известно, что для бинарной системы CaO—Si02 коэффициент YsiOa Умень* шается с уменьшением (Si02). Таким образом, увеличение основности шлака (уменьшение в нем Si02) должно привести к увеличению LSi и снижению содержания кремния в наплавленном металле, что мы и видим на рис. 24.
Проведенные рассуждения хотя и носят упрощенный характер, но позволяют наиболее наглядно пояснить влияние основности шлака на протекание реакций окисления шлаком кремния и марганца.
Реакция восстановления кремния и марганца из шлака. Из выражений реакций окисления кремния и марганца следует, что условием протекания этих реакций влево, т. е. в сторону восстановления марганца и кремния, является низкая активность FeO в шлаке. Если это условие выполняется, как, например, при сварке под флюсом или при наличии в зоне сварки энергичных раскислителей, возможно развитие марганце — и кремневосстановительного процессов. Равновесные концентрации марганца и кремния будут соответственно равны
Влияние содержания в шлаке FeO на степень восстановления кремния показано на рис. 24.
Аналогично действуют и другие окислители. Повышение окислительного потенциала покрытия или флюса является одним из путей подавления реакций восстановления кремния и марганца. Развитию реакций восстановления кремния и марганца при сварке способствует высокая температура в зоне сварки, так как эти реакции являются эндотермическими, т. е. идут с поглощением
Классическим примером интенсивного протекания при сварке реакций восстановления кремния и марганца является сварка низкоуглеродистой стали под флюсами с высоким содержанием силикатов и окислов марганца. Повышенное содержание кремния и особенно марганца (за счет их восстановления из шлака) позволяет применять проволоку Св-08А вместо кремнемарганцовистой проволоки.
Неизотермические условия сварочного процесса приводят к тому, что в зоне понижающейся температуры (в хвостовой части ванны) реакции восстановления кремния и марганца меняют направление, в результате чего образуются окислы, удаление которых затруднено; это приводит к увеличению содержания кислорода в металле. Окисные включения, имеющие обычно весьма малые размеры, заметно ухудшают свойства металла шва, особенно его ударную вязкость при низких температурах, как это видно из табл. 12 на примере сварки стали 16ГНМА.
12. Ударная вязкость металла шва
Ударная вязкость (в кгс-м/см2) при температуре испытания, °С
Восстановительные процессы особенно интенсивно протекают при наличии энергичных раскислителей — алюминия, титана и др. (рис. 25). Поэтому при свар* ке легированной стали рекомендуется применение низкокремнистых флюсов. Влияние содержания Si02 во флюсе на пластичность металла шва при сварке
стекло). Бессиликатное связующее (например, алюминат натрия) пока не получило применения (за исключением электродов для сварки алюминия) вследствие технологических трудностей. Подавление же восстановительных процессов путем создания в зоне сварки окислительных условий (как, например, на рис. 25) далеко не всегда приемлемо и этим способом следует пользоваться с большой осторожностью.
Условия контакта металла со шлаком. В уравнения кинетики (см. с. 68) входит величина поверхности F взаимодействия металла со шлаком, зависящая от условий контакта между ними. Наибольшая величина поверхности взаимодействия расплавленного металла со шлаком наблюдается при электрошлаковой сварке, когда электродный металл (проволока, лента) расположен в шлаковой ванне и вся поверхность металлической ванны контактирует со шлаком.
При сварке под флюсом поверхность F взаимодействия уменьшается вследствие того, что дуга горит в газовом пузыре и шлак частично оттесняется с поверхности ванны скоростным напором потока газов дуги.
При сварке покрытыми электродами поверхность F контакта капель электродного металла со шлаком зависит от длины втулки из нерасплавленного покрытия на конце электрода. Чем длиннее втулка, тем благоприятнее условие для контакта капель со шлаком.
Однако при некоторой длине втулки (толщине покрытия) увеличение поверхности контакта прекращается, как это показывает зависимость перехода легирующих элементов из покрытия в капли от относительной массы покрытия (рис. 26).
Условия контакта металл — шлак при сварке покрытыми электродами и порошковой проволокой различные. Если в первом случае покрытие (шлак) располагается снаружи металлического стержня и капли формируются как бы в оболочке из шлака, то в случае порошковой проволоки шихтовые материалы расположены внутри оболочки из металлической ленты и поверхность контакта металла со шлаком оказывается меньшей (рис. 27). Соответственно меньше и полнота протекания реакций между ними. Это наглядно иллюстрируется данными о переходе (восстановлении) кремния при наплавке электродами и порошковой проволокой С шихтой одинакового состава (30% плавикового шпата, 6% мрамора, 42% кварцевого песка,
15% ферромарганца, 7% алюминиевого порошка с одинаковым количеством силиката натрия) и с одинаковой относительной массой покрытия (шихты сердечника) kn = 0,7 (рис. 28).
Подобно восстановлению кремния окислительные реакции при сварке электродами также протекают с большей полнотой по сравнению со сваркой порошковой проволокой.
Говоря о контакте между металлом и шлаком, образующимся при расплавлении сварочных материалов, необходимо отметить важную роль смачивания металла шлаком. Чем лучше смачивание, тем больше, очевидно, может быть контакт между ними.
Переход серы и фосфора из сварочных материалов в наплавленный металл.
Окислительно-восстановительные реакции, рассмотренные выше, играют наибольшую роль при сварке. Но сварочные материалы наряду с окислителями могут содержать и другие компоненты, переход которых в металл так же нежелателен, как и переход кислорода. Такими компонентами являются прежде всего сера и фосфор, попадающие во флюсы (реже в покрытия) с шихтовыми материалами. Переход серы в металл тем меньше, чем выше основность шлака (за счет образования CaS, нерастворимого в стали) и чем выше концентрация марганца в металле за счет образования сульфида марганца MnS по реакции
[FeS] + [Мп] ^ [Fe] + (MnS).
Сульфид марганца менее растворим в стали, чем сульфид железа, что вызывает перераспределение серы в сторону большего ее содержания в шлаке. Что
касается предупреждения перехода в металл из шлака фосфора, то, как известно из металлургической практики, лучшие результаты дают окислительные условия процесса. Фосфор при этом переводится в пятиокись фосфора, которая в шлаке связывается в фосфаты.
1. Ерохин А. А. Основы сварки плавлением. Физико-химические закономерности. М., «Машиностроение», 1973. 448 с.
2. Любавский К. В. Металлургия сварки стали плавлением. Справочник по сварке. Под. ред. Е. В. Соколова. Т. 1. М., Машгиз, 1960, с. 51 — 140.
Взаимодействие металла со шлаком и газами
Распавляемое при сварке электродное покрытие кроме шлака выделяет газы, осуществляя, таким образом, газошлаковую защиту металла. В зависимости от состава покрытия или флюса может выделяться значительное количество газа и меньшее крдичество шлака, или наоборот. В первом случае покрытие называют
газозашитным, а во втором — шлакозащитным. Обычно применяют смешанную защиту. Металлургическая обработка металла выделяющимися при сварке шлаком и газами заключается в процессах раскисления, легирования и рафинирования металла шва.
Раскисление — это освобождение стали от кислорода, попадающего в ванну из воздуха, покрытий и других источников. В процессе сварки происходит осаждающее раскисление, при котором удаление кислорода из расплавляемого металла капли или ванны осуществляется реакциями с другими элементами, более активно взаимодействующими с кислородом, чем железо. Удаление кислорода происходит путем восстановления железа из оксида FeO по реакциям:
FeO + Мп = MnO + Fe; 2FeO +Si= Si02 + 2F;
При этом MnO и Si02 переходят в шлак, а СО — в атмосферу. Процесс идет беспрерывно: окисление Fe идет в передней части ванны, где температура более высокая, а восстановление железа из оксида — в задней части, где температура более низкая. Наряду с осаждающим раскислением происходит процесс диффузионного раскисления путем реакции между оксидом железа и другими оксидами
FeO + Si02 її FeO-Si02.
FeO, таким образом, связывается в стойкий силикат, который переходит в шлак. При большом содержании в шлаке силиката кремния реакция может пойти в обратную сторону, и металл будет окисляться, растворяя FeO. Поэтому содержание БЮг в шлаке должно быть в количестве, необходимом для диффузионного раскисления. Следует иметь в виду, что БЮг делает щлак «длинным», малоподвижным и ухудшает его газопроницаемость. При необходимости добавляют в покрытие другие материалы, повышающие жид- котекучесть шлака. Из приведенных выше химических реакций видно, что раскисление металла при сварке осуществляется при введении в покрытие химических элементов-раскислителей: Mn, Si, Al, Т и др. в виде порошка или ферросплавов (сплавов с железом), а также при увеличении содержания этих элементов в электродных стержнях.
Легирование металла шва различными полезными примесями для улучшения его качества осуществляется путем введения полезных элементов в электродные стержни или проволоку, а также в состав электродного покрытия. Такие элементы, как кобальт, никель и др., полностью усваиваются наплавленным металлом. Элементы Мп и Si, участвующие в раскислении, при их достаточной концентрации в шлаке в электродном металле также частично усваиваются, переходя в сварной шов.
Рафинирование металла шва заключается в освобождении его от вредных примесей, главным образом от серы и фосфора, которые попадают в ванну из основного металла, электродного стержня и покрытия, проволоки и флюса. Сера может остаться в шве в виде сульфида железа FeS, располагаясь между кристаллами стали. Это приводит к появлению горячих трещин в стали (см. § 9.7). Фосфор, находясь в шве в виде фосфидов РезР H-Fe2P, снижает его ударную вязКбсть, особенно при низкой температуре, поэтому удаление из шва серы и фосфора необходимо. Это осуществляется путем связывания серы и фосфора в химические соединения, не растворимые в стали и удаляемые в шлак, по реакциям:
FeS + Мп = MnS — J — Fe;
FeS + CaO = FeO + CaS;
2Fe3P + 5FeO = PA + 9Fe;
3CaO — j — PA — Ca3P20g.
При этом MnS, CaS и Ca3P208 переходит в шлак. Следует контролировать состав применяемых для уварки материалов (металла, покрытия, флюса) и не допускать содержания в них серы и фосфора выше норм, установленных стандартами. Металл шва, выполненного электродами с защитным покрытием или сваркой под флюсом, обладает высоким качеством. Если в мартеновской кипящей стали кислорода содержится 0,01—0,02 и азота 0,001—0,008 %, а в металле, наплавленном незащищенной дугой, соответственно 0,!|—0,7 и 0,12—0,18 %, то в металле, наплавленном защищенной дугой электродами УОНИИ-13/45, кислорода содержится не более 0,02—0,03 и азота 0,02—0,05 %; при сварке под флюсом их содержится еще меньше. Показатели механических и других свойств наплавленного металла обычно выше показателей основною металла, поэтому сварное стыковое соединение, как правило, равнопрочно основному металлу. При сварке неплавящимся вольфрамовым электродом в инертном газе (аргоне или гелии) металлургический процесс протекает без участия элементов, поступающих из воздуха или из электродного покрытия. Возможно только взаимодействие с оксидом железа FeO, находящимся в стали и в присадочной проволоке, а также с водородом, растворенным в стали или находящимся на ее поверхности в виде влаги и ржавчины. При взаимодействии FeO с углеродом образуется СО, который вызывает пористость. Этому способствует водород, его растворимость в ванне повышается с уменьшением ее раскисленности (отсутствие раскисляющих элементов Мп, Si и др.). При кристаллизации водород не успевает выделиться, образуя поры. Для борьбы с пористостью при аргонодуговой сварке вводят в ванну присадочную проволоку с увеличенным количеством элементов раскислителей. Применяют также смеси газов, добавляя в состав аргона 10—15 % углекислого газа или 5 % кислорода. Эти добавки бурно окисляют углерод, вызывая кипение ванны, в результате чего пузырьками газа выносится СО и Н2 в атмосферу. Кроме того, кислород уменьшает поверхностное натяжение капель металла, перенос их становится мелкокапельным или даже струйным, что наряду с уменьшением содержания водорода способствует лучшему формированию шва. Кислород также соединяется с водородом, образуя не растворимые в стали соединения, уходящие в шлак.
Распавляемое при сварке электродное покрытие кроме шлака выделяет газы, осуществляя, таким образом, газошлаковую защиту металла. В зависимости от состава покрытия или флюса может выделяться значительное количество газа и меньшее крдичество шлака, или наоборот. В первом случае покрытие называют газозашитным, а во втором — шлакозащитным. Обычно применяют смешанную защиту. Металлургическая обработка металла выделяющимися при сварке шлаком и газами заключается в процессах раскисления, легирования и рафинирования металла шва.
Раскисление — это освобождение стали от кислорода, попадающего в ванну из воздуха, покрытий и других источников. В процессе сварки происходит осаждающее раскисление, при котором удаление кислорода из расплавляемого металла капли или ванны осуществляется реакциями с другими элементами, более активно взаимодействующими с кислородом, чем железо. Удаление кислорода происходит путем восстановления железа из оксида FeO по реакциям:

При этом МпО и SiO2 переходят в шлак, а СО — в атмосферу. Процесс идет беспрерывно: окисление Fe идет в передней части ванны, где температура более высокая, а восстановление железа из оксида — в задней части, где температура более низкая. Наряду с осаждающим раскислением происходит процесс диффузионного раскисления путем реакции между оксидом железа и другими оксидами

FeO, таким образом, связывается в стойкий силикат, который переходит в шлак. При большом содержании в шлаке силиката кремния реакция может пойти в обратную сторону, и металл будет окисляться, растворяя FeO. Поэтому содержание SiO2 в шлаке должно быть в количестве, необходимом для диффузионного раскисления. Следует иметь в виду, что SiO2 делает щлак «длинным», малоподвижным и ухудшает его газопроницаемость. При необходимости добавляют в покрытие другие материалы, повышающие жидкотекучесть шлака. Из приведенных выше химических реакций видно, что раскисление металла при сварке осуществляется при введении в покрытие химических элементов-раскислителей: Мп, Si, Al, Т и др. в виде порошка или ферросплавов (сплавов с железом), а также при увеличении содержания этих элементов в электродных стержнях.
Легирование металла шва различными полезными примесями для улучшения его качества осуществляется путем введения полезных элементов в электродные стержни или проволоку, а также в состав электродного покрытия. Такие элементы, как кобальт, никель и др., полностью усваиваются наплавленным металлом. Элементы Мn и Si, участвующие в раскислении, при их достаточной концентрации в шлаке в электродном металле также частично усваиваются, переходя в сварной шов.
Рафинирование металла шва заключается в освобождении его от вредных примесей, главным образом от серы и фосфора, которые попадают в ванну из основного металла, электродного стержня и покрытия, проволоки и флюса. Сера может остаться в шве в виде сульфида железа FeS, располагаясь между кристаллами стали. Это приводит к появлению горячих трещин в стали. Фосфор, находясь в шве в виде фосфидов Fe3P и Fe2Р, снижает его ударную вязКбсть, особенно при низкой температуре, поэтому удаление из шва серы и фосфора необходимо. Это осуществляется путем связывания серы и фосфора в химические соединения, не растворимые в стали и удаляемые в шлак, по реакциям:

При этом MnS, CaS и Ca3P2O8 переходит в шлак. Следует контролировать состав применяемых для уварки материалов (металла, покрытия, флюса) и не допускать содержания в них серы и фосфора выше норм, установленных стандартами. Металл шва, выполненного электродами с защитным покрытием нли сваркой под флюсом, обладает высоким качеством. Если в мартеновской кипящей стали кислорода содержится 0,01—0,02 и азота 0,001—0,008 %, а в металле, наплавленном незащищенной дугой, соответственно 0,2—0,7 и 0,12—0,18 %, то в металле, наплавленном защищенной дугой электродами УОНИИ-13/45, кислорода содержится не более 0,02—0,03 и азота 0,02—0,05 %; при сварке под флюсом их содержится еще меньше.
Показатели механических и других свойств наплавленного металла обычно выше показателей основною металла, поэтому сварное стыковое соединение, как правило, равнопрочно основному металлу. При сварке неплавящимся вольфрамовым электродом в инертном газе (аргоне или гелии) металлургический процесс протекает без участия элементов, поступающих из воздуха или из электродного покрытия. Возможно только взаимодействие с оксидом железа FeO, находящимся в стали и в присадочной проволоке, а также с водородом, растворенным в стали или находящимся на ее поверхности в виде влаги и ржавчины. При взаимодействии FeO с углеродом образуется СО, который вызывает пористость. Этому способствует водород, его растворимость в ванне повышается с уменьшением ее раскисленности (отсутствие раскисляющих элементов Мп, Si и др.).
При кристаллизации водород не успевает выделиться, образуя поры. Для борьбы с пористостью при аргонодуговой сварке вводят в ванну присадочную проволоку с увеличенным колччеством элементов раскислителей. Применяют также смеси газов, добавляя в состав аргона 10—15 % углекислого газа или 5 % кислорода. Эти добавки бурно окисляют углерод, вызывая кипение ванны, в результате чего пузырьками газа выносится СО и Н2 в атмосферу. Кроме того, кислород уменьшает поверхностное натяжение капель металла, перенос их становится мелкокапельным или даже струйным, что наряду с уменьшением содержания водорода способствует лучшему формированию шва. Кислород также соединяется с водородом, образуя не растворимые в стали соединения, уходящие в шлак.
Читайте также:
