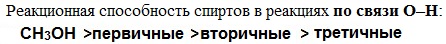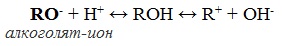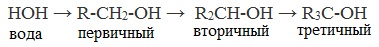Взаимодействие спиртов с металлическим натрием лабораторная работа
Обновлено: 04.10.2024
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Лабораторная работа №2.
Изучение свойств спиртов.
Цель: изучить некоторые физические и химические свойства предельных одноатомных и многоатомных спиртов.
Реактивы и материалы: спирт этиловый; глицерин; гидроксид натрия, сульфат меди (II); оксид меди (II); медная проволока; лучина; пробирки; фарфоровая чашка; прибор для окисления спирта.
Оборудование: набор пробирок, пробка с газоотводной трубкой, стаканчик, пипетка, спиртовка.
Опыт 1. Изучение физических свойств одно- и многоатомных спиртов.
Растворимость спиртов в воде .
Запишите свои наблюдения в таблицу и сделайте вывод о растворимости одноатомных спиртов.
Изучение физических свойств глицерина .
В пробирку налейте 0,5 мл воды, добавьте 0,5 мл глицерина, перемешайте. Раствор глицерина не выливать!
Запишите свои наблюдения и сделайте вывод о растворимости глицерина в воде.
Название спирта и формула
Растворимость в воде
С характерным запахом
Смешиваются с водой в любых соотношениях
Опыт 2. Горение спиртов.
Налейте немного этилового спирта в фарфоровую чашку. Поднесите к ней горящую лучину. Проделать с бутиловым и изоамиловым спиртом.
Запишите свои наблюдения и уравнение реакции горения этанола и остальных спиртов.
Название и формула спирта
Как загорается и горит
Опыт 3. Окисление этилового спирта оксидом меди (II).
(Качественное определение этанола).
1-й способ. В сухую пробирку налейте приблизительно 1 мл этанола. Раскалите медную спираль в пламени до появления черного налета (оксида меди II) и быстро опустите спираль в пробирку со спиртом, выньте и нагревая ее, снова опустите в спирт. Осторожно понюхайте содержимое пробирки, направляя поток воздуха к себе рукой.
Метаболит спирта – альдегид вызывает повреждение печени, цирроз.
Врачи доказали, что возникновение мутаций и уродов у эмбрионов вызывает уксусный альдегид.
Запишите наблюдения и уравнения соответствующих реакций.
Задача: Рассчитайте смертельную дозу алкоголя на свою массу тела.
Дано: Решение:
т (спирта на 1кг)=6 г
т (спирта смертельной дозы) =?Ответ: т (спирта смертельной дозы) = ____ г
Опыт4. Влияние этанола на молекулы белков .
Выяснить, как влияет алкоголь на структуру и свойства белка.
В пробиркe налить по 1 мл яичного белка. В пробирку добавить спирта 80 – 90 %.
Запишите свои наблюдения и выводы.
Опыт 5. Качественная реакция на многоатомные спирты.
В пробирку налейте 2 мл раствора гидроксида натрия и добавьте к нему немного раствора сульфата меди (II). Полученный свежеприготовленный осадок гидроксида меди (II) является реактивом на многоатомные спирты.
К осадку прилейте раствор глицерина, который вы получили в первом опыте, перемешайте.
Методическая разработка урока химии по теме «Химические свойства спиртов»
Развивающая : развивать познавательный интерес учащихся, умение анализа, обобщения и систематизации учебной информации, критическое мышление, умение анализировать, выделять главное, развивать рефлексивную культуру учащихся; формировать навыки наблюдения;
Воспитательная: воспитывать аккуратность, внимательность при выполнении лабораторной работы, соблюдая правила техники безопасности, бережное отношение к своему здоровью.
Оборудование: дидактический материал: тестовые задания, проверочная работа; пробирки, раствор этилового спирта, медная проволока, сухое горючее; мультимедиапроектор; презентация к уроку; компьютер; экран.
1. Организационный момент
Приветствие, проверка готовности класса к уроку.
2. Актуализация опорных знаний
Мы с вами начали изучать класс кислородосодержащих органических соединений - спирты. Давайте вспомним, что мы изучали на прошлом уроке.
Слайд 1 - «Мозговой штурм»
· Что такое спирты?
· Какую они имеют общую формулу?
· На какие группы делятся спирты?
· Какие бывают радикалы у спиртов?
· Как дают названия спиртам?
Проверочная работа (по проверке домашнего задания).
Предлагается тренажер "Строение спиртов" в двух вариантах. Проводится инструктаж о выполнении задания (время выполнения – 3 мин). Работы проверяются у доски (2 учащихся).
Какой вопрос о спиртах у нас остался еще не изученным? (химические свойства)
(Объявление темы и целей урока)
Сегодня мы с вами будем рассматривать химические свойства спиртов.
Какие цели поставим перед собой?
- изучить: химические свойства предельных одноатомных спиртов;
- научиться составлять уравнения химических реакций, характеризующих свойства предельных одноатомных спиртов.
4. Изучение нового материала
1) Начнем с лабораторной работы о свойствах этилового спирта (5 мин)
Слайд 4 – Химические свойства предельных одноатомных спиртов
Лабораторная работа №6. «Свойства этилового спирта» (Инструкция - с. 176 учебника), правила техники безопасности, вывод по лабораторной работе:
- этиловый спирт растворяется в воде;
- является хорошим растворителем;
Что получили при взаимодействии этанола и оксида меди ( II ) при нагревании? Что ощущали?
взаимодействие этанола с оксидом меди ( II ):
этиловый спирт уксусный альдегид
2) изучение химических свойств спиртов
Опыт № 1. Горение спиртов
Демонстрационный опыт.
Запись реакций у доски и в тетрадях: горение этилового спирта - у доски и самостоятельно. После этого результаты работы проверяются с помощью медиапроектора на экране.
Слайд 2 – окисление (горение):
Опыт № 2. Взаимодействие спиртов с металлическим натрием.
Виртуальная лабораторная работа
С помощью мультимедиапроектора (слайд 5) на экран проецируется реакция взаимодействия этанола с металлическим натрием. Учащимся объясняется механизм этой реакции и они записывают ее уравнение. После этого результаты работы проверяются с помощью медиапроектора на экране.
Особое внимание указывается на то, что эта реакция является качественной реакцией на спирты.
Слайд 2 – взаимодействие этанола с натрием:
этиловый спирт этилат натрия
(Качественная реакция на предельные одноатомные спирты)
Опыт 3. Внутримолекулярная дегидратация спиртов с образованием непредельных углеводородов (алкенов).
С помощью мультимедиапроектора на экран проецируется механизм реакции дегидратации этанола с образованием алкенов. Эту реакцию мы проводили в теме «Алкены». Ребятам объясняется механизм этой реакции, её условия протекания и они пишут уравнение этой реакции. После этого результаты работы проверяются с помощью медиапроектора на экране.
Слайд 2 - Внутримолекулярная дегидратация спиртов (с образованием алкенов)
H ─ C ─ C ─ H → CH 2 = CH 2 ↑ + H 2 O
Опыт 4. Межмолекулярная дегидратация спиртов с образованием простых эфиров.
С помощью мультимедиапроектора на экран проецируется механизм реакции дегидратации этанола с образованием простого эфира. Ребятам объясняется механизм этой реакции, её условия протекания и они пишут уравнение этой реакции. После этого результаты работы проверяются с помощью медиапроектора на экране.
Слайд 2 - Межмолекулярная дегидратация (с образованием простых эфиров)
этиловый спирт этиловый спирт диэтиловый эфир
Опыт 5. Дегидратация спиртов с образованием сложных эфиров - реакция этерификации. С помощью мультимедиапроектора на экран проецируется механизм реакции
Слайд 2 - Реакция этерификации (дегидратация спиртов с образованием сложных эфиров)
Вывод: какие реакции характерны для спиртов? (6 реакций - назвать)
3) Ознакомление с применением этанола на основе его свойств
Слайд 6- Применение этанола (схема применения этанола)
Слайд 10 – Влияние спирта на организм человека
Схемы: «Образование водородных связей с молекулами воды», «Влияние алкоголя на органы человека», «Процессы окисления этилового спирта».
5. Закрепление изученного материала.
1. Работа с тестом.
1) Этиловый спирт реагирует …. ( Na , NaOH )
2) Продукт реакции этанола с пропановой кислотой - …(этилацетат, этилпропилат)
3). Для этилового спирта характерна реакция …(гидратация, дегидратация)
2. Определите тип реакции:
1. Этиловый спирт безгранично растворим в воде в связи с тем, что…
1) имеет только одну гидроксильную группу;
2) его молекула неполярна;
3) является жидким веществом;
4) образует с молекулами воды водородные связи.

6. Итог урока.
Какими же свойствами обладают спирты? (горение, дегидратация, реакция этерификации, окисление оксидом меди, с металлическим натрием)
7. Домашнее задание.
Слайд 3 - Домашнее задание
Взаимодействие спиртов с металлическим натрием лабораторная работа
Химические свойства спиртов ROH определяются наличием полярных связей В химических реакциях спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы)
O–H (с отщеплением водорода)
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н + ) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О — свойства основания и нуклеофильного реагента.
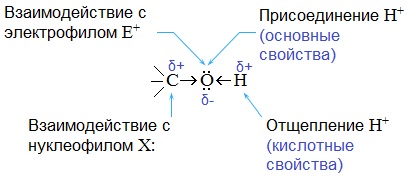
С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Различают два основных типа реакций спиртов с участием функциональной группы –ОН:
1) Реакции с разрывом связи О-Н:
а) взаимодействие спиртов со щелочными металлами с образованием алкоголятов;
б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений.
2) Реакции сопровождающиеся разрывом связи С-О:
а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Спирты – амфотерные соединения.
Реакции замещения
Кислотно-основные свойства ![]()
Кислотные свойства уменьшаются в ряду, а основные возрастают: ![]()
Кислотные свойства
1. Взаимодействие со щелочными и щелочноземельными металлами (Li, Na, K, Ca, Ba, Sr)
Реакции с разрывом связи О-Н
При действии на спирты активных металлов в безводной среде атом водорода гидроксильной группы замещается на металл:
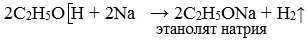
Образующиеся соединения (соли спиртов) называются алкоголятами — производные метилового спирта – метил ат ами, производные этилового спирта – этил ат ами.
Видеоопыт «Взаимодействие спиртов с металлическим натрием»
Алкоголяты химически не стабильны и при действии воды они полностью гидролизуются с образованием исходного спирта и щелочи:
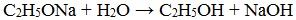
Эта реакция показывает, что спирты по сравнению с водой являются более слабыми кислотами (сильная кислота вытесняет слабую). При взаимодействии с растворами щелочей спирты не образуют алкоголяты.
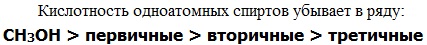
Спирты не взаимодействуют с водными растворами щелочей.
Основные свойства
2.Взаимодействие с галогенводородными кислотами
Реакции с разрывом связи С-О
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований:
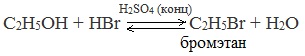
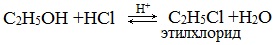
Видеоопыт «Взаимодействие этилового спирта с бромоводородом»
Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Отличительной особенностью этой реакции является то, что атом Н отщепляется от спирта, а группа ОН – от кислоты:
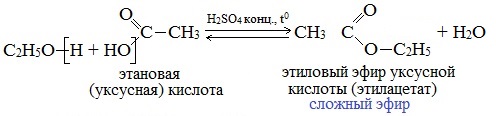
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
Реакции отщепления
1. Дегидратация (отщепление воды)
При действии на спирты водоотнимающих реагентов, например, концентрированной серной кислоты, происходит отщепление воды – дегидратация.
Она может протекать по двум направлениям: с участием одной молекулы спирта (внутримолекулярная дегидратация, приводящая к образованию алкенов) или с участием двух молекул спирта (межмолекулярная дегидратация, приводящая к получению простых эфиров).
При переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов и уменьшается способность образовывать простые эфиры.
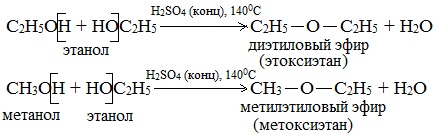
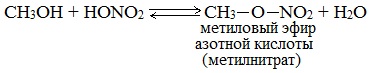
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R-O-R'. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
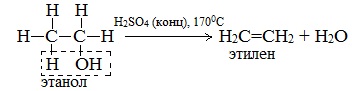
Такие реакции отщепления называются реакциями элиминирования.
Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
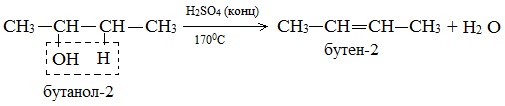
2. Дегидрирование
Реакции с разрывом связей О-Н и С-Н
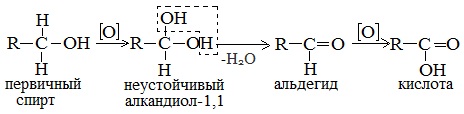
а) При дегидрировании первичных спиртов образуются альдегиды:
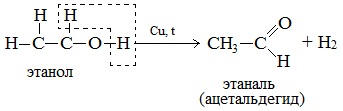
Реакция происходит при пропускании нагретых до 300 0 С паров спирта без доступа воздуха над металлическими катализаторами (Cu или металлы платиновой группы – Pd, Pt, Ni). Ni является типичным катализатором дегидрирования или гидрирования, т.е. отщепления или присоединения водорода.
В организме человека этот процесс происходит под действием (алкогольдегидрогеназы).
б) При дегидрировании вторичных спиртов образуются кетоны:
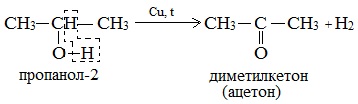
Третичные спирты не подвергаются дегидрированию.
Реакции окисления
Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления, приводящие к получению альдегидов, кетонов и карбоновых кислот.
В лабораторных условиях для окисления спиртов обычно используют подкисленные растворы перманганата или дихромата калия, оксид меди и т.д.
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла. С увеличением массы углеводородного радикала – пламя становится всё более коптящим.
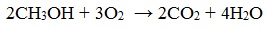
При сгорании спиртов выделяется большое количество тепла:
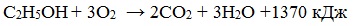
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В этом случае энергия химических связей переходит в тепловую энергию, а затем в механическую, что позволяет двигаться автомобилям. В лабораторной практике этанол применяется как горючее для «спиртовок».
2. Неполное окисление
1). В присутствии окислителей [O] – K 2 Cr 2 O 7 или KMnO 4 спирты окисляются до карбонильных соединений:
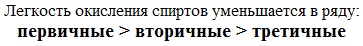
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
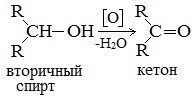
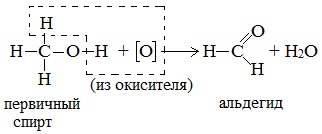
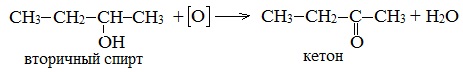
Видеоопыт «Окисление этилового спирта раствором перманганата калия»
Видеоопыт «Окисление этилового спирта кристаллическим перманганатом калия»
Видеоопыт «Каталитическое окисление этанола»
Видеоопыт «Окисление этанола (тест на алкоголь)»
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Качественные реакции на спирты
1. Окисление спиртов дихроматом (Na2Cr2O7) или перманганатом (КMnО4)
Качественная реакция на первичные и вторичные спирты!
В кислой среде
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с раствором дихромата натрия. Для повышения скорости реакции ее проводят при нагревании, для создания кислой среды добавляют серную кислоту.
Первичные спирты окисляются дихроматом натрия до альдегидов.
Растворы дихроматов имеют оранжевый цвет и содержат хром в степени окисления +6. В кислой среде они переходят в растворы солей хрома в степени окисления +3 и приобретают зеленый цвет.
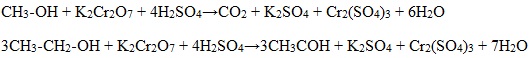
На изменении цвета соединений хрома также основана работа алкотестеров, когда пары спирта, содержащиеся в выдыхаемом водителем воздухе, восстанавливают дихромат в стеклянной трубочке.
Вторичные спирты окисляются дихроматом натрия до кетонов.
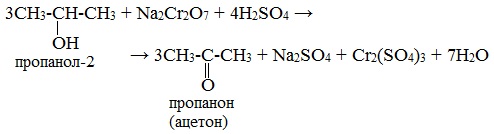
Третичные спирты в реакции с дихроматами не вступают.
Т.к. перманганат калия в кислой среде более сильный окислитель, чем дихромат, то окисление спирта не останавливается на стадии альдегида и продолжается дальше до карбоновой кислоты.

Также как и дихроматом натрия, перманганатом калия вторичные спирты могут окисляться до кетонов. Далее возможна деструкция, т.е. разрушение органической молекулы и получение смеси веществ, которые не имеют практического применения.
В жёстких условиях с перманганатом калия третичные спирты окисляются с расщеплением связей С-С и образованием смеси веществ.
Метиловый спирт окисляется перманганатом калия до углекислого газа.
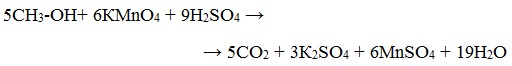
2. Окисление спиртов оксидом меди (II)
Качественная реакция на первичные спирты!
Первичные спирты окисляются оксидом меди (II) до альдегидов.
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
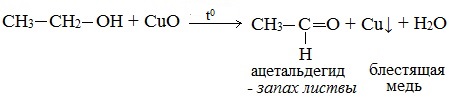
Видеоопыт «Качественная реакция на этанол»
Вторичные спирты окисляются оксидом меди (II) до кетонов.
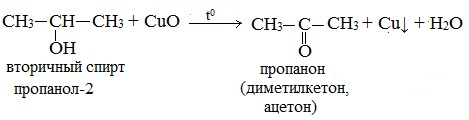
Третичные спирты оксидом меди (II) не окисляются.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
Спирты
учебно-методический материал
Развивающая : развивать познавательный интерес учащихся, умение анализа, обобщения и систематизации учебной информации, критическое мышление, умение анализировать, выделять главное, развивать рефлексивную культуру учащихся; формировать навыки наблюдения;
Воспитательная: воспитывать аккуратность, внимательность при выполнении лабораторной работы, соблюдая правила техники безопасности, бережное отношение к своему здоровью.
1. Организационный момент
2. Актуализация опорных знаний
Слайд 1 - «Мозговой штурм»
- Что такое спирты?
- Какую они имеют общую формулу?
- На какие группы делятся спирты?
- Какие бывают радикалы у спиртов?
- Как дают названия спиртам?
Предлагается тренажер "Строение спиртов" в двух вариантах. Проводится инструктаж о выполнении задания (время выполнения – 3 мин). Работы проверяются у доски (2 учащихся).
Сегодня мы с вами будем рассматривать химические свойства спиртов.
4. Изучение нового материала
Слайд 4 – Химические свойства предельных одноатомных спиртов
Лабораторная работа №6. «Свойства этилового спирта» (Инструкция - с. 176 учебника), правила техники безопасности, вывод по лабораторной работе:
Что получили при взаимодействии этанола и оксида меди (II) при нагревании? Что ощущали?
взаимодействие этанола с оксидом меди (II):
t 0 C OC 2 H 5 ─ OH + CuO → CH 3 ─ C + Cu + H 2 O
Слайд 2 – окисление (горение):
С 2 Н 5 ─ОН + О 2 →…
С 2 Н 5 ─ОН + 3О 2 →2СО 2 +3Н 2 О+Q
Виртуальная лабораторная работа
Слайд 2 – взаимодействие этанола с натрием:
2СН 3 ─ СН 2 ─ ОН + 2Na → 2СН 3 ─ СН 2 ─ ОNa + H 2 ↑
(Качественная реакция на предельные одноатомные спирты)
Слайд 2 - Внутримолекулярная дегидратация спиртов (с образованием алкенов)
H ─ C ─ C ─ H → CH 2 = CH 2 ↑ + H 2 O
Слайд 2 - Межмолекулярная дегидратация (с образованием простых эфиров)
0 С, H 2 SO 4 конц .
С 2 Н 5 ─ О ─ Н + Н ─ О ─ С 2 Н 5 → С 2 Н 5 ─ О ─ С 2 Н 5 + H 2 O
Слайд 2 - Реакция этерификации (дегидратация спиртов с образованием сложных эфиров)
Слайд 6- Применение этанола (схема применения этанола)
Слайд 10 – Влияние спирта на организм человека
5. Закрепление изученного материала.
1) Этиловый спирт реагирует …. ( Na , NaOH)
2) Продукт реакции этанола с пропановой кислотой - …(этилацетат, этилпропилат )
3). Для этилового спирта характерна реакция …(гидратация, дегидратация )
2С 3 Н 7 ─ОН + 9О 2 →6СО 2 +8Н 2 О+Q
4) образует с молекулами воды водородные связи.


Читайте также: