Взаимодействие уксусной кислоты с металлами практическая работа
Обновлено: 04.10.2024
Цель: экспериментально обосновать сходство химических свойств органических и неорганических кислот; откорректировать практические умения с лабораторным оборудованием.
Оборудование: штитив с пробирками.
Реактивы: порошкообразный магний, гранулы цинка, индикаторы (фенолфталеин, лакмус), CH3COOH , растворы NaOH и K2CO3.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
Описание опыта, рисунок
Наблюдения и уравнения реакций
Действие уксусной кислоты на индикаторы.
В пробирку прилили 1-2 мл уксусной кислоты и внесни несколько капель лакмуса.
Раствор в пробирке приобрел светло-розовый цвет.
Лакмус показал ответ на кислую среду, уксусная кислота – слабая кислота, поэтому цвет раствора светло-розовый.
Взаимодейские уксусной кислоты с маталлами.
Во вторую пробирку с порошком магния прилили 1мл уксусной кислоты.
Очень бурное выделение газа.
Металлы с карбоновыми кислотами реагируют также, как и с неорганическими кислотами. Так как восстановительная активность магния выше, чем цинка, то скорость реакции с магнием выше.
В третью пробирку с гранулой цинка прилили 1 мл уксусной кислоты.
Медленное выделение газа.
Взаимодействие уксусной кислоты с основаниями.
В четвертую пробирку с раствором щелочи прилили несколько капель фенолфталеина. Затем в пробирку с раствором прилили несколько капель уксусной кислоты.
При добавлении фенолфталеина к щелочи, раствор приобрел малиновое окрашевание.
А после после добавления к этому раствору уксусной кислоты – раствор обесцветился.
Уксусная кислота реагирует с основаниями как минеральные кислоты, образуя соль (ацетат) и воду. Такую реакцию называют – реакция нейтрализации.
Взаимодействие уксусной кислоты с солями.
В пятую пробирку с раствором уксусной кислоты внесите 1 г кристаллического карбоната калия.
При добавление карбоната калия к уксусной кислоте – выделился газ.
Уксусная кислота реагирует с солями слабых кислот (карбонатами) также как и неорганические кислоты, образуя соль (ацетат), углекислый газ и воду.
Общий вывод: на данной практической работе мы исследовали химические свойства карбоновых кислот (на примере уксусной кислоты), и выяснили, что уксусная кислота является слабой кислотой; металлы взаимодействуют с уксусной кислотой также, как и с неорганическими; для уксусной кислоты характерна реакция нейтрализации, и уксусная кислота взаимодействует с солями слабых кислот (карбонатами) с образованием углекислого газа и воды.
Задание учителя:
Докажите опытным путем, что выданное вещество в пробирке – муравьиная кислота.
1. Проба на индикатор. Лакмусовая бумага приобретет красный цвет, что доказывает наличие кислой среды.
2. Отличие муравьиной кислоты от других карбоновых кислот в том, что в молекуле муравьиной кислоты карбоксильная группа связана с атомом водорода, и получается, что в молекуле есть альдегидная группа. Поэтому муравьиная кислота, как и альдегид, проявляет свойства восстановителя, и дает реакцию «серебрянного зеркала».
Практическая работа по теме "Карбоновые кислоты"
Цель работы: Получить уксусную кислоту и изучить её свойства.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
Ход работы: Внимание. Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:

Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не собёрётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю фенолфталеина. Что наблюдаете? Почему?
Затем добавьте к содержимому пробирки уксусную кислоту. Почему происходит обесцвечивание? Запишите УХР, назовите продукты.
Опыт 4. Взаимодействие уксусной кислоты с солями слабых неорганических кислот.
В пробирку налейте 1 мл карбоната натрия и по каплям добавьте уксусную кислоту. Что наблюдаете? Почему?
Запишите УХР, назовите продукты.
Опыт 5 Моющая способность мыла
5.1) Налейте в пробирку 2—3 мл раствора мыла и прибавьте к нему соляной кислоты до образования хлопьев. Что собой представляет этот осадок? Составьте уравнение реакции. Проверьте, растворяется ли осадок в растворе щелочи. Объясните это явление.
5.2) К 2—3 мл раствора мыла в пробирке прилейте раствор хлорида кальция. Что наблюдаете? Напишите уравнение реакции. Какое свойство мыла иллюстрируется данным опытом?
Оформите работу в виде таблицы
Название опыта. Что делали.
УХР. Наблюдения. Выводы
Сделайте общий вывод о проделанной работе.
Опыт 1 . Получение уксусной кислоты.
В пробирку поместили немного ацетата натрия и добавили раствор H2SO4 (1:1). Пробирку закрыли пробкой с газоотводной трубкой, конец которой поместили в другую, чистую пробирку.

Исходную пробирку нагрели. Наблюдаем конденсацию уксусной кислоты в приемнике, чувствуется резкий характерный запах уксусной кислоты.
Опыт 2 . Растворимость карбоновых кислот в воде
В одну пробирку налили 2 мл воды и добавили 3 капли уксусной кислоты, полученный раствор перемешали. В другую пробирку налили 2 мл воды и добавили чуть-чуть бензойной кислоты, содержимое перемешали, бензойная кислота в воде не растворилась. Тогда эту пробирку нагрели. Наблюдаем растворение бензойной кислоты. После охлаждения пробирки осадок вновь выпадает. Прибавили к осадку немного раствора гидроксида натрия. Наблюдаем вновь растворение осадка.

Различие растворимостей кислот объясняется природой вещества.
Опыт 3 . Взаимодействие уксусной кислоты с металлами
В пробирку налили немного уксусной кислоты и добавили 1 гранулу цинка. Пробирку нагрели. Наблюдаем выделение пузырьков газа водорода и растворение гранулы цинка.



Полученную кислоту разделили на 2 части. В первую пробирку поместили лакмусовую бумажку, наблюдаем ее покраснение. Затем прильем немного раствора гидроксида натрия. Помещенная в полученный раствор лакмусовая бумажка синеет. Во вторую пробирку добавили немного порошка магния, наблюдаем выделение газа.
Все кислоты, как органические, так и неорганические реагируют с металлами, стоящими в ряду напряжений до водорода. С металлами, стоящими после водорода, кислоты не будут реагировать, в том числе и уксусная кислота.
Опыт 4 . Получение сложного эфира
В пробирку налили 2 мл изоамилового спирта, 2 мл уксусной кислоты и чуть-чуть концентрированной серной кислоты. Пробирку закрыли пробкой с газоотводной трубкой и нагрели на водяной бане. После охлаждения в пробирку добавили немного воды. При этом выделяется слой изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции, произошла реакция этерификации.

В реакционную смесь добавляют концентрированную серную кислоту, как водоотнимающее средство, чтобы сместить равновесие вправо.
Опыт 5. Взаимодействие уксусной кислоты с оксидами металлов.

В пробирку с уксусной кислотой добавили немного оксида кальция, наблюдаем его растворение.
Опыт 6. Взаимодействие муравьиной кислоты с с аммиачным раствором оксида серебра.
4. При прилипании в пробирку с аммиачным раствором муравьиной кислоты, смесь нагрели.

Наблюдаем образование налета серебра на стенках пробирки и выделение газа. Муравьиная кислота окисляется оксидом серебра.
Опыт 7. Моющая способность мыла
В пробирку с водой добавили стружек хозяйственного мыла и нагрели. К полученному мыльному раствору добавили раствор НСl. Наблюдаем образование хлопьев:
7. При добавлении к мыльному раствору раствора СаСl наблюдаем образование хлопьев:
Эта реакция иллюстрирует, что моющая способность мыла уменьшается в жесткой воде.
8. При приливании в пробирку с олеиновой кислотой (растительным маслом) бромной воды наблюдаем ее обесцвечивание – признак не предельности.
Лабораторный опыт 3 ГДЗ Рудзитис Фельдман 10 класс (Химия)
1. Получение уксусной кислоты. Поместите в пробирку 2—Зг ацетата натрия и прибавьте 1,5—2 мл концентрированной серной кислоты. Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку (рис. 31). Смесь нагревайте на пламени до тех пор, пока в пробирке-приемнике не будет 1,0—1,5мл жидкости.
1. Какое вещество образовалось в пробирке-приемнике? Какие свойства уксусной кислоты это подтверждают? 2. Составьте уравнение соответствующей реакции.
2. Взаимодействие уксусной кислоты с некоторыми металлами. B две пробирки налейте по 1 мл раствора уксусной кислоты.
B первой пробирке происходит бурная реакция, а во второй реакция протекает спокойно (иногда она начинается только при нагревании).
Задание для самостоятельного вывода. Как уксусная кислота реагирует с магнием и цинком? Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
3. Взаимодействие уксусной кислоты с основаниями. Налейте в пробирку 1 — 1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной кислоты малиновая окраска фенолфталеина исчезает.
4. Взаимодействие уксусной кислоты со спиртами. B пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл изоамилового спирта. Затем осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте на водяной бане.
После охлаждения добавьте к содержимому пробирки несколько миллилитров воды. При этом образуются маслянистые капли нерастворимого в воде изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции.
Задания для самостоятельных выводов. 1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот? 2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями? При помощи каких опытов это можно доказать? 3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? Напишите уравнение соответствующей реакции.
5. Окисление муравьиной кислоты оксидом cepe6pa(l). B чистую пробирку налейте 2 мл свежеприготовленного раствора с массовой долей нитрата cepe6pa(l) 0,02. Добавьте немного разбавленного раствора аммиака до растворения появившегося осадка. Затем добавьте несколько капель муравьиной кислоты и пробирку со смесью нагрейте в колбе с горячей водой.
Задание для самостоятельного вывода. Почему из всех карбоновых кислот только для муравьиной кислоты характерна реакция «серебряного зеркала»? Напишите уравнение соответствующей реакции.
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Практическая работа № 3. Сравнение свойств органических и неорганических соединений
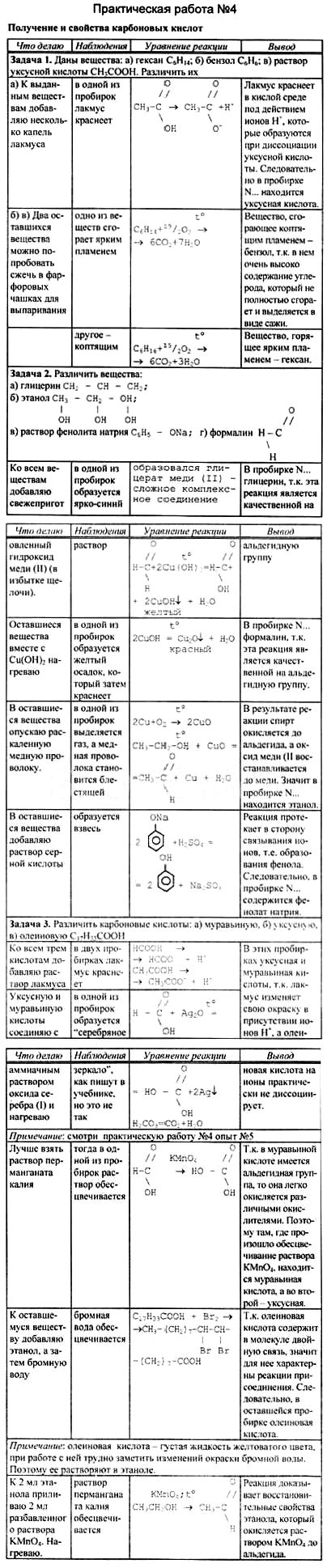
В обе пробирки добавляйте по каплям концентрированную соляную кислоту. Что наблюдаете?
К образовавшимся растворам солей добавляйте по каплям концентрированный раствор щелочи. Что наблюдаете?
Запишите уравнения проделанных реакций и сделайте выводы.
«Образование солей взаимодействием органических и неорганических оснований и кислотами и опыты с ними»
Вывод: органические и неорганические основания и соли проявляют схожие свойства.
Получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами а) В пробирку налейте 2 мл изоамилового спирта, 2 мл концентрированной уксусной кислоты и 0,5—1 мл концентрированной серной кислоты (выдает учитель).
Смесь хорошо перемешайте и нагревайте (осторожно!) несколько минут на водяной бане (в стакане с горячей водой) до пожелтения жидкости (но не до кипения!).
Дайте смеси остыть, затем вылейте в пробирку с холодной водой или с насыщенным раствором поваренной соли: эфир соберется на поверхности. Отделите эфир с помощью делительной воронки. Какой ощущается запах?
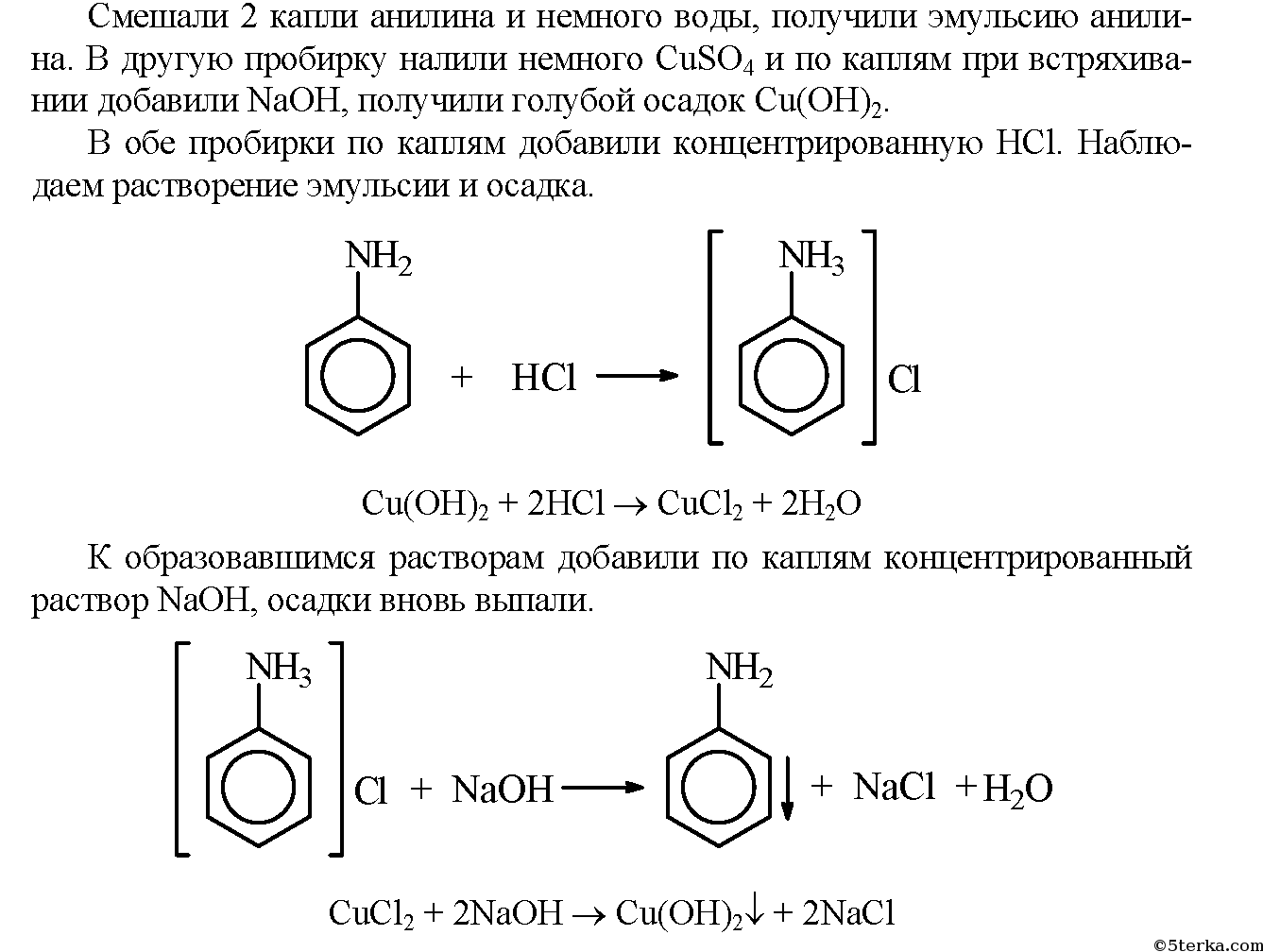
Примечание. Оставьте полученный эфир для решения задачи IV в практической работе № 4. б) В фарфоровую чашечку поместите несколько кристалликов борной кислоты, добавьте 1 мл этилового спирта. Хорошо перемешайте смесь стеклянной палочкой. Поднесите к ней зажженную лучинку. Образовавшийся сложный эфир — триэтилборат сгорает красивым зеленым пламенем.
Запишите уравнения реакций, проделанных в опытах 2а и 26, сделайте выводы.
«Получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами»
а) В пробирку налили немного изоамилового спирта и концентрированной уксусной кислоты и добавили чуть-чуть концентрированной серной кислоты. Смесь перемешали и нагрели на водяной бане. Наблюдаем пожелтение жидкости. Смесь остудили, эфир собрался на поверхности, ощущаем запах грушевой эссенции.

б) В фарфоровую чашку поместили несколько кристаллов борной кислоты и прибавили немного этилового спирта. Смесь перемешали и поднесли к ней зажженную лучинку. Образовавшееся вещество сгорело зеленым пламенем.
Вывод: органические и неорганические кислоты проявляют аналогичные химические свойства.
Амфотерность гидроксида цинка и аминоуксусной кислоты а) В две пробирки налейте по 1 —2 мл раствора нитрата цинка и добавьте к нему 2—3 капли щелочи до образования осадка. В одну из пробирок прилейте соляной кислоты до растворения осадка, в другую — избыток раствора щелочи и наблюдайте растворение осадка. б) Налейте в пробирку 2—3 мл раствора карбоната натрия и всыпьте в него щепотку глицина. Что наблюдаете? Какие свойства глицина проявляются в этой реакции? Поместите в пробирку немного кристалликов глицина, смочите их каплями концентрированной соляной кислоты, нагрейте. Что наблюдаете? Вылейте несколько капель образовавшегося раствора на стекло. Наблюдайте образование при охлаждении кристаллов соли глицина. Сравните форму этих кристаллов с формой кристаллов глицина. Запишите уравнения реакций и выводы.
«Амфотерность гидроксида цинка и аминоуксусной кислоты»


Сравнение свойств солей а) В две пробирки налейте по 2 мл растворов нитрата и ацетата свинца. Затем прилейте в обе пробирки по 1 мл раствора иодида калия. Что наблюдаете? б) В две пробирки налейте по 2 мл растворов сульфата ме-ди(II) и соли анилина. Затем добавьте в обе пробирки несколько капель концентрированного раствора щелочи. Что наблюдаете? Запишите уравнения проделанных реакций и сделайте выводы.
«Сравнение свойств солей» Выполнение работы:
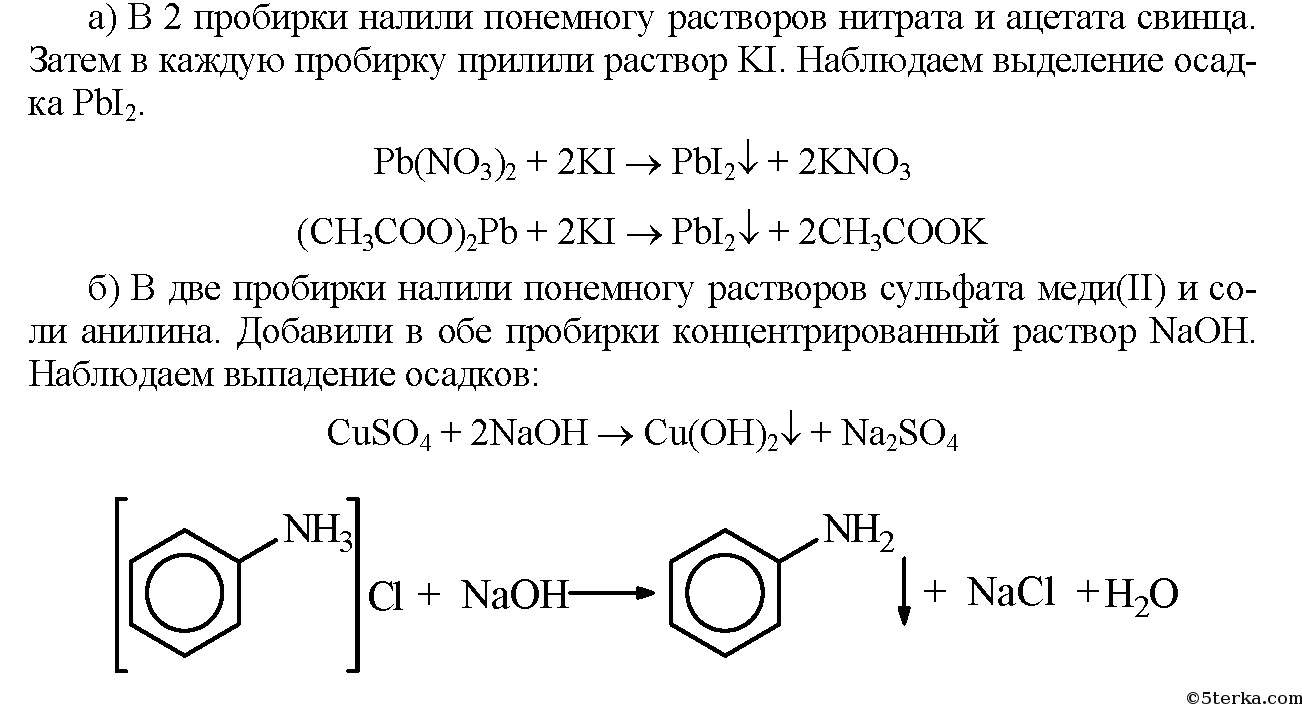
Вывод: соли органические и неорганические также проявляют схожие свойства.

Решебник по химии за 11 класс (О.С.Габриелян, 2002 год),
задача №3
к главе «Глава 6. Химический практикум».
Читайте также:
