Неравновесные структуры в сталях
Обновлено: 09.05.2024
Получение неравновесной структуры в результате термической обработки значительно изменяет многие свойства и особенно механические. В лабораторных работах предусмотрено изучение влияния термической обработки на прочность и вязкость, значения которых во многом определяют поведение деталей в эксплуатации. [1]
Получение неравновесной структуры в результате термической обработки значительно изменяет многие свойства стали и особенно механические свойства. В лабораторных работах, приведенных ниже, предусмотрено изучение влияния термической обработки на механические свойства, так как основной задачей термической обработки конструкционной ( машиностроительной) стали является получение высоких механических свойств. [2]
Одним из способов получения неравновесной структуры литого металла , эффективно проявляющей свои качества после соответствующей термической обработки является литье с кристаллизацией ПОД давлением. Данный метод литья сочетает ряд достоинств, прежде всего, обеспечивает высокое качество литых заготовок аналогично го-рячештампованным и позволяет использовать сплавы с низким коэффициентом линейного расширения при относительной простоте техно - Логического процесса. Вместе с тем особенности армирования структуры и свойств различных материалов, получаемых литьем с кристаллизацией под давлением остается мало изученными. В качестве материала для исследования использовались алюминиевые сплавы типа АЛ25, которые широко применяются для изготовления поршней ДВС. [3]
Закалка ( 3) - процесс термической обработки, обусловливающий получение неравновесных структур превращения или распада аустенита, при резком его переохлаждении со скоростью выше критической. Закалка осуществляется путем нагрева деталей ( изделий) до температур в интервале превращений или выше, выдержки при этих температурах и последующего охлаждения со скоростью выше критической ( Б интервале наименьшей устойчивости аустенита, фиг. [4]
Почти все легирующие элементы увеличивают устойчивость переохлажденного аустеннта и тем самым способствуют получению неравновесных структур . [6]
Если для осуществления структурных превращений требуется нагрев до определенных температур и соответствующая выдержка, то для получения неравновесной структуры и предотвращения полного распада высокотемпературного состояния охлаждение необходимо вести с такой скоростью, чтобы резко затормозить подвижность атомов. Поэтому чаще всего при закалке деталей в качестве охлаждающей среды используют воду. [7]
Закалкой называют процесс термической обработки - нагрев стали до оптимальной температуры, выдержка и последующее быстрое охлаждение с целью получения неравновесной структуры . В результате закалки повышается прочность и твердость и понижается пластичность стали. [8]
Скорость охлаждения легированной стали при термической обработке, по сравнению с углеродистой, как правило, всегда меньше, так как почти все легирующие элементы увеличивают устойчивость аустенита и тем самым способствуют получению неравновесных структур . [9]
Легированные стали свариваются, как правило, хуже углеродистых. Легирующие элементы, вводимые в углеродистую сталь, способствуют образованию неравновесных структур при более медленном охлаждении, чем требуется для получения неравновесных структур у обыкновенной углеродистой стали. При этом чем больше введено легирующих элементов, тем требуется меньшая скорость охлаждения для получения неравновесных структур. Поэтому легированные стали, содержащие до 2 - 2 5 % легирующих элементов, сваривают по особым режимам. [10]
Легирующие элементы по-разному влияют на структурные превращения различных зон металла сварного соединения. Растворяясь полностью в феррите, они замедляют скорость превращения аустенита, сдвигая начало и конец превращения вправо ( С-образные кривые) и тем самым способствуют получению неравновесных структур при относительно малых скоростях охлаждения. Элементы, повышающие точку Л3, не упрочняют феррит при закалке, а элементы, понижающие эту точку, при закалке упрочняют его. Упрочнение при быстром охлаждении происходит благодаря образованию игольчатой структуры мартенситного вида. Большинство легирующих элементов понижают скорость распада мартенсита и повышают устойчивость закаленной стали к снижению твердости после отпуска. [11]
Закалка - термическая обработка, в результате которой в сплавах образуется неравновесная структура. Неравновесные структуры при термической обработке можно получить только в том случае, когда в сплавах имеются превращения в твердом состоянии: переменная растворимость, полиморфные превращения твердых растворов, распад высокотемпературного твердого раствора по эвтектоидной реакции и др. Для получения неравновесной структуры сплав нагревают выше температуры фазового превращения в твердом состоянии, после чего быстро охлаждают, чтобы предотвратить равновесное превращение при охлаждении. [12]
Легированные стали свариваются, как правило, хуже углеродистых. Легирующие элементы, вводимые в углеродистую сталь, способствуют образованию неравновесных структур при более медленном охлаждении, чем требуется для получения неравновесных структур у обыкновенной углеродистой стали. При этом чем больше введено легирующих элементов, тем требуется меньшая скорость охлаждения для получения неравновесных структур . Поэтому легированные стали, содержащие до 2 - 2 5 % легирующих элементов, сваривают по особым режимам. [13]
Чтобы убедиться в этом, необходимо провести следующие опыты: нагреть образец до равновесного состояния и охладить вещество до некоторого неравновесного состояния, после чего прекратить охлаждение, далее повторить первый опыт и в момент достижения того же неравновесного состояния начать нагревание. Из этих опытов удается рассчитать три взаимно независимых значения fug, соответствующие моменту перехода от охлаждения к отжигу, от охлаждения к нагреванию и от нагревания к отжигу. Совпадение значений f к g укажет на возможность разделения теплового расширения на две составляющие. Поскольку скорость охлаждения q в обоих опытах одинакова и охлаждение производится из равновесного состояния, то обеспечивается получение одинаковой неравновесной структуры в моменты скачков q, хотя истинные параметры этой структуры остаются скрытыми. [14]
Поскольку пластифицированный ПВХ проявляет высокоэластическую деформацию, он является очень важным техническим материалом. Наличие кристаллических узлов и преобладающий энтропийный характер деформации обеспечивают сохранение начальной формы и не очень значительную ползучесть ( крип) изделий из пластифицированного ПВХ. Вероятно, это объясняется тем, что происходит некоторая перестройка структуры, поскольку полимеризация ПВХ приводит к получению неравновесных структур из-за нерастворимости полимера в мономере. [15]
Структура и фазовый состав железоуглеродистых сплавов
Структура и фазовый состав сплавов изучаются с помощью диаграмм состояния, изображаемых в координатных осях «состав-температура». Для двухкомпонентных сплавов ось составов изображается в виде отрезка, по концам которого указывают символы компонентов (условно А и В). От точки В к точке А содержание компонента А в сплаве возрастает от 0 до 100%, а содержание компонента В уменьшается до 0 от 100 %. В любой точке оси сумма концентраций компонентов А и В равна 100 %. Состав, характеризуемый точкой / на оси АВ можно определить по правилу отрезков, согласно которому содержание компонентов в процентах равно умноженному на 100 отношению длин соответствующих отрезков к длине оси: А = (1В/АВ)Ш; В = (А1/АВ)Ж.
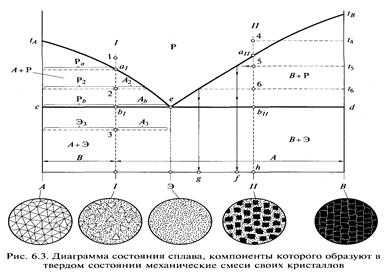
Диаграмма состояния, изображенная на рис. 6.3, характеризует сплав, компоненты которого в жидком состоянии неограниченно растворимы друг в друге, а в твердом состоянии образуют механические смеси (не образуют твердых растворов и химических соединений).
Точки tAm tB — температуры кристаллизации свободных компонентов А и В (буквами Аи В обозначаются также кристаллы этих компонентов в составе структуры сплава); Э — эвтектика — особая структура, представляющая собой механическую смесь одновременно кристаллизовавшихся из жидкости и поэтому очень мелких и тесно перемешанных кристаллов компонентов А и В, содержание которых пропорционально соответственно отрезкам ЭВ и A3; е — эвтектическая точка, указывающая на состав эвтектики и температуру ее кристаллизации, начало и конец которой, в отличие от других составов, совпадают.
Эвтектика — не фаза, а структурная составляющая (элемент структуры сплава), поэтому ее 100%-е содержание в отличие от компонентов отмечается на диаграмме штриховой линией.
Кривая tAetB — кривая температур начала кристаллизации сплава, или кривая верхних критических точек, называемая ликвидусом (от лат. liquidus — жидкий). Выше ликвидуса сплав находится в расплавленном состоянии (Р — расплав). Линия ced — линия температур конца кристаллизации сплава, или линия нижних критических точек, называемая солидусом (от лат. solidus — твердый). Ниже солидуса сплав состоит из твердых кристаллов (А, В и Э). Между ликвидусом и солидусом существуют жидкая (Р) и твердые и В) фазы одновременно.
Температуры начала и конца кристаллизации сплава / соответствуют точкам а, и Ь,, сплава — точкам аи и Ь„.
Проведем через точку 2 горизонтальную линию до границ области tAec. Эта линия является осью фазовых составов, по концам которой имеем: слева — 100 % компонента А, а справа (на границе с расплавом) — 100 % расплава. Это отмечено буквами А + Р. В данной области из расплава при охлаждении выделяются кристаллы компонента А. В области etBd записано В + Р, так как здесь из расплава выделяется в твердом состоянии компонент В. Точка 2 делит ось фазовых составов А — Р на отрезки А2 и Р2, измерив которые, можно определить процентные содержания фаз А и Р в сплаве / при температуре в точке 2.
Характер изменения фазового состава сплава при понижении температуры можно проследить, строя оси фазовых составов для различных точек на вертикали. Сравнение отрезков в точках ah 2 и Ь/ показывает, что при понижении температуры от точки Я/ до точки Ь [ содержание компонента А увеличивается от 0 (Аа = 0) до [Ab/(Ab + Pfc)]100 ~ 44%, а содержание расплава уменьшается от 100% до [РЬ/(АЬ + Рй)]100 = 56 %. В точках 4,иЗ имеем: Рь = Э3 и Аь - Аъ, т.е. то количество компонента А, которое выделилось из расплава, пока он оставался жидким, существует теперь в твердом сплаве, а расплав, который в конце кристаллизации (в точке Ь) составляет около 56 % сплава, превращается в эвтектику. Соответственно в областях АсеЭ и 3edB указано А + Э и В + Э.
Проследим за изменением состава расплава в сплаве при охлаждении. При температуре t4 (точка 4) и ниже, вплоть до точки а и, сплав полностью жидкий, поэтому состав расплава и состав сплава — одно и то же (точка h на оси составов). В точке аи начинается кристаллизация расплава и из него выделяются первые кристаллы компонента В. В результате частичной потери этого компонента изменяется состав и количество расплава. Для определения состава расплава при температуре ts из точки 5 проведем горизонтальную прямую линию до границы с расплавом и опустим перпендикуляр на ось составов в точку. При более низкой температуре f6 состав расплава будет характеризоваться точкой g, а в конце кристаллизации (в точке Ь) он будет соответствовать составу эвтектики. Следовательно, при охлаждении сплава содержание компонентов А и В в жидкой фазе (состав расплава) изменяется по кривой апе. Аналогично по кривой ар изменяется состав расплава при кристаллизации сплава.
Рассмотрим, как формируются структуры сплава в зависимости от его состава. Изобразим условно кристаллы компонента А треугольниками, а компонента В — квадратиками; тогда структура эвтектики будет представлена смесью треугольников и квадратиков, только очень мелких, практически не различимых на фоне крупных кристаллов чистых компонентов. Площади, занимаемые в эвтектике треугольниками (компонентом А) и квадратиками (компонентом В) составляют соответственно 57,5 и 42,5 %, что соответствует отрезкам Эй и АЭ оси составов. Для того чтобы определить структуру сплава /, измерим длины отрезков Э3 и А> и по ним вычислим процентное содержание в сплаве компонента А и эвтектики. Получим 44 и 56%. Следовательно, площадь, занятая крупными треугольниками на картинке структуры сплава /, должна составлять 44 % от общей площади, а оставшаяся площадь должна приходиться на долю эвтектики, изображаемой точками. Аналогичным образом, измерив отрезки Э/г и hB (с учетом того, что крупные кристаллы в данном случае — квадратики), получим структуру сплава.
Для решения обратной задачи — определения состава сплава по его структуре — нужно измерить площади, занимаемые элементами структуры, и с помощью диаграммы определить состав сплава.
Фазы в структуре стали. Углерод и железо в зависимости от температуры образуют жидкий раствор (расплав Р), два твердых раствора — феррит (Ф) и аустенит (А) — и химическое соединение Fe3C, называемое цементитом (Ц).
Феррит — твердый раствор углерода в а-железе, существующий при температурах ниже 911 "С. Растворимость углерода в а-железе мала (не более 0,02 %), так как в плотной решетке а-желе-за углерод может находиться, только замещая атомы железа, что требует высокой энергии.
Аустенит — твердый раствор углерода в у-железе, существующий при температурах выше 727 0 С. Ниже 727 0 С аустенит распада ется на феррит и цементит. В у-железе углерод растворяется до 2,14%. В этом случае углерод внедряется между атомами железа благодаря тому, что у-решетка не так плотно упакована.
Структура углеродистой стали. Структура углеродистой стали при нормальной температуре образована двумя фазами (двумя типами кристаллов): очень мягким и пластичным ферритом и очень твердым и хрупким цементитом. Чем больше в стали углерода, тем больше образуется цементита и меньше феррита и тем выше твердость и ниже пластичность стали. При содержании углерода менее 0,01 % сталь состоит из одного только феррита.
Если сталь содержит 0,8 % углерода, то ее структура представляет собой эвтектоидную (похожую на эвтектику) смесь мелких кристаллов феррита (88%) и цементита (12%), называемую перлитом (П). При 200-кратном увеличении кристаллы феррита и цементита в перлите практически неразличимы, в то время как кристаллы феррита, выделившиеся ранее из аустенита, являются достаточно крупными. Структура перлита видна только при большом увеличении. При содержании углерода менее 0,8 % структура стали включает в себя перлит и феррит, при содержании углерода более 0,8 % — перлит и цементит.
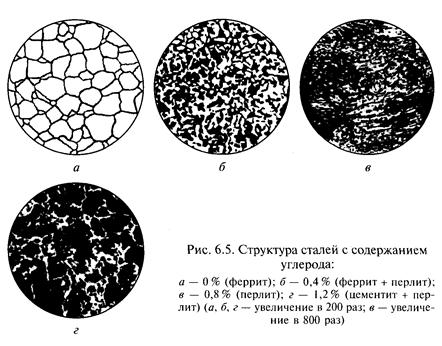
Диаграмма состояния железоуглеродистых сплавов. Диаграмма состояния Fe — Fe3C является только частью полной диаграммы Fe —С, поэтому углерод как фаза на диаграмме отсутствует. В этой части диаграммы цементит, являющийся одной из фаз, играет роль второго компонента, хотя им и не является (второй компонент — углерод). Первый компонент — железо — также не фигурирует на диаграмме, поскольку всегда растворяет в себе некоторое количество углерода и представляет собой твердый раствор (феррит или аустенит).
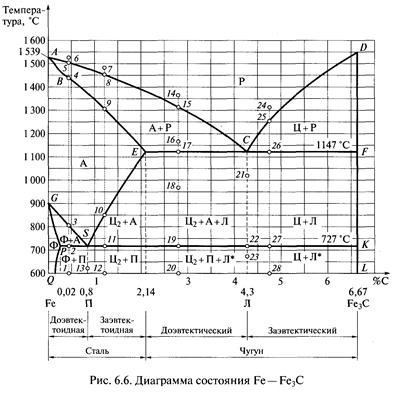
Кривая ACD — ликвидус. Выше ликвидуса находится область расплава (Р). Кривая BECF— солидус. Ниже солидуса все сплавы — твердые. В области BESG — это твердый раствор аустенит, а в области ECFKS — механические смеси аустенита и цементита с эвтектикой, которая называется ледебуритом (Л). Сплав (чугун) с содержанием углерода 4,3 % полностью состоит из эвтектики. Он имеет самую низкую температуру плавления (кристаллизации) — 1 147 °С (точка С). При / > 121 "С ледебурит представляет собой механическую смесь мелких кристаллов аустенита и цементита, а при t 727 °С — перлита и цементита.
Дело в том, что твердый раствор (аустенит) разлагается при охлаждении аналогично жидкому раствору (расплаву) с выделением тех или иных растворенных веществ. Поэтому пересечения линий диаграммы в точках S и С сходны между собой. Точка S называется эвтектоидной точкой, т.е. похожей на эвтектическую точку С. Структура, образующаяся в точке S — это перлит. Кривая GSE — это кривая температур начала разложения аустенита. На участке GS (в области GSP) из аустенита выделяется феррит, а на участке SE (в области SEFK) — цементит (вторичный). Линия PSK — линия температур конца разложения аустенита, или линия эвтектоидных превращений. Ниже этой линии аустенит не существует. Он превращается в перлит.
Рассмотрим процессы при нагревании доэвтектоидной стали, содержащей 0,4 % углерода (точка 1). Пока температура не достигнет 727 °С (линия PS), сталь будет состоять из феррита и перлита (Ф + П). При температуре 727 °С (точка 2) перлит (П) превращается в аустенит (А), так как ос-железо переходит в у-железо. В феррите же (Ф) сохраняется а-модификация железа и он остается в стали. При повышении температуры более 727 °С количество феррита уменьшается, он растворяется в аустените. В точке 3 содержание феррита будет 0 %, а содержание аустенита — 100 %.
Сталь в отличие от чугуна при нагревании полностью переходит в фазу аустенита. Дальнейший нагрев приводит к плавлению стали. Первые капли расплава появятся при температуре в точке 4. Затем количество расплава будет увеличиваться, а количество аустенита — уменьшаться, пока он полностью не растворится в расплаве (в точке 5).
При охлаждении сплава все будет происходить в обратном порядке. При очень медленном (равновесном) охлаждении образуется первоначальная структура стали, состоящая из феррита и перлита. Такую структуру называют равновесной. При быстром охлаждении возникают неравновесные (метастабильные) структуры, характеризующиеся высокой твердостью. На этом основана закалка стали.
Рассмотрим процессы, происходящие при охлаждении заэв-тектоидной стали с содержанием углерода 1,2 %. При температуре в точке 8 начинается кристаллизация расплава; из него выделяются кристаллы аустенита. С понижением температуры твердой фазы (аустенита) становится все больше, а жидкой — все меньше. В точке 9 заканчивается переход расплава в аустенит. В виде аустенита сплав существует до точки 10. Начиная с этой температуры аустенит разлагается — из него выделяется цементит. Этот цементит называют вторичным (Ц2), чтобы отличать его от цементита (Ц), выделяющегося в области CDF из расплава и не имеющего ограничений в росте и расположении кристаллов. Вторичный цементит выделяется в крайне стесненных условиях, поэтому его кристаллы являются очень мелкими и располагаются в виде узких прослоек по границам кристаллов аустенита. Выделение вторичного цементита заканчивается в точке //. Количество выделившегося вторичного цементита в нашем сплаве составляет 6,8 %. Оставшийся к концу разложения аустенит (93,2 %) при температуре 727 °С переходит в перлит, т.е. распадается на смесь мелких кристаллов феррита и цементита.
Механические свойства неравновесных структур стали
Троостит имеет твердость 400…450 НВ, он тверже сорбита. Троостит более мелкозернистая структура, чем сорбит. Троостит игольчатой структуры (игольчатый троостит) называется бейнитом. Сорбит имеет твердость 250…300 НВ. Сорбит тверже перлита и имеет более мелкозернистую структуру, чем перлит. Твердость сплавов проявляется в сопротивлении пластической деформации при сдвиге. Чем выше при закалке скорость охлаждения стали, тем мельче зернистость структуры и тем выше твердость стали, так как увеличивается блокировка сдвигов.
На практике закалку осуществляют нагревом стали до температуры на 30…50 °С выше аустенитных превращений, выдержкой и последующим быстрым охлаждением в жидкой среде. Закалке подвергают готовые изделия. Температура нагрева стали под закалку для углеродистых доэвтектоидных сталей на 30…50 °С выше верхней критической точки Ас3 (линия GS). Для заэвтектоидных сталей она на 30…50 °С выше нижней критической точки Ас1 (линия PSK). Длительность выдержки при температуре закалки определяется временем, необходимым для превращения исходной структуры в аустенит. Скорость охлаждения определяется получением требуемой структуры. Скорость охлаждения регулируется подбором закалочной среды (воды, масла, расплава соли и др.).
Охлаждающая способность закалочной среды зависит от ее физических свойств, температуры и объема. Все закалочные среды делят на три группы: с малой (воздух, расплав натриевой селитры, сжатый воздух), умеренной (масло, вода при температуре 50…75 °С) и большой скоростью охлаждения (чистая вода с температурой не более 40…50 °С, водные растворы едких щелочей, поваренной соли, кислот, соды, водяной душ).
В зависимости от состава и назначения стали а также вида изделий применяют такие виды закалки, как полная, неполная, ступенчатая, изотермическая, с самоотпуском, светлая и поверхностная.
При полной закалке нагрев деталей производят до температуры на 30…50 °С выше верхней критической точки. Неполную закалку при-меняют для заэвтектоидных сталей. Ее осуществляют нагревом деталей, до температуры, превышающей только нижнюю критическую точку АС1. После неполной закалки в структуре присутствует мартенсит и оставшиеся от исходной структуры зерна цементита. Изотермическая закалка предполагает нагрев изделий выше верхней критической точки, выдержку при этой температуре и последующее охлаждение в расплавленных солях с заданной температурой (350…500 °С) до полного распада аустенита. При ступенчатой закалке охлаждение также производится в солях, нагретых до заданной температуры, но выдержка при температуре ванны дается только для выравнивания температуры по сечению изделия. Структурных превращений при выдержке не происходит. Дальнейшее охлаждение ведется ускоренно для получения структуры мартенсита. Светлая закалка осуществляется нагревом деталей в защитной атмосфере и охлаждением в масле для защиты от окисления и потери углерода в поверхностном слое. Поверхностную закалку выполняют быстрым нагревом поверхности детали выше верхней критической точки и последующим охлаждением в соответствующей закалочной среде. Нагрев поверхности можно произвести токами высокой частоты в индукторе. Чем выше частота тока, тем меньше глубина закалки.
Отпуск применяется с целью уменьшения остаточных напряжений, частичного снижения твердости закаленных изделий, повышения вязкости и улучшения обрабатываемости резанием. При отпуске сталь нагревают ниже критической точки Ас1, выдерживают при этой температуре и охлаждают с заданной скоростью. Известны 3 вида отпуска стали: низкий, средний и высокий.
При низком отпуске изделия нагревают до 130…240 °С. В них начинается процесс выделения углерода из мартенсита с образованием высокодисперсного цементита. Распад мартенсита при низком отпуске происходит незначительно. Структура после низкого отпуска называется мартенситом отпуска. При этом немного снижается твердость и хрупкость закаленных изделий.
При среднем отпуске с нагревом закаленной стали до 240…450 °С происходит распад мартенсита и образование мелкозернистой ферритно-цементитной структуры. Концентрация углерода в твердом растворе стремится к равновесной. Формируются очень мелкие, не различимые под микроскопом зерна цементита. Структура металла среднего отпуска носит название троостит отпуска. Средний отпуск повышает предел упругости и предел выносливости.
Закаленная сталь, подвергнутая высокому отпуску, имеет структуру сорбита отпуска. Высокий отпуск осуществляют нагревом стали до 450…700 °С. В сорбите отпуска при больших увеличениях видны зерна выделившегося цементита. С повышением температуры отпуска прочность и твердость понижаются, а относительное удлинение и вязкость возрастают.
Самое удачное соотношение прочности и вязкости обеспечивается после закалки и высокого отпуска. Такая термическая обработка называется улучшением.
Отжиг предпринимают для получения равновесного фазового и структурного состояния стали.
Отжиг первого рода устраняет неоднородность строения металла, вызванную предшествующей обработкой. Он применяется для гомогенизации, рекристаллизации и снятия остаточных напряжений. Его производят при температуре выше и ниже температуры фазовых превращений. При гомогенизации крупные отливки и слитки нагревают до 1100…1200 °С, выдерживают в течение 8…20 ч и медленно охлаждают.
Холодное деформирование металла приводит к наклепу – искажению упорядоченного кристаллического строения, которое сопровождается ростом внутренних напряжений в металле. Наклеп снимают при рекристаллизационном отжиге: металл нагревают выше температуры порога рекристаллизации, обычно до 700 °С, выдерживают 0,5…1,5 ч и медленно охлаждают. Отжиг для снятия остаточных напряжений применяют для изделий после литья, сварки, резания, шлифования. В зависимости от вида обработки изделия нагревают до 160…700 °С, выдерживают 2…3 ч и медленно охлаждают.
Отжиг второго рода снижает фазовую неоднородность стали и позволяет получить сталь равновесной структуры. Полный отжиг применяют для перекристаллизации доэвтектоидной стали с целью измельчения зерна и снятия остаточных напряжений. При этом сталь нагревают на 30…50 °С выше температуры аустенитных превращений, выдерживают до завершения фазовых превращений и медленно охлаждают (например, вместе с печью). При полном отжиге сначала образуется мелкозернистый аустенит, который при охлаждении со скоростью 0,03…0,05 К/с переходит в мелкозернистый перлит.
При нормализации, которая является разновидностью отжига, процесс охлаждения проводится с большей скоростью, чем при полном отжиге. При нормализационном отжиге ( с охлаждением на спокойном воздухе со скоростью 1…3 К/с) также протекает перекристаллизация стали и формируется мелкозернистая ферритно-цементитная структура. Прочность и твердость нормализованной стали почти на 20 % выше, чем у отожженой стали.
Маркировка сталей и чугунов
Классификация сталей.В настоящее время промышленность выпускает большое количество марок сталей и чугунов. Конкретные их марки имеют условные обозначения, состоящие из комбинации русских букв и цифр. Маркировка содержит определенную информацию о составе и свойствах сплавов. Эта информация необходима инженеру при выборе материала и способа его обработки.
Стали классифицируются по различным признакам: по химическому составу, по назначению и по качеству.
По химическому составу стали подразделяются на углеродистые и легированные. Углеродистыми называют стали, в которых, кроме железа и углерода, содержатся в ограниченном количестве некоторые сопутствующие примеси, присутствие которых обусловливается особенностями металлургического процесса. Примеси марганца и кремния в углеродистых сталях присутствуют в таких количествах, при которых они не оказывают существенного влияния на свойства сталей. В стали имеются также такие вредные примеси, как сера, фосфор, кислород, которые невозможно полностью удалить в промышленных условиях.
Свойства углеродистых сталей зависят от степени их раскисления, от содержания углерода и примесей. По содержанию углерода различают стали малоуглеродистые, среднеуглеродистые и высокоуглеродистые.
Влияние примесей на свойства железоуглеродистых сплавов
В состав обычных углеродистых сталей кроме железа и углерода входят в небольшом количестве примеси кремния, марганца, фосфора, серы, кислорода, азота. Их присутствие вызывается условиями получения стали. В обычных углеродистых сталях содержание кремния не превышает 0,35 % и марганца 0,9 %. В таких количествах они не оказывают существенного влияния на механические свойства сталей.
Фосфор относится к числу вредных примесей. Образуя с α-железом твердый раствор замещения, фосфор сильно искажает кристаллическую решетку феррита, в связи с чем повышаются его твердость и хрупкость. Наличие фосфора в количестве более 0,045 % делает сталь хрупкой при низких температурах. Фосфор является сильно ликвирующим эле-ментом, поэтому содержание его в сталях не должно превышать 0,07 %. Фосфор способствует росту зерен, что ухудшает механические свойства стали. В присутствии меди добавки фосфора могут улучшать обрабатываемость и повышать коррозионную стойкость сплава.
Сера, так же как и фосфор, - вредная примесь. Сера находится в стали в виде химического соединения FеS, образуя с железом легкоплавкую эвтектику с температурой затвердевания около 985 °С. Затвердевая в последнюю очередь, она располагается по границам зерен, разобщая их хрупкой и непрочной оболочкой. При нагреве стали до красного каления эти оболочки частично расплавляются, и прочная связь между зернами нарушается. Поэтому сталь с повышенным содержанием серы становится хрупкой при горячей механической обработке. Кроме того, сера понижает коррозионную стойкость и ухудшает свариваемость стали. Содержание серы в стали не должно превышать 0,06 %.
Повышенным содержанием кислорода характеризуются плохо раскисленные стали. Кислород находится в стали преимущественно в виде хрупких оксидов: FеО, SiO2, Al2O3. FеО растворяется в железе, но при охлаждении растворимость его снижаетсяи закись железа выделяется в виде хрупких шлаковых прослоек на поверхности зерен металла, способствуя повышению хрупкости и понижению ударной вязкости. В спокойной стали 0,002…0,001 % кислорода, в кипящей — 0,03…0,08 %.
Азот присутствует в стали в виде нитрида Fe4N или в свободном виде, располагаясь в дефектах кристаллов, трещинах, повышая хрупкость. Повышенное содержание азота снижает пластичность стали.
Существенное влияние на свойства чугуна оказывает форма углеродной составляющей. При медленном охлаждении чугуна цементит распадается с образованием графита. Кремний способствует графитизации чугуна. Марганец в количестве 0,5…1,4 % препятствует графитизации. Фосфор не оказывает существенного влияния на процесс графитизации. Сера, являясь вредной примесью, ухудшает литейные свойства чугуна, увеличивает его усадку, повышает склонность к трещинообразованию, снижает температуру хрупкости. Чтобы устранить вредное влияние серы, в состав чугуна вводят марганец. Марганец образует с серой тугоплавкое соединение MnS – пластичный сульфид марганца, с температурой плавления 1620 °С.
Термическая обработка стали
Термическая обработка стали производится с целью придать ей ту или иную структуру для изменения соответствующим образом ее свойств, поскольку последние определяются структурой металла. При этом под термином “термическая обработка” понимают лишь такие приемы изменения внутреннего строения стали при которых как действующим фактором пользуются исключительно только теплом, не прибегая к другим воздействиям. Основой процессов термической обработки является полиморфизм железа и его твердых растворов определяющих структуру стали. Термическая обработка заключается в нагреве сплавов до определенных температур, выдержке их при этих температурах и последующем охлаждением с различной скоростью. Различают три основных вида термической обработки стали: закалку, отпуск и отжиг.
При медленном охлаждении стали происходит полный распад аустенита с образованием равновесной структуры, представленной ферритом и цементитом. В процессе закалки получают сталь неравновесной структуры повышенной твердости. Под закалкой понимают термическую обработку, состо-ящую в нагреве стали до температуры выше критической точки Ас1 (линия РSK, рис.7) или Ас3 (линия GS на диаграмме состояния железо – цементит), выдержке и последующем быстром охлаждении. Различают два вида превращений в стали при закалке: закалка на мартенсит и закалка на ферритно-цементитную смесь. При скорости охлаждения стали ≥ Vкр происходит бездиффузионное превращение аустенита в мартенсит (рис.9). При этом имеет место перестройка кубической гранецентрированной решетки аустенита в тетрагональную объемно-центрированную решетку мартенсита. Мартенсит представляет собой пересыщенный твердый раствор внедрения углерода в -железе. Таким образом, главным фактором закаливаемости является содержание углерода.
В практике термической обработки при регулировании скорости охлаждения аустенита с целью получения требуемой структуры стали пользуются С-образными кривыми, получаемыми для каждой марки стали опытным путем (рис. 10). По оси ординат показана температура переохлаждения аустенита, а по оси абсцисс – логарифм времени. Линия А1 - нижняя критическая точка, соответствующая 727 °С. Первая С-образная кривая лежащая ближе к оси ординат показывает начало, а вторая С-образная кривая соответственно окончание превращения аустенита в ферритно-цементитную смесь.
Мартенсит отличается высокой твердостью (600…650 НВ) и хрупкостью. Критическая скорость охлаждения при закалке это минимальная скорость охлаждения для получения мартенситной структуры. Регулируя скорость охлаждения ниже критической Vкр,можно получать структуры пониженной твердости в виде смесей связанных между собой частиц феррита и цементита: перлит, сорбит или троостит. Эти структуры отличаются друг от друга количеством и степенью дисперсности зерен цементита, а также степенью дисперсности зерен. Свойства неравновесных структур стали приведены в табл.8.1.
Большая Энциклопедия Нефти и Газа
Неравновесные структуры приходят в равновесное состояние в случае отсутствия факторов, удерживающих эти структуры в неравновесном состоянии. Если исходное состояние отличается сильной неравновесностью и возникающие процессы достаточно интенсивны, то на фоне общего стремления системы к равновесию появляется подсистемы, в которых энтропия уменьшается локально. Эти подсистемы представляют значительный интерес. Однако суммарная энтропия для общей системы с учетом внешних систем увеличивается, т.е. нарушение закона возрастания энтропии не происходит. Локальное уменьшение энтропии в какой-либо подсистеме происходит само по себе. Для обеспечения этого процесса необходимо неравновесное состояние с достаточно малой энтропией, но, подчеркнем, общая энтропия всей большой системы увеличивается. [1]
Неравновесная структура , созданная холодным деформированием, у большинства металлов устойчива при 25 С. Переход металла в более стабильное состояние происходит при нагреве. При повышении температуры ускоряется перемещение точечных дефектов и создаются условия для перераспределения дислокаций и уменьшения их количества. [2]
Неравновесные структуры биополимеров , как правило, являются не диссипативными структурами, так как для их поддержания не требуется экспорт энтропии ( или импорт свободной энергии), а консервативными структурами. [4]
Неравновесные структуры закалки крайне нежелательны в сварных соединениях элементов работающих, при высоких температурах. Поэтому сварку поверхностей нагрева труб, а также трубопроводов, работающих под давлением, согласно Инструкции по ручной электродуговой сварке труб из углеродистых и низколегированных сталей, можно проводить в зимних условиях только с предварительным и сопутствующим подогревом. [5]
Неравновесную структуру катализатора с неоднородной поверхностью нужно не только получить, но и сохранить. Для этого в катализатор вводят специальные примеси ( промоторы), которые стабилизируют его неоднородную неравновесную поверхность. [6]
Получение неравновесной структуры в результате термической обработки значительно изменяет многие свойства и особенно механические. В лабораторных работах предусмотрено изучение влияния термической обработки на прочность и вязкость, значения которых во многом определяют поведение деталей в эксплуатации. [7]
Получение неравновесной структуры в результате термической обработки значительно изменяет многие свойства стали и особенно механические свойства. В лабораторных работах, приведенных ниже, предусмотрено изучение влияния термической обработки на механические свойства, так как основной задачей термической обработки конструкционной ( машиностроительной) стали является получение высоких механических свойств. [8]
Переход неравновесных структур в равновесные сопровождается короблением и усадкой изделий во время эксплуатации. Для уменьшения этого недостатка используют термическую стабилизацию - отжиг при температурах, превышающих максимальные температуры эксплуатации. [9]
Наличие неравновесных структур закалки нежелательно как из-за склонности металла к хрупкому разрушению, так и из-за нестабильности этих структур при длительной эксплуатации. [11]
Наличие неравновесных структур закалки крайне нежелательно с точки зрения работоспособности сварного соединения при высоких температурах. Поэтому согласно Инструкции по ручной электродуговой сварке труб из углеродистых и низколегированных сталей сварку труб поверхностей нагрева и трубопроводов, работающих под давлением, в ряде случаев необходимо производить с предварительным и сопутствующим подогревом. Так, при сварке труб из сталей 20 и 15ГС при толщине стенки более 32 мм и температуре окружающего воздуха выше нуля необходим подогрев до 200 - 250 С. При сварке труб с толщиной стенки более 10 мм из сталей 16М, 12МХ и 15ХМ в тех же условиях требуется подогрев до 250 - 300 С, а труб из сталей 12Х1МФ, 15Х1М1Ф, 12Х2МФБ и 12Х2МФСР - до температуры 300 - 350 С. [12]
Наличие неравновесных структур закалки крайне нежелательно с точки зрения работоспособности сварного соединения при высоких температурах. Поэтому сварку труб поверхностей нагрева и трубопроводов, работающих под давлением, согласно Инструкции по ручной электродуговой сварке труб из углеродистых и низколегированных сталей, можно проводить в зимних условиях только с [ предварительным и сопутствующим подогревом. [13]
Элементами неравновесной структуры шва являются химическая неоднородность, дисперсность карбидной или интерметал-лидной фазы в зависимости от легирования), повышенное содержание примесей в твердом растворе и искаженность кристаллической решетки. Первичная структура сварных швов состоит из четко выраженных столбчатых дендритов; вторичная - обычно мелкозернистая с дисперсным распределением второй фазы. [14]
В неравновесной структуре метастабильный аустенит обнаружить легче, чем в равновесной. Это соответствует гораздо меньшей концентрации углерода в аустените ( точка с. Чем более неравновесно состояние исходной феррито-карбидной матрицы, тем меньшей должна быть концентрация углерода в аустените, находящемся в состоянии квазиравновесия с исходной искаженной а-фазой. Следовательно, чем больше степень неравновесности исходной структуры, тем выше эквивалентная температура превращения и тем большим должно быть количество аустенита, образующегося при данной температуре. [15]
Читайте также:
