Сталь представляет собой твердый раствор железо углерод с концентрацией углерода
Обновлено: 18.04.2024
Компонентами железоуглеродистых сплавов являются железо, углерод и цементит:
Железо
Железо – d-переходный металл серебристо-светлого цвета. Температура плавления – 1539° С. Удельный вес равен 7,86 г/см3. Наиболее существенной особенностью железа является его полиморфизм. В твердом состоянии железо может находиться в двух модификациях - α и γ. Полиморфные превращения происходят при температурах 911° С и 1392° С. При температуре ниже 911° С и выше 1392° С существует Feα (или α-Fе) с объемно-центрированной кубической решеткой. В интервале температур 911…1392° С устойчивым является Feγ (или γ-Fе) с гранецентрированной кубической решеткой. При превращении α→γ наблюдается уменьшение объема, так как решетка γ-Fе имеет более плотную упаковку атомов, чем решетка α-Fе. При охлаждении во время превращения γ→α наблюдается увеличение объема. В интервале температур 1392…1539° С высокотемпературное Feα называют Feδ. Высокотемпературная модификация Feα не представляет собой новой аллотропической формы.
При температуре ниже 768° С железо ферромагнитно, а выше – парамагнитно. Точку 768° С, соответствующую магнитному превращению, т.е. переходу из ферромагнитного состояния в парамагнитное называют точкой Кюри. Модификация Feγ парамагнитна.
Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (временное сопротивление – σв=250 МПа, предел текучести – σт=120 МПа) и высокими характеристиками пластичности (относительное удлинение – δ=50 %, а относительное сужение – ψ=80 %). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна. Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов.
Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения.
Углерод
Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500° С, плотность – 2,5 г/см3) или в форме алмаза со сложной кубической решеткой с координационным числом равным четырем (температура плавления – 5000° С).
В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах).
Цементит
Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода. Более точные исследования показали, что цементит может иметь переменную концентрацию углерода. Однако в дальнейшем, при разборе диаграммы состояния, сделаем допущение, что Fе3С имеет постоянный состав. Кристаллическая решетка цементита ромбическая, удельный вес 7,82 г/см3 (очень близок к удельному весу железа). При высоких температурах цементит диссоциирует, поэтому температура его плавления неясна и проставляется ориентировочно – 1260° С. Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу. При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 210° С. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность.
Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: например, азотом; атомы железа – металлами: марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом.
Если графит является стабильной фазой, то цементит – это метастабильная фаза. Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов.
Фазы в системе "железо-углерод"
В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
Жидкая фаза
Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
Феррит
Феррит (Ф, α)- твердый раствор внедрения углерода в α-железе (от латинского слова ferrum – железо). Различают низкотемпературный феррит с предельной растворимостью углерода 0,02 % при температуре 727° С (точка P) и высокотемпературный δ-феррит (в интервале температур 1392…1539° С) с предельной растворимостью углерода 0,1 % при температуре 1499° С (точка J).
Свойства феррита близки к свойствам железа. Он мягок (твердость – 80 - 130 НВ, временное сопротивление – σв=300 МПа) и пластичен (относительное удлинение - δ=50 %), магнитен до 768° С.
Под микроскопом феррит выглядит как светлые полиэдрические зерна. В сталях может существовать в виде сетки (разной толщины, в зависимости от содержания углерода), зерен (малоуглеродистые стали), пластин или игл (видманштетт).
Аустенит в сталях
Аустенит (А, γ) – твердый раствор внедрения углерода в γ–железо (по имени английского ученого Р. Аустена). Углерод занимает место в центре гранецентрированной кубической ячейки. Предельная растворимость углерода в γ -железе 2,14 % при температуре 1147° С (точка Е). Аустенит имеет твердость 180 НВ, пластичен (относительное удлинение – δ=40…50 %), парамагнитен. При растворении в аустените других элементов могут изменяться свойства и температурные границы существования. Под микроскопом выглядит как светлые полиэдрические зерна с двойниками.
Цементит – формы существования
В железоуглеродистых сплавах присутствуют фазы: цементит первичный, цементит вторичный, цементит третичный. Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
Поскольку углерод в сплавах с железом встречается в виде цементита и графита, существуют две диаграммы состояния, описывающие условия равновесия фаз в системах железо - цементит и железо - графит. Первая диаграмма (Fе — Fе3С) называется цементитной (метастабильная), вторая (Fе - С) - графитной (стабильная). Оба варианта диаграммы приводятся вместе в одной системе координат: температура - содержание углерода. Диаграмма состояния системы железо - углерод построена по результатам многочисленных исследований, проведенных учеными ряда стран. Особое место среди них занимают работы Д.К. Чернова. Он открыл существование критических точек в стали, определил их зависимость от содержания углерода, заложил основы для построения диаграммы состояния железоуглеродистых сплавов в ее нижней, наиболее важной части.
Буквенное обозначение узловых точек в диаграмме является общепринятым как в России, так и за рубежом.
Диаграмма состояния железо-углерод
Имеющиеся во всех областях диаграммы фазы видны на рисунке. Значение всех линий указано в таблице.
Ликвидус по всей диаграмме проходит по линиям АВ, ВС, СD; солидус - по линиям АН, НJ, JЕ, ЕСF. Сплавы железа с углеродом обычно делят на стали и чугуны. Условной границей для такого деления является 2,14 % С (точка E). Сплавы, содержащие углерода менее 2,14 %, относятся к сталям, более 2,14 % - к чугунам.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо – цементит, т.е. критические точки, имеют условные обозначения. Обозначаются буквой А. В зависимости от того, при нагреве или при охлаждении определяется критическая точка, к букве А добавляется индекс с (от слова chauffage – нагрев) при нагреве и индекс r (от слова refroidissement – охлаждение) при охлаждении с оставлением цифры, характеризующей данное превращение.
Таким образом, например, нагрев доэвтектоидной стали выше соответствующей точки на линии GS обозначается как нагрев выше точки АС3. При охлаждении же этой стали первое превращение должно быть обозначено как Аr3, второе (на линии РSК) - как Аr1.
Другие структурные составляющие в системе "железо-углерод"
Кроме компонентов и фаз в системе сплавов "железо-углерод" присутствуют другие структурные составляющие - перлит и ледебурит
Перлит
Перлит - эвтектоид, механическая смесь феррита и цементита, полученная в результате распада аустенита при охлаждении сплавов ниже 727° С. При медленном охлаждении перлит присутствует во всех сплавах с концентрацией углерода от 0,02 до 6,67%. Под микроскопом перлит может выглядеть либо как пластины, либо как зерна - зернистый перлит. Его вид, также как и механические свойства, зависит от скорости охлаждения сплава и вида его термической обработки
Ледебурит в сталях
Ледебурит - эвтектика, механическая смесь аустенита и цементита, выделяющаяся из жидкости при охлаждении сплавов ниже 1147° С. Принципиальное отличие эвтектикой составляющей от эвтектоидной заключается в том, что первая выделяется из жидкости, а вторая из твердого раствора, в случае железоуглеродистых сплавов - из аустенита. Название данная структурная составляющая получила в честь имени немецкого ученого-металлурга Ледебура.
Узловые критические точки диаграммы состояния системы железо-углерод
Узловые критические точки диаграммы железо-углерод
Значение линий диаграммы состояния системы железо-углерод
Значения линий на диаграмме железо-углерод
Всякая диаграмма состояния показывает условия равновесного сосуществования фаз во взятой системе компонентов.
Полное физико-химическое равновесие между фазами может быть достигнуто только в специальных лабораторных условиях, а на практике некоторым приближением к этому состоянию может быть случай чрезвычайно медленного охлаждения или нагрева сплава с весьма длительными выдержками во времени при любых искомых температурах.
Лазерная резка металла как бизнес-идея
Когда речь идет о резке металла, существует несколько различных способов. Можно использовать традиционные методы.

Крупнейшие мировые выставки в сфере металлургии на 2022-2023 г
Специализированные выставки в сфере металлообработки и металлургии позволяют изучить новые тенденции рынка, а также, что.

Очистка изделий из металла: простые советы
В быту мы сталкиваемся с огромным количеством металлических изделий, а точнее с различными сплавами.

Какое оборудование подлежит сертификации?
Оборудованием называют совокупность аппаратов, машин, устройств, приспособлений, предназначенных для выполнения определенного перечня функций. Применяется.

Начало и конец поиска месторождений полезных ископаемых
Поиском полезных ископаемых люди стали заниматься с тех пор, как зародилась идея повышать качество.
Газорезка – эффективный способ резки металлических изделий
Сегодня большое распространение получили изделия из металлопроката. Они повсеместно используются в строительстве и в.
Углерод в металле

Содержание углерода в металле определяет свойства углеродистых сталей, в частности, механические характеристики. Благодаря изменению процентного соотношения углерода можно сделать материал более пластичным или твердым, вязким или прочным.
Такие стали называются углеродистыми и классифицируются по своему составу, степени окисления, а также методам производства и применения. Металлы с разной степенью цементита используются в разных сферах. Как же углерод в металле способствует повышению ее востребованности?
На что влияет углерод в металле
В процессе производства невозможно полностью удалить примеси из стали, поэтому они остаются в небольшом процентном содержании во всех углеродистых соединениях. Также их наличие зависит от выбранного метода плавки.
На основании доли углерода в металле принято выделять углеродистую и легированную сталь. Интересующий нас компонент позволяет скорректировать технические и механические характеристики материала.
В стали присутствуют:
- железо – в пределах 99 %;
- углерод – до 2,14 %;
- кремний – не более 1 %;
- марганец – до 1 %;
- фосфор – максимум 0,6 %;
- сера – до 0,5 %.
VT-metall предлагает услуги:
Лазерная резка металла Гибка металла Порошковая покраска металла Сварочные работы
Также сталь содержит небольшую долю водорода, кислорода, азота.
Для чего нужен углерод в металле? В сталеплавильных процессах он играет такие роли:
- Присутствует в большинстве марок стали, поскольку позволяет получить материал с широким диапазоном механических свойств. А именно: влияет на соотношение феррита и перлита в структуре твердого металла, расширяет диапазон температур, при которых железо остается в устойчивом состоянии.
- Считается вредной примесью в сталях специального назначения, таких как электротехнические, жаропрочные, стойкие к коррозии, пр.
- Забирает на свое окисление основную долю кислорода, вдуваемого в ванну с целью избавления от примесей. Например, в кислородно-конвертерном и мартеновском скрап-рудном процессах уходит более 75–80 % кислорода. Поэтому основной задачей управления окислительным рафинированием считается регулировка удаления углерода в металле.
- Является единственной примесью при изготовлении стали, во время окисления которой выделяются газы CO и CO2. Объем последних многократно превосходит объема металла – если говорить точнее, то окисление килограмма углерода при +1 500 °C приводит к образованию более 10 м3 CO. Газ удаляется из ванны в форме пузырей, благодаря чему металл перемешивается со шлаком, возрастает скорость протекания тепло- и массообменных процессов. В результате на плавку уходит меньше времени.
- Пузыри оксида углерода проходят через расплав, параллельно избавляя его от газов, неметаллических включений при плавке и вакуумировании.
- Реакция окисления углерода сопровождается нагревом ванны, что важно для протекания кислородных процессов. Так, на кислородно-конвертерном этапе обработки металла тепло реакции окисления углерода обеспечивает 20–25 % приходной части теплового баланса плавки. Так сплав достигает температуры выпуска при значительной доле лома в шихте.
- От количества углерода в металле и его постоянного окисления зависит содержание кислорода в стали и оксидов железа в шлаке. Окисленность ванны влияет на потери железа со шлаком в виде оксидов, остаточное содержание прочих примесей, угар раскислителей и легирующих добавок, пр.
- Благодаря окислению интересующего нас элемента во время затвердевания металла в изложницах удается формировать слитки стали разных видов. Речь идет о кипящем, спокойном и полуспокойном типе данного металла.

Увеличение доли углерода в металле провоцирует такие изменения:
- повышение электросопротивления;
- увеличение коэрцитивной силы;
- ухудшение проницаемости магнитов;
- снижение плотности индукции магнитов.
Свойства металла (стали) с разным содержанием углерода
Говоря о том, что такое углерод в металле, важно понимать, что свойства углеродистых сталей определяются сложным молекулярным строением. Структура цементита такова, что каждая ее ячейка имеет форму октаэдра.

Данная особенность обеспечивает ряд таких важных технико-экономических показателей сплавов, как:
- высокая прочность, несущая способность;
- твердый поверхностный слой в сочетании с мягкой сердцевиной, что объясняется плохой прокаливаемостью – данная характеристика компенсирует хрупкость металла;
- большой срок службы, достигающий 50 лет при нормальных условиях, либо применении средств, призванных защитить материал от появления очагов ржавчины;
- низкая стоимость технологии выплавки, которая используется с конца XIX века – именно тогда были созданы мартеновские печи.
От количества углерода в металле зависит определенный вид стали:
- Низкоуглеродистая сталь имеет в составе до 0,25 % данного компонента, отличается пластичностью, однако легко поддается деформации. Такой металл может обрабатываться в холодном виде либо при высоких температурах.
- Среднеуглеродистая сталь содержит 0,3–0,6 % углерода, является пластичной, текучей, имеет средний уровень прочности. Данный процент углерода в металле позволяет использовать его как материал для деталей и конструкции, эксплуатируемых в нормальных условиях.
- Высокоуглеродистая сталь предполагает долю углерода в 0,6–2 %. Отличается хорошей стойкостью к износу, низкой вязкостью, а также она прочная и дорогостоящая. Для проведения сварных работ металл необходимо предварительного разогреть до +225 °C.
Стоит отметить, что первые два вида проще поддаются обработке, свариванию.
Каждая марка стали имеет свою сферу применения и отличается от других методом изготовления:
Конструкционные стали
Обладают большой долей углерода в металле, для их производства используются мартеновские печи и специальные конвертеры. В маркировке конструкционных сталей применяют первые три буквы алфавита и цифры. По буквам можно определить принадлежность сплава к определенной группе, тогда как цифровое значение говорит о количестве углерода.
Если в металле присутствует марганец, обозначение дополняется буквой «Г». Группа А разделяет сплавы по механическим характеристиками, Б – по доле примесей, В – сразу по двум показателям. Так, при производстве группы А отталкиваются от необходимых качеств, тогда как в группе Б опираются на соответствие нормам.
Инструментальные стали
Производят в мартеновской или электрической печи, которая стала наиболее распространена в последнее время. Марки сплава имеют различную вязкость, степень раскисления. Кроме того, среди инструментальных сталей принято выделять качественные и высококачественные.
Технология изготовления углеродистых сталей
Зная содержание углерода в металле, важно также понимать, что это позволяет использовать в металлургии различные методы производства углеродистых сталей, для каждого из них используется особое оборудование.

Специалисты выделяют несколько типов печей, применяемых для этих нужд:
- конверторные плавильные;
- мартеновского типа;
- электрические.
Конверторные печи расплавляют все компоненты сплава, после чего смесь проходит обработку техническим кислородом. В горячий металл вносят известь, чтобы удалить присутствующие примеси, превратив их в шлак. Процесс производства сопровождается активным окислением металла, из-за чего выделяется большое количество угара.
Использование конверторных печей для изготовления углеродистых сталей требует установки дополнительных фильтровальных систем, поскольку во время работы образуется много пыли. А монтаж дополнительного оборудования всегда чреват значительными финансовыми затратами.
Однако этот недостаток не мешает конверторному методу активно использоваться на металлургических производствах, так как специалисты ценят его за высокую производительность.
Печи мартеновского типа обеспечивают высокое качество различных марок стали. Здесь производство металла с содержанием углерода состоит из таких этапов:
- в отдельный отсек печи загружают чугун, стальной лом, пр.;
- металл нагревается до значительной температуры;
- составляющие будущего сплава превращаются в однородную горячую массу;
- происходит химическая реакция между компонентами в процессе плавления;
- готовый металл поступает из печи.
Электрические печи предполагают совершенно иной подход к производству: отличается способ нагрева материалов. Благодаря использованию электричества снижается окисляемость металла в процессе разогрева, из-за чего в сплаве сокращается доля водорода. Это позитивно отражается на структуре и качестве готовой стали.
Области применения углеродистых сталей
Производство деталей машин
Прежде чем приступить к изготовлению определенной детали из углеродистых сталей, оценивают режим ее дальнейшей работы.

Марки металла, в которых содержится малая доля углерода, подходят для изделий, защищенных от серьезных нагрузок, воздействия вибрации, ударов. К таким элементам относятся:
- дистанционные кольца;
- втулки;
- крышки;
- колпаки;
- маховики;
- стаканы для подшипников;
- прихваты, планки.
В качестве отдельной категории выделяют сварные каркасные конструкции, корпусные изделия, поскольку в этом случае низкая прочность данного вида сталей компенсируется толщиной несущего сечения. Тогда как податливость материала обработке сваркой обеспечивает более высокий уровень общей технологичности.
Для деталей, которые ожидают большие нагрузки в процессе эксплуатации, выбирают среднеуглеродистые стали для дальнейшей закалки. Либо могут использоваться марки металла с низким содержанием углерода при условии цементации.
Данные требования распространяются на следующие виды продукции:
- шкивы ременных передач;
- звездочки цепных передач;
- зубчатые колеса, шестерни, валы-шестерни;
- валы, оси;
- шпиндели;
- рычаги;
- ролики;
- штока, поршни цилиндров.

В первую очередь, производят заготовку – на этом этапе осуществляется резка проката, отливка, штамповка или поковка. После чего переходят к механической и температурной стадии.
В конце приступают к доводочным, отделочным операциям при помощи абразива, то есть к шлифовке, хонингованию, притирке, суперфинишированию. Нужно учитывать, что невозможно эффективно обработать незакаленные стали абразивным инструментом, так как процесс сопровождается засаливанием режущих зерен.
Высокоуглеродистые рессорно-пружинные разновидности стали применяют лишь в особых случаях, поскольку такой металл с углеродом в составе предполагает значительно более сложную обработку. Кроме того, любые промахи трудно устранить, например, заварить дефект.
Обычно подобные стали выбирают для навивки спиральных пружин, производства рессор, цанг, направляющих скольжения и прочих элементов, от которых требуется упругость в сочетании с твердостью.
Производство инструмента
Назначение углеродистых инструментальных сталей очевидно уже из названия. Ограничением в их применении является повышенная температура: при превышении +250…+300 °C закаленный металл отпускается, утрачивает прочность, твердость.
Также важно учитывать, что углеродистые стали уступают легированным по функциональности. Ими нельзя резать или давить материалы, имеющие более высокие показатели прочности.
Из-за всех названных особенностей такие металлы используют для изготовления ручного инструмента, позволяющего осуществлять холодную обработку дерева, пластика, мягких цветных металлов.

В производстве задействуются исключительно кованые заготовки, а не литье. Среди проката выбирают упрочненный сортамент, созданный непосредственно для изготовления инструмента.
Далее металл с необходимой долей углерода в составе точат, сверлят, фрезеруют, закаляют, после чего доводят до нужного состояния при помощи абразива. Стоит отметить, что шлифовка является наиболее трудоемким этапом изготовления, так как именно в это время инструменту сообщаются требуемые параметры.
Кроме того, эти операции позволяют удалить с металла поверхностный слой, содержащий дефекты, которые остались после термической обработки.
Производство крепежа
ГОСТ 1759.4-87 содержит в себе требования к механическим свойствам резьбового крепежа. В соответствии с этим документом, болты, винты, шпильки могут изготавливаться из таких углеродистых сталей:
- 10 и 20 – для классов прочности 3.6, 4.6, 4.8, 5.8 и 6.8, не предполагающих проведение термической обработки;
- 30, 35, 45 – для классов прочности 5.6 и 6.6 с термической обработкой;
- 35 – для классов прочности 8.8, 9.8, 10.9 и 12.9, где термическая обработка является обязательным этапом.
Массовое и крупносерийное производство метизов из металла, в составе которого есть углерод, предполагает использование технологии горячей или холодной штамповки и высадочных автоматов. После чего на заготовки нарезают либо накатывают резьбу.
Если речь идет о мелкой серии, доступен заказ нестандартного крепежа – партия изготавливается на универсальном оборудовании для металлорезки.
Для производства крепежа нередко используют особую группу углеродистых сталей. Речь идет о марках, отличающихся повышенной обрабатываемостью – у них в начале маркировки стоит буква «А». Такие металлы отличаются от всех остальных максимальной однородностью структуры и химического состава по всему объему проката.
Поэтому при обработке на станках-автоматах отсутствует риск перепада нагрузки на инструмент, что обычно возможно из-за разной твердости сплава, присутствия микродефектов в виде неметаллических включений.
Рекомендуем статьи
Углеродистые стали подходят для решения большей части технических задач от производства элементов машин до сборки несущих металлоконструкций. Такие марки отличаются долей углерода в металле, что позволяет легко понять область их использования.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
Сплав железа с углеродом

Открытие сплава железа с углеродом явилось одним из самых важных событий в истории развития металлургии. Именно эти два элемента подарили миру наиболее востребованные марки стали и чугуна. Это те сплавы, из которых производится большая часть промышленного оборудования, металлических конструкций, инструмента, изделий бытового назначения.
В зависимости от процентного содержания углерода в железе, а также способа литья эти сплавы приобретают разные свойства: стойкость к коррозии, необычайную прочность, эластичность и т. д. О том, какие сплавы железа и углерода используются сегодня и как их получают, вы узнаете из нашего материала.
История открытия сплавов железа с углеродом
Выдающийся изобретатель Дмитрий Чернов прославился диаграммой «железо-углерод» и открытием, связанным с полиморфными превращениями. Именно он стал первооткрывателем особых точек в таких сплавах, как чугун и сталь. По мнению ученого, на расположение точек на диаграмме влияет процентная доля углерода.
Открытие стало настолько значимым, что положило начало новой науке – металлографии.
Сама диаграмма сплава железа с углеродом – это масштабный проект, разработанный несколькими учеными из разных уголков мира. Именно поэтому обозначения фаз и основных точек являются международными.
Структурные составляющие сплавов железо-углерод
Основа чугуна и стали – сплав железа с углеродом. Оба черных сплава являются незаменимыми при создании конструкционных деталей для техники. Их качества и структура определяются свойствами базовых компонентов и примесей. Также важно учитывать характер взаимодействия элементов.
Чистое железо – это серебристо-белый металл, который имеет температуру плавления +1 539 °С. Металл является тугоплавким и может обладать одной из полиморфных модификаций – a либо g.
Нагрев железа приводит к превращению решетки из объемно-центрированной в гранецентрированную. Для создания g-железа необходим высокотемпературный режим – от +910 °С до +1 392 °С.
Углерод представляет собой неметаллический элемент. Его температура плавления составляет +3 500 °С. В природе элемент способен существовать в виде алмаза или графита. Первая полиморфная модификация в сплавах не встречается.
Если говорить об углеродистой структуре в сплаве железо-углерод, то она слоистая. В связи с этим неметаллический элемент в свободном виде имеет форму графита, особенность которого заключается в низких показателях пластичности и прочности.
Углерод растворим в железе и в жидком, и в твердом состоянии. Он способен создать химическое соединение под названием цементит, где углерод в свободном виде также будет иметь форму графита.
Возможные составляющие сплавов железа с углеродом перечислены ниже:
Диаграмма сплава железо-углерод
На диаграмме сплава можно выделить следующие границы:
- Линия ледебуритного превращения (линия ECF). Если содержание углерода в сплаве выше 2,14 %, то при его охлаждении жидкая фаза под линией становится ледебуритом.
- Линия ликвидус (линия ACD). Ее особенность заключается в том, что при снижении температуры под ней запускается кристаллизация сплавов.
- Линия перлитного превращения (линия PSK). При снижении температуры сплав под ней из аустенита превращается в перлит.
- Линия солидус (линия AECF). При снижении температуры сплав под ней становится твердым.

Также на диаграмме присутствует несколько важных точек:
Обычно температурный режим, при котором достигается необходимое состояние сплава, обозначается буквой А.
Из-за того, что фазы в сплавах железа с углеродом имеют разные температуры при нагреве и охлаждении, приходится вводить дополнительные обозначения.
Как читать диаграмму сплава железа с углеродом
Сплавы системы железо-углерод имеют свойство меняться при охлаждении или нагреве, повышении или снижении давления. Графически такие процессы обозначены на диаграмме состояния. Благодаря ей можно понять, как происходит то или иное превращение сплава.
Состав сплава с первоначальной долей углерода при заданной температуре можно увидеть, если двигаться по вертикальной прямой, которая соответствует содержанию в сплаве углерода.
Правило легче понять на примере, поэтому рассмотрим на диаграмме зону AEC. Возле нее находятся области жидкой фазы и аустенита (AESG). Следовательно, соединение в данной области состоит из образующегося твердого аустенита и жидкой фазы.
Определим для него концентрация углерода, двигаясь по разным фазам. Для этого нужно знать изначальную концентрацию углерода и заданную температуру. В примере это 2,5 % и +1 250 °С.
Теперь из точки графика нужно провести горизонтальную линию. Ее пересечение с АЕ, которая граничит с зоной аустенита, покажет содержание углерода в аустените при температуре +1 250 °С.

Если же прямая будет пересекаться с АС, которая граничит с зоной жидкой фазы, то можно узнать концентрацию углерода уже в жидкой фазе.
При сохранении температуры по данному методу определимо процентное содержание углерода в фазах абсолютно любого сплава:
- в области AEC в аустените и в жидкой фазе;
- в области CDF в жидкой фазе (процентное содержание углерода в цементите при этом неизменно – 6,67 %);
- в области GPS в аустените и в феррите;
- в области QPKL в феррите;
- в области SEFK в аустените.
Когда содержание углерода становится выше, чем 2,14 %, охлаждаемый сплав получает насыщение углеродом ближе к 4,3 % (по линиям DC и AC) по мере приближения к температуре +1 147 °С (на уровне ECF). Затем жидкость превращается в эвтектику (ледебурит). Среднее содержание углерода остается неизменным.
Применение стали из железоуглеродистых сплавов
Сталь, как и чугун, представляет собой сплав железа с углеродом. Металлы имеют широкое распространение, особенно часто их задействуют в машиностроении.
В стали концентрация углерода составляет не более 2 %.
Примеры металла:
- инструментальная сталь;
- конструкционная сталь;
- техническое железо.
Если в стали содержание углерода было строго меньше 2 %, то в чугуне – больше. В среднем, концентрация вещества составляет от 2,5 до 3,5 %.
Помимо железа и углерода в металлах содержатся такие добавки:
- марганец и кремний, содержание которых исчисляется в десятых долях процента (от 0,15 до 0,6 %);
- фосфор и сера, концентрация которых составляет сотые доли процента (от 0,05 до 0,03 %).

Сталь, в которой концентрация углерода составляет не более 0,7 %, часто используется для создания:
- листов;
- проволоки;
- ленты;
- фасонного профиля разных видов;
- уголкового железа;
- таврового железа;
- различных деталей, используемых в машиностроении (например, осей, шестерен, болтов, кувалд, молотков и др.).
Сталь, в которой концентрация углерода составляет более 0,7 %, используется при изготовлении режущих инструментов:
- бородок;
- резцов;
- зубил;
- сверл;
- метчиков.
Свойства данного сплава железа с углеродом зависят от концентрации неметаллического компонента. Так, чем больше будет углерода, тем прочнее и тверже получится сталь.
Разновидности чугуна из сплава железа с углеродом
Выделяют два основных вида чугуна – литейный и предельный. Первый вид принято использовать в производстве и промышленной сфере. Второй находит применение в создании стали кислородно-конвертерным путем. В получившемся соединении доля марганца и кремния крайне мала.

Литейный чугун также имеет несколько разновидностей:
- Половинчатая. Такой чугун имеет специальные свойства, так как часть углерода из состава имеет форму цементита, а другая часть – форму графита.
- Белая. Здесь углерод находится в виде карбида железа. Название произошло от белого оттенка разлома. Белый чугун не находит применения в чистом виде, но активно используется при создании ковкого чугуна.
- Серая. Отлив на изломе серебристый, поэтому такой чугун называют серым. Сфера использования материала достаточно широкая, в том числе и потому, что чугун легко обрабатывать резцами.
- Высокопрочная. Данная разновидность способна увеличить прочность любого материала, куда она будет добавлена. Материал получают из серого чугуна и небольшого количества магния.
- Ковкая. Как и в случае высокопрочной разновидности, в основе находится серый чугун. Повысить пластичность помогает процесс отжига.
Полиморфные превращения в сплавах железо-углерод
Полиморфные превращения в сплавах железа с углеродом происходят при соблюдении температурного режима.
Если температура составляет меньше +911 °С, то состояние железа называется α-феррумом. Кристаллическая решетка железа – ОЦК, что расшифровывается как объемный гранецентрированный куб. Особенность решетки состоит в большом расстоянии между атомами.

При температуре от +911 до +1392 °С у железа наблюдается модификация гамма. Кристаличесская решетка γ-феррума – ГЦК, т. е. гранецентрированный куб. Расстояние между атомами меньше, чем в случае объемного гранецентрированного куба.
Когда железо переходит из модификации альфа в гамму, его объем уменьшается. Причина кроется в виде кристаллической решетки. В ОЦК атомы не настолько упорядочены, как в ГЦК.
Правило работает и в обратном направлении. При переходе из гамма-стадии в альфа-стадию объем сплава железа с углеродом возрастает.
Если температура находится в диапазоне от +1 392 до +1 539 °С (последняя – температура плавления железа), то α-феррум переходит в свою другую разновидность – δ-феррум. Стоит помнить, что структура δ-феррума неустойчива, поэтому стремится перейти в более устойчивое состояние.
В результате удалось выяснить, что сталь и чугун – сплавы железа с углеродом с разным содержанием углерода и примесей. Это напрямую влияет на механические и химические свойства стали, а они – на сферу применения конечного материала.
Диаграмма железо-углерод
Диаграмма железо-углерод – это графическое отображение структуры сплавов, состоящих только из железа и углерода, в зависимости от исходной средней концентрации углерода и текущей температуры сплава. Диаграмма железо-углерод позволяет понять процессы, происходящие при термообработке стали.
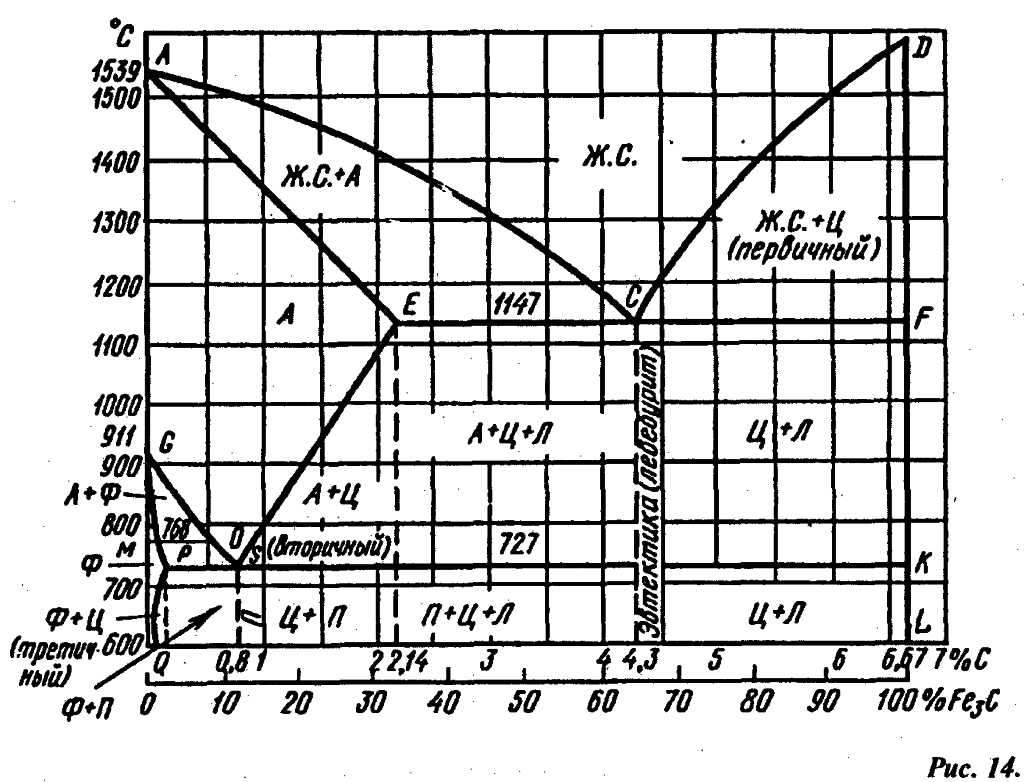
Диаграмма железо-углерод (железо-цементит). Упрощенная

Структуры на диаграмме железо-углерод
Напомним о 2 кристаллических формах железа:
Полиморфное превращение одной формы в другую при проведении термообработки сталей происходит при прохождении сплавами линии GSK.
Выделим 4 фазы в системе железо-углерод:
- Жидкая фаза. Концентрация углерода не ограничена;
- Феррит – это твёрдый раствор углерода в α-железе. Максимальная концентрация углерода – всего лишь 0,025% (точка P). При комнатной температуре – не выше 0,006%. Феррит мягок и пластичен.
- Аустенит – твёрдый раствор углерода в γ-железе. Максимальная концентрация углерода — 2,14 % (точка E). Аустенит имеет невысокую твёрдость, пластичен, не магнитится.
- Цементит — химическое соединение железа с углеродом (карбид железа, Fe 3 C). Концентрация углерода, соответственно, постоянная – 6,67 % углерода. Цементит очень твёрд, хрупок, непластичен.
В зависимости от условий образования выделяют:
- первичный цементит (образуется из жидкости);
- вторичный цементит (выделяется из аустенита вокруг его зерен);
- третичный цементит (выделяется из феррита по границам его зерен);
- эвтектоидный цементит (является составной частью перлита);
- эвтектический цементит (является составной частью ледебурита).
Необходимо так же выделить 2 структурные составляющие железоуглеродистых сплавов:
- Перлит (эвтектоид) – механическая смесь 2 фаз – пластинок/зерен феррита и цементита. Перлит образуется в результате перлитного превращения аустенита («свободного» или входящего в состав ледебурита) с концентрацией углерода 0,8% при прохождении ниже линии PSK:

Структура перлита. Ф — феррит, Ц — цементит
Железо при этом переходит из γ-формы в α-форму. Механические свойства сильно зависят от размера (дисперсности) частичек, из которых состоит данный перлит.
- Ледебурит (эвтектика) – механическая смесь 2 фаз – пластинок/зерен аустенита и цементита. Ледебурит образуется из жидкой фазы с концентрацией углерода 4,3% при прохождении ниже линии ECF:
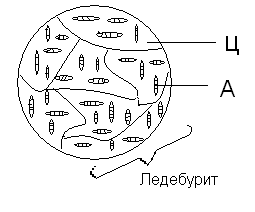
Структура ледебурита. Ц — цементит, А — аустенит.
Повторяясь, напомним, что при прохождении сплавов ниже линии PSK (727°С) аустенит, входящий в состав ледебурита, претерпевает перлитное превращение, разделяясь на феррит и цементит. Ледебурит тверд и хрупок.
При комнатной температуре железоуглеродистые сплавы могут иметь различную структуру, а значит и свойства, хотя и состоят всегда всего из 2 фаз: феррита и цементита.

Некоторые элементы диаграммы железо-углерод
Выделим несколько границ на диаграмме железо-углерод:
- линия ACD. Линия ликвидус. При охлаждении сплавов ниже нее начинается их кристаллизация;
- линия AECF. Линия солидус. При охлаждении сплавов ниже нее весь сплав переходит в твердое состояние;
- линия ECF. Иногда называется линией ледебуритного превращения. При охлаждении сплавов с содержанием углерода выше 2,14% ниже нее жидкая фаза превращается в ледебурит;
- линия PSK. Линия перлитного превращения. При охлаждении сплавов ниже нее аустенит превращается в перлит.
Отметим несколько важных точек на диаграмме:
- точка E. Точка максимального насыщения аустенита углеродом – 2,14%, при температуре 1147°С;
- точка P. Точка максимального насыщения феррита углеродом – 0,025%, при температуре 727°С;
- точка S. Точка «0,8% С-727°С» превращения аустенита с концентрацией углерода 0,8% в перлит (эвтектоид) той же средней концентрации;
- точка C. Точка «2,14 % С-1147°С» превращения жидкости с концентрацией углерода 2,14% в ледебурит (эвтектику) той же средней концентрации.
Часто значения температур, при которых происходят структурные изменения конкретного сплава обозначают буквами A:
Поскольку температуры фазовых переходов при нагреве и охлаждении слегка отличаются, то часто вводят дополнительные буквенные обозначения:
Чтение диаграммы железо-углерод
Состав сплава с данным исходным содержанием углерода при заданной температуре мы можем увидеть, двигаясь по вертикальной линии, соответствующей содержанию углерода в сплаве.
Рассмотрим, например, область AEC. С ней соседствуют области аустенита AESG и жидкой фазы. Сплавы в ней состоят из жидкой фазы и образующегося твердого аустенита. Как определить концентрацию углерода в разных фазах для данного сплава? Рассмотрим для примера сплав с исходной концентрацией углерода 2,5% при температуре 1250°С.
Проведем из этой точки графика «2,5% C – 1250°С» горизонтальную прямую. Пересечение этой прямой с линией AE, граничащей с областью аустенита, покажет концентрацию углерода в аустените при данной температуре (~1.5%).
Пересечение этой же горизонтальной прямой с линией AС, граничащей с областью жидкой фазы, покажет концентрацию углерода в жидкой фазе при данной температуре (~3.5%).
Именно таким образом мы можем определить концентрацию углерода в фазах любого сплава при заданной температуре:
- в жидкой фазе и аустените в области AEC;
- в жидкой фазе в области CDF (концентрация углерода в цементите, конечно, постоянна – 6,67%);
- в аустените в области SEFK;
- в феррите в области QPKL;
- в феррите и аустените в области GPS.
Как видим, при концентрации углерода выше 2,14% насыщение охлаждаемого расплава углеродом всегда стремится к 4,3% (по линиям AC и DC) по мере приближения к температуре 1147°С (уровень ECF). Далее происходит превращение жидкости в ледебурит (эвтектику). Естественно, с этим же средним содержанием углерода.
По мере приближения к температуре 727°С (уровень PSK) концентрация углерода в аустените («свободном» и/или входящем в состав ледебурита) стремится к 0,8% (по линиям GS и ES). Далее происходит превращение аустенита в перлит (эвтектоид). Перлит, конечно, имеет среднее содержанием углерода 0,8%.
Классификация железоуглеродистых сплавов
Классификация железоуглеродистых сплавов в зависимости от концентрации углерода в сплаве:
Техническое железо выделяет то, что оно состоит исключительно из феррита. Который и определяет его свойства: мягкость, чрезвычайную пластичность и т.д.
Чугуны же выделяет наличие ледебурита, придающего им хрупкость. Поэтому чугуны не могут подвергаться ковке. Зато обладают лучшими литейными свойствами (чем стали), обусловленными наличием легкоплавкого ледебурита.
Термообработка сталей в ООО КВАДРО
Наше предприятие уже почти четверть века производит на заказ термообработку металлов в Санкт-Петербурге. Заказать термообработку у нас Вы можете, оставив Вашу заявку на электронной почте или позвонив нам.
Мы производим термообработку сталей (в т.ч. нержавеющих, инструментальных и т.п.) по чертежам Заказчика или заданным режимам , а так же иных металлов и сплавов (алюминиевых и титановых, латуней и бронз, и т.д.).
Основные виды термической обработки металлов, осуществляемые на нашем предприятии на заказ:
Напоминаем так же, что у нас вы можете воспользоваться широким спектром методов металлообработки, включая фрезерные работы и токарную обработку.
Диаграмма состояния сплавов «железо-углерод». Характер взаимодействия железа с углеродом. Основные линии диаграммы.
Различные комбинации этих элементов приводят к получению большого количества сплавов, которые можно разделить на три большие группы:
- Техническое железо.
- Стали.
- Чугуны.

К техническому железу относят материалы, в которых содержится менее 0,02% углерода. К сталям относят, материалы, в которых углерод находится в пределах от 0,02 до 2,14%. И в группу чугунов входят материалы, количество углерода в которых превышает 2,14%.



Феррит
Является твердым раствором внедрения углерода в α-ферруме. Также может быть включено небольшое количество примесей. Но феррит имеет почти одинаковые качества, как и чистое железо. Если рассмотреть структуру под микроскопом, то можно увидеть полиэдрические зерна светлого тона.
- низкотемпературный (при температуре 727° С растворимость углерода 0,02 %);
- высокотемпературный (при 1499° С растворимость углерода 0,1 %), или его называют δ-феррум.
- твердость — 80-120 НВ;
- временное сопротивление — 300 МПа;
- относительное удлинение — 50 %;
- обладает хорошими магнитными свойствами (до температуры 768° С).
Компоненты в системе железо углерод
Аустенит
Атомы размещается в гранецентрированной ячейке. Твердость аустенита имеет твердость 200 … 250 единиц по Бринеллю. Кроме того у него хорошая пластичность и он отличается парамагнитностью.
Железо – это материал, относящийся к металлам. Его натуральный цвет – серебристо-серый. В чистом виде он очень пластичен. Его удельный вес составляет 7,86 г/куб. см. Температура плавления составляет 1539 °C. На практике чаще всего применяют техническое железо, в составе которого присутствуют следующие примеси – марганец, кремний и многие другие. Массовая доля примесей не превышает 0,1%.

У железа есть такое свойство как полиформизм. То есть, при одном и том же химическом составе, это вещество может иметь разную структуру кристаллической решетки и соответственно разные свойства. Модификации железа называют соответственно – Б, Г, Д. Все эти модификации существуют при разных условиях. Например, тип Б, может существовать только при температуре 911 °С. Тип Г может существовать в диапазоне от 911 до 1392 °С. Тип Д существует в диапазоне от 1392 до 1539 °С.
Каждый из типов обладает своей формой кристаллической решеткой, например, у типа Б решетка представляет собой куб, решетка типа Г имеет гранецентрированную кубическую форму. Решетка типа Д, имеет форму объемно центрированного куба.
Еще одно свойство состоит в том, что при температуре ниже 768 железо ферримагнитно, а при ее повышении это свойство теряется.
Точки полиморфной и магнитной трансформации называют критическими. На таблице они обозначены следующим образом – А2, А3, А4. Цифровые индексы показывают тип трансформации. Для более полного различия превращения железа из одного вида в другой к обозначению добавляют индексы с и r. Первый говорит о нагреве, второй об охлаждении.

Полиморфные модификации железа
При высоких параметрах пластичности, железо не обладает высокой твердостью, по шкале Бринелля она равна 80 единиц.
Железо имеет возможность образовывать твердые растворы. Их можно разделить на две группы – раствор замещения и внедрения. Первые состоят их железа и других металлов, вторые из железа и углерода, водорода и азота.
Другой компонент системы – углерод. Это – неметалл и он обладает тремя модификациями в виде алмаза, графита и угля. Он плавится при 3500 °С.

Аллотропные модификации углерода
В сплаве железа, этот элемент находится в виде твердого раствора, его называют цементит или в виде графита. В таком виде он присутствует в сером чугуне. Графит, не отличается ни пластичностью, ни прочностью.
Доля углерода составляет 6,67%. Он обладает высокой твердостью – 800 НВ, но при этом у него отсутствует пластичность. Полиморфными свойствами не обладает.
Он обладает следующим свойством – при формировании раствора замещения, углерод может быть заменен на атомы других веществ, например, на хром или никель. Такой раствор получил название легированного раствора.

Он не обладает устойчивостью, при наличии некоторых условий он может разлагаться, при этом происходит трансформация углерода в графит. Это свойство нашло применение при образовании чугунов.
Кстати, в жидком состоянии, железо может растворять в себе примеси, при этом образуя, однородная масса.
Так называют твердый раствор, при котором происходит внедрение углерода в железо.
Он растворяется с определенной переменностью, при нормальной (комнатной) температуре объем углерода лежит в пределах 0,006%, при 727 °С, то концентрация углерода составит 0,02%. По достижении 1392 °С образуется феррит.

Содержание углерода составит 0,1%. Его атомы размещаются в дефектных узлах решетки.
Феррит по своим параметрам близок к железу.
Полиморфные превращения
Более подробно о каждой фазе чуть ниже в статье. А если кратко, то осуществление главных превращений происходит при особых температурах.
Состояние железа обозначают как α-феррум (при температуре менее 911° С) . Кристаллическая решетка – объемный гранецентрированный куб. Или ОЦК. Дистанция между атомами такой решетки достаточно высокая.
Железо приобретает модификацию гамма, то есть обозначается как γ-феррум (911-1392° С) . Кристаллическая решетка — гранецентрированный куб (ГЦК). В этой решетке дистанция между атомами ниже, чем в ОЦК.
При переходе α-феррума в γ-феррум объем вещества становится меньшим. Причиной тому является кристаллическая решетка – ее вид. Потому что решетка ГЦК имеет более упорядоченное состояние атомов, чем ОЦК.

Если переход осуществляется в обратном направлении — из γ-феррума в α-феррум, то объем сплава увеличивается.
Когда температура достигает значения 1392° С (но менее температуры плавления железа 1539° С), то α-феррум превращается в δ-феррум, но это не является ее новой формой, а лишь разновидностью. К тому же δ-феррум является неустойчивой структурой.
Аустенит в сталях
Наличие аустенита в стальных сплавах придает им определенные свойства. Детали и узлы, произведенные из подобных сталей, предназначаются для работы в средах, содержащие агрессивные компоненты, например, на предприятиях, перерабатывающих разные кислоты.
Стали этого класса отличаются высоким уровнем легирования, во время кристаллизации формируется гранецентрированная решетка. Такая структура не подвержена изменению даже под воздействием глубокого холода.
Стали этого типа можно разделить на два типа отличающиеся друг от друга составом. В первых, содержатся такие вещества как железо, никель, хром. При этом общее количество добавок не может превышать 55%. Ко второй группе относят никелевые и железоникелевые композиции. В никелевых композициях, его содержание превышает 55%. В железоникелевых составах соотношение никеля и железа составляет 1:5, а количество никеля начинается от 65%.
Такое количество никеля обеспечивает повышенную пластичность, а хром, в свою очередь обеспечивает высокую коррозионную стойкость и жаропрочность. Применение других легирующих материалов позволяет выплавлять сплавы с уникальными эксплуатационными свойствами. Металлурги, составляя рецептуру сплавов, руководствуются будущим назначением сталей.
Для получения легированный сталей применяют ферритизаторы, которые придают постоянство аустенитам, к таким веществам относят ниобий, кремний и некоторые другие. Кроме них применяют углерод, марганец – их называют аустенизаторами.
Цементит: формы существования
Так называют соединение углерода и железа. Это компонент чугуна и некоторых сталей. В него входит 6,67% углерода.
В его кристалл входит несколько октаэдров, они расположены друг по отношению к другу с некоторым углом. Внутри каждого из них расположен атом углерода. В результате такого построения получается следующая картина – один атом вступает в связь с несколькими атомами железа, а железо в свою очередь связано с тремя атомами этого элемента.

Кристаллическая решетка цементита
У этого вещества имеются все свойства, которые присущи металлам – электропроводность, своеобразным блеском, высокая теплопроводность. То есть, смесь железа и углерода, ведет себя как металл. Этот материал обладает определенной хрупкостью. Большая часть его свойств определена сложным строением кристаллической решетки.
Этот материал плавится при 1600 градусах Цельсия. Но на этот счет существует несколько мнений, одни исследователи считают, что его температура плавления лежит в диапазоне от 1200 до 1450, другие определяют, что верхний уровень равен 1300 °С.
Первичный цементит
Металлурги разделяют три типа этого вещества – первичный, вторичный, третичный.

Первичный, получается из жидкости при закалке сплавов, которые содержат в себе 5,5% углерода. Первичный имеет форму в виде крупных пластин.
Вторичный
Этот элемент получается из аустенита при охлаждении последнего. На диаграмме этот процесс этот процесс можно видеть по диаграмме Fe – C. Цементит представлен в виде сетки, размещенной по границам зерен.
Третичный
Этот тип, является производным от феррита. Он имеет форму иголок.
В металлургии существуют и другие формы цементита, например, цементит Стеда и пр.
Другие структурные составляющие в системе железо углерод
Перлит – это механическая смесь, которая состоит из феррита и цементита. Ледебурит представляет собой переменный раствор.

При температуре от 1130 и до 723 °С в его состав входят аустенит и цементит. При более низких температурах он состоит из аустенит заменяет феррит.
Узловые критические точки диаграммы состояния системы железо углерод
На диаграмме железо углерод отмечено некоторое количество точек, называемых критичными. Каждая точка несет в себе информацию о температуре, долевом содержании углерода и описанием того, что именно происходит в этом месте.
Всего существует 14 этих критичных точек.
Например, А, говорит о том, что при температуре 1539 °С и при нулевом содержании углерода происходит плавление чистого железа. D говорит о том, что при температуре 1260 возможно плавление Fe3c.
Точки расположены на пересечении линий, размещенных на диаграмме.
Свойства технически чистого железа
Магнитные свойства железа при различных температурах:
- менее 768° С – ферромагнитно;
- более 768° С – парамагнитно.
А температурную точку 768° С называют точкой магнитного превращения, или точкой Кюри.
Читайте также:
