Стальная вода что это
Обновлено: 19.05.2024
Повышенное содержание этого элемента в жидкости для питья — большая проблема как для пользователей центральной системы водоснабжения, так и для тех, в чьем владении имеются собственные скважины и колодцы. «Железистая» живительная влага пагубно сказывается на здоровье людей и животных, существенно уменьшает период службы сантехнических узлов и приборов бытового пользования. А из-за характерного запаха и специфического привкуса употребление воды, обогащенной железом, не приносит никакого удовольствия.

Введение
Металлические примеси выступают отличительным признаком водных ресурсов в регионах с повышенной влажностью. Проблема характерна для Центральной части России, Дальнего Востока и Сибири. В подземных источниках Московской области его наличие превышает допустимые показатели повсеместно. Мы расскажем, что делать, если в воде много железа, плохо это или хорошо, в чем его опасность и какое на самом деле влияние оно оказывает на организм человека.
Польза и вред
Для полноценного функционирования человеческому организму необходим этот микроэлемент. Оптимальное количество в сутки колеблется от 15 до 22 мг. Но не стоит полагать, что ценное вещество можно просто получать из-под крана, не беспокоясь больше об уровне гемоглобина. Неспроста СанПин установил строгие нормы для потребляемой жидкости с избыточным содержанием металлопримесей. Составив свой рацион надлежащим образом, человек из пищи получает все необходимое. Переизбыток веществ может в лучшем случае не усвоиться, в худшем — сильно навредить.
Уровень содержания металла в воде может быть разным. Если при 0,4 мг/л почувствовать его на вкус невозможно, то при десятикратном увеличении — запросто. Чем вредно превышение содержания общего железа в воде в 10 раз, говорить не требуется. И это далеко не предел. В пригородных районах встречается и стократное. В таких ситуациях приходится монтировать целые очистные комплексы и даже осваивать новые скважины. Нельзя недооценивать пагубное воздействие переизбытка данного микроэлемента. Ведь в первую очередь от него страдает здоровье.
Влияние на организм
Количество Fe в воде для питья, существенно превышающее допустимые нормы, не лучшим образом сказывается на состоянии человека. Излишки вещества не усваиваются, но и не выводятся полностью. Постепенно происходит его накапливание в тканях и внутренних органах, которые из-за этого начинают разрушаться.
Чем грозит превышение железа в воде, чем вредно для человека
Переизбыток элемента способен нанести непоправимый вред и привести к множеству тяжелых заболеваний, среди них:
гемохроматоз (поражение тканей);
патологии печени, почек, ЖКТ;
ослабление иммунитета, общая слабость;
разрушение структуры волос, аллергические проявления.
Также не стоит забывать о вреде воды с высоким содержанием железа для кожи.
Не только люди могут пострадать от чрезмерно концентрации железной составляющей. Навредить она может и коммуникациям:
Интенсивное скопление ржавчины может привести к возникновению засоров, удалить которые впоследствии будет непросто. Если засорение все-таки произошло, но было успешно устранено, какое-то время из крана будет идти ржавая жидкость. Пользоваться ею ни в коем случае нельзя! Нужно подождать, пока она стечет.
Металлические примеси портят сантехнику. Кирпично-коричневый налет на ванне, раковине, унитазе портит внешний вид. Удалить такие пятна достаточно сложно.
При концентрации железобактерий в системе водоснабжения возникает вероятность капитальной поломки. Одновременно могут забиться и прийти в негодность коммуникации на обширной территории.
Можно ли пить воду с избытком железа

1,5 м3/ч Для технической воды

MBFT-75 Мембрана на 75GPD
Можно, если его уровень соответствует установленным нормам. При превышении — нельзя. Употребление несоответствующего качественным стандартам питья способно привести к тяжелейшим последствиям: возникновению заболеваний различного характера и другим осложнениям. Железистая жидкость причиняет огромный вред здоровью. И это, если не брать во внимание отвратительные вкусовые и ароматические качества. Пить такую, порой, просто невозможно.
Влияние на оборудование и технику
Обилие ржавчины в системе способствует выведению из строя любых бытовых приборов, которые используют воду. Газовые нагреватели, стиральные машины, посудомойки — все эти незаменимые помощники находятся под угрозой. Сбои и поломки связаны с возникающими закупорками и засорами, провоцирующими неправильную работу техники. К тому же, металлический налет имеет свойство накапливаться на поверхностях, что в итоге приводит к неисправностям.

Очищающие средства (фильтры), которыми фильтруют жидкость для питья или технических устройств, очень быстро придут в негодность из-за переизбытка металла. Особенно опасны в этом отношении железобактерии. Сетчатая структура фильтрующих элементов моментально забивается. Если не заметить этого и своевременно не принять меры, бытовые приборы могут сломаться.

Содержание железа в воде: норма СанПин
Прежде чем ответить на вопрос о том, какое количество вещества принято за норму, следует разобраться, что именно подлежит измерению. В водной среде данный микроэлемент присутствует в двух формациях:
Трехвалентная (она же окисленная). Это известная всем ржавчина, которая придает жидкости густой бурый цвет и оседает впоследствии в хлопьевидной форме.
Двухвалентная (растворенная). Выпадает в осадок только после взаимодействия с кислородом. Обнаружить ее можно по характерным вкусовым и ароматическим признакам. В чистой прозрачной воде на первый взгляд незаметна. Но при нагревании или отстаивании активно оседает на поверхностях сантехники, внутренних частях бытовых приборов. Так появляется желтый шершавый налет на ванне, унитазе, раковине, внутри чайника, фильтров.

По установленным нормативам СанПин в питьевой жидкости допускается содержание металла в размере 0,3 мг/л. Учитывается общее количество вещества в обоих его состояниях. Даже небольшое превышение предельного показателя позволяет это почувствовать (по вкусу и запаху).
ПДК железа в питьевой воде

Металлы — важные микроэлементы для человеческого организма и количество каждого из них строго регламентировано. Данные СанПин:
Медь (Сu, суммарно)
Почему в воде большое содержание железа и чем это опасно
В поверхностные потоки металл попадает вследствие выветривания горных пород, которое сопровождается их разрушением и растворением. Немалое его количество находится в заболоченной местности. В болотах микроэлемент находится в виде сочетаний с гуминовыми кислотами. Также им насыщаются подземные потоки, проходящие через глиняные толщи. В глине преобладает пирит, а из него вещество довольно легко переходит в жидкость.
Кроме того, внушительная доля элемента поступает в водоемы вместе со стоковыми водами металлургических, металлообрабатывающих, текстильных и лакокрасочных предприятий. Концентрация железосодержащих примесей зависит от процентного содержания в воде кислорода.

SF-mix Clack до 0,8 м3/ч

SF-mix Runxin до 0,8 м3/ч

SF-mix ручной до 0,8 м3/ч
Как определить содержание
Сведения о составе жидкости в системе водоснабжения в квартире можно узнать на сайтах коммунальных служб. При использовании собственной водяной скважины или колодца никто подобной информации не предоставит. Остается определять присутствие металла самостоятельно.
Первое, что предстоит провести — это визуальный анализ. Признаки, сигнализирующие об избыточном количестве микроэлемента:
у воды появился ярко выраженный металлический привкус;
на посуде, сантехнике в ванной стал появляться желтый шершавый налет;
светлые вещи после стирки приобретают некрасивый коричневатый оттенок, яркое белье теряет цвета уже после пары стирок;
кафель, краны, раковина, унитаз покрываются ржавыми потеками;
на первый взгляд абсолютно чистая прозрачная жидкость при непродолжительном отстаивании дает осадок, такой тест совсем нетрудно провести самостоятельно;
несмотря на отсутствие осадочных хлопьев, цвет остается бурым, мутность не исчезает.

Внешние признаки, конечно, помогают определить наличие металла в составе воды. Однако не всегда присутствуют при его переизбытке. В таком случае правильным решением будет обратиться в лабораторию.
Лабораторный анализ проводится платно, зато благодаря ему можно точно определить нахождение вредоносных примесей. При взятии пробы следует соблюдать несколько рекомендаций:
При взятии образца надлежит использовать пластиковую или стеклянную посуду. Брать металлическую категорически нельзя, как и тару от сахаросодержащих напитков.
Емкость предварительно необходимо хорошенько вымыть без задействования моющих средств. Стекло нужно обязательно обдать кипятком.
Прежде чем набирать из крана жидкость для исследования, ей нужно дать стечь несколько минут. Застоявшаяся в трубах вода не даст верного результата.
Набирать ее следует медленно, тонкой струйкой, чтобы насколько возможно сократить время контакта с кислородом. Из этих же соображений бутылку надо наполнять до краев.
После наполнения бутыль необходимо доставить в лабораторию не позднее, чем через 2 – 3 часа.
Что делать, если в воде много железа
Каждый день пить железистую воду, отличающуюся неприятным запахом и вкусом — то еще испытание. Но употреблять ее не только неприятно, но и небезопасно для здоровья. Поэтому, при превышении допустимой концентрации вещества следует принять соответствующие меры.

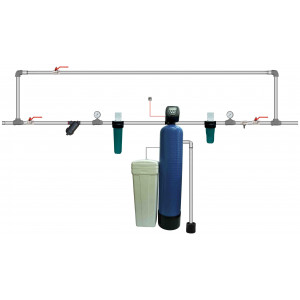
Превышение железа в скважине
Для удаления металлических примесей применяют ряд эффективных методов.
Отстаивание и окисление
Один из самых простых и недорогих способов. Для этого необходимо:
взять пластиковый или стальной (нержавеющий) бак подходящего размера;
монтировать его на определенной высоте, к примеру, на крыше или мансарде;
осуществить подачу воды из источника в емкость, пропуская ее предварительно через специальный аэратор;
оставить ее на некоторое время, чтобы находящиеся в ней железные примеси окислились, и она отстоялась;
отстоявшуюся жидкость надлежит слить из бачка так, чтобы не допустить попадания осадка в систему водоснабжения.
Объем накопителя следует подбирать из расчета потребления. Наполнять его лучше вечером, чтобы к утру процесс отстаивания успел завершиться. Помните, допустимая норма железа в воде из скважины — о,3 мг/л.

АМЕТИСТ - 02 М до 2 куб.м./сут.

Аэрационная установка AS-1054 VO-90

Диспенсер магистральный настольный AquaPro 919H/RO (горячая и холодная вода)
Аэрация
При задействовании данной методики происходит обогащение кислородом, а примеси задерживаются и выпадают в осадок. Отличительными особенностями способа являются возможность переработки больших объемов, способность действовать при любой температуре. Для функционирования очистного комплекса потребуются существенные затраты электроэнергии и регулярный технический уход. Существует несколько разновидностей метода:
Напорный. Для его осуществления предстоит приобрести компрессор, датчики уровня давления и устройство для его понижения.
Без напора. Суть его заключается в сепарации жидкости, что приводит к ускорению окисления. Если поток не достаточно сильный, рекомендуется обзавестись дополнительно насосной станции, или же сразу купить укомплектованное аэрационное оборудование. Также будут необходимы аэраторы, гидроаккумулятор и блок управления.
Эжекторы. Самые простые в плане эксплуатации, так как не требуют электричества. Устройство представляет собой компактную конструкцию со специальным отверстием, через которое поступает воздух. Устанавливают его прямо на магистраль.
Обратный осмос
С его помощью можно удалить любые химические соединения, включая металл. Фильтрующий комплекс состоит из ионообменных картриджей с мембранами, которые монтируют в местах входа водопроводных труб в помещении. Изнутри элементы, осуществляющие фильтрацию, покрыты специальным составом, способствующим окислению железа. Нежелательные примеси надежно удерживаются фильтрами, а потом удаляются через водоотвод. Кроме понижения концентрации вредоносных микроэлементов посредством задействования этой системы удастся исключить и неприятный запах.
Единственным, но весьма ощутимым минусом такого очистного комплекса выступает его высокая стоимость. Но она полностью оправдывается качеством получаемой после очищения воды. Устанавливают его в скважины и колодцы во время обустройства, после монтажа насосного оборудования и обсадной трубы.
Фильтры с ионообменными картриджами
Они оснащены особыми элементами фильтрации, содержащими каталитические смолы. Эти вещества обладают способностью замещать железные соединения на натриевые. При постоянном использовании таких приборов удастся в короткие сроки произвести обезжелезивание жидкости. Следует учитывать, что эти картриджные устройства эффективны если металла не больше 5 мг/л.
Безреагентные титановые фильтры-окислители
Обладают повышенной износостойкостью, продолжительное время не нуждаются в замене. Способны осуществлять работу при любом температурном режиме. Отличаются компактными размерами, даже при наличии смягчителя или грязевика. Восстанавливают свои свойства при замачивании в лимонной кислоте. Кроме железа устраняют аммиак, хлор и марганец.
Выбирая средства для очистки, следует обратить внимание на продукцию производителя «Вода Отечества». Эта компания на протяжении долгих лет выпускает фильтрующие приборы и очистные системы высокого качества. Осуществляет доставку, монтаж и обслуживание оборудования. Выяснить все подробности и узнать стоимость товаров и услуг можно на официальном сайте организации.

Много железа в воде из колодца: последствия
Проблемы со здоровьем, испорченная бытовая техника, засоры в коммуникациях — закономерный итог переизбытка металлических примесей. Исходя из собственных предпочтений и возможностей, можно задействовать различные методы очистки. Есть среди них и «народные»:
Заморозка. При осуществлении данного процесса жидкость очищается и проходит реструктуризацию. Подходящую емкость наполняют и ставят ее в морозильную камеру. Как только произойдет первичное замораживание, оставшуюся влагу необходимо слить. Делается это для того, чтобы вместе с ней устранились и вредоносные вещества, которые оседают на дно.
Использование активированного угля. Порцию вещества (несколько таблеток) заворачивают в плотную вату или обкладывают ватными дисками, формируя самодельный фильтр. Пропускают через него воду и сливают ее в чистую тару. Эта простая технология поможет избавиться от загрязняющих примесей и устранит осадок.
Минерализация с задействованием полезных ископаемых: шунгита и кремния. Эти природные материалы превосходно справляются с очищением и обеззараживанием питьевой жидкости. Процесс осуществляют таким образом: образцы породы выкладывают на дно емкости и оставляют настаиваться на 2 – 3 дня. Данная методика очистки абсолютно безопасна и идеально подходит для задействования в домашних условиях. Окажется действенным способом, если вода пахнет железом и имеет неприятный резкий привкус.
Жесткость воды: что это такое, как определить, какой вред человеку наносит, чем опасна

Сегодня мы расскажем о понятии « жесткость воды » , что это такое, ее виды, в каких единицах измерения ее определяют, есть ли допустимые нормы для питья, а также чем она плоха и какой вред для человека она может нанести. С данным термином мы сталкиваемся практически ежедневно при просмотре рекламы, а также при использовании порошка или моющего средства для посудомоечной машины, при установке фильтра. Но зачастую мы не подозреваем, какой показатель именно у нас – общий по городу или индивидуальный.
Вторая распространенная проблема, когда сталкиваются с данной характеристикой, – при монтаже собственной, индивидуальной точки доступа к скважине или колодцу. Обычно требуется произвести химический анализ, чтобы определить, какая фильтрационная система необходима. И при высоком содержании примесей (кальция и магния) требуется специальное оборудование для устранения данных солей. Но если вам не подскажет это специалист, необходимо самостоятельно разобраться в теме. Давайте это и сделаем.
Жесткость воды – что это такое

Это совокупное физико-химическое свойство жидкости, которое предопределяет ее использование и возможности эксплуатации в различных условиях, питьевое качество. Согласно второму определению, это уровень содержания в водном растворе примесей – солей щелочноземельных металлов (они в мельчайших фракциях находятся в подземных слоях), магния, кальция, а также других элементов, которые полностью не растворяются. Для этого следует понять, что Н2О – это только в учебниках химии, а в жизни химический состав гораздо более разнообразен.
Как понять, что вода жесткая, и что это значит? Легко определить повышенную жесткость можно в домашних условиях обычным кипячением. Если по краям после такого теста остался белый след, который красится как меловая крошка, то, скорее всего, это кальциевые отложения.

Данное свойство очень важно с точки зрения хозяйственного значения и потребительских качеств. Особенно это значимо с двух сторон:
для здоровья потребителей при употреблении в качестве напитка, а также при использовании в гигиенических процедурах, ведь волосы после мытья такой водой могут стать безжизненными и сухими, а кожа грубой;
для долговечности работы нагревательных элементов в стиральной и посудомоечной машинах (ТЭНы), чайниках и иных нагревателях – на них образуется накипь и они быстро выходят из строя.
Также это оказывает негативное воздействие на качество стирки, поскольку химические элементы препятствуют протеканию нормальной реакции стирального порошка, он может слабо вспениваться или недостаточно хорошо проникать в структуру ткани и избавлять ее от загрязнений.
Окружающая природа, горные породы и залежи различных полезных минералов совершенно разные на каждом участке гидродобычи (это зависит от почвы, близлежащих предприятий, глубины пролегания источника), поэтому в разных водоемах и жесткость различная. Именно по этой причине перед использованием обязательно берут пробы, делают химический анализ образца на наличие вредных веществ. Угадать наверняка без этого очень сложно, но можно указать на такую закономерность – чем глубже пролегают грунтовые воды, тем они более жесткие, на поверхности они мягче, поскольку протекают через меньшее количество различных земельных слоев.

Вторая тенденция характерна для природных, естественных водоемов и связана с таянием снегов и дождями. Максимальный показатель зимой, а минимальный – весной сразу после схода льда.
Дадим еще один простой вариант определения, каких примесей больше – магния или кальция. Магниевые соли хуже растворяются, поэтому дают осадок, также они имеют горький привкус.
А теперь посмотрим на сравнительную таблицу:
Шкала жесткости воды или как определить параметр по таблице
Сперва дадим график, согласно которому любую жидкость можно разделить на классы:

Alkaline – щелочная, она же карбонатная. Степень определяется наличием и концентрацией карбонатов и гидрокарбонатов кальция и магния. Особенность в том, что данные микроэлементы выпадают в осадок сразу после кипячения, поэтому такие водные растворы также называют непостоянными или временными.
Вторая часть шкалы Acidic – то есть, кислотосодержащая или некарбонатная. В ее составе не карбонаты и гидрокарбонаты, а кислотные соли на основе вышеперечисленных химических веществ. И они более устойчивые.
И есть также общая – она включает суммарное количество примесей. Чаще всего в бытовых ситуациях определяется именно последняя, то есть итоговая сумма микроэлементов. Но в ряде ситуаций имеет наибольшее значение именно одно состояние магниевых и кальциевых солей, их соединения. Если в анализе жидкости или в иной ситуации вы видите такую шкалу, то можно ориентироваться по цветам и картинке выше. То есть от 0 до 7 вы имеете дело с кислотными солями, а с 7 до 14 – с гидрокарбонатами.
Единицы измерения
Мы объяснили, какую воду называют жесткой, чем обусловлена общая жесткость и какие виды различают, теперь обсудим, в чем измеряется показатель и что на него влияет.
К сожалению, нет мирового стандарта, поэтому, используя аппаратуру европейского изготовления, будьте готовы к непонятным на первый взгляд обозначениям. Российскими учеными были установлены следующие единицы – моль на кубический метр. А перед этим ставится число, которое соответствует значению перевоплощения в миллиграммы на литр. А что можно встретить еще:
d° или dH – придумали в Германии, но применяют на всей территории Запада;
f° – пишут во Франции;
ppm CaCO3 – используют в США.
Жесткость: виды
По количеству примесей можно разделить воду на:
Мягкую. Она соответствует небольшой доли микроэлементов в составе. Получить ее можно после многочисленной обработки – специальной фильтрации, перегонки или многоразового кипячения, когда из-за термального воздействия карбонаты выпадают в осадок. Наибольшая мягкость у дождевой воды. Стоит отметить, что она благотворно воздействует на кожу, волосы, а также на здоровье в целом.
Среднюю. Это самый распространенный вариант, который считается приемлемым для бытовых и промышленных нужд. Именно поэтому такого качества жидкость идет по городскому и, вероятнее всего, по частному трубопроводу. Она вполне пригодна для приготовления пищи. В большинстве открытых природных водоемов вода тоже преимущественно средней жесткости.
Жесткую. В ней либо искусственным путем растворяют примеси, либо влага проходит через такие слои почвы, что сама быстро приобретает высокую концентрацию веществ. Самым распространенным вариантом можно считать морскую воду.
Как измерить и понять, допустимая или повышенная жесткость – способы

Представляем три варианта:
Наиболее точный – заказать лабораторный анализ. Во время пристального изучения будет произведен разбор на химические вещества, поэтому справка не только покажет общий показатель, но и конкретное содержание микроэлементов – какие и в каком объеме присутствуют в образце. Необходимо делать такую экспертизу владельцам частных домов при оборудовании скважины или колодца и заказе фильтрационной системы.
Быстрый и доступный каждому. Для этого стоит приобрести тестер в виде бумажной полоски. Его нужно опустить в жидкость, подождать указанный период, а затем определить цвет индикатора. Дело в том, что на активную части нанесен реагент, который вступает в реакцию и показывает количество примесей. Минус в сложности интерпретации и достаточно неточных результатах.

Домашний химический опыт. В два одинаковых мерных стакана следует нарезать по одному грамму хозяйственного мыла 72%. Затем залейте их подогретой водой – в одну емкость дистиллированной, во вторую водопроводной. В первом бокале будет уровень 7 см. А во втором – остановитесь вливать жидкость в тот момент, когда появится мыльная пена. Затем измерьте разницу влитой влаги. Каждый 1 см раствора соответствует двум °dH.
Какая должна быть оптимальная жесткость воды – норма
Как и единиц измерения, так и стандартов для всего мира общих нет. Зато в России в 2014 году появились жесткие нормативы, закрепленные ГОСТ 31865-2012. В нормативном документе показатель указывается в градусах и обозначается как °Ж. Он соответствует одному мг-экв/л. Посмотрим на таблицу нормативов, принятых у нас и в Америке:
Границы в России, в мг-экв/л
Как видим, российские требования гораздо более мягкие. Именно по этой причине бытовая техника, произведенная в Америке, служит гораздо меньше в контакте с нашим трубопроводом, чем у себя на родине.
Сравнивая европейские показатели, на примере Германии, мы сталкиваемся с такой же проблемой – у нас слишком гибкие рамки среднего качества. Таким образом, фактически любая водопроводная вода подходит под норматив.

Но употреблять такую жидкость попросту небезопасно, поэтому не стоит надеяться на государственные нормы, берегите здоровье своих домочадцев самостоятельно. Для этого устанавливайте системы фильтрации – обратитесь в компанию «Вода Отечества» для комплексной услуги установки фильтрационной системы на вашем участке.
Нормы для питьевой воды
Данный показатель регулирует не столько ГОСТ, сколько Всемирная Организация Здравоохранения и СанПиН. По рекомендации ВОЗ в одном литре жидкости для питья не может быть растворено более 30 мг магния и 80 мг кальция. А СанПиН 2.1.4.1074-01 предопределяет до 50 мг на магниевые отложение, кальциевые соли не регламентируются. Зато указана общая жесткость – до 7 градусов.
Влияние жесткой и мягкой воды – как отличить, рекомендации

ВОЗ утверждает, что употреблять необходимо только жидкость низкой или средней жесткости с установленными границами для примесей. Не всегда водопроводный ресурс, к сожалению, соответствует этим нормативам. Негативные последствия использования воды с повышенной жесткостью приводят к:
скорым поломкам бытовой техники – часто приходится заменять нагревательный элемент;
неисправностям инженерных систем – стенки труб постепенно разрушаются из-за образования отложений, а также засоряются;
мелким неприятностям – например, меняется вкус еды или качество постиранных вещей (моющий состав хуже пенится), мягкость вымытых волос.
Рекомендуем не дожидаться негативного воздействия и установить мощную систему фильтрации. Также стоит использовать не водопроводную, а специально подготовленную для питья жидкость, а при стирке или во время запуска посудомоечной машины добавлять специальные средства от накипи.
Вред для человека
Если соли поступают в чрезмерном количестве, они не успевают выводиться естественным образом и скапливаются в мочевых протоках и пузыре, почках – так начинается мочекаменная болезнь.
При умывании кожа становится более сухой, может образоваться раздражение. А на волосах появляется корочка, которая препятствует их естественному увлажнению и питанию подкожным жиром. Они становятся безжизненными.
Мясо, приготовленное в водном растворе с большим содержанием кальция, хуже усваивается организмом.
Как избавиться от жесткости воды и от чего она зависит

Если перед вами стоит вопрос что делать непосредственно с водопроводной жесткой водой, то выходов из ситуации не много:
поставить фильтр внутри квартиры, регулярно проверять систему и менять кассеты;
кипячение – стоит учесть, что данным способом можно убрать только карбонатный осадок, он останется внизу чайника или на его стенках, но если примесь в виде магниевых и кальциевых солей, способ не подходит;
заморозка – емкость следует проморозить так, чтобы на 90% образовался лед, а остальные 10% – слить, ведь именно концентрированный раствор замораживается медленнее всего.
Как повысить и понизить жесткость в аквариуме

Аквариумные рыбки – очень прихотливые создания, даже морские виды. У них всегда есть пределы, родной ареал обитания. Если вы хотите, чтобы они жили и размножались, следует воссоздать все необходимые условия.
Если нужно увеличить показатель солей, на дно можно положить известняк или мрамор, добавить хлористый кальций или магнезию.
В обратном случае придется прибегнуть к одному из вышеперечисленных трех способов. Чем больше объем резервуара, тем выгоднее будет создание фильтрационной системы.
Как избавиться от примесей в скважине
При бурении индивидуальной точки доступа к ресурсу просто необходимо делать предварительный анализ. Очень часто от этого зависит выбор расположения, а также глубина пролегания труб и насоса. Но если на участке испорченные грунтовые воды, поскольку они протекают через многочисленные солесодержащие почвенные слои, то и выбор места особенно не поможет, нужно производить фильтрацию. Обратитесь в компанию «Вода Отечества», чтобы специалисты выбрали для вас индивидуальное комплексное решение.
Методы устранения жесткости
Их несколько, все – эффективные. Выбирать следует, ориентируясь на конкретные показатели и степень эксплуатации – постоянно или сезонно.
Термоумягчение
Иными словами, это обычное кипячение. Следует немного приоткрыть крышку и ждать полного осадка примесей. Но если концентрация превышает 4 мл на литр, то способ не эффективен, поскольку испарение влаги произойдет быстрее, чем полное осаждение частиц.
Реагентное умягчение
В качестве реагентов чаще всего выступает обычная пищевая сода и известь. Они поочередно вводятся в раствор, отдельные химические элементы вступают с ними в реакцию с высвобождением Н2О и выпадают в осадок.
Катионирование
Это обессоливание с использованием катионов натрия или водорода. В первом случае это добавление обычной поваренной соли – что недорого, а также просто в утилизации продуктов регенерации.
Обратный осмос
В качестве фильтра выступает мембрана из ацетилцеллюлозы. С ее помощью достигается практически дистиллированная чистота. Такие установки небольшие, они хорошо берегут энергию. Но есть и минус – из раствора убираются практически все микроэлементы, а они важны для жизнедеятельности.
Электродиализ
Экологичный способ обессоливания. Он основывается на том, что вещества (положительные и отрицательные ионы) притягиваются к электродам под воздействием электрического заряда.
Дистилляция
Это промышленная перегонка жидкости. В ходе нагрева образуется водяной пар. Он впоследствии охлаждается и собирается как конденсат.
Вместо заключения
Мы рассказали, от чего зависит жесткость воды, чем она опасна и как ее устранить. Завершая тему, посмотрим видео:
Тяжелая вода: что это такое и где она применяется, как получить такую жидкость в домашних условиях – физические свойства воды и химическая формула

Вы наверняка о ней слышали, но уделяли ли ей достаточно внимания? Чтобы ответить, рассмотрим, что собой представляет тяжелая вода: что это такое, где применяется, чем отличается от обычной, что будет, если регулярно употреблять ее в быту и так далее.
Сразу отметим: сегодня она используется все активнее, особенно в химической промышленности и в экспериментальной медицине. Ученые подбирают различные ее дозировки для проведения глобальных исследований, призванных улучшить приплод и увеличить вес домашних животных, а также побороть раковые опухоли. Успехи переменные, но они есть (плюс многие изыскания рассчитаны на длительную перспективу, и их результаты пока не оценить), поэтому работы в этих направлениях продолжаются, чему только способствует общее развитие технологий.
Что значит термин «тяжелая вода»

Она представляет собой оксид — либо водорода 2H (вместо легкого 1H в обычных условиях), либо дейтерия D, то есть изотопа, содержащего на один нейтрон больше, чем в стандартном случае. Такая замена оборачивается повышением удельной массы на 10%.
Немного справочной информации:
- в реакциях записывается как 2H2O (2H2O) или, соответственно, D2O;
- t кипения = 101,43 .С;
- t плавления = 3,813 .С;
- плотность = 3,98 .С (1,104 г/см3).
В природных источниках соотношение D к H сегодня измеряется как 1 к 6900; ее немного и это хорошо, так как в целом она действует на организмы угнетающе (подробнее рассмотрим этот вопрос ниже).
История открытия
Впервые ее молекулы в обычной среде обнаружил американский физиохимик Гарольд Юри: было это в 1932-м году, а в 1934-м ему присудили Нобелевскую премию за это открытие. В 1933-м уже другой ученый из США, Гилберт Льюис, путем электролиза получил чистую тяжеловодородную воду: он многократно пропускал ток через остаток H2O, постепенно насыщая его молекулами HDO и D2O – до тех пор, пока концентрация последних не достигла 99%.
В СССР химическая формула тяжелой воды и те преимущества, которые она дает, получала все больше внимания по мере развития атомной энергетики. В частности, предшественница ИТЭФ, Лаборатория №3 АН СССР, начала производить 2H2O в промышленных масштабах – для обеспечения нужд реакторов (современная классификация которых – тип PHWR) и различных установок.
Со временем об оксиде узнавали повсеместно, попутно развеивая мифы. Например, в 1968 году еще появлялись околонаучные публикации, утверждавшие, что его концентрация увеличивается в результате многократного кипячения. Сегодня он продолжает активно использоваться, стоимость его получения значительно удешевилась. Средняя цена продажи составляет 1 евро за грамм против 19 долларов в 1935-м, и не забудьте об инфляции — тогда это была более внушительная сумма, за $19 можно было купить гораздо больше, чем сейчас.
Физические свойства тяжелой воды

Одни из них такие же, что и у обычной, другие — кардинально отличаются, но общая их совокупность определяет условия применения и употребления D2O (2H2O), а значит заслуживает внимания. Рассмотрим каждый из важных параметров отдельно.
Запах
Отсутствует — по этому показателю отличить ее от «легкой» не представляется возможным. Какие-то оттенки неприятного аромата — допустим, серной тухлости, хлористой резкости или гниловатой сладости — говорят только о наличии вполне конкретных проблем в самом источнике, вызванных не превышением концентрации оксида дейтерия. Причина может быть в разложении водорослей, сливе промышленных отходов и других подобных факторах.

Во всех вариациях своих изотопов тяжелая вода в природе так же прозрачна, как обычная. Поэтому вполне можно спутать ее визуально и случайно выпить, если она, например, будет налита в стакан или графин (на вкус она может показаться чуть сладковатой).
Обратите внимание: помутнение, затемнение или осветление, появление буроватого или зеленоватого оттенка свидетельствует лишь о присутствии примесей в отдельно взятом заборе, но никак не о повышенном содержании D2O, его так просто не определить. Другой вопрос, чем обусловлено наличие посторонних веществ (чаще всего это соли жесткости, ржавчина, нитраты, марганец и другие опасные элементы).
Температура кипения
Это первое свойство, по которому тяжелая вода будет отличаться от легкой, пусть и незначительно. Потому что при сравнении мы увидим следующие градусы:
- H2O – 100 0C (всем известный показатель);
- D2O – 101,7 0C.
Нагрев является своеобразным маркером «веса», но в условиях бытовой практики он малоприменим, а наука и промышленность располагают более совершенными и точными способами определения разницы.
Отдельно отметим, что выделяют еще и такой показатель, как температура плавления (кристаллизации), и он составляет:
Проще говоря, это отметка, при которой начинает образовываться лед, и это даже более явный признак «тяжести», который может пригодиться в быту.
Вязкость
Имеется в виду динамическая, являющаяся частью системы единиц СГС и измеряемая в сантипуазах (сокращенно сП). При этом 1 П = 0,1 Н х с/м2.
У обычной она 1,0016 сП, в то время как у оксида дейтерия уже 1,2467 сП (все сравнения производятся при температуре в 20 градусов Цельсия). Разница в 24% существенным образом влияет на эксплуатационные характеристики и является одним из тех факторов, которые способствуют замедлению химических реакций (в частности, поглощения нейтронов).
Молекулярная масса

Составляет 20,034 г/моль, по сравнению с 18,01528 г/моль «легкой» H2O, и это еще одна из причин, почему воду называют тяжелой, ведь она буквально весит больше. Данная особенность также провоцирует снижение скоростей обменных процессов, что особенно важно для управления термоядерным синтезом.
Растворимость
Она достаточно быстро и равномерно смешивается с этанолом, но в случае с диэтиловым эфиром такого результата уже не наблюдается. В свою очередь, растворить в ней соли уже значительно труднее, чем в обычной H2O, ориентированной на бытовые нужды, и это даже удобно. Во-первых, это явный показатель повышенного «веса», во-вторых, определенная защита от загрязнений, что просто необходимо технологической среде, актуальной на самых ответственных объектах.
Плотность
Измеряется при температуре в 25 градусов Цельсия и составляет 1,1042 г/см3, по сравнению с 0,997 г/см3 «легкой». И это еще одна характеристика, снижающая общий уровень поглощения нейтронов и способствующая замедлению реакций.
Есть и другие параметры, в числе которых:
- стандартная энтропия;
- энтальпия (кипения, плавления, образования);
- энергия Гиббса;
Но они не столь важны конкретно в нашем случае, то есть в вопросах подготовки забора из артезианской скважины к бытовому употреблению, и поэтому на каждом из них мы не будем подробно останавливаться.
Где и для чего используется тяжелая вода
Поначалу сам Гарольд Юри отнесся к своей находке как к интересному научному факту. И, несмотря на Нобелевскую премию, на первых порах он и его коллеги не видели сфер, в которых может пригодиться оксид дейтерия. Ситуация изменилась уже через 5 лет: в связи с открытием деления ядер, стал очевиден тот промышленный потенциал, которым обладает D2O. В результате сегодня можно выделить сразу несколько сфер ее актуальности.
В ядерных технологиях

Современные физики рассматривают ее в качестве топлива будущего, а некоторые даже заявляют, что она станет источником бесконечной энергии. И это уже не просто мечты, ведь с ее помощью уже можно управлять термоядерным синтезом (пусть пока и с ограничениями), и ожидается, что с ее помощью удастся провести сверхвыгодные реакции вроде:
D + T → 4He + η + 17,6 МэВ
Перспективность считается настолько высокой, что ее коммерческий оборот в ряде стран находится под жестким государственным надзором. Это как раз та ситуация, в которой запреты и ограничения оправданы, так как позволяют защититься от создания неконтролируемых, а значит и опасных установок, работающих на природном уране.
Важную роль играет и возможность обнаружения нейтрино именно с помощью D2O. Около 1000 ее тонн содержится в SNO, то есть в крупнейшем детекторе мира, комплексе оборудования, расположенном в Канаде.
В ядерных реакторах

В этом случае применение тяжелой воды актуально в одном из двух качеств:
- Замедлитель нейтронов, помогающий обеспечить должную скорость синтеза; благодаря этому отпадает необходимость в установке графитовых стержней, опасных на этапе вывода из эксплуатации своей наведенной радиоактивностью и угрозой взрыва пыли.
- Практичный носитель, эффективно отводящий тепло из зоны цепной реакции, сравнительно доступный по стоимости и, что важно, инертный. Он также хорош тем, что не забирает часть энергии, выделяющейся в процессе синтеза.
В роли изотопного индикатора в химии
А также в области гидрологии, биологии и других сферах, для которых только может быть актуальным использование оксида дейтерия.
Например, в небольших концентрациях он препятствует размножению и распространению бактерий, грибков и других вредных микроорганизмов, и эту особенность взяла на вооружение экспериментальная медицина.
Рассуждая о том, что такое тяжелая вода и где применяется, нужно отметить, что ученые в течение десятилетий проводили глобальные и комплексные исследования. И установили несколько любопытных закономерностей, возникающих при определенном проценте содержания D2O в употребляемой в пищу жидкости:
- уменьшение на 20-25% — крупный рогатый скот начинает активнее набирать вес, а куры — лучше нестись;
- увеличение до 50% — организм приобретает антимутагенные свойства, что способствует росту биологической массы и ускоренному половому созреванию;
- накопление свыше 70% — могут отступить раковые болезни, но это также сопровождается резким преждевременным старением, ухудшением обменных процессов, отказом органов, а впоследствии и смертью.
Естественно, все медицинские опыты (тем более что они показывают столь неоднозначные результаты) пока проводились на животных, но не на людях.
Отличия между легкой и тяжелой водой

На основании свойств D2O понятно, чем опасно такое соединение для человека: постепенно накапливаясь в организме, оно нарушает метаболизм, убыстряет появление необратимых возрастных изменений, провоцирует возникновение болезней и злокачественных новообразований.
С другой стороны, H2O, с нормальной или восстановленной структурой:
- питает клетки энергией за счет проведения отрицательных окислительных реакций;
- дает антиоксидантную защиту, помогая предотвратить многие случаи отравления;
- оставляет pH-уровень слабощелочным, стабилизируя состояние крови и лимфы;
- способствует улучшению обмена веществ, параллельно снижая поверхностное натяжение.
Напомним также, что обе этих жидкости прозрачны и обладают нейтральным вкусом и запахом, поэтому их вполне реально перепутать.
Какая польза от тяжелой воды

Естественно, она не была столь востребованной, если бы несла только вред. То же замедление нейтронов обеспечивает нормальное протекание ядерных реакций, а значит оксид дейтерия все-таки стоит на страже нашей безопасности, пусть и опосредованно.
Ну а добавление в качестве индикатора дает удобную возможность контролировать изменения состава смесей и своевременно вносить необходимые корректировки.
Также нужно учитывать те потенциальные преимущества, которые в будущем принесут медицинские исследования. Специалисты из самых разных областей все уверенней говорят о скором прорыве.
Что случится, если выпить тяжелую воду
В небольших количествах она никак не скажется на состоянии организма. За раз можно употребить даже литр D2O — ничего страшного не случится: за две недели она полностью выйдет из тела, а сам дейтерий не радиоактивен. Так что не опасайтесь, что случайно возьмете не тем наполненный стакан. Максимум, что можно почувствовать — это небольшой дискомфорт из-за изменения давления.
Другое дело — регулярное употребление. В этом случае оксид будет:
- постепенно нарушать целостность ДНК;
- замедлять обменные процессы;
Это обернется уже описанными проблемами со здоровьем (отказом органов, появлением опухолей). Если же концентрация D2O достигнет 20% от общего объема жидкости, то это спровоцирует летальный исход.
Тяжелая вода в жизни человека
За тот комплексный угнетающий эффект, который она может подарить, ее зачастую называют мертвой. Да, несмотря на то что размножение вредных микроорганизмов она тоже замедляет или даже полностью останавливает.
Нюанс в том, что оксид дейтерия в малых количествах, но содержится во всех естественных источниках. Небольшой его процент есть в озерах, прудах, реках, морях, глубоких скважинах и даже в осадках. Причем в дожде его обычно в несколько раз больше, чем в снеге, что объясняется частой электризацией облаков.
В любом случае выходит, что мы, пусть и неосознанно, но потребляем D2O, и получение тяжелой воды в домашних условиях происходит независимо от нашего желания, просто не в таких количествах, которые могли бы нам навредить.
Поэтому важно не повышать риск накопления оксида дейтерия в организме и не употреблять для питья и приготовления пищи морскую H2O, опресненную методом обратного осмоса. Данный способ как раз даст жидкость со сравнительно более высоким уровнем концентрации изотопа.
Мы поможем подобрать оборудование, которое будет контролировать количество примесей в каждом заборе и отфильтровывать вредные частицы – обращайтесь в компанию «Вода Отечества».
Но механическая очистка в этом конкретном случае может не сработать, так как фильтры смогут удалить лишь нерастворимые частицы, но окажутся бессильными на уровне молекул и атомов. Хотя один способ, применимый в быту, все-таки есть, предлагаем его рассмотреть.
Как получить тяжелую воду в домашних условиях
Выделить D2O, чтобы потом слить его, можно с помощью процесса таяния. Для этого необходимо:
Образовавшаяся корочка – это и есть оксид дейтерия (который кристаллизируется еще при 3,82 0С. Останется лишь избавиться от него, так как в быту его пока не используют.
Заключение
Теперь вы знаете, что означает понятие «тяжелая вода», где она может применяться и какую опасность несет, и еще больше понимаете, насколько важно получать во всех смыслах чистую жидкость.
Тяжелая вода, бассейны у АЭС – чем опасны для окружающей среды?
Любая жизнь на нашей планете неразрывно связана с водой, которая до середины 19 века считалась простым элементом, и только позже оказалось, что вода – это химическое соединение. Человечество регулярно потребляет миллиарды литров. С потреблением некачественной воды медики связывают более 50% всех заболеваний. В прозрачной на вид жидкости содержатся десятки химических и органических веществ. Одни из них обязательны для нашего здоровья, а другие приводят к проблемам со здоровьем.

Присутствие ряда примесей можно определить с помощью органолептических показателей: запаха, вкуса и внешнего вида, но такие опасные примеси, как нитраты, тяжелые металлы и радиоактивные элементы невозможно почувствовать. Они постепенно накапливаются в организме, но выявить их присутствие могут только специальные анализы и исследования.
Ряд вредных для живого мира соединений присутствует в окружающей среде в мизерных количествах и не могут навредить. К сожалению, некоторые из них нашли применение в промышленной отрасли, поэтому их научились синтезировать искусственно. Например, тяжелая вода, которая нашла применение в ядерной энергетике, отрасли, которая относится к самым опасным.
Что такое тяжелая вода и сколько она весит?
По химической формуле тяжелая вода не отличается от обычной, но вместо двух простых атомов водорода, в ее состав входят атомы дейтерия – его тяжелого изотопа. Всего подобных комбинаций воды насчитывается около 50, а теоретически – больше 100. Тяжелую воду обозначают D2O или 2H2O. Ее органолептические показатели ничем не отличаются от простой воды.
Существование дейтерия прогнозировал известный ученый Э. Резерфорд. Впервые молекулы тяжеловодородной воды заметил и описал в начале 1930-х американец Гарольд Юри. Исследователь нашел их в осадке, образовавшемся после выпаривания простой воды. За свое открытие химик получил Нобелевскую премию.
Ключевая особенность тяжелой воды в том, что она практически не поглощает нейтроны. Это качество позволило использовать ее для торможения нейтронов в ядерных реакторах и в качестве теплоносителя. Также ее применяют как изотопный индикатор в биологии и химии
В лабораторных условиях ее синтезировал в 1933 году Гильберт Льюис с помощью электролиза. В природе соотношение между молекулами обычной и тяжелой водой в природных условиях 1/5500. Некоторое количество дейтерия находится в составе полутяжелой воды HDO – в ней только один атом водорода заменяется дейтерием.
После определения полезных качеств тяжелой воды началось ее промышленное производство. Первое предприятие этого направления «Норск-Гидро» заработало в Норвегии в 1934году. Суть производства сводилась к расщеплению легкой воды с помощью электролиза. С тяжелой водой связаны несколько эпизодов Второй мировой войны. С подачи ядерщика Ф. Жолио-Кюри Франция закупила весь мировой запас в объеме еще до боевых действий. Во время оккупации Норвегии в Германию было ввезено 500 кг тяжелой воды. Чтобы предотвратить создание ядерной бомбы диверсионная бригада подорвала завод, который был впоследствии восстановлен немцами.
Как тяжелая вода влияет на живые организмы
Вместе с производством и применением в ядерной энергетике начались исследования воздействия больших количеств тяжелой воды на живые организмы. Она играет значительную роль в протекании биологических процессов. В реальных условиях концентрации тяжелой воды сверхнизкие и вероятность потребления отравляющего количества невозможна.
Тяжелая вода имеет токсичный статус. После экспериментов над животными ученые получили следующие результаты:
- Замедление протекания химических реакций;
- Стерильность лабораторных млекопитающих (иногда необратимая) при замене четверти атомов водорода дейтерием;
- 30% содержание дейтерия приводило к изменениям в обменных процессах, разрушению почек;
- Гибель после недельного потребления тяжелой воды вместо обычной;
- Растения прекращали расти при поливе водой с пропорцией 50/50;
- Рыбы погибали после накопления 90% дейтерия в организме;
- Простейшие и водоросли выживают в тяжелой воде.
Снижение концентрации дейтерия в питьевой воде дало отличные результаты – увеличивалась численность и качество потомства, пшеница созрела раньше с повышенной урожайностью. Эти результаты стали основой теории, что исключение дейтерия станет путем к существенному продлению жизни
Независимые исследования однозначно доказали, что тяжелая вода отрицательно влияет на флору и фауну, хотя клетки бактерий, водорослей, грибов и растений успешно адаптируются к жизни с тяжелой водой. Время привыкания зависит от вида живого организма. Рекордсменами считаются чайный гриб 1 сутки и хлорелла – 6 суток. Наблюдается прямая зависимость, чем сложнее объект, тем дольше идет процесс адаптации к тяжелой воде, ее можно считать прототипом мертвой воды из сказок.
Как человек реагирует на потребление тяжелой воды
В нашем теле содержится около 75% воды. Если исходить из данных, что 1000 л воды содержится 150 мл тяжелой, то получается, что за свою жизнь человек выпивает максимум 15 л воды дейтериевой воды. Содержание дейтерия в природных условиях зависит от климатических особенностей зоны. Например, глобальное потепление увеличивает концентрации изотопа. Из-за разности температур испарения в жарких странах тяжелой воды больше, чем в умеренных и холодных широтах.
Каждый живой организм – это набор сбалансированных химических реакций. Он способен самостоятельно противостоять заболеваниям, обновлять клетки и регулировать метаболизм. Как только наступает сбой, появляются проблемы со здоровьем. Тяжелая вода замедляет биохимические процессы, что несовместимо с жизнью большинства растений и животных. Последствия определяются исходным содержанием дейтерия в организме, периодом и количеством употребления дейтериевой воды. Среди стабильных изотопов, он имеет наиболее выраженное влияние на все живое. Его атомы идентичны водороду и могут его замещать в клетках, в том числе и в молекулах РНК и ДНК. В биологическом плане – это неравноценная замена.
Был период, когда отрицательное и замедляющее действие дейтерия пытались использовать для лечения опухолей. Итог эксперимента – опухоли уменьшались, но лабораторные мыши погибли. Дейтерий не может продлевать жизнь.
По количеству в человеческом организме дейтерий в атомных процентах стоит на 12 месте и относится к категории микроэлементов. Выходит превышение потребления – вред, а полное изъятие – непредсказуемые последствия
Отравление тяжелой водой
Тяжелая вода опасна только при потреблении в больших количествах и регулярно. Стоимость оборудования и производства высока, поэтому шанс попасть на разлив в повседневной жизни маловероятен. Исключение представляют территории населенных пунктов вокруг атомных электростанций, где она используется. Проходя по трубам, вода вбирает остаточные следы радиоактивных веществ, и становится ядовитой.
Более опасным изотопом считается тритий. Исследования показали, что, несмотря на меры безопасности, он медленно, но уверенно распространяется вокруг АЭС, отравляя водоемы и колодцы. По идее, тяжелая вода должна циркулировать только в пределах закрытого контура, но в охлаждающих бассейнах для ускорения остывания используется разбрызгивание, при котором часть водной пыли и капель уносится за пределы порывами ветра.
Самым популярным методом очистки тяжелой воды в домашних условиях считается охлаждение с последующей фильтрацией кристалликов льда. Дейтериевая вода замерзает при 3,8 градусах, поддерживая ее можно добиться кристаллизации дейтериевой воды с последующим отцеживанием. К сожалению, проверить результативность подручными средствами невозможно, а для реальной очистки тяжелой воды используется изотопный обмен, электролиз, ректификация, вакуумная заморозка – методы, которые доступны только в специализированных лабораториях.
Читайте также:
