Типы карбидов в сталях
Обновлено: 28.04.2024
Добавленные в сталь легирующие элементы могут образовывать твердые растворы или химические соединения с железом и между собой. В большинстве случаев для сталей важную роль имеет взаимодействие ЛЭ с углеродом и азотом. Способность ЛЭ к образованию карбидов или нитридов в стали, где основу составляет железо, определяется их сродством к С и N. Если сродство ЛЭ к С и N больше, чем у железа, то будет образовываться карбид на основе ЛЭ, а не цементит.
Так как закономерности образования карбидов и нитридов в стали имеют одинаковый характер и углерод чаще применяется при легировании, чем азот, обычно рассматривают закономерности карбидообразования.
Все легирующие элементы можно разделить на две группы: карбидообразующие и не образующие карбидов в стали.
Карбиды и нитриды относятся к фазам внедрения, которые и образуются между d-переходными металлами и соответственно углеродом и азотом. Активность карбидообразующих элементов тем больше и устойчивость карбидных фаз тем выше, чем менее достроена d-электронная оболочка у данного металла. На рис. 77 приведен фрагмент таблицы Д. И. Менделеева, где расположены карбидо- и нитридообразующие элементы.
Co и Ni, представленные на рис. 77, не образуют карбиды и нитриды в стали, так как они имеют более совершенное электронное строение, чем железо.
В периодах сродство к углероду возрастает справа налево (Fe Ti), а в группах – сверху вниз (Cr W). Таким образом, самым активным из представленных в таблице элементов будет Hf. С увеличением содержания легирующего элемента в стали образуется карбид более высокого класса (с бóльшим содержанием ЛЭ). Например, для хрома: (Cr,Fe)3C Cr7C 3Cr23C6.
Рис. 77. Структуры d–переходных металлов, карбидов и нитридов, образуемых в стали
В некоторых карбидах легирующих элементов может растворяться железо. Так, например, в карбидах Cr3c и Мn3С железо растворяется неограниченно. Карбиды Cr7C3 и Mn23C6 образуют ограниченные твердые растворы с железом.
Прочность связи между атомами металла и неметалла в карбидах и нитридах характеризуются теплотой образования 298К, кДж/(г-атом) и свободной энергией образования фаз ( 298к, кДж/(г-атом), температурой их плавления и структурно-нечувствительными упругими свойствами. Наиболее высокие значения из указанных свойств имеют карбиды и нитриды элементов IV и V групп. По мере увеличения номера группы свойства изменяются в сторону уменьшения прочности связи атомов в карбиде и нитриде или, как говорят, прочности или стойкости карбидов и нитридов.
Следовательно, переходные металлы по их сродству к углероду и азоту, прочности и стойкости карбидов и нитридов, их устойчивости к распаду можно расположить в следующий убывающий ряд: Hf, Zr, Тi, Та, Nb, V, Мо, Сr, Мn, Fе.
Карбид Сr7С3 образуется чаще всего в конструкционных сталях с относительно невысоким содержанием хрома (до 3 – 4%). Этот карбид имеет сложную гексагональную решетку с 80 атомами на одну элементарную ячейку (56 атомов металла и 24 атома углерода).
В сталях этот карбид может содержать от 30 до 50 % Сr, т. е. его формула должна быть в пределах Fе4Сr3С3 и Fе2Сr5С3. Обычно такой карбид обозначают (Сr, Fе)7С3 или Me7C3.
Карбид Сr23С6 образуется в высоколегированных хромистых сталях при большом содержании хрома (выше 5 – 8 %). Он имеет сложную г. ц. к. решетку, элементарная ячейка которой содержит 116 атомов, в том числе металла 92 атома и углерода – 24. В сталях карбид Сr23С6 в чистом виде не встречается, часть атомов хрома в нем замещается карбидообразующими элементами, входящими в состав стали (Fе, Мо, W).
В зависимости от характера легирования атомы металла могут содержать два или несколько элементов. Так, в высокохромистых сталях содержание железа в карбиде может повышаться до 35 %, т. е. часть атомов хрома замещается железом, при этом формула карбида имеет, например, вид Fе8Сr15С6. При меньшем содержании хрома возможно образование карбида Fе12Сr11С6. В общем виде такой карбид в сталях принято обозначать формулой (Сr, Fе)23С6 или Me23C6. В сталях с молибденом формула карбида будет Fе20Мо2С6, а в сталях с несколькими легирующими элементами (Сr, Мо, W и др.) все они могут входить в состав карбида.
Железо широко замещает в этом карбиде хром, но так как размер атомов железа несколько меньше размера атомов хрома, то начиная с определенного момента (после замещения ~30% Сr) эти узлы становятся слишком “просторными”, и для устойчивости решетки необходимо присутствие крупных атомов W (или Мо). Атомы W (Мо) занимают также определенные позиции в решетке карбида Ме23С6, поэтому их максимальное число в элементарной ячейке составляет 8 из 92 атомов металла. Дальнейшее увеличение в стали концентрации вольфрама и молибдена в выделяющейся фазе сверх этого предела приводит к переходу Ме23С6 Þ Ме6С, как к следующему карбиду, который может вместить большее количество W и Mo.
Этот карбид образуется только при сложном легировании, поэтому он является комплексным карбидом. Его преимущество перед другими карбидами на основе Mo, W и других тугоплавких элементов заключается в том, что он имеет более низкую температуру диссоциации, что позволяет переводить Мо и W при нагреве при закалке в твердый раствор (аустенит).
Однако этот карбид метастабильный и при высокой температуре и длительных выдержках он превращается в стабильные карбиды типа МеС или Ме2С. По этой причине высоколегированные стали, содержащие в больших количествах Cr, W, Mo и V не подвергают смягчающему отжигу с нагревом и длительной выдержкой при температурах 1100. 1200 о С. При закалке из этой области температур длительность выдержки строго регламентирована.
Л 5.2. Влияние легирующих элементов на С–образные кривые.
Влияние легирующих элементов на критические точки и свойства стали
Легирующие элементы значительно влияют на температурное положение критических точек в сталях. В частности, они могут интенсивно смещать точку Ас1. Подобное влияние легирующих элементов связано с двумя факторами.
| Рис. 78. Влияние легирующих элементов на положение критической точки Ас1 (а) и содержание углерода в эвтектоиде (б) |
Как известно, критическая температура Ас1 в углеродистой стали отвечает превращению эвтектоидной смеси перлита +Fе3С в аустенит путем фазового перехода a®g, диссоциации карбида и растворению углерода в g-железе. С одной стороны, легирующие элементы изменяют температуру –прeвращения для феррита, входящего в состав эвтектоида (перлита), и, с другой стороны, влияют на температуру диссоциации эвтектоидных карбидов и последующее растворение углерода и легирующих элементов в g-железе. Как правило, карбидообразующие элементы повышают температуру диссоциации карбидов, и, если при этом они также повышают температуру -превращения, то влияние их на точку Ас1 сказывается особенно сильно (рис. 78).
Некарбидообразующие элементы, растворяясь в цементите, несколько понижают температуру диссоциации карбида. При этом никель и марганец понижают температуру -перехода и, следовательно, снижают точку Ас1. Своеобразно влияние хрома на точку Ас1. Он до 12–13 % сравнительно слабо повышает точку Ас1, а при содержании его более 14 % наблюдается резкое повышение температуры Ас1. Подобное влияние объясняется тем, что при содержании хрома до 12 – 13 % он понижает температуру -перехода, а наблюдаемое при этих содержаниях хрома повышение точки Ас1 обусловлено более сильным влиянием диссоциации эвтектоидных карбидов при этих температурах. Закономерности влияния элементов на критические точки в основном сохраняются и в сталях, содержащих одновременно несколько легирующих элементов.
Легирующие элементы значительно влияют и на положение эвтектоидной точки S (рис. 79), и на предельную концентрацию углерода в аустените (точку Е). Некарбидообразующие элементы (никель, кобальт, кремний), растворяясь в феррите и замещая часть атомов железа в его решетке, тем самым уменьшают содержание железа в эвтектоиде и смещают точку S в сторону меньших концентраций углерода. Аналогично влияют и карбидообразующие элементы, которые в большом количестве растворяются в феррите. Их карбиды участвуют в образовании эвтектоида (например, Мп и Сr). Такие элементы, как Мо и W, сначала уменьшают, а затем увеличивают содержание углерода в эвтектоиде.
Имеются сведения, что сильные карбидообразующие элементы Тi, Nb и V, незначительно растворяющиеся в феррите и образующие стойкие карбиды, которые не участвуют в образовании эвтектоида, уменьшают количество эвтектоида в стали и увеличивают содержание углерода в эвтектоиде, т. е. смещают точку S в сторону больших концентраций углерода. В то же время, если Тi, Nb и V растворены в аустените, то они снижают содержание углерода в эвтектоиде.
Большинство легирующих элементов понижает предел растворимости углерода в -железе и, следовательно, смещает точку Ена диаграмме Fе–Fе3С в сторону меньших концентраций углерода.
| Рис. 79. Изменение содержания углерода в эвтектоиде и эвтектике при легировании |
Легирующие элементы смещают не только критические точки равновесных систем, но и изменяют кинетику распада аустенита. Кинетика распада аустенита определяет поведение стали при термической обработке. Влияние же легирующих элементов на кинетику превращения аустенита очень велико.
Элементы, которые только растворяются в феррите или цементите, не образуя специальных карбидов, оказывают лишь количественное влияние на процессы превращения (изменяют длительность инкубационного периода). Они или ускоряют превращение (к таким элементам относится только кобальт), или замедляют его (большинство элементов, в том числе марганец, никель, медь и др.).
| Рис. 80. Диаграммы изотермического превращения аустенита: доэвтектоидной (а), эвтектоидной (б) и заэвтектоидной (с) углеродистой стали |
Карбидообразующие элементы вносят не только количественные, но и качественные изменения в кинетику изотермического превращения. Так, легирующие элементы, образующие растворимые в аустените карбиды, при разных температурах по-разному влияют на скорость распада аустенита: при 700 – 500 о С (образование перлита) – замедляют превращение, а при 500 – 400 о С – весьма значительно замедляют превращение; при 400 – 300 о С (образование бейнита) – ускоряет превращение при малых концентрациях и замедляют при больших.
Таким образом, в сталях, легированных карбидообразующими элементами (хром, молибден, вольфрам), наблюдаются два максимума скорости изотермического распада аустенита, разделенных областью высокой устойчивости переохлажденного аустенита. Изотермический распад аустенита имеет два явно выраженных интервала превращений – превращение в пластинчатые кристаллиты (перлитное превращение) и превращение в игольчатые кристаллиты (бейнитные превращения).
Диаграммы изотермического распада представлены на рис. 80 и 81. Видно, что увеличение содержания углерода понижает температуры начала и конца мартенситного превращения; форма кривых начала и конца перлитного превращения принципиально не изменяется.
При легировании карбидообразующими элементами диаграмма приобретает другой вид (рис. 81). Причины изменения формы диаграммы подробно изучаются в дисциплине “Теория термической обработки”. Следует обратить внимание на тот факт, что положение бейнитной области зависит от содержания углерода и ЛЭ-карбидообразователя.
В легированных сталях в зависимости от положения линий начала перлитного превращения и точки Мн можно получить стали перлитного, мартенситного, бейнитного или аустенитного классов. Увеличение инкубационного периода при легировании позволяет создавать стали с высокой прокаливаемостью.
| Рис. 81. Схемы диаграмм изотермического распада аустенита, легированного карбидообразующими элементами: а – малоуглеродистая сталь; б – высокоуглеродистая сталь |
Легирующие элементы не влияют на кинетику мартенситного превращения, которая, по-видимому, похожа во всех сталях. Их влияние сказывается исключительно на положении температурного интервала мартенситного превращения, а это в свою очередь отражается и на количестве остаточного аустенита, которое фиксируется в закаленной стали.
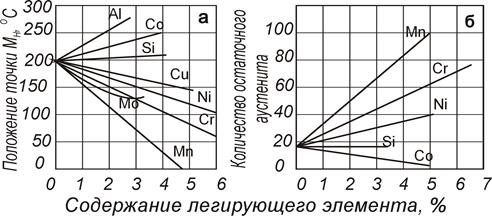 Рис. 82. Влияние ЛЭ на Мн и содержание остаточного аустенита в стали с 1 % углерода |
Некоторые элементы повышают мартенситную точку и уменьшают количество остаточного аустенита (алюминий, кобальт), другие не влияют на нее (кремний), но большинство снижает мартенситную точку и увеличивает количество остаточного аустенита (рис. 82). Из диаграммы видно, что 5% Мn снижает мартенситную точку до 0 о С, следовательно, при таком (или большем) содержании этого легирующего элемента можно зафиксировать аустенитное состояние посредством быстрого охлаждения..
Л 5.3. Влияние легирования на вязкость, прочность, Тх , размер зерна.
карбиды в стали
карбиды в стали [carbides in steel] — карбиды, образующиеся в углеродистой и легированной сталях при кристаллизации, полиморфном превращении и термической обработке. В большинстве случаев при нормальных температуpax в структуре углеродистых сталей присутствует карбид железа — цементит Fe3C. Известны и другие карбиды Fe: метастабильные ε-карбид Fe2C с гексагональной решеткой и к-карбид Fe5C2 с ромбической решеткой, выделенной при отпуске мартенсита при ≤ 200 °С и 250-300 °С соответственно. Цементит может образовывать твердые растворы замещения. Атомы С могут замещаться атомами неметаллов, например N, а атомы Fe металлами: Mn, Cr, W и др. Такой карбид называется легированным цементитом и обозначается Me3C, где Me — Fe и другие металлы, замещающие атомы Fe в решетке цементита. Легирующие элементы в возрастной степени сродства к углероду и устойчивости карбидных фаз располагаются в последовательноти:
Fe → Mn → Cr → Мо → W → Mb → V → Zr → Ti. При повышении содержании Cr, W, Мо в зависимости от содержания С в стали могут образовываться специальные карбиды. При содержании Cr > 2 % образуются специальные карбиды (Cr,Fe)7C3, при содержании Cr ≥ 10-12 % — карбиды (Cr,Fe)23C6. При введении W и Мо в сталь в количестве, превышающим предел насыщения цементита этими элементами, образуются сложные карбиды Fe3Mo3C(Fe2Mo2C) и Fe3W3C(Fe2W2C). Специальные карбиды способны растворять Fe и другие металлические элементы. Так, карбиды Cr7С3 при 20 °С рряет до 55 % Fe, образуя сложный карбид (Cr, Fe)7C3. Карбид Cr23С5 растворяет до 35 % Fe, образуя карбид (Cr, Fe)23C6. Особую группу составляют карбиды типа МеС (VC, NbC, ZrC, TiC, TaC) с ГЦК, WC с ОЦК, W2C,
Энциклопедический словарь по металлургии. — М.: Интермет Инжиниринг . Главный редактор Н.П. Лякишев . 2000 .
Полезное
Смотреть что такое "карбиды в стали" в других словарях:
Карбиды — [carbides] соединения углерода с электроположительными элементами, главным образом, с металлами и некоторыми неметаллами. По типу химической связи карбиды подразделяются на три основные группы: ионные (или солеобразные), ковалентные и… … Энциклопедический словарь по металлургии
КАРБИДЫ — соединения металлов (а также некоторых неметаллов) с углеродом. К. относительно легкоплавких металлов разлагаются водой и разбавленными кислотами с образованием углеводородов. К. тугоплавких металлов, а также кремния и бора водой и кислотами не… … Геологическая энциклопедия
Карбиды — см. Углерод, Углеродистый кальций, Хром, Уран, Церий, Цирконий, Торий, Чугун, Микроструктура стали … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
КАРБИДЫ — соединения углерода с металлами и нек рыми неметаллами. Св ва и области применения К. исключительно разнообразны. Т. н. металлоподобные К. наиболее тугоплавки из всех известных в в, тверды, износостойки и жаропрочны. Керамико металлич. материалы… … Большой энциклопедический политехнический словарь
штамповые стали для инструментов холодного деформирования — Стали этой группы должны обладать повышенным или высоким сопротивлением пластической деформации и высокой износостойкостью. По теплостойкости они могут быть нетеплостойкими, полутеплостойкими и теплостойкими (вплоть до быстрорежущих). По… … Справочник технического переводчика
carbides in steel — Смотри карбиды в стали … Энциклопедический словарь по металлургии
Сталь — (Steel) Определение стали, производство и обработка стали, свойства сталей Информация об определении стали, производство и обработка стали, классификация и свойства сталей Содержание Содержание Классификация Характеристики стали Разновидности… … Энциклопедия инвестора
легированная сталь — помимо обычных примесей содержит так называемые легирующие элементы (смотри Легирование). Различают низколегированную (суммарное содержание легирующих элементов до 2,5%), среднелегированную (2,5 10%) и высоколегированную (свыше 10%) сталь. * * *… … Энциклопедический словарь
ЖЕЛЕЗА СПЛАВЫ — металлич. системы, одним из компонентов к рых (как правило, преобладающим) служит железо. Различают сплавы железа с углеродом (нелегир. и легир. чугуны и стали), сплавы с особыми физ. хим. св вами и ферросплавы. Система железо углерод. Наиб.… … Химическая энциклопедия
Быстрорежущая сталь — Быстрорежущие стали легированные стали, предназначенные, главным образом, для изготовления металлорежущего инструмента, работающего при высоких скоростях резания … Википедия
Свойства и особенности карбидов металлов
В природе металлы активно вступают в химические реакции с кислотами, щелочами и атмосферным кислородом. В большинстве случаев для этого не требуется дополнительная обработка (химическая, термическая). При сильном нагреве металлы начинают активно вступать в реакцию с углеродом, что приводит к образованию сложных соединений под названием карбиды. Эти соединения отличаются рядом необычных свойств — высокая прочность, тугоплавкость, химическая инертность. Какие бывают карбиды металлов? Как эти соединения применяются в промышленности? Какие вещества получили наибольшее применение?

Краткие сведения
Карбиды — это химические соединения, которые состоят из углерода (C) и другого элемента. Обычно в качестве второго элемента выступают металлы — это может быть железо (Fe), титан (Ti), хром (Cr), гафний (Hf) и другие. В карбидных соединениях углерод более высокой электроотрицательностью (в сравнении со вторым элементом). Поэтому карбиды нельзя отнести к оксидам, галогенидам и другим химическим соединениям. Карбиды металлов — в основном твердые тугоплавкие вещества, которые отличаются очень высокой прочностью и почти не вступают в реакции с химически активными веществами.
Благодаря этим необычным свойствам карбиды часто применяют в качестве абразивов для обработки различных сплавов (это может быть чугун, сталь, соединения на основе алюминия). Из них делают электроды для сварки, огнеупорные стержни, элементы электрических систем. Первые карбиды на основе калия, железа и магния были открыты и получены совсем недавно — в XIX веке. Однако со временем были получены и новые карбидные соединения — на основе хрома, титана, гафния, вольфрама, кальция.
Физические свойства, особенности
- Высокая твердость. Атомы углерода и металлов образуют твердую кристаллическую решётку, для разрушения которой потребуется большое механическое усилие. Поэтому с помощью ударов разрушить карбидные вещества будет крайне сложно. Благодаря высокой твердости материалы нашли широкое распространение в различных технических сферах (от военного машиностроения до строительства).
- Высокая температура плавления. Плотная кристаллическая решетка обеспечивает устойчивость вещества при сильном нагреве или охлаждении. Средняя температура плавления карбидов находится в пределах от 1500 до 2000 градусов. Поэтому такой материал без проблем выдержит длительное воздействие экстремальных температур (скажем, его можно использовать в печах, металлургических ковшах для расплавления других материалов).
- Устойчивость к химическим веществам и коррозии. Внешние электронные оболочки веществ-карбидов являются полностью заполненными. Поэтому такой материал будет редко вступать в химические реакции с другими веществами (он устойчив к воздействию кислот, щелочей, солей). Вещества не вступают в реакцию с водой и атмосферным кислородом, поэтому они не покрываются ржавчиной, что обеспечивает их высокий срок годности.
- Повышенная износоустойчивость. Изделия на основе карбидов долгое время сохраняют свою форму даже в случае удара, деформации или воздействия высоких температур. Поэтому они обладают повышенной износоустойчивостью, что делает их срок годности большим. Благодаря повышенной устойчивости материал часто применяют для изготовления абразивных и шлифовальных изделий, которыми можно пользоваться в течение большого срока.
Стоит обратить внимание, что далеко не все карбидные соединения обладают перечисленными свойствами. Скажем, карбид золота (I) чрезвычайно взрывоопасен (тогда как большинство других карбидов металлов — нет). Он может взорваться даже в случае неаккуратного пересыпания вещества на бумажную поверхность. Поэтому при рассмотрении физических и химических свойства карбидов нужно по отдельности рассматривать каждое соединение, поскольку карбидные материалы могут обладать уникальными необычными свойствами.

Разновидности карбидов
- Материалы с ковалентной решеткой. Вещества с таким способом связи возможны только в том случае, если в качестве второго элемента выступает бром или кремний. На атомарном уровне соединение образуется за счет sp, sp-2 или sp-3 гибридизации. В веществе атомарный металл заменяет собой углерод, что позволяет формировать прочное устойчивое вещество, которое устойчиво к механическим ударам, высоким температурам, химическим веществам. С точки зрения электропроводности вещество является полупроводником (хотя использование карбидов в качестве полупроводниковых элементов невыгодно с практической точки зрения).
- Металлоподобные материалы. В эту группу входят соединения, у которых металлических элемент является железом, кобальтом, никелем либо относится к переходной группе (IV-VII). У таких карбидных соединений металлические атомы располагаются не на месте атомов углерода, а в различных пустотах кристаллических решеток (поэтому часто такие вещества называют карбидами внедрения). Такое необычное расположение делает вещество устойчивым, крепким, надежным, оно не будет разрушаться под воздействием высоких температур или при воздействии химически активных веществ (кислоты, щелочи, соли и другие).
- Материалы с ионной связью. В эту группу входит множество карбидов, у которых в качестве металлического элемента выступает алюминий, редкоземельные металлы либо элементы I или II группы периодической таблицы. По химической структуре вещества похожи на соединения с ковалентной решеткой с той лишь разницей, что здесь металлы обычно теряют один или несколько электронов на внешнем уровне, что приводит к образованию веществ-ионов. По химико-физическим свойствам ионные карбиды аналогичны стандартным соединениям — отличная прочность, высокая температура плавления. Единственное крупное отличие — вещества активно взаимодействуют с кислотами (обычно с образованием металла или подобных веществ).

Применение материалов
Карбиды металлов применяются производстве (в основном — в тяжелом). Перечислим основные варианты применения:
- Простые карбидные соединения на основе железа могут добавлять в металлический сплав (чугун, сталь, чистое железо), чтобы улучшить его физико-химические свойства. Дополнительные компоненты улучшают прочность, повышают химическую инертность, минимизируют риск коррозии под действием воды или атмосферного воздуха. Еще одно полезное свойство — увеличение температуры плавления, что удобно в случае изготовления тугоплавких запчастей или деталей.
- Карбиды на основе титана или вольфрама отличаются сверхвысокой прочностью, а плавятся они при сверхвысоких температурах. Поэтому из них делают режущие и абразивные инструменты, которые отличаются высоким сроком годности. Подобные соединения можно использовать в качестве огнеупорных материалов (скажем, при производстве печей), для изготовления сварочных стержней.
- Карбид кальция обладает необычным свойством — при контакте с водой происходит ряд химических реакций, что в конечном счете приводит к образованию ацетилена. Это вещество широко применяется для кислородной сварки, резки или напайки. Поэтому такое карбидное соединение может использоваться для изготовления соответствующих деталей (электроды для сварочных инструментов, напайка и другие). Ацетилен при горении выделяет большое количество тепла, поэтому к работам нужно подойти осторожно.
Основные металлические карбиды
На практике широко применяется множество карбидных соединений. Рассмотрим основные из них.
Карбид гафния
Встречается в виде только одного вещества — HfC. В нормальных условиях обладает кристаллической структурой, окрашено в серый цвет. плавится при температуре 3900 градусов — интересно, что его закипание происходит уже при температуре 4160 градусов. Поэтому к расплавлению нужно подходить аккуратно, чтобы не испарить его. При нагреве до 2000 градусов начинает взаимодействовать с металлами (молибден, вольфрам). Вещество не обладает полной химической инертностью — оно вступает в реакцию с кислотами (в азотной или серной кислоте оно способно полностью раствориться).

Карбиды хрома
Встречается в виде нескольких веществ; основные — Cr23C6, Cr3C2, Cr7C3. Отличаются высокой химической инертностью (хотя могут реагировать с цинком при сильном нагреве). Не вступают в контакт с водой, атмосферным воздухом, кислотами, щелочами, солями, другими карбидными соединениями. Температура плавления не слишком высокое — большинство соединений плавятся уже при температуре 1500-1700 градусов. У соединения Cr7C3 при нагреве до 800 градусов происходит ряд эндотермических реакций и превращений, что приводит к превращению вещества в Cr23C6.
Карбид титана
Встречается в виде одного стабильного соединения — TiC. При нормальных условиях обладает серым цветом с характерным металлическим блеском. Плавится при температуре 3100 градусов, кипит — при 4305 градусах. Обладает высокой устойчивостью, прочностью. Химическая инертность средняя — в нормальном состоянии может вступать в реакцию с кислотами и щелочами (хотя реакция идет слабо). При нагреве до 2500 градусов может вступать в реакцию с азотом (в том числе — атмосферным). При нагреве до 1200 градусов может окисляться и/или вступать в реакцию с углекислым газом.
Карбиды вольфрама
Встречается в виде двух устойчивых соединений — WC и W2C. Оба карбида отличаются приблизительно одинаковыми химико-физическими свойствами. Вид — мелкий порошок серовато-черного цвета (со слабым металлическим блеском или без него). Вещества плавятся при температуре около 2720 градусов, однако при более низких температурах начинается их активных контакт с атмосферным воздухом, азотом или углекислым газом. Соединения легко растворяются в разогретых до температуре кипения серных и азотных кислотах.
Карбид кальция
Основное устойчивое соединение — CaC2. Вид — крупные прозрачные кристаллы, которые могут обладать светло-голубым оттенком. При наличии примесей может окрашиваться в другие цвета — серый, желтый, коричневый, черный и другие (в зависимости от типа примеси и ее концентрации). Соединение плавится при температуре порядка 2500 градусов, однако при комнатной температуре оно активно вступает в реакцию с водой с активным выделением ацетилена. Поэтому вещество нуждается в особых безопасных способах хранения (ацетилен является токсичным для человека).
Карбид циркония
Основное соединение — ZrC. Стандартное состояние — небольшие кристаллы серого цвета, обладающие металлическим блеском. Температура плавления — 3530 градусов, однако при нагреве до 1200 градусов вещество начинает активно вступать в реакцию с атмосферным кислородом, что приводит к образованию оксидов. Вещество слабо реагирует с кислотами, щелочами и солями, однако может вступать в реакцию с атомизированным азотом в составе сложных веществ, что приводит к образованию нитритов. Поэтому вещество нуждается в особых способах хранения.

Заключение
Подведем итоги. Карбиды металлов — соединения, в состав которых входит углерод и какой-либо дополнительный металл. Это может быть железо, хром, цирконий, вольфрам и другие. Соединение может образовывать сложную прочную кристаллическую решетку (ковалентную, металлическую, ионную). Карбиды из-за особенностей своего строения отличаются высокой прочностью, устойчивостью к механической деформации, химической инертностью. Вещества обычно не вступают в реакцию с кислотами, щелочами, солями, атмосферными газами (кислород, азот, углекислый газ).
Из карбидов делают абразивные или шлифовальные инструменты, поскольку они не деформируются, не портятся со временем, могут деформировать другие прочные соединения. Из них делают электроды для сварочных инструментов, термоустойчивые стержни, элементы электрических инструментов. Некоторые виды карбидов могут проявлять необычные свойства. Скажем, карбид золота взрывается при легком контакте, а карбид кальция может вступать в реакцию с водой при комнатной температуре с образованием ацетилена.
Карбиды
Карбиды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения где углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и т.п.)
Содержание
Свойства
Карбиды — тугоплавкие твёрдые вещества, не растворимы [источник не указан 1313 дней] ни в одном из известных растворителей. Карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Применение
Карбиды применяют в производстве чугунов и сталей, керамики, различных сплавов, как абразивные и шлифующие материалы, как восстановители, раскислители, катализаторы и др. WC и TiC входят в состав твердых сплавов, из которых готовят режущий инструмент; карбид кальция СаС2 используют для получения ацетилена; из карбида кремния SiC (карборунд) готовят шлифовальные круги и другие абразивы; карбид железа Fe3C (цементит) входит в состав чугунов и сталей, из карбида вольфрама и карбида хрома производят порошки, используемые при газотермическом напылении.
Разновидности
Карбиды могут быть образованы разными органическими соединениями, а могут не иметь аналогов среди органических веществ. Есть, например, ацетилениды, метаниды и другие.
Карбиды подразделяются на следующие виды:
- солеобразные (CaC2, Al4C3),
- ковалентные (карборунд SiC),
- металлоподобные (имеющие нестехиометрический состав, например, цементит (Fe3C)).
Солеобразные карбиды обычно разлагаются водой и кислотами с выделением углеводородов (некоторые очень бурно, например, карбиды натрия, калия, цезия). Ковалентные карбиды обычно химически инертны. Металлоподобные карбиды имеют промежуточную химическую активность.
См. также
Ссылки
Литература
Косолапова Т.Я. Карбиды. М., 1968;
Самсонов Г.В., Косолапова Т.Я. Домасевич Л.Т. Свойства, методы получения и области применения тугоплавких карбидов и сплавов на их основе. Киев, 1974;
Высокотемпературные карбиды. Киев, 1975;
Карбиды и сплавы на их основе. Киев, 1976;
- Карбиды
- Бинарные соединения
- Анионы
Wikimedia Foundation . 2010 .
Смотреть что такое "Карбиды" в других словарях:
КАРБИДЫ — КАРБИДЫ, неорганические соединения углерода с металлами или другими электроположительными элементами. БОР и КРЕМНИЙ образуют чрезвычайно твердые карбиды, которые используют как абразив. Многие ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ также образуют карбиды, в которых … Научно-технический энциклопедический словарь
КАРБИДЫ — КАРБИДЫ, соединения углерода с металлами, бором и кремнием. Карбиды основа многих твердых сплавов, упрочняют чугун и сталь, входят в состав жаропрочных и жаростойких композиционных материалов и др. Смотри, например, Бора карбид, Кальция карбид … Современная энциклопедия
КАРБИДЫ — химические соединения углерода с металлами и некоторыми неметаллами, напр. карбид кальция, карборунд, цементит. Карбиды вольфрама, титана, тантала, ниобия и др. тугоплавки, тверды, износостойки, жаропрочны; входят в состав твердых сплавов,… … Большой Энциклопедический словарь
КАРБИДЫ — (лат.). Соединения металлических элементов с углеродом. Карбид кальция, употребляется для добывания ацетилена. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. карбиды , карбон. ( лат. carbo (carbo nis) уголь )… … Словарь иностранных слов русского языка
карбиды — Соединения углерода с электроположит. эл тами, гл.обр., с металлами и нек рыми неметаллами. По типу химич. связи к. подразд. на три осн. группы: ионные (или солеобразные), ковалентные и металлоподобные. Ионные к. образуют сильные электроположит.… … Справочник технического переводчика
КАРБИДЫ — КАРБИДЫ, соединения углерода с металлами или металлоидами, образующиеся при нагревании в электрической печи угля с окислом соответствующего элемента. Примером могут служить карбид кальция СаС2, алюминия А14С3, карборунд CSi. Большинство К.… … Большая медицинская энциклопедия
КАРБИДЫ — соединения углерода с др. хим. элементами; часто высокопрочные и химически стойкие. К. широко применяются в технике, входят в состав сверхтвёрдых или тугоплавких сплавов; хорошо известны К. железа (см.), К. кремния (см.), К. вольфрама и др … Большая политехническая энциклопедия
КАРБИДЫ — (от лат. carbo уголь), соед. углерода с металлами, а также с бором и кремнием. По типу хим. связи К. делят на ионные (солеобразные), ковалентные и металлоподобные (ионно ковалентно металлические). Ионные К. (см. табл. 1) образуют металлы I и II… … Химическая энциклопедия
Типы карбидов в сталях
В сталях карбиды образуются только металлами, расположенными в периодической системе элементов левее железа (см. рис. 279). Эти металлы, как и железо, относятся к элементам переходных групп, имеют менее достроенную -электронную полосу. Чем левее расположен в периодической системе карбидообразующий элемент, тем менее достроена его -полоса.
Имеется достаточно оснований предполагать, что в процессе карбидообразования углерод отдает свои валентные электроны на заполнение электронной полосы атома металла, тогда как у металла валентные электроны образуют металлическую связь, обусловливающую металлические свойства карбидов.
Многочисленные опыты показывают, что чем левее в периодической системе расположен элемент, т. е. чем менее достроена у него электронная полоса, тем более устойчив карбид. Эти обстоятельства позволяют сформулировать положения, характеризующие в общем виде условия карбидообразования в сталях: только элементы с -электронной полосой, заполненной меньше, чем у железа, являются карбидообразующими; активность их как карбидообразователей тем сильнее и устойчивость образующихся карбидных фаз тем больше, чем менее достроена -полоса у металлического атома.
Это положение позволяет указать условия образования карбидов в стали при наличии нескольких карбидообразующих элементов, последовательность растворения в аустените различных карбидов и другие факторы, важные для теории легирования, практики производства и применения легированных сталей.
В соответствии со сказанным карбиды в сталях будут образовывать следующие элементы: титан, ванадий, хром, марганец, цирконий, ниобий, молибден, гафний, тантал, вольфрам.
В природе известны карбиды никеля и кобальта, но в сталях, т. е. в сплавах на основе железа, эти металлы карбидов не образуют, так как на -полосе кобальт
1 Из курса физики известно, что электроны располагаются вокруг ядра атома в виде отдельных электронных оболочек. Чем дальше от ядра отстоит оболочка, тем выше уровень энергии электронов этой оболочки. Каждая оболочка в свою очередь расщепляется на ряд уровней энергии или полос, получивших обозначения (по направлению от ядра атома) На каждой полосе может располагаться ограниченное число электронов. Так, например, на -полосе может разместиться не более 10 электронов. При последовательном переходе от атома водорода к другим элементам периодической системы число электронов возрастает в соответствии с их атомным номером, причем электроны сначала занимают все места с наименьшими уровнями энергии, т. е. последовательно все места в первой оболочке, затем во второй и т. д. Однако у некоторых элементов, получивших наименование элементов переходных групп, на внешней (валентной) оболочке уже появляются 1 или 2 электрона еще до того, как достроена -полоса предыдущей оболочки. К этим элементам относятся многие металлы, в том числе железо и карбидообразующие элементы.
Сформулированное выше положение является частным случаем условий образования карбидов или нитридов в сплавах. Карбидо- и нитридообразующим элементом в сплаве является такой элемент, у которого менее достроена -полоса, чем у основного металла.
Иногда, правда очень редко, в металлических сплавах образуются карбиды бора, алюминия, кремния и других элементов, по приведенной классификации относящихся к «некарбидообразующим» элементам. Дело в том, что карбиды совершенно отличны от рассматриваемых карбидов. Это соединения с ковалентной связью, не обладающие металлическими свойствами.
имеет 7, а никель 8 электронов, т. е. больше чем железо, имеющее на d-полосе 6 электронов. Поэтому углерод отдает свои электроны железу и карбиды никеля или кобальта не образуются.
Элементы с полностью заполненной -полосой (медь, цинк, серебро и т. д.) ни при каких условиях карбидов в сплавах не образуют.
Вместе с тем в соответствии с высказанным выше положением, активность карбидообразования и устойчивость карбидов в легированных сталях будет возрастать при переходе от элементов марганца и хрома к элементам молибден, ванадий, вольфрам и титан и др. имеющим менее достроенные -полосы, чем у марганца и хрома. Это значит, например, что при наличии в стали одновременно хрома и ванадия следует ожидать в первую очередь образования карбидов ванадия.
Приняв атомный радиус углерода равным 0,079 нм легко подсчитать, что у всех карбидообразующих элементов, кроме железа, марганца и хрома, отношения атомных радиусов углерода к металлу меньше 0,59.
Выше указывалось (гл. IV, что если у металла переходной группы и у металлоида с малым атомным радиусом (углерод, азот, водород) отношение атомных радиусов меньше 0,59, то возможно образование особых видов соединений, которые называются «фазами внедрения» (см. с. 99).
У большинства карбидообразующих элементов соотношение поэтому между ними и углеродом возможно образование фаз внедрения.
Установлено, что в сталях могут образовываться следующие карбидные соединения:
Однако в сталях в чистом виде перечисленные карбиды не существуют. Карбиды всех легирующих элементов содержат в растворе железо, а при наличии нескольких карбидообразующих элементов — и эти элементы. Так, в хромомарганцовистой стали вместо чистого карбида хрома образуется карбид содержащий в растворе железо и марганец.
Так как карбиды, имеющие одинаковую химическую формулу, взаимно растворяются, то, например, при наличии в стали одновременно титана и ниобия будут образовываться не два разделенных вида карбидов, а один общий карбид, в который «на равных основаниях» входят и титан и ниобий. Поэтому возможных вариантов карбидообразования меньше, чем это указано выше, и фактически мы встречаемся в сталях лишь с карбидами шести видов:
где под М подразумевается сумма карбидообразующих элементов (металлических). Соотношения между металлическими элементами и углеродом (для недефектной решетки) указываются формулой.
Карбиды, отнесенные в I группу, имеют сложную кристаллическую структуру. Типичным представителем карбидов этого типа
является цементит, кристаллическая структура которого была показана на рис. 133.
Особенность строения карбидов II группы как фаз внедрения заключается в том, что они имеют простую кристаллическую решетку и кристаллизуются обычно со значительным дефицитом по углероду.
Следует отметить, что фазы внедрения трудно растворимы в аустените. Это значит, что при нагреве (даже очень высоком) они могут не перейти в твердый раствор. В этом их отличие от карбидов
I группы, которые при нагреве легко растворяются в аустените.
Рис. 283. Диаграммы изотермического распада аустенита: а — углеродистая (1) и легированная некарбидообразующими элементами (2) стали; б — углеродистая (1) и легированная карбидообразующими элементами (2) стали
Все карбидные фазы обладают высокой температурой плавления и высокой твердостью. Фазы внедрения в этом отношении превосходят карбиды I группы.
Читайте также:
