Влияние водорода на сталь
Обновлено: 17.05.2024
Как известно, водород не образует с металлом соединений, отрицательно влияющих на прочность этого металла. Но при этом он усиливает вредное влияние макро- и микронесплошностей, способствует резкому снижению пластических свойств металла и его хрупкому разрушению. В целях предупреждения водородной пористости, необходимо обеспечить в газовой фазе более полное связывание водорода в соединения, нерастворимые в металле. Для удаления водорода используют соединения фтора.
1. Лякишев Н.П., Шалимов А.Г. Развитие технологии непрерывной разливки стали. — М.: Элиз, 2002.
2. Айзатулов Р. С., Харлашин П.С. Теоретические основы сталеплавильных процессов. — М.: МИСиС, 2002.
3. Кудрин В.А. Теория и технология производства стали. — М.: Мир, 2003.
4. Бородин Д.И., Григорьев В.П., Чурсин Г.М. Металлургия стали: учеб. пособие. — М.: МИСиС, 2001.
Водород может оказывать на металл двоякое влияние: с одной стороны, он защищает его от насыщения кислородом и азотом, предупреждает окисление, связывая кислород, восстанавливает при известных условиях металл из оксидов, препятствует образованию нитридов железа; с другой — растворяется в металле и становится причиной появления существенных дефектов в шве в виде пористости и трещин.
Металлы по способности взаимодействовать с водородом делятся на 2 группы:
1) не образующие химических соединений с водородом — Fe, Ni, Al, Со, Сu, Mo, Pt и др.;
2) образующие твердые растворы и химические соединения с водородом (гидриды) — Zr, Ti, V, Та, Th и др.
Наряду с этим водород не образуют химических соединений с Fe, но образует химические соединения с легирующими элементами стали. Атомарный водород растворяется как в твердом, так и в жидком железе.
Для сварных соединений нежелательно резкое изменение растворимости газов. Растворимость водорода в железе с повышением температуры растет и изменяется скачкообразно в моменты полиморфных превращений.
При переходе железа из твердого состояния в жидкое наблюдается резкое возрастание растворимости водорода, достигающее максимальной величины при температуре ~ 2400 °С. Таким образом, наиболее значительное насыщение металла водородом происходит в процессе переноса капель металла.
Степень насыщения жидкого металла водородом зависит от наличия в газовой среде элементов, способных связывать водород в химические соединения, нерастворимые в жидком металле и тем самым снижающие парциальное давление его в газовой среде. Так, образование в газовой среде соединений ОН и HF, нерастворимых в жидком металле, снижает насыщенность металла водородом.
Находясь в окисленном жидком металле, водород взаимодействует с кислородом по уравнениям:
Поэтому наличие в металле кислорода ограничивает концентрацию в нем водорода. На рис. 1 приведены данные о совместном растворении водорода и кислорода в жидком железе. Как видим, даже незначительная окисленность жидкого металла резко снижает содержание в нем водорода.
Влияние давления водорода на механизм водородной коррозии углеродистой стали

Углеродистые и низколегированные стали, применяемые для материального исполнения аппаратов гидрогенизационных процессов, подвергаются агрессивному воздействию водорода при повышенных температурах и давлениях. В этих условиях при контакте водорода с поверхностью металла происходит его диссоциация на атомы и диффузия внутрь металла. Скорость диффузии и концентрация водорода зависят от природы металла, температуры, давления газа и других факторов.
Хорошо известно, что повышенная концентрация водорода в металле оказывает влияние на деформационную способность металла, его длительную прочность и ползучесть, кратковременные прочностные и особенно пластические свойства [1–3].
Воздействие водорода на сталь проявляется в двух формах: охрупчивание в результате повышения концентрации водорода в стали (обратимая водородная хрупкость) и охрупчивание в результате взаимодействия водорода с углеродом стали (необратимая водородная хрупкость). Последнее явление часто называют обезуглероживанием.
Диссоциированный водород, адсорбируясь поверхностью стали, в виде протонов проникает в ее объем, диффундирует вглубь, в основном через кристаллическую решетку феррита, и накапливается в коллекторах, расположенных преимущественно у границ зерен. Диффузия водорода через кристаллы цементита при повышенных температурах неизбежно ведет к реакции гидрирования цементита [4]:
Fe3C + 4H → 3Fe + CH4. (1)
В результате протекания данной реакции карбидная фаза у границ зерен перлита постепенно уменьшается.
При этом образуется рыхлый мелкодисперсный феррит с весьма низкими механическими свойствами. Метан, образовавшийся при обезуглероживании стали, диффундирует через рыхлый слой феррита и микротрещины в газовую фазу, аккумулируясь подобно водороду в микропустотах. Под действием сильного распирающего давления продуктов реакции, скопившихся в несовершенствах кристаллической решетки, происходит растрескивание и разрушение металла.
Несмотря на то, что в литературе имеется большое число публикаций, освещающих влияние водорода на свойства сталей, специфичность поведения водорода в сталях при различных условиях их эксплуатации до настоящего времени не позволяет дать однозначные ответы на ряд вопросов относительно физической природы и механизма влияния водорода на служебные свойства сталей.
В случае высокотемпературной водородной коррозии наблюдается резкое снижение пластических и прочностных свойств, что приводит к хрупкому разрушению конструкций. В зависимости от параметров воздействия водорода на металл процесс обезуглероживания может протекать без растрескивания металла (так называемое «мягкое обезуглероживание») или сопровождаться межкристаллитным разрушением стали. Оценка границы перехода от «мягкого обезуглероживания» к водородной коррозии имеет большое практическое значение, так как при «мягком обезуглероживании» стали пластические характеристики металла повышаются даже при некотором снижении прочностных свойств, и металл в ряде случаев имеет достаточный запас прочности.
Целью настоящей работы является уточнение механизма разрушения углеродистой стали (на примере стали 20) на стадии водородной коррозии. Исследовали характер обезуглероживания стали, изменения механических свойств, фрактографию разрушения стали в зависимости от давления водорода при температуре 530°C.
Выбор температуры обусловлен условиями работы промышленной нефтехимической аппаратуры применительно к ряду процессов нефтепереработки.
Объектом исследования являлась углеродистая сталь 20 следующего состава (%): С – 0,19; Cr – 0,13;
Mn – 0,39; P – 0,030; S – 0,040. Механические свойства: σв = 190 МПа, σ0,2 = 280 МПа, δ0,5 = 35%, ψ = 61%.
Для испытаний использовали стандартные цилиндрические образцы на растяжение диаметром 3 мм и длиной рабочей части 18 мм, изготовленные по ГОСТ 1497.
Образцы предварительно термообрабатывали по режиму: нормализация – выдержка при температуре 920°C в течение 50 мин, охлаждение на воздухе, отпуск при температуре 680°C, охлаждение с печью.
Исследование всестороннего воздействия водорода на сталь 20 проводили в автоклавах при повышенных температурах и давлениях водорода. Образцы выдерживались при температуре 530°C под всесторонним давлением водорода 2…4 МПа в течение 500…10 000 ч, после чего определяли механические свойства металла.
Сталь 20, давление водорода 2 МПа
На рис. 1 представлены результаты механических испытаний стали 20, полученные после различной продолжительности воздействия водорода.
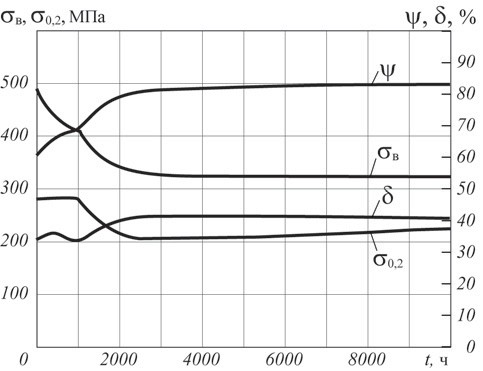
Рис. 1. Изменение механических свойств стали 20 в зависимости от продолжительности воздействия t водорода (давление 2 МПа)
Из рассмотрения приведенных данных следует, что прочностные свойства (σв, σ0,2) стали 20 резко снижаются в течение первых 3 000 ч выдержки, а далее изменяются незначительно. Пластические характеристики практически не меняются (δ0,5) или незначительно увеличиваются (ψ). Такое поведение характерно для стали, подвергающейся отпуску в процессе опыта.
Рис. 2. Микроструктура стали 20 в исходном состоянии Рис. 3. Микроструктура стали 20 после воздействия водорода (давление – 2 МПа, время выдержки – 1 000 ч) Рис. 4. Микроструктура стали 20 после воздействия водорода (давление – 2 МПа, время выдержки – 10 000 ч)
На рис. 2–4 представлена микроструктура стали 20: исходная и после выдержки в течение 1 000 и 10 000 ч.
Обезуглероживания после выдержки 1 000 ч практически не наблюдается, а после 10 000 ч заметно обезуглероживание без растрескивания металла.
Сталь 20, давление водорода 3 МПа
Испытание проводили только при одной продолжительности выдержки – 500 ч. Механические свойства стали 20 при давлении водорода 3 МПа (в числителе – исходные свойства, в знаменателе – после 500 ч испытания):
| σв, МПа | 490/390 |
| σ0,2, МПа | 280/250 |
| δ0,5 ,% | 35/33 |
| ψ, % | 61/66 |
Сталь 20, давление водорода 4 МПа
По сравнению с испытанием при давлении водорода 2 МПа в данном случае наблюдается более резкое падение прочностных свойств, а также снижение пластических характеристик. Соответствующие зависимости представлены на рис. 5.
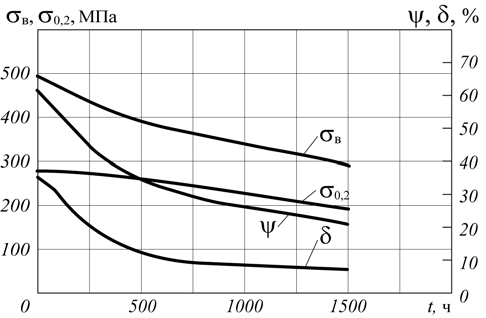
Рис. 5. Изменение механических свойств стали 20 в зависимости от продолжительности воздействия водорода (давление – 4 МПа)
На рис. 6 представлена микроструктура металла после выдержки в течение 500 ч. Видно, что на значительной части сечения образца наблюдается уменьшение перлитной составляющей, а в обезуглероженной зоне – расширение границ зерен феррита. Такое изменение структуры металла вызывает его охрупчивание, что подтверждается снижением пластических характеристик – δ и ψ.

Рис. 6. Микроструктура стали 20 после воздействия водорода (давление – 4 МПа), время выдержки – 500 ч: а – необезуглероженная зона; б – зона с уменьшенной перлитной составляющей; в – обезуглероженная зона
Охрупчиваение стали 20 при давлении водорода 4 МПа подтверждается фрактографическими исследованиями, которые показывают изменение характера разрушения образцов с увеличением давления водорода при выдержке (рис. 7). При давлении водорода до 3 МПа наблюдается вязкое ямочное разрушение, в то время как при давлении водорода 4 и более МПа наблюдаются зарождающиеся трещины. Таким образом, при давлении водорода меньше 3 МПа происходит «мягкое обезуглероживание» металла без растрескивания, а при давлениях больше 3 МПа наблюдается растрескивание стали.

Рис. 7. Фрактография изломов стали 20:
а – давление – 3 МПа, время выдержки – 500 ч;
б – давление – 4 МПа, время выдержки – 1 000 ч
Как видно из представленных данных, с повышением давления водорода наблюдается снижение прочностных характеристик (предел прочности и предел текучести), при этом пластические характеристики с ростом давления увеличиваются, и, проходя через максимум, начинают снижаться. Для стали 20 резкое снижение пластических свойств происходит при давлении водорода 3 МПа. Полученные экспериментальные данные хорошо коррелируют с термодинамическими критериями водородной коррозии [5].
Для оценки водородостойкости стали вводится понятие критического давления метана, ниже которого растрескивания металла не происходит.
Начальная стадия обезуглероживания стали протекает за счет образования и роста небольших межзеренных пузырьков метана внутри стали [6]. При образовании дополнительного метана эти пузырьки расширяются, что приводит к растрескиванию и разрушению металла.
Рост пузырьков метана при обезуглероживании контролируется равновесным внутренним давлением.
Исследования микроструктуры стали 20 на растровом электронном микроскопе наглядно показывают, что пузырьки образуются вдоль границ зерен. Это подтверждает предположение, что первоначально рост пузырьков осуществляется преимущественно за счет зернограничной диффузии и определяется внутренним равновесным давлением метана [7].
Рис. 8. Электронно-микроскопические снимки пузырьков метана в стали 20:
а – во вторичных электронах;
б – в обратно-рассеянных электронах
На рис. 8 приведены результаты исследования микроструктуры стали 20 после выдержки в течение 500 ч при давлении водорода 4 МПа и температуре 530°C: хорошо видны метановые пузырьки вдоль границ перлитных зерен (почти полностью разрушенных), представляющие собой полости, образованные метаном, выделившимся при взаимодействии водорода с карбидом железа Fe3C.
Прочностные свойства стали допускают ее использование при давлении метана, не превышающем критическое, которое можно вычислить по приближенной формуле [5] pкр = 2/3(σпл – σт), (2) где pкр – критическое давление газа; σпл – предел ползучести стали; σт – предел текучести стали.

Рис. 9. Температурная зависимость равновесного давления метана pCH4 и критического давления pкр для стали 20
при разных давлениях водорода
Температурная зависимость pкр (см. рис. 9) делит равновесные давления метана на две области. Эксплуатация стали в области, лежащей ниже критических давлений, допустима, так как при этих давлениях не возникают напряжения, вызывающие растрескивание стали при данной температуре. Эксплуатация стали при давлении метана выше критического с точки зрения термодинамического анализа водородной коррозии стали недопустима.
Расчет равновесных давлений метана для стали 20 проведен по уравнению. lgpCH4 = 3800/T – 4,4 + 2lgpH2. (3)
Из графика (см. рис. 9) видно, что растрескивание стали 20 при температуре 530°C происходит при давлении водорода, большем 2 МПа.
Несколько меньшие значения параметров водородостойкости сталей, оцененные по термодинамическим характеристикам, объясняются тем, что в реальных условиях процесс метанообразования в порах затруднен стадиями подвода углерода к реакционным зонам и отводом продуктов реакции (метана).
Таким образом, рассчитанные термодинамические характеристики удовлетворительно коррелируют с полученными на практике результатами водородостойкости стали и, следовательно, могут быть использованы для ориентировочной оценки возможности протекания водородной коррозии. Оценка водородостойкости стали по величине равновесного давления обоснована для случая, когда кинетическая заторможенность процесса взаимодействия углерода стали с водородом не является определяющей. Подобным образом можно оценить склонность любой конструкционной стали к водородной коррозии.
В связи с опасностью развития водородной коррозии углеродистых и низколегированных сталей их правильный выбор для изготовления оборудования, работающего в водородсодержащих средах, особенно в нефтеперерабатывающей промышленности, в России и зарубежных странах регламентируется целым рядом нормативных документов и технических рекомендаций [8–10].
Влияние водорода на свойства стали
Водород может оказывать на металл двоякое влияние: с одной стороны, он защищает его от насыщения кислородом и азотом, предупреждает окисление (связывая кислород), восстанавливает при известных условиях металл из оксидов, препятствует образованию нитридов железа (см. рис. 9.5); с другой стороны, водород растворяется в металле и становится причиной появления существенных дефектов в шве - пористости и трещин.
Металлы, растворяющие водород, делятся на две группы:
- металлы (Fe, Ni, Al, Со, Си, Мо и др.), не образующие химических соединений с водородом;
- металлы (Zr, Ті, V, Та, Th и др.), образующие твердые растворы и химические соединения с водородом (гидриды).
Атомарный водород растворяется как в твердом, так и в жидком железе. Как следует из рис. 9.6, б, растворимость водорода в железе с повышением температуры растет и изменяется скачкообразно в моменты полиморфных превращений. При переходе железа из твердого состояния в жидкое наблюдается резкое возрастание растворимости водорода, достигающей максимального значения при температуре ^2700 К. Таким образом, наиболее значительное насыщение металла водородом при сварке происходит в процессе формирования и переноса капель с электрода в сварочную ванну.
Рис. 9.12. Влияние температуры и парциального давления водорода в газовой фазе на его растворимость в жидком железе (кривые 7, 2, 3, 4 - для значений соответственно КГ1, 5x10-2, 25x10-3, 10 2 МПа)
Рис. 9.13. Зависимость растворимости водорода в жидких металлах от концентрации в нем кислорода при температуре, близкой к температуре плавления металла
Степень насыщения жидкого металла водородом зависит от наличия в газовой среде элементов, способных связывать водород в химические соединения, не растворимые в жидком металле и тем самым снижающие его парциальное давление в газовой среде. Так, образование в газовой среде соединений ОН и HF, не растворимых в жидком металле, снижает насыщенность металла водородом.
Кроме того, весьма существенным является парциальное давление водорода в газе, контактирующем с металлом. Об этом свидетельствуют представленные на рис. 9.12 зависимости растворимости водорода в металле от температуры среды при разном его парциальном давлении (рщ) в газовой среде.
Находясь в окисленном жидком металле, водород взаимодействует с кислородом по реакциям:
(квадратными скобками обозначены газы, растворенные в металле). Поэтому наличие в металле кислорода ограничивает концен-
ірацию в нем водорода. На рис. 9.13 приведены данные о совместном растворении водорода и кислорода в жидких металлах: железе, меди и никеле. Как следует из рисунка, даже при незначительной окисленности жидкого металла резко снижается содержание в нем водорода.
Насыщение водородом жидкого металла отрицательно сказывается на его свойствах. При достаточно быстром охлаждении металла сварочной ванны не весь растворенный в ней водород успевает выделиться. Особенно много водорода задерживается при снижении температуры превращения у - а. Оставшийся в металле атомарный водород задерживается в ветвях зарождающихся и растущих дендритов, у поверхности кристаллов, у мест расположения посторонних включений, а также в микронесплошностях - скоплениях дислокаций и других дефектах кристаллического строения. В этих местах атомы водорода соединяются в молекулы. Поэтому парциальное давление атомарного водорода в районе дефектов резко снижается, вследствие чего он продолжает диффундировать в том же направлении. Непрерывно образующийся молекулярный водород создает значительные давления, так как сам он не диффундирует через металл и практически не растворим в нем. Кроме того, водород может окисляться и образовывать водяной пар, который в металле не растворяется. В связи с тем что давление направлено во все стороны, в металле возникает объемное напряженное состояние, приводящее к снижению его пластических свойств, а иногда - к хрупкому разрушению и закалочно-водородным трещинам.
. Следовательно, хотя водород и не образует с металлом шва соединений, отрицательно влияющих на прочность сталей, он усиливает вредное влияние макро - и микронесплошностей, способствует резкому снижению пластических свойств и хрупкому разрушению закаленных сталей.
Водородная хрупкость

Элементы различных конструкций могут подвергаться совместному воздействию длительно действующих нагрузок, температур и различных агрессивных сред. Одним из видов агрессивной среды является водородосодержащая среда. Причем она может действовать на конструкцию как при высоких температурах и давлениях, так и при нормальных, которые условно называют низкими температурами. При высоких температурах и давлениях водород, действуя на материал конструкции, вызывает водородную коррозию - обезуглероживает сечение, в результате значительно изменяются кратковременные и длительные механические свойства. Это приводит к изменению напряженно-деформированного состояния (НДС) элементов конструкций и сокращению долговечности.
При нормальных температурах водород оказывает избирательное воздействие на механические свойства напряженного металла конструкции. Механические свойства сильно изменяются в растянутых зонах и практически остаются стабильными в сжатых зонах конструкции; причем в растянутых зонах изменение механических свойств тем сильнее, чем большее количество водорода проникло в соответствующий объем конструкции. Водородное воздействие приводит к охрупчиванию материала, которое может привести, и в ряде случаев уже приводило к авариям. Несмотря на это, водород широко применяется в различных отраслях техники и промышленности. Более того, в силу целого ряда причин технического, экономического и экологического характера ожидается значительное увеличение потребления водорода в мировой экономике для различных нужд.
Низкотемпературное водородное охрупчивание наблюдается при температурах, не превышающих 200°С (от t = -20 до t = +200 °С), и в этом случае в качестве источника водорода выступает либо сам водород, когда конструктивный элемент представляет собой бак, сосуд, баллон и т.д. (тогда водород просто под давлением проникает в металл), либо водород может появиться как побочный продукт в ряде технологических процессов.
Низкотемпературное водородное воздействие отличается тем, что водород по диффузионному механизму проникает в напряженные и ненапряженные элементы конструкций, причем он интенсивнее проникает в растянутые зоны конструкций и менее интенсивно - в сжатые зоны, накапливается там и после достижения определенной концентрации приводит к изменению механических свойств материала конструкции. При этом степень изменения свойств металлов сильно зависит от содержания водорода. При малом содержании водорода изменения механических свойств практически не наблюдается, после достижения критического уровня происходит интенсивное ухудшение свойств, по достижении предельной концентрации (предельного уровня насыщения) изменение механических свойств затормаживается, несмотря на продолжающееся насыщение материала конструкции.
Особенность работы нагруженных конструкций, подвергающихся низкотемпературному наводороживанию, заключается в том, что изменение механических свойств материала в растянутых зонах происходит более интенсивно, чем в сжатых зонах. Неравномерное изменение свойств вызывает перераспределение поля напряжений, которое в свою очередь влияет на распределение водородного поля. Этот процесс перераспределения напряжений и водородного поля по объему конструкции будет неустановившимся до тех пор, пока либо не стабилизируется состояние конструкции, либо она не разрушится.
При низкотемпературном наводороживании кинетика водородного охрупчивания контролируется кинетикой транспорта водорода. Если концентрация водорода превысит предельно допустимое значение, то развивается водородная хрупкость. Водородная хрупкость проявляется в изменении механических характеристик металла. Термин «водородная хрупкость» является условным, так как водород не всегда приводит к замедленному разрушению.
Под водородной хрупкостью понимают всю совокупность отрицательных явлений, вызванных повышенным содержанием водорода в металле. Вредное воздействие водорода на металл проявляется прежде всего в снижении его прочностных и пластических свойств. Так, снижение пластичности металлов может колебаться в широком диапазоне: от нескольких процентов до почти полной потери пластичности. Влияние водорода на механические свойства металла может осуществляться в результате облегчения обычного для данного металла вязкого разрушения или в результате изменения характера разрушения от вязкого внутризеренного к хрупкому межзеренному. Под воздействием водорода значительно увеличивается чувствительность металлов к наличию трещин. Это делает реальной опасность катастрофического хрупкого разрушения конструкций, обладающих в обычных условиях достаточной несущей способностью.
Природа водородной хрупкости металлов определяется содержанием водорода, характером взаимодействия металлов и сплавов с водородом, состояние водорода в металле, величиной напряжений.
Водородная хрупкость связана с различного рода дефектами и несовершенствами кристаллической решетки металлов. Водородная хрупкость металлов создается самим водородом благодаря особенностям его состояния в металле.
Анализ экспериментальных данных позволил выявить следующие закономерности проявления водородного охрупчивания:
1) вызванная водородом хрупкость проявляется при низких скоростях деформации;
2) повышение содержания водорода в материале ухудшает его прочностные и пластические характеристики;
3) наводороженный металл подвержен замедленному разрушению, т.е. разрушению при постоянной или слабо меняющейся нагрузке;
4) механические характеристики наводороженного металла, находящегося в напряженном состоянии, могут хотя бы частично быть восстановлены в процессе отдыха после снятия напряжений;
5) с ужесточением схемы напряженного состояния интенсивность охрупчивания заметно возрастает[2].
Присутствие водорода приводит к увеличению хрупкости всех без исключения металлов, ни в одном случае не было обнаружено увеличение пластичности металла при окклюзии водорода.
Установлено, что результатом возникновения водородной хрупкости стали является понижение ударной вязкости, относительного удлинения и относительного сужения. Вредное влияние водорода на пластические свойства более резко проявляются у хромоникелевых, хромомолибденовых и хромоникельмолибденовых сталей. Значительное охрупчивание стали, содержащей водород, происходит в интервале температур от - 100 до + 100 0 С, максимум водородной хрупкости имеет место при температурах, близких к комнатной, а при температуре – 196 0 С водородная хрупкость стали практически не наблюдается. На рисунке 1 схематично это изображено.
Чувствительность стали к водородной хрупкости зависит от многих факторов: в первую очередь от уровня прочности, а затем от состояния, состава, структуры стали, а также свойств отдельных плавок [3].
Так же установлено, что присутствие водорода приводит к резкому понижению пластических свойств никеля и в характере этого процесса имеется много общего с процессом охрупчивания стали и ряда других металлов, имеющих кубическую решетку. Однако в отличие от стали, где давление приводило к необратимым изменениям вследствие пластической деформации, никель деформируется только упруго: после прекращения наводороживания деформация постепенно исчезает.
При воздействии водорода на медь происходит резкое снижение пластичности. Опасность охрупчивания меди необходимо учитывать при некоторых технологических операциях, например при светлом отжиге медных изделий, получившем широкое практическое применение.
Рисунок 1. Схема растяжения стали.
1- исходная нормализация; 2- после наводороживания.
Алюминий не склонен к водородной хрупкости. Единственный дефект, возникающий в алюминиях и его сплавах под действие водород, - газовая пористость, которая оказывает влияние на механические свойства сплавов. Снижение предела прочности представляется следствием охрупчивания из-за пористости.
Тантал наименее склонен к водородной хрупкости. Долговечность наводороженного тантала также значительно ниже, чем не содержащей водород.
Присутствие водорода в титане вызывает резкое ухудшение пластических свойств металла при растяжении и других видах деформации, понижает сопротивление ударному разрушению, отрицательно влияет на характеристики длительной прочности и другие служебные свойства металла. Технический титан обладает большой чувствительностью к водородной хрупкости, чем титан высокой чистоты [1].
Таким образом, проблема водородной хрупкости металлов оказалась значительно более глубокой и всеобъемлющей, чем это предполагалось.
1. Галактионова, Н.А. Водород в металлах. - М.: Металлургия, 1967. – 304c.
2. Колачев, Б.А. Водородная хрупкость металлов. – М.: Металлургия, 1985. – 215c.
3. Мороз,Л.С Водородная хрупкость металлов. М.: Металлургия, 1967. – 275c.
Основные термины (генерируются автоматически): Водородная хрупкость, Водород, Водородная хрупкость металлов, металл, присутствие водорода, свойство, температура, водородное охрупчивание, водородное поле, сам водород.
Похожие статьи
Взаимодействие металлов с водородом | Статья в журнале.
Снижение пластических свойств материалов (водородная хрупкость), раковины, пузыри, трещины и другие макроскопические
Стойкость к водородному охрупчиванию повышается добавкой кремния [3].
312с. 2. Колачев, Б.А. Водородная хрупкость металлов.
Исследование механизма наводораживания металла.
Разрушения в результате водородного охрупчивания и коррозионного водородного
Влияние водорода на хрупкость конструкционных сталей и сварных соединений
Похожие статьи. Исследование температурно-тепловых режимов нагрева металла в печи отжига.
Физико-химические свойства редкоземельных элементов.
В свободном состоянии лантаноиды представляют собой типичные металлы, по большинству свойств сходные с лантаном
Известно, что эрбий при низких температурах реагирует с водородом с образованием ЕгН3, а при температурах 600–800°С с образованием ЕгН2.
К вопросу применения водорода на двигателях внутреннего.
Диффузия водорода в металлы возрастает с повышением температуры.
Диффузия водорода в металлы ухудшает их твердость, термическую стойкость, текучесть и ряд других свойств.
Получение водорода в домашних условиях
Ключевые слова: водород, получение водорода. Так что же такое водород? Каковы его свойства?
Наблюдение выделения водорода в результате взаимодействия металлов с разбавленными кислотами было самых первым в истории химии.
Влияние структурных изменений при высокотемпературном отжиге.
При этом высокая температура спекания спрессованных штабиков (2300-2400 ºС) из этих
Одним из основных факторов, влияющих на хрупкость молибдена, полученного методом
зерен в процессе термомеханической деформации и вызывающих охрупчивание металла[2].
Краткий обзор опытно-конструкторских работ по использованию.
Применение водорода в машиностроении потребовало изучение его теплофизических и моторных свойств.
Фрагменты его исследований [2], учитывающие свойства водорода как добавки к бензовоздушным смесям, приведены в таблице 1.
Изменение структуры и состава нитридного слоя при.
— парциальное давление водорода
Металловедение и термическая обработка металлов. - 1974. № 3 С. 14–21.
Изменение углеводородного состава автомобильного бензина в результате обработки электрическим полем.
Модификация электрических и оптических свойств тонких слоев.
Указанные изменения обусловлены перераспределением ионов водорода в результате их электомиграции (дрейфа) в электрическом поле («внутренний электрохромный эффект»).
Взаимодействие металлов с водородом

Изучению взаимодействия водорода с металлами посвящено большое количество исследований как материаловедческого, так и фундаментального плана. Это вызвано тем, что водород, проникающий в металл во время плавки, разливки и различных химических, электрохимических, газоразрядных и ядерных процессов, является одной из важнейших причин ухудшения эксплуатационных характеристик материала. Снижение пластических свойств материалов (водородная хрупкость), раковины, пузыри, трещины и другие макроскопические несовершенства структуры способствуют быстрому разрушению изделий, контактирующих с водородом.
Основными проблемами конструкционных и функциональных материалов является механизм проникновения водорода в металл и изменение свойств под действием водорода.
Причиной низкотемпературного наводороживания является катодная поляризация поверхности стального оборудования в электролитических средах. Такая поляризация на практике может иметь место в результате двух принципиально отличающихся процессов: 1) саморастворения (коррозии, химического травления); 2) электрохимической обработки с наложением тока [1].
Наводороживание слагается из этапов адсорбции, абсорбции (растворение) и диффузии водорода. Следовательно, чтобы узнать характер неоднородности, появившейся в результате наводороживания нужно знать закон распределения водорода по объему конструктивного элемента и связь концентрации водорода со степенью изменения механических свойств.
Следуя Б.А.Колачеву, процесс диффузии водорода в металл можно описать следующим образом [2]. При адсорбции молекулы водорода в конечном итоге распадаются на атомы, которые затем диффундируют вглубь металла. Плотность потока J, то есть количество вещества, диффундирующего в единицу времени через единицу поверхности, перпендикулярной потоку вещества, пропорциональна пространственному коэффициенту концентрации
где D – коэффициент диффузии, C - концентрация водорода.
Для одномерной задачи уравнение переходит в первый закон Фика
Если коэффициент D не зависит от концентрации, то из первого вытекает второй закон Фика в виде
В интегральной форме коэффициент диффузии:
где - концентрации диффундирующего тела в поверхностных слоях.
Кроме того, коэффициент диффузии для тонких мембран зависит от толщины сечения, это связано с тем, что при тонких сечениях не выполняется первый закон Фика, так как не достигается независимость концентрации от плотности поляризующего тока.
Для нахождения закона распределения концентрации водорода и по объему конструктивного элемента в любой момент времени нужно решить уравнение диффузии с начальными и граничными условиями, соответствующими рассматриваемой задачи.
Большой интерес представляют работы Катлинского B.M. [2]. Он провел большую работу по анализу и статистической обработке опубликованных экспериментальных данных для коэффициента диффузии водорода в различных металлах. Причем автор при анализе исключал из рассмотрения резко отклоняющиеся данные и использовал метод наименьших квадратов для нахождения значений D и E в зависимости:
где D0 – предэкспоненциальный множитель, E – энергия активации при диффузии, R – газовая постоянная, T - абсолютная температура.
В таблице 1 приведены эффективные значения D и E.
Таблица 1. Параметры температурной зависимости коэффициента диффузии водорода D.
Читайте также:
