Металлы с переменной степенью окисления
Обновлено: 18.05.2024
Переходные металлы — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Переходные металлы - общая характеристика
Все d-элементы расположены в побочных подгруппах периодической системы элементов и являются переходными.
Находясь только в больших периодах (IV, V, VI), d-элементы образуют "вставные декады" (по 10 элементов) между s- и d-элементами, поэтому имеют общее название — переходные металлы.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока) на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах n— номер периода.
В отличие от щелочных и щелочноземельных металлов, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементов являются не только s-электроны внешнего слоя, но и все или некоторые d-электроны предвнешнего слоя, d-элементы образуют три переходных ряда — в IV, V и VI периодах соответственно. Первый ряд включает 10 элементов: от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей (табл. 29).
| Элемент | Символ | Атомный номер | Электронная конфигурация |
| Скандий | Sc | 21 |  |
| Титан | Ti | 22 |  |
| Ванадий | V | 23 |  |
| Хром | Cr | 24 | |
| Марганец | Mn | 25 | |
| Железо | Fe | 26 | |
| Кобальт | Co | 27 | |
| Никель | Ni | 28 | |
| Медь | Cu | 29 | |
| Цинк | Zn | 30 |
Как следует из таблицы, хром и медь имеют всего по одному электрону. Согласно закономерностям заполнения энергетических уровней и подуровней у атомов хрома и меди на четвертом энергетическом уровне должно быть два электрона. Однако один из двух электронов переходит на третий энергетический уровень, на незаполненную d-орбиталь ("провал электрона"). Медь в соединениях проявляет степени окисления + 1, +2, хром проявляет степени окисления +2, +3, +6. Для d-металлов III—VII групп высшая валентность и высшая степень окисления равны номеру группы, т. е. суммарному числу (n — 1)d- и ns-подуровнях, например у d-элементов четвертого периода (табл. 30).
d-металлы II группы, атомы которых имеют завершенную структуру d-подуровня d-подуровень полностью завершен, поэтому цинк в соединениях проявляет только степень окисления +2.
В периодах с увеличением заряда ядра металлические свойства изменяются более медленно по сравнению со свойствами s- и p-элементов. В побочных подгруппах сверху вниз восстановительные свойства d-элементов уменьшаются. В свободном состоянии d-металлы (как и вообще все металлы) являются восстановителями. Восстановительная активность различных d-металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода: (Fe, Cr, Zn, Mil и др.); малоактивные металлы (Сu, Hg и др.) и благородные металлы (Аu, Pt), располагающиеся в ряду напряжений после водорода.
Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с высокими степенями окисления являются окислителями, а соединения с невысокими степенями окисления — восстановителями, например:
— восстановители.
Кислотно-основные свойства оксидов и гидроксидов d-элементов, а также окислительно-восстановительные свойства их соединений зависят от степени окисления металла. Как следует из таблицы при увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается (табл. 31).

Например, СrО и Сг(ОН)2 — это основные оксиды и гидроксиды. Сг2O3 и Сг(ОН)3 — амфотерные, СrO3 и Н2СrО4, Н2Сг2О2 — кислотные.
d-металлы по сравнению с другими металлами характеризуются более большей твердостью, плотностью, высокой температурами плавления и кипения, d-металлы хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон. Так, медь, серебро и золото, обладающие конфигурацией d 10 s 1
Большинство соединений переходных металлов окрашены. Для d-элементов характерно образование комплексных соединений.
Все d-элементы расположены в побочных подгруппах периодической системы элементов и являются металлами. В каждом большом периоде d-элементы располагаются между s- и p-элементами. В отличие от щелочных и щелочноземельных металлов, большинство d-металлов имеют переменную валентность и переменную степень окисления. В свободном состоянии d-металлы (как и вообще все металлы) являются восстановителями. Соединения d-элементов могут проявлять как восстановительные, так и окислительные функции. Соединения с высокими степенями окисления являются окислителями, а соединения с невысокими степенями окисления — восстановителями. При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается.
Комплексные соединения
Мир веществ многообразен, и мы встречались с группой веществ, которые принадлежат к комплексным соединениям. Данными веществами стали заниматься с XIX века, но понять их строение с позиций существовавших представлений о валентности было трудно. В 1893 году швейцарским химиком-неоргаником Альфредом Вернером была сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений, которую назвали координационной теорией, поэтому комплексные соединения часто называют координационными соединениями. Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Комплексные соединения образуются в результате взаимодействия между собой солей, кислот и оснований, например:

Строение комплексных соединений. Комплексные соединения образованы двумя составляющими: внутренней координационной сферой и внешней координационной сферой.
Во внутреннюю сферу, которую обозначают квадратными скобками, входит центральный атом, или комплексообразователь, и окружающие его ионы, атомы или молекулы, называемые лигандами. Наиболее часто комплексообразователями служат атомы металлов. В качестве лигандов выступают ионы Cl, Br, I , CN, NO2, ОН или нейтральные молекулы NH3, Н2O, СО.

В состав внутренней сферы одного соединения могут входить различные лиганды, например, в и Cl2, являются лигандами. Число лигандов, располагающихся вокруг комплексообразователя, определяет координационное число центрального атома. Так, в соединении — шести. Координационное число принимает значения от 2 до 12, но чаще всего оно равно 2, 4 или 6. Внешняя сфера может быть образована как катионами, так и анионами. Заряды внешней и внутренней сфер противоположны. Рассмотрим несколько примеров: 1. Структура комплекса
Железо (+2) является центральным ионом. Ионы CN выполняют роль лигандов. Железо в комплексе с цианогруппами образует внутреннюю координационную сферу. Ионы калия образуют внешнюю координационную сферу. Положительный заряд внешней сферы компенсирует отрицательный заряд внутренней сферы. Координационное число комплексообразователя (Fe), определяемое числом координационных связей, равно 6.
2. Структура комплекса 3 выполняют роль лигандов. Кобальт в комплексе с NH3 образует внутреннюю сферу. Ионы хлора образуют внешнюю координационную сферу. Координационное число комплексообразователя (Со) равно 6.
3. Структура комплекса 3 и ионы Сl выполняют роль лигандов- Платина в комплексе с NH3 иСl образует внутреннюю координационную сферу. Заряд внутренней сферы равен 0. Внешняя координационная сфера отсутствует. Координационное число комплексообразователя Pt равно 4. Как видим, комплексные соединения чрезвычайно разнообразны по составу и строению.
Классификация комплексных соединений Большое многообразие комплексных соединений и их свойств не позволяет создать единую классификацию. Однако можно группировать вещества по некоторым отдельным признакам.
1. По составу: например, соли кислоты
2. По типу координируемых лигандов: а) аквакомплексы — это комплексные катионы, в которых лигандами являются молекулы Н2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз. Например: б) гидроксокомплексы — это комплексные анионы, в которых лигандами являются гидроксид-ионы ОН - . Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств — Be, Zn, Al, Сг. Например:

в) аммиакаты — это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы. Например:

г) ацидокомплексы — это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например:

3. По заряду внутренней сферы а) комплексный катион, например,

б) комплексный анион, например,
Химические свойства
1. В растворе комплексные соединения ведут себя как сильные электролиты, т. е. полностью диссоциируют на катионы и анионы:

а)

б)
2. При действии сильных кислот происходит разрушение гидроксокомплексов, например:
а) при недостатке кислоты:


б) при избытке кислоты:

3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
Значение и применение комплексных соединений
Комплексные соединения имеют большое значение в природе. Достаточно сказать, что почти все ферменты, многие гормоны, лекарства, биологически активные вещества представляют собой комплексные соединения. Например, гемоглобин крови является комплексным соединением железа, а хлорофилл — комплексным соединением магния, витамин В12 — комплексным соединением кобальта. Образование комплексных соединений используют в химической технологии для извлечения золота, металлов платиновой группы и др. Эти соединения широко применяют в аналитической химии в качестве индикаторов.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Комплексные соединения образованы двумя составляющими: внутренней координационной сферой и внешней координационной сферой. Комплексообразователями являются металлы. Окружающие комплексообразователя ионы, атомы или молекулы, называются лигандами. Число лигандов, располагающихся вокруг комплексообразователя, определяет координационное число центрального атома. Координационное число принимает значения от 2 до 12, но чаще всего оно равно 2, 4 и 6.
Биологическая роль переходных металлов
Хром — постоянная составная часть растительных и животных организмов. Биологическая активность хрома объясняется главным образом способностью ионов Сr 3- образовывать комплексные соединения. Например, ионы Сr 3- участвуют в стабилизации структуры нуклеиновых кислот. Недостаток хрома замедляет рост живых организмов, нарушает углеводный обмен вызывает болезнь глаз, симптомы диабета. Соединения хрома ядовиты и в медицине не применяются.
Марганец. Марганец — микроэлемент. Биогенная функция ионов Мn 2+ состоит в регуляции активности ферментов. Поэтому ионы Мn 2+ обладают широким спектром биологических эффектов: оказывают влияние на кроветворение, минеральный обмен, рост, размножение и т. д. Кроме того, ионы Мn 2+ стабилизируют структуру нуклеиновых кислот. В медицине используется перманганат калия КМnO4. Этот антисептик применяется в водных растворах для промывания ран, полоскания горла и т. д.
Железо. Железо входит в состав ферментов, которые катализируют окислительно-восстановительные процессы в организме человека. Играет важную роль в синтезе белков, процессах фотосинтеза и дыхания растений. Недостаток железа в организме человека приводит к болезни крови (анемии) и нарушению иммунной системы. В организме взрослого человека содержится около 3,5 г железа. Основная его масса сконцентрирована в гемоглобине. По форме гемоглобин похож на шарик диаметром около 5,5 нм. Гемоглобин — сложный белок,который переносит кислород по всем тканям и органам. В нашей жизни становится все больше продуктов, которые могут вызвать недомогание у любого человека. Одним из таких продуктов является оксид углерода (II) — угарный газ. Оксид углерода (II) образуется при неполном сгорании любого топлива (газ, уголь, дрова, бензин и др.) Кроме того увеличивается количество транспорта, а с ним и угарного газа в атмосфере. При этом распространяется газ быстро, смешиваясь с воздухом без потери своих отравляющих свойств. Для человека угарный газ — сильнейший яд. Поступая в организм при дыхании, он проникает из легких в кровеносную систему, где и вступает в обратимое химическое взаимодействие как с окси-, так и с дезоксигемоглобином:

где Нb — гемоглобин. Образующийся комплекс карбоксигемоглобин (НbСО) не способен присоединять к себе кислород. Таким образом,связываясь с гемоглобином угарный газ препятствует снабжению организма кислородом. В результате кровь утрачивает способность переносить и доставлять тканям кислород и развивается кислородное голодание или гипоксия. В первую очередь страдает головной мозг, но возможно поражение и других органов — в зависимости от общего состояния здоровья.
Такое состояние опасно для жизни и при тяжелом отравлении может быть смертельным. Основная проблема состоит в том, что угарный газ не имеет ни цвета, ни вкуса, ни запаха, не вызывает вообще никаких ощущений.
К первым симптомам отравления угарным газом относятся: тошнота, рвота, головокружение, частый пульс, дезориентация. Возможно развитие обморока, эйфории, спутанности сознания.
• Если начинается озноб, падает температура — укутайте потеплее, напоите сладким чаем (если человек в сознании, разумеется).
• Устройте поудобнее (и желательно — на свежем воздухе или, хотя бы, у открытого окна), чтобы облегчить дыхание.
• Потерявшего сознание уложите на бок и следите, чтобы его голова не запрокидывалась, особенно если вдруг возникнет рвота, дайте понюхать ватку, смоченную нашатырным спиртом, для того, чтобы привести человека в сознание; При необходимости сделать пострадавшему непрямой массаж сердца и провести искусственное дыхание.
• Чем раньше пострадавшему будет оказана медицинская помощь, тем больше шансов на его выздоровление.
Учтите: от отравления угарным газом существует противоядие. Этот препарат называется ацизол, выпускается в виде капсул и в виде раствора в ампулах (для внутримышечных инъекций).
Для того, чтобы предотвратить отравление угарным газом нужно соблюдать несложные правила:
• не ночевать в гараже;
• не использовать газовую горелку или керосиновую лампу для отопления закрытого помещения;
• не оставлять в гараже машину с включенным двигателем;
• не спать в машине с включенным двигателем.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Валентность. Степень окисления химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) - валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) - валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) - валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2H4 (гидразин) - валентность азота равна III, а степень окисления равна +2.
- H2 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)H4(-), B2(+3)H6(-), B(+3)H3(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)H2(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом - фтором - степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
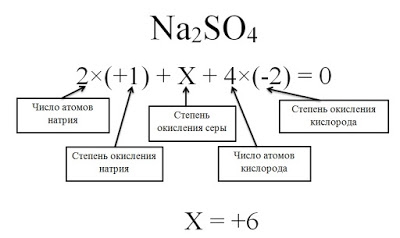
Определите степени окисления всех элементов в соединение Na2SO4.
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Определение степени окисления элементов в соединениях
Окисление и восстановление — что это за процесс в химии?
Рассмотреть данные процессы можно на примере опыта. Раствор хлорида меди (II) подвергают воздействию электрического тока. При этом катод покрывается медным налетом, а на аноде образуется хлор.
Схема процесса на катоде электрода:
Схема химической реакции на аноде электрода:
Катион меди превращается в электронейтральный атом меди, когда катод передает ему два элетрона. Образование молекулы хлора из пары анионов хлора происходит при отдаче двух электронов.
Восстановление меди на катоде:
C u 2 + + 2 е → C u
Окисление хлора на аноде:
2 C l - - 2 е → С l 2
Восстановление является процессом, при котором элемент принимает электроны.
Окислением называют процесс отдачи электронов.
Восстановитель — вещество, которое отдает электроны.
Окислителем называют вещество, которое принимает электроны.
В процессе приема электронов происходит восстановление окислителя. При отдаче восстановителем электронов вещество окисляется.
Окислительно-восстановительные реакции — процессы окисления и восстановления, которые не могут протекать раздельно друг от друга.
Электронный баланс
При окислительно-восстановительном процессе количество электронов, которые были приняты окислителем, совпадает с числом электронов, отданных восстановителем. В рамках рассматриваемого опыта электронный баланс имеет следующий вид:
F e + C u S O 4 = F e S O 4 + C u
C u 2 + + 2 e = C u
Функцию восстановителя при этом выполняет простое вещество в виде железа, которое окисляется до двухзарядного катиона.
F e – 2 e = F e 2 +
Электролиз — окислительно-восстановительная реакция, протекающая при воздействии электрического тока.
Процесс электролиза являлся предметом исследований ученого Майкла Фарадея. В настоящее время электролиз нашел широкое применение в промышленной сфере. Данная реакция позволяет получать копии разнообразных деталей, покрывать стальные компоненты кузова автомобилей защитной оболочкой из другого металла.
Понятие электроотрицательности элементов
Все элементы Периодической таблицы классифицируют на две группы:
Металлами называют элементы, атомы которых обладают способностью отдавать электроны.
Неметаллы являются элементами, атомы которых более склонны принимать электроны.
В процессе контакта металла и неметалла атом первого лишается электронов, а атом второго — присоединяет электроны.
Атомы разных элементов обладают различной способностью притягивать к себе общие электронные пары.
Электроотрицательность — способность атомов элементов притягивать к себе общие электронные пары в химических соединениях.
Зная, что общие электронные пары образованы валентными электронами, можно заключить следующее: электроотрицательность представляет собой способность атома оттягивать к себе валентные электроны от других атомов. С увеличением электроотрицательности неметаллические свойства элемента становятся более выраженными.
В связи с тем, что абсолютные параметры электроотрицательности являются неудобными для расчетов, принято использовать в работе относительную электроотрицательность, согласно шкале Полинга. За единичное значение электроотрицательности в данном случае принято значение электроотрицательности лития.
Максимальной электроотрицательностью (4) обладает фтор. Наименьшая электроотрицательность отмечена у франция (0,7). В случае остальных химических элементов данный показатель соответствует интервалу от 0,7 до 4.
В распространенных случаях неметаллы обладают электроотрицательностью более 2. Металлы характеризуются значениями до 2. Определенные элементы, в том числе, B, Si, Ge, As, Te, электроотрицательность которых составляет около 2, могут проявлять промежуточные свойства. Если значение электроотрицательности элемента очень высокое или низкое, то такой элемент называют активным. Высокая электроотрицательность от 3 до 4 характерна для активных неметаллов, а низкие значения, близкие к 1, — для активных металлов.
При увеличении порядкового номера элементов электроотрицательность изменяется периодически. В периоде можно наблюдать рост показателя слева направо при повышении числа электронов на внешнем слое. В группе данная характеристика уменьшается по направлению вниз с увеличением количества электронных слоев и атомных радиусов. Максимальная электроотрицательность в каждом периоде характерна для наиболее маленьких атомов, которые имеют семь внешних электронов, то есть атомов галогенов. Минимальный показатель можно наблюдать в периоде у самого крупного атома, обладающего одним внешним электроном, то есть у атома щелочного металла.
Степенью окисления называют условный заряд, который приобретает атом в соединении, если рассматривать связь в соединении как ионную, т. е. предположить, что электроны полностью переходят к более электроотрицательному атому.
Степень окисления соответствует количеству электронов, которые были смещены от атома или к атому.
При положительной степени окисления наблюдается смещение электронов от атома. Характерна для атома с меньшей электроотрицательностью.
Отрицательная степень окисления является степенью окисления, при которой электроны смещаются к атому.
В случае простых веществ сдвиг электронов отсутствует. При этом степень окисления атомов принимает нулевое значение.
Степень окисления находят и записывают над знаком химического элемента:
Примеры задач с решением
Требуется определить степень окисления, которой обладает сера в кислотах с формулами:
- H 2 S O 3
- H 2 S 2 O 5
- H 2 S 3 O 10
Водород обладает степенью окисления +1, для кислорода данный показатель равен -2. За обозначение степени окисления серы можно принять х. Таким образом:
Необходимо рассчитать степень окисления хлора в следующих соединениях:
- K C l O 3
- C a ( C l O 4 ) 2
- A l ( C l O 2 ) 3
В первую очередь требуется определить заряд, которым обладают сложные ионы.
Нужно определить, какими степенями окисления обладают элементы в аммиаке N H 3 .
Водород характеризуется степенью окисления +1. Необходимо рассчитать данный параметр для азота. Предположим, что х является искомой степенью окисления. Можно записать простое уравнение:
Ответ: N - 3 H 3 + 1
Определите степени окисления всех атомов всех элементов в молекуле H 2 S O 4 ?
В первую очередь нужно записать известные степени окисления для водорода и кислорода:
Далее требуется составить краткое уравнение, чтобы определить возможную степень окисления серы:
2 * ( + 1 ) + х + 4 * ( - 2 ) = 0
Ответ: H 2 + 1 S + 6 O 4 - 2 .
Необходимо определить степени окисления, которыми обладают все элементы в составе вещества A l ( N O 3 ) 3 .
Руководствуясь стандартным алгоритмом, рассмотрим формульную единицу нитрата алюминия. В ее состав входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, для которого нужно искать степень окисления. Решим уравнение:
1 * ( + 3 ) + 3 x + 9 * ( - 2 ) = 0
Ответ: A l + 3 ( N + 5 O 3 - 2 ) 3 .
Имеется ион ( A s O 4 ) - 3 . Нужно определить степень окисления всех его атомов.
В этом примере сумма степеней окисления обладает не нулевым значением, а соответствует заряду иона, то есть -3. Уравнение примет вид:
Требуется рассчитать степени окисления, которыми обладают все элементы в ( N H 4 ) 2 S O 4 .
Известны значения степеней окисления для водорода и кислорода. Необходимо рассчитать данные показатели в случае серы и азота. В этом случае целесообразно принять сульфат аммония не в виде единой формульной единицы, а как пару объединенных ионов:
В каждом ионе, заряды которых известны, расположен один атом со степенью окисления, которую требуется определить. Как в предыдущих примерах, можно найти данные величины:
Переходные металлы комплексы и строение
Переходные металлы , Переходные металлы. переходные металлы — простые и сложные комплексы переходных металлов. Переходные металлы (переходные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом: . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на -орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Общая характеристика переходных элементов. Все переходные элементы имеют следующие общие свойства:
Небольшие значения электроотрицательности.
Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди. Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность. [8]
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[9]
Медь, Медные группы. Медь представляет собой довольно мягкий металл красно-жёлтого цвета. В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
таб?
В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди (II).
Для меди наиболее характерна степень окисления +2, однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Платиновые металлы
Основная статья: Металлы платиновой группы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Нас находят по запросам:
— переходные металлы
— комплексы переходных металлов
— строение переходные металлы
— простые и переходные металлы
— галогениды переходных металлов
— нитриды переходных металлов
— комплексы переходных металлов
— сплав переходных металлов
— расчёт комплексов переходных металлов
— водорастворимые полимеры переходные металлы
— свойства комплексов переходных металлов
— структура переходных металлов
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Уроки по неорганической химии для подготовки к ЕГЭ
Перед тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ.
Элементы с постоянными степенями окисления в сложных соединениях:
| Степень окисления | Элементы | Примеры соединений | Названия соединений |
|---|---|---|---|
| -1 | F | NaF OF2 | Фторид натрия Фторид кислорода |
| +1 | Все металлы 1-ой группы главной подгруппы (Li-Fr) | Na2O KH | Оксид натрия Гирид калия |
| +2 | Все металлы 2-ой группы главной подгруппы (Be-Ra), а также Zn и Cd | BeO CaH2 | Оксид бериллия Гидрид кальция |
| +3 | Al | Al2O3 Al(OH)3 Al2(SO4)3 | Оксид алюминия Гидроксид алюминия Сульфат алюминия |
Элементы с переменными степенями окисления:
1. Водород
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | H2 | Водород (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| +1 | H2O H2O2 H2SO4 KOH NaHSO3 | Вода Пероксид водорода Серная кислота Гидроксид калия Гидросульфит натрия | В таких соединениях, как вода, пероксид водорода, все кислоты, основания, кислые соли, все органические соединения |
| -1 | NaH CaH2 | Гидрид натрия Гидрид кальция | Только с металлами водород может проявлять степень окисления -1 |
2. Кислород
Положительные степени окисления кислород проявляет только в соединениях с фтором
3. Сера
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | S8 | Сера | Светло-желтый порошок; нерастворим в воде, тяжелее её, но в воде не тонет, плавает на её поверхности, так как ею не смачивается. Молекулы S8 образуют молекулярную кристаллическую решетку. Сера существует в виде нескольких аллотропных модификаций: ромбическая, моноклинная, пластическая. |
| -2 | H2S CaS | Сероводородная кислота Сульфид кальция | Все сульфиды |
| -1 | FeS2 | Персульфид железа (II) (пирит, серный колчедан, железный колчедан) | Единственное соединение со ст. ок. -1 |
| +4 | SO2 H2SO3 CaSO3 | Оксид серы (IV) Сернистая кислота Сульфит кальция | В таких соединениях как оксид серы (IV), сернистой кислоте и всех её солях |
| +6 | SO3 H2SO4 CaSO4 | Оксид серы (VI) Серная кислота Сульфат кальция | В таких соединениях как оксид серы (VI), серной кислоте и всех её солях |
4. Азот
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | N2 | Азот (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| -3 | NH3 Na3N Ca3N2 | Аммиак Нитрид натрия Нитрид кальция | В таких соединениях, как аммиак и все нитриды |
| -2 | N2H4 | Гидразин | Степени окисления -2 и -1 встречаются только в органических соединениях |
| -1 | NH2OH | Гидроксиламин | |
| +1 | N2O | Оксид азота (I) | Азот проявляет положительные степени окисления только в соединениях с кислородом и фтором |
| +2 | NO | Оксид азота (II) | |
| +3 | N2O3 HNO2 NF3 | Оксид азота (III) Азотистая кислота Фторид азота (III) | В таких соединениях, как оксид азота (III), азотистой кислоте и всех её солях, фториде азота (III) |
| +4 | NO2 | Оксид азота (IV) | Смешанный оксид азота (IV) |
| +5 | N2O5 HNO3 | Оксид азота (V) Азотная кислота | В таких соединениях, как оксид азота (V), азотной кислоте и всех её солях |
5. Галогены*
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
6. Углерод**
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | C | Углерод | Аллотропные модификации: алмаз, графит, карбин (черный порошок, полимерные цепи -CC-, =С=С=), фуллерены (темные, похожие на сажу, C60-C200) |
| +2 | CO | Оксид углерода (II) (угарный газ) | В таких соединениях как CO, а также в некоторых органических соединениях |
| +4 | CO2 |
** В органических соединениях углерод проявляет все степени окисления от -4 (например, CH4) до +3 (например, CH3COOH).
Читайте также:
