Молярная масса оксида металла
Обновлено: 05.05.2024
Задача №1
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода
mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена
mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда: mЭ(Г) 8 . 3,17/0,200 = 126,8г/моль.
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
Ответ: 126,г/моль.
Задача №3
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 . 3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) . В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 3 = 48г.
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7
,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
Ответ: 9г/моль; 79,9г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Ответ: CuCl.
Задача№9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98г/моль.
Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(H2) = 3,36л.
Задача№10
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м 3 ). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль.
Отношение - объём водорода;
Примеры решения задач. Пример 2.1.Рассчитать эквивалент и молярную массу эквивалентов H2S и NaOH в реакциях:
Пример 2.1. Рассчитать эквивалент и молярную массу эквивалентов H2S и NaOH в реакциях:
Решение. Молярная масса эквивалентов кислоты или основания, участвующих в кислотно-основной реакции, рассчитывается по формуле
где М – молярная масса кислоты или основания; n – для кислот – число атомов водорода, замещенных в данной реакции на металл; для оснований – число гидроксильных групп, замещенных в данной реакции на кислотный остаток.
Значение эквивалента и молярной массы эквивалентов вещества зависит от реакции, в которой это вещество участвует.
В реакции H2S + 2NaOH = Na2S + 2H2O (1) оба иона водорода молекулы H2S замещаются на металл и, таким образом, одному иону водорода эквивалентна условная частица ½ H2S. В этом случае
В реакции H2S + NaOH = NaHS + H2O (2) в молекуле H2S на металл замещается только один ион водорода и, следовательно, одному иону эквивалентна реальная частица – молекула H2S. В этом случае
Эквивалент NaOH в реакциях (1) и (2) равен NaOH, так как в обоих случаях на кислотный остаток замещается одна гидроксильная группа. Молярная масса эквивалентов NaOH равна
Таким образом, эквивалент H2S в реакции (1) равен ½ H2S, в реакции (2) −
1 H2S, молярные массы эквивалентов H2S равны соответственно 17 (1) и 34 (2) г/моль; эквивалент NaOH в реакциях (1) и (2) равен NaOH, молярная масса эквивалентов основания составляет 40 г/моль.
Пример 2.2. Рассчитать эквивалент и молярную массу эквивалентов оксидов P2O5 и CaO в реакции P2O5 + 3CaO = Ca3(PO4)2.
Решение. Молярная масса эквивалентов оксида рассчитывается по формуле
где М – молярная масса оксида; n – число катионов соответствующего оксиду основания или число анионов соответствующей оксиду кислоты; |c.o.| – абсолютное значение степени окисления катиона или аниона.
В реакции P2O5 + 3CaO = Ca3(PO4)2 эквивалент P2O5, образующего два трехзарядных аниона (РО4) 3- , равен 1 /6 P2O5, а Мэк (P2O5) = = 23,7 г/моль. Эквивалент СаО, дающего один двухзарядный катион (Са 2+ ), равен ½ СаО, а Мэк (СаО)= = 28 г/моль.
Пример 2.3. Вычислить эквивалент и молярную массу эквивалентов фосфора в соединениях РН3, Р2О3 и Р2О5.
Решение. Чтобы определить молярную массу эквивалентов элемента в соединении, можно воспользоваться следующей формулой:
где МА – молярная масса элемента; |c.o.| – абсолютное значение степени окисления элемента.
Степень окисления фосфора в РН3, Р2О3, Р2О5 соответственно равна –3, +3 и +5. Подставляя эти значения в формулу, находим, что молярная масса эквивалентов фосфора в соединениях РН3 и Р2О3 равна 31/3 = 10,3 г/моль; в Р2О5 – 31/5 = 6,2 г/моль, а эквивалент фосфора в соединениях РН3 и Р2О3 равен 1 /3 Р, в соединении Р2О5 – 1 /5 Р.
Пример 2.4. Рассчитать молярную массу эквивалентов соединений фосфора РН3, Р2О3 и Р2О5.
Решение. Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей:
Пример 2.5. На восстановление 7,09 г оксида металла со степенью окисления +2 требуется 2,24 л водорода при нормальных условиях. Вычислить молярные массы эквивалентов оксида и металла. Чему равна молярная масса металла?
Решение. Задача решается по закону эквивалентов. Так как одно из реагирующих веществ находится в газообразном состоянии, то удобно воспользоваться следующей формулой:
где Vэк (газа) – объем одного моля эквивалентов газа. Для вычисления объема моля эквивалентов газа необходимо знать число молей эквивалентов (υ) в одном моле газа: υ = . Так, М (Н2) = 2 г/моль; Мэк (Н2) = 1 г/моль. Следовательно, в одном моле молекул водорода Н2 содержится υ = 2/1 = 2 моль эквивалентов водорода. Как известно, моль любого газа при нормальных условиях (н.у.) (Т = 273 К, Р = 101,325 кПа) занимает объем 22,4 л. Значит, моль водорода займет объем 22,4 л, а так как в одном моле водорода содержится 2 моль эквивалентов водорода, то объем одного моля эквивалентов водорода равен Vэк (Н2) = 22,4/2 = 11,2 л. Аналогично М (О2) = 32 г/моль, Мэк (О2) = 8 г/моль. В одном моле молекул кислорода О2 содержится υ = 32/8 = 4 моль эквивалентов кислорода. Один моль эквивалентов кислорода при нормальных условиях занимает объем Vэк (О2) = 22,4/4 = 5,6 л.
Подставив в формулу численные значения, находим, что Мэк (оксида) = г/моль.
Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Оксид – это соединение металла с кислородом, поэтому молярная масса эквивалентов оксида представляет собой сумму Мэк (оксида) = Мэк (металла) + Мэк (кислорода). Отсюда Мэк (металла) = Мэк (оксида) − Мэк (кислорода) = 35,45 – 8 = 27,45 г/моль.
Молярная масса эквивалентов элемента (Мэк) связана с атомной массой элемента (МА) соотношением: Мэк (элемента) = , где ½с.о.½ − степень окисления элемента. Отсюда МА = Мэк (металла) ? ½с.о.½ = 27,45×2 = 54,9 г/моль.
Таким образом, Мэк (оксида) = 35,45 г/моль; Мэк (металла) = 27,45 г/моль; МА (металла) = 54,9 г/моль.
Пример 2.6. При взаимодействии кислорода с азотом получено 4 моль эквивалентов оксида азота (IV). Рассчитать объемы газов, вступивших в реакцию при нормальных условиях.
Решение. По закону эквивалентов число молей эквивалентов веществ, вступающих в реакцию и образующихся в результате реакции, равны между собой, т.е. υ (О2) = υ (N2) = υ (NO2). Так как получено 4 моль эквивалентов оксида азота (IV), то, следовательно, в реакцию вступило 4 моль эквивалентов О2 и 4 моль эквивалентов N2.
Азот изменяет степень окисления от 0 (в N2) до +4 (в NО2), и так как в его молекуле 2 атома, то вместе они отдают 8 электронов, поэтому
Мэк (N2) = = 3,5 г/моль. Находим объем, занимаемый молем эквивалентов азота (IV): 28 г/моль N2 – 22,4 л
Так как в реакцию вступило 4 моль эквивалентов N2, то их объем составляет V (N2) = 2,8·4 = 11,2 л. Зная, что моль эквивалентов кислорода при нормальных условиях занимает объем 5,6 л, рассчитываем объем 4 моль эквивалентов О2, вступивших в реакцию: V (O2) = 5,6?4 = 22,4 л.
Итак, в реакцию вступило 11,2 л азота и 22,4 л кислорода.
Пример 2.7. Определить молярную массу эквивалентов металла, если из 48,15 г его оксида получено 88,65 г его нитрата.
Решение. Учитывая, что Мэк (оксида) = Мэк (металла) + Мэк (кислорода), а Мэк (соли) = Мэк (металла) + Мэк (кислотного остатка), подставляем соответствующие данные в закон эквивалентов:
отсюда Мэк (металла) = 56,2 г/моль.
Пример 2.8. Вычислить степень окисления хрома в оксиде, содержащем 68,42 % (масс.) этого металла.
Решение. Приняв массу оксида за 100 %, находим массовую долю кислорода в оксиде: 100 – 68,42 = 31,58 %, т.е. на 68,42 частей массы хрома приходится 31,58 частей массы кислорода, или на 68,42 г хрома приходится 31,58 г кислорода. Зная, что молярная масса эквивалентов кислорода равна 8 г/моль, определим молярную массу эквивалентов хрома в оксиде по закону эквивалентов:
ОСНОВНЫЕ ПОНЯТИЯ
1. Ознакомить студентов с основными химическими законами и единицами массы.
2. С помощью математической обработки подученных студентами экспериментальных данных сделать вывод о названии металла, данного для работы и его положении в периодической таблице Д.И. Менделеева.
ОСНОВНЫЕ ПОНЯТИЯ
Вспомним основные частицы вещества:
Молекула – наименьшая частица вещества, обладающая его химическими свойствами и состоящая из атомов. Атом – наименьшая частица элемента, обладающая его химическими свойствами. Химический элемент можно определить как вид атомов, характеризующийся определенной совокупностью свойств.
Простейшим примером сказанному может служить молекула хлористого водорода ( HCl ). Водород и хлор, вступая в реакцию, теряют свои свойства, характерные для газообразных Н2 и Cl2, поэтому считается, что в состав хлористого водорода входят элементы – водород и хлор.
Масса атомов и молекул выражается в атомных единицах массы (а.е.м.), принятых в 1961 г. За одну атомную единицу массы принимается 1/12 часть массы атома изотопа углерода 12 С. Таким образом, масса атома или молекулы любого вещества представляется относительной величиной, показывающей, во сколько раз масса данного атома (молекулы) тяжелее выбранной атомной единицы массы.
Так, относительная атомная масса цинка (Ar) равна 65.38 а.е.м., относительная молекулярная масса воды (Mr) равна 1,008 ∙ 2 + 15,9994 = 18,0154 а.е.м. и т.д.
Однако при решении задач и в расчетах по уравнениям реакций гораздо чаще пользуются понятием «моль».
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 граммах изотопа углерода 12 C.
Применяя слово «моль», необходимо в каждом случае точно указывать, какие единицы входят в данное вещество. Существует понятия «моль атомов», «моль молекул» и т.д. Масса одного моля взятого вещества называется его молярной массой. Она выражается в г/моль.
Числовое значение молярной массы вещества в г/моль равно относительной молекулярной массе Mr, если вещество состоит из молекул, или относительной атомной массе Ar, если вещество состоит из атомов. Например, молярная масса атомарного кислорода равна ~16 г/моль, молекулярного кислорода ~32 г/моль.
Моль любого вещества содержит совершенно одинаковое количество структурных единиц. Это число называет числом Авогадро, его значение принимают равным 6,02·10 23 .
Часто в химических расчетах используется понятие эквивалента.
Эквивалентом вещества называется такое его количество, которое соединяется без остатка с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Например, в соединениях HCl, H2S и NH3 эквивалент элементов хлора, серы и азота соответственно равен 1 моль, ½ моля и 1/3 моля. Масса одного эквивалента называется его эквивалентной массой или молярной массой эквивалента.Выражается в г/моль.
Так, в приведенных примерах эквивалентные массы хлора, серы и азота легко подсчитать, используя атомные массы этих элементов, они соответственно равны mэ(Cl) = 35,5 г/моль; mэ(S) = 32:2 = 16 г/моль; mэ(N) = 14:3 = 4,7 г/моль. Из разобранных примеров видно, что эквивалентная масса элемента находится из соотношения
Эквивалентная масса или .
Понятие об эквивалентах и эквивалентных массах распространяется также на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества.
1. Эквивалентная масса оксида складывается из значений эквивалентных масс, составляющих оксид элементов.
а) Эквивалентные массы металла и кислорода в оксиде ZnO, соответственно, равны половине молярных масс атомов:
б) Валентность серы в оксиде SO3 равна 6, следовательно
2. Эквивалентная масса кислоты равна её молярной массе, деленной на основность кислоты (число атомов водорода в молекуле кислоты).
а) Молярная масса HNO3 равна 63 г/моль. Кислота одноосновная, следовательно .
б) Молярная масса H3PO4 равна 98 г/моль. Основность равна 3.
3. Эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание.
Молярная масса Mg(OH)2 равна 58 г/моль, валентность цинка 2. .
4. Эквивалентная масса соли равна отношению её молярной массы к произведению валентности металла на число его атомов в молекуле.
а) Молярная масса Na2CO3 равна 106 г/моль. Валентность металла I, число его атомов 2.
5. Эквиваленты одних и тех же сложных веществ и их эквивалентные массы могут иметь различные значения, если их рассматривать не как отдельные вещества, а составные части химических реакций, в которых они участвуют.
| H2CO3 + 2NaOH = Na2CO3 + 2H2O | (1) |
| H2CO3 + NaOH = NaHСO3 + H2O | (2) |
эквивалент H2CO3 и его масса зависит от количества атомов водорода, участвующих в реакции и соответственно равны:
| , – по уравнению (1); | (1) |
| , – по уравнению (2); | (2) |
| Cr(OH)3 + 2HCl = CrOHCl2 + 2H2O; | (3) |
| Cr(OH)3 + 3HCl = CrCl3 + 3H2O; | (4) |
| , – по уравнению (3); | (3) |
т.к. в реакции было замещено только две гидроксидных группы на кислотный остаток.
| , – по уравнению (4); | (4) |
т.к. произошло замещение всех трех гидроксогрупп.
Известно несколько способов определения эквивалента.
I. Прямое или непосредственное определение эквивалента из соединения элементов с водородом или кислородом.
Пример 1. Рассчитать эквивалент железа в его оксиде FeO.
Эквивалент кислорода по определению равен ½ моля атомов, эквивалентная масса кислорода равна 16 : 2 = 8 г/моль. В данном соединении на ½ моля атомов кислорода приходится столько же, т.е. ½ моля атомов железа. Следовательно, эквивалент железа в данном оксиде равен ½ моля, а его эквивалентная масса 56 : 2 = 28 г/моль.
II. Определение эквивалента с помощью закона эквивалентов.
Закон эквивалентов (эквивалентных масс), предложенный в 1803-1814 гг. Дальтоном и Рихтером: Элементы и вещества соединяются друг с другом, а также замещают друг друга, в химических реакциях в строго определенных весовых количествах, прямо пропорциональных их эквивалентам.
Математическая запись закона такова:
где m1 и m2 – массы взаимодействующих элементов или веществ, г;
mЭ1 и mЭ2 – соответственно эквивалентные массы этих веществ, г/моль.
Пример 2. Определить эквивалентную и молярную массы 3-валентного металла, зная, что 0,52 г его при окислении образуют 0,98 г оксида.
Решение. В соответствии с законом эквивалентов
Массу кислорода определим по разности масс оксида и металла
mO = 0,98 – 0,52 = 0,46 г.
Эквивалентная масса кислорода известна, она равна 8 г/моль.
Т.к. валентность металла равна 3, то его молярная масса
Пример 3. Вычислить эквивалентную массу металла, если в его хлориде массовая доля хлора 79,78 %, эквивалентная масса хлора равна 53,45 г/моль.
Решение. Массовая доля w металла в хлориде равна
w = 100 - 79,78 = 20,22 %.
Согласно закону эквивалентов, отношение массы металла и массы хлора в соединении должно быть равно отношению их эквивалентных масс
Пример 4. Определите молярную массу двух валентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла.
Эквивалентная масса сульфата металла равна .
Согласно закону эквивалентов
Т.к. валентность металла равна 2, то его молярная масса равна:
A = 27,5 · 2 = 55 г/моль.
III. Если в химической реакции одно из участвующих веществ находится в газообразном состоянии, то запись закона эквивалентов выражается формулой
где соответственно m(Me) и mэ(Me) – масса металла и его эквивалентная масса, а V и Vэ - объем вступившего в реакцию газа и объем эквивалентной массы этого газа.
Для расчета объемов реагирующих газов необходимо знание Закона Авогадро и его следствий.
Закон Авогадро (1911): В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Следствия из закона Авогадро:
1. Один моль любого газа при нормальных условиях (н.у.) –температура 0 ºС и давление 760 мм.рт.ст. занимает один и тот же объем равный 22,4 литра. Этот объем называют – молярным объемом газа VМ = 22,4 л/моль.
2. Один моль любого газа содержит одно и то же число молекул, а именно NA = 6,02 · 10 23 моль -1 .
3. Относительная плотность одного газа по другому равна отношению их молярных (M) или относительных молекулярных масс
На основании этих следствий можно рассчитать количество вещества
Пример 5. Рассчитать массу 3 л хлора, взятого при н.у.
Решение. Т.к. молярная масса хлора (Cl2) равна 35,5 ∙ 2 = 71 г/моль то из соотношения (IV) легко найти массу искомого объема
Пример 6. Сколько молей и сколько молекул содержится в 2,2 г углекислого газа? Какой объем они занимают при н.у.?
Решение. Т.к. молярная масса углекислого газа (СО2) равна 44 г/моль, то
Найдем объем газа при н.у.
Пример 7. Определите массу молекулы газа, если масса 2 л газа (н.у.) равна 0,357 г.
Решение. Исходя из молярного объема газа определим молярную массу газа
Число молекул в 1 моль любого вещества равно постоянной Авогадро. Следовательно, масса молекул газа (m) равна
Первое следствие из закона Авогадро позволяет рассчитать объемы эквивалентных масс различных газов:
Так, если эквивалентная масса водорода равна 1,008 г/моль, то её объем равен
Подобным образом находится объем эквивалентной массы кислорода, который оказывается равным
Пример 8. При растворении 0,506 г металла в серной кислоте выделилось 100,8 мл водорода, измеренного при н.у. Определить эквивалентную массу металла.
Задачу можно решить двумя способами:
а) прямой подстановкой данных в формулу (II).
б) используя формулу (I), откуда
, где mэ(H) = 1,008 г/ моль.
Для решения задачи в этом случае надо найти m(H2). Согласно следствию из закона Авогадро
Теперь найденное значение m(H2) подставим в формулу (I)
Значения эквивалентных масс позволяют определить атомную массу металлов по формуле:
A = тэ · В, (V)
где В – валентность металла
А – его атомная масса, в г/моль.
Если же валентность металла неизвестна, то атомную массу можно определить через удельную теплоемкость. В данных расчетах используется правило Дюлонга и Пти: Произведение удельной теплоемкости простого твердого вещества на его атомную массу для большинства элементов приблизительно одинаково. Полученная величина имеет среднее значение, равное 26,8 Дж/моль·К (6,3 кал/моль·град). Она носит название атомной теплоемкости металлов (СА) и представляет собой количество тепла, необходимого для нагревания 1 моля атомов металла на один Кельвин. Математически это правило имеет вид
| СА = А · С ~ 26,8 Дж/моль·К | (VI) |
где С – удельная теплоемкость металла, Дж/г·К;
А – атомная масса взятого металла, г/моль.
Под удельной теплоемкостью понимается то количество тепла, которое необходимо затратить для нагревания 1 г вещества на 1 Кельвин.
Пример 9. При окислении 0,16 г металла образовалось 0,223 г оксида. Вычислить точную атомную массу металла, зная, что удельная теплоемкость 0,635 Дж/г·К.
Решение. По правилу Дюлонга и Пти найдем приближенное значение атомной массы данного металла
По формуле (1) найдем эквивалентную массу этого металла. Масса кислорода 0,223 г. – 0,16 г. = 0,063 г.
Зная приближенную атомную массу металла и его эквивалентнуюмассу, можно найти валентность этого металла.
Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
Одним из основных законов химии является закон эквивалентов, открытый в конце 18 века: массы элементов, соединяющихся друг с другом, пропорциональны их эквивалентам:
где mA, mВ – массы взаимодействующих веществ А и В;
ЭА и ЭВ – эквиваленты этих веществ.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях ионного обмена равноценна одному атому или одному иону водорода, а в окислительно-восстановительных реакциях одному электрону.
Массу одного моля эквивалента элемента называют молярной массой эквивалента MЭ(X). Значение эквивалента веществ зависит от того, в какой конкретной реакции участвует это вещество.
Молярная масса эквивалента химического элемента (MЭ(X)), а также простых или сложных веществ рассчитывается по формуле
где M(X) – молярная масса; вал – суммарная валентность.
Для простых веществ суммарная валентность определяется произведением валентности атома химического элемента и числа атомов. Так, молярная масса эквивалента алюминия составляет MЭ(AI) = 27/3 = 9г моль -1 . Молярные массы эквивалента кислорода и водорода следует запомнить, они равны соответственно MЭ(О) = 16/2=8г моль -1 , МЭ(Н) = 1/1 = 1 г моль -1 .
Молярные массы эквивалента сложных веществ вычисляются по их химическим формулам с учетом происходящих химических реакций.
К сложным веществам относятся оксиды, гидроксиды, соли.
Суммарная валентность оксидов равна произведению валентности кислорода (2) на количество атомов кислорода в молекуле. Суммарная валентность гидроксидов определяется их кислотностью, которая равняется числу замещенных гидроксильных групп. Суммарная валентность кислот равняется основности данных соединений, которая определятся числом замещенных атомов водорода. Суммарная валентность соли равняется произведению валентности катиона и количества катионов в молекуле, или валентности аниона и количества анионов в молекуле.
Молярная масса эквивалентов сложных веществ может быть определена как сумма молярных масс эквивалентов элементов или условных частиц, образующих данное вещество.
Мэ (оксиды) = Мэ (О) + Мэ (элемента) = 8 + Мэ (элемента), т.к. Мэ кислорода величина постоянная, равна 8г моль -1 .
Мэ (кислота) = Мэ (Н) + Мэ (кислотного остатка) = 1 + Мэ (кислотного остатка), т.к. Мэ водорода величина постоянная, 1г моль -1
Мэ (гидроксиды) = Мэ (OH - ) + Мэ (металла) = 17 + Мэ (металла), т.к. Мэ “OH” групп величина постоянная, равна 17г моль -1 .
Мэ (соли) = Мэ (катиона) + Мэ (кислотного остатка).
Пример 1. Выразите в молях: а) 6,0210 21 молекул CO2; б) 1,2010 24 атомов кислорода; в) 2,0010 23 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02 10 23 ). Отсюда:
а) 6,0210 21 , т.е. 0,01 моль; б) 1,20 10 24 , т.е. 2 моль; в) 2,00 10 23 м, т.е. 1/3 моль.
Так как молекулярные массы СО2 и H2O и атомная масса кислорода соответственно равны 44; 18 и 16 а.е.м., то их мольные (молярные) массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. Определите эквивалент (Э) и эквивалентную массу МЭ (Х) азота, серы и хлора в соединениях NHз ,H2S и HCl.
Решение. Масса вещества и количество вещества – понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества – в молях.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота,1/2 моль серы и 1 моль хлора. Отсюда Э(N) = 1/3 моль, Э(S) = 1/2 моль, Э(Cl) = 1 моль. Исходя из мольных масс этих элементов определяем их эквивалентные массы:
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла? Нормальные условия по Международной системе единиц (СИ): давление 1,013 10 5 Па (760 мм рт. ст. = 1 атм), температура 273 К или 0 0 С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объемам):
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см 3 , л, м 3 ).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объёмом этого вещества. Мольный объём любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объём водорода VmЭ (Н2) = 22,4/2 = 11,2 л, а эквивалентный объём кислорода равен 5,6 л.
В формуле (2) отношение mН2/mЭ(Н2) заменяем равным ему отношением VН2/VmЭ(Н2), где VН2 - объём водорода, VmЭ(MeO) - эквивалентный объём водорода:
Из уравнения (3) находим эквивалентную массу оксида металла mЭ (МеО):
Согласно закону эквивалентов mЭ (МеО) = mЭ (Ме) + mЭ (О2), отсюда
Мольная масса металла определяется из соотношения mЭ = А/В ,
где mЭ - эквивалентная масса, А - мольная масса металла, В- стехиометрическая валентность элемента; А = mЭ В = 27,452 = 54,9 г/моль. Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 4. Вычислите эквиваленты и эквивалентные массы H2SО4 и Аl(OH)3 в реакциях, выраженных уравнениями:
Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основность) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп).
Пример 5. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см 3 кислорода (н.у.)?
Решение. Так как молярная масса О2 (32 г/моль) при н.у. занимает объем 22,4 м, то объем молярной массы эквивалента кислорода (8 г/моль) будет равен 22,4/4 = 5,6 = 5600 см 3 . По закон эквивалентов
,
откуда тМе = 12,16 ? 310/5600 = 0,673 г.
Пример 6. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла (тЭ(Ме) ).
Решение. При решении задачи следует иметь в виду:
а) молярная масса эквивалента гидроксида равна сумме молярных масс эквивалентов металла и гидроксильной группы;
б) молярная масса эквивалента соли равна сумме молярных масс эквивалентов металла и кислотного остатка. Вообще молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3:
Пример 7. В какой массе Са(ОН)2 содержится столько же эквивалентных масс, сколько в 312 г А1(ОН)3?
Решение. Молярная масса эквивалента А1(ОН)3 равна 1/3 его молярной массы, т.е. 78/3 = 26 г/моль. Следовательно в 312 г А1(ОН)3 содержится 312/26 =12 эквивалентов. Молярная масса эквивалента Са(ОН)2 равна ½ его молярной массы, т.е. 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль? 12 моль = 444 г.
Пример 8. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Молярная масса H2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,0210 23 ) = 1,6310 -22 г.
Молярная масса

Для решения многих задач по химии нужно знать количество молекул или других частиц, необходимое для реакции. Однако оперировать столь малыми числами неудобно, поэтому ученые ввели новые величины. В этой статье вы познакомитесь с такими понятиями, как моль, количество вещества, молярная масса в химии.
О чем эта статья:
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 10 23 . Постоянная Авогадро обозначается NA, а измеряется в моль -1 .
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 10 23 моль -1 .
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.

Что такое молярная масса
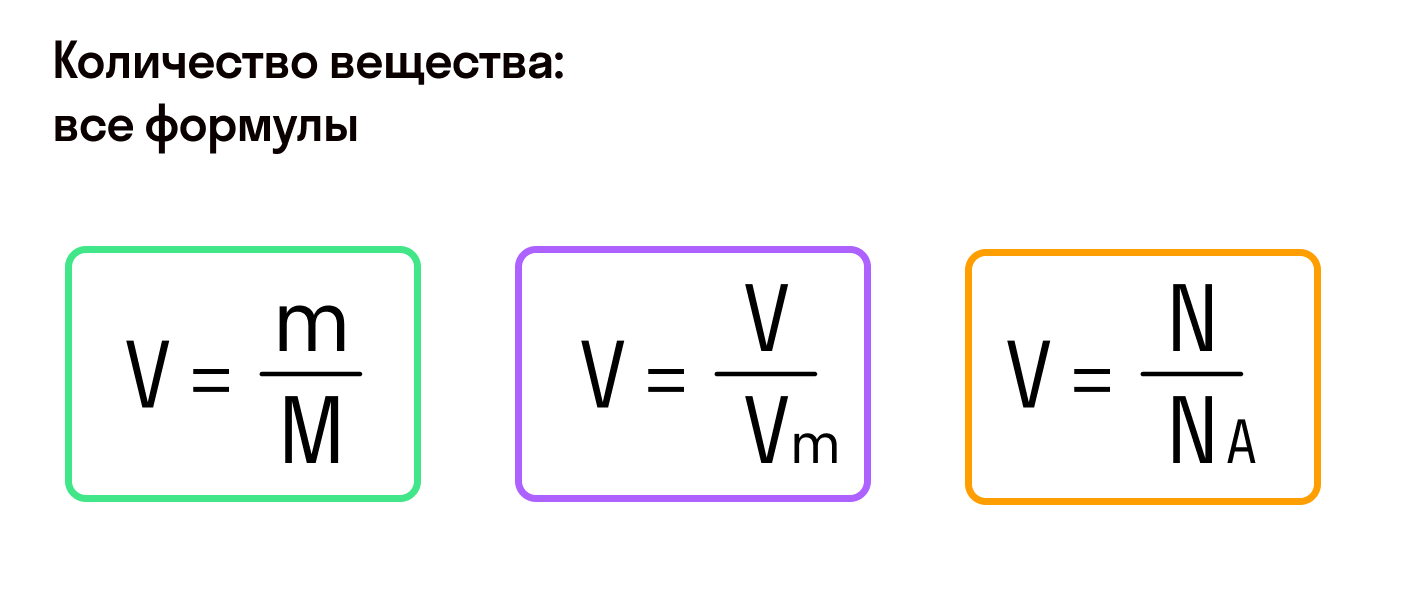
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
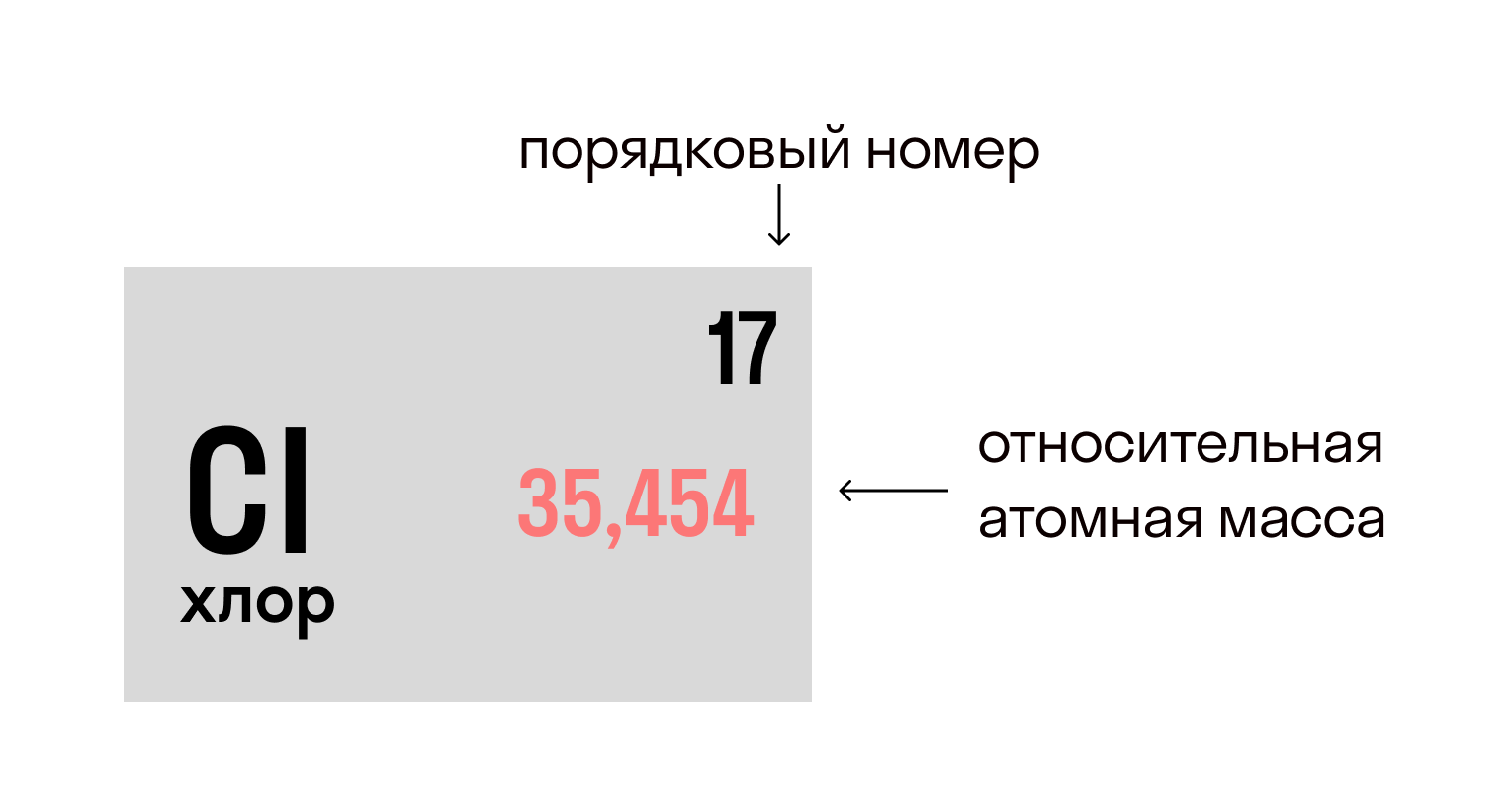
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Подставим значение молярной массы в формулу:
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 10 23 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
Ответ: угарный газ в 14 раз плотнее водорода.
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 10 23 молекул. Чему равна молярная масса данного вещества?
N(х) = 12,04 · 10 23 .
Найдем количество вещества моль.
Подставим количество вещества в формулу :
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 10 23 атомов кислорода. Какова масса этой порции?
N(O) = 8,356 · 10 23 .
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
Зная количество молекул, рассчитаем количество вещества:
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 10 23 молекул? Назовите это вещество.
N(x) = 15,05 · 10 23 .
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
Исходя из этого, рассчитаем молярную массу:
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Нам требуется вычислить относительную плотность сероводорода по водороду:
Читайте также:
