Алюминий металл или неметалл
Обновлено: 20.09.2024
АЛЮМИ́НИЙ -я; м. [от лат. alumen (aluminis) - квасцы]. Химический элемент (Al), серебристо-белый лёгкий ковкий металл с высокой электропроводностью (применяемый в авиации, электротехнике, строительстве, быту и т.п.). Сульфат алюминия. Сплавы алюминия.
(лат. Aluminium, от alumen — квасцы), химический элемент III группы периодической системы. Серебристо-белый металл, лёгкий (2,7 г/см 3 ), пластичный, с высокой электропроводностью, tпл 660ºC. Химически активен (на воздухе покрывается защитной оксидной плёнкой). По распространённости в природе занимает 4-е место среди элементов и 1-е среди металлов (8,8% от массы земной коры). Известно несколько сотен минералов алюминия (алюмосиликаты, бокситы, алуниты и др.). Получают электролизом глинозёма Al2O3 в расплаве криолита Na3AlF6 при 960ºC. Применяют в авиации, строительстве (конструкционный материал, преимущественно в виде сплавов с другими металлами), электротехнике (заменитель меди при изготовлении кабелей и др.), пищевой промышленности (фольга), металлургии (легирующая добавка), алюминотермии и др.АЛЮМИ́НИЙ (лат. Aluminium), Al (читается «алюминий»), химический элемент с атомным номером 13, атомная масса 26,98154. Природный алюминий состоит из одного нуклида 27 Al. Расположен в третьем периоде в группе IIIA периодической системы элементов Менделеева. Конфигурация внешнего электронного слоя 3s 2 p 1 . Практически во всех соединениях степень окисления алюминия +3 (валентность III).
Радиус нейтрального атома алюминия 0,143 нм, радиус иона Al 3+ 0,057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5,984, 18,828, 28,44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1,5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
История открытия
Латинское aluminium происходит от латинского же alumen, означающего квасцы (см. КВАСЦЫ) (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия (см. АЛЮМИНИЯ ОКСИД) ) сделал еще в 1754 немецкий химик А. Маргграф (см. МАРГГРАФ Андреас Сигизмунд) . Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед (см. ЭРСТЕД Ханс Кристиан) . Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.
Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль (см. СЕНТ-КЛЕР ДЕВИЛЬ Анри Этьен) в 1854 предложил использовать для получения алюминия металлический натрий (см. НАТРИЙ) , и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (см. ЭРУ Поль Луи Туссен) (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.
Нахождение в природе
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов (см. АЛЮМОСИЛИКАТЫ) , и горных пород. Соединения алюминия содержат граниты (см. ГРАНИТ) , базальты (см. БАЗАЛЬТ) , глины (см. ГЛИНА) , полевые шпаты (см. ПОЛЕВЫЕ ШПАТЫ) и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов (см. БОКСИТЫ) — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты (см. АЛУНИТ) и нефелины (см. НЕФЕЛИН) .
В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски.
Промышленное получение
При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается.
Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит (см. КРИОЛИТ) Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий:
2Al2О3 = 4Al + 3О2.
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
При электролизе получают металл с содержанием алюминия около 99,7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99,999% и более.
Физические и химические свойства
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2,6989 г/см 3 . Температурный коэффициент линейного расширения алюминия около 2,5·10 -5 К -1 . Стандартный электродный потенциал Al 3+ /Al –1,663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl3 + 3H2,
3Н2SO4 + 2Al = Al2(SO4)3 + 3H2.
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Затем протекают реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2,
NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно:
2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты (см. АЛЮМИНАТЫ) : Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число (см. КООРДИНАЦИОННОЕ ЧИСЛО) 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2].
При нагревании алюминий реагирует с галогенами:
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3.
Интересно, что реакция между порошками алюминия и иода (см. ИОД) начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:
2Al + 3I2 = 2AlI3.
Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al2S3,
который легко разлагается водой:
Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S.
С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений (см. АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ) , можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель.
В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3.
Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже
3СаО + 2Al = Al2О3 + 3Са.
Такой способ получения металлов называют алюминотермией (см. АЛЮМИНОТЕРМИЯ) .
Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yH2O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3.
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4,
или за счет добавления соды к раствору соли алюминия:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3Ї + 6NaCl + 3CO2,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl3 + 3NH3·H2O = Al(OH)3Ї + 3H2O + 3NH4Cl.
Применение
По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65,5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия.
Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (см. ДУРАЛЮМИН) (94% Al, 4% Cu, по 0,5% Mg, Mn, Fe и Si), силумина (85—90% Al, 10—14% Si, 0,1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др.
Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ.
Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию.
При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно.
Алюминий в организме
В организм человека алюминий ежедневно поступает с пищей (около 2—3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
Энциклопедический словарь . 2009 .
Полезное
Смотреть что такое "алюминий" в других словарях:
Алюминий — или глиний (хим. обозначение Al, атомный вес 27, 04) металл, ненайденный до сих пор в природе в свободном состоянии; зато ввиде соединений, а именно силикатов, элемент этот повсеместно и широкораспространен; он входит в состав массы горных пород … Энциклопедия Брокгауза и Ефрона
АЛЮМИНИЙ — (глиний) хим. зн. AL; ат. в. = 27,12; уд. в. = 2,6; т. пл. около 700°. Серебристо белый, мягкий, звонкий металл; является в соединении с кремневой кислотой главной составной частью глин, полевого шпата, слюд; встречается во всех почвах. Идет на… … Словарь иностранных слов русского языка
АЛЮМИНИЙ — (символ Аl), металл серебристо белого цвета, элемент третьей группы периодической таблицы. Впервые в чистом виде был получен в 1827 г. Наиболее распространенный металл в коре земного шара; главным источником его является руда боксит. Процесс… … Научно-технический энциклопедический словарь
АЛЮМИНИЙ — АЛЮМИНИЙ, Aluminium (хим. знак А1, ат. вес 27,1), самый распространенный на поверхности земли металл и, после О и кремния, важнейшая составная часть земной коры. А. встречается в природе, по преимуществу, в виде солей кремнекислоты (силикатов);… … Большая медицинская энциклопедия
Алюминий — представляет собой голубовато белый металл, отличающийся особой легкостью. Он очень пластичен, легко поддается прокатке, волочению, ковке, штамповке, а также литью и т.д. Как и другие мягкие металлы, алюминий также очень хорошо поддается… … Официальная терминология
Алюминий — (Aluminium), Al, химический элемент III группы периодической системы, атомный номер 13, атомная масса 26,98154; легкий металл, tпл660 °С. Содержание в земной коре 8,8% по массе. Алюминий и его сплавы используют как конструкционные материалы в… … Иллюстрированный энциклопедический словарь
АЛЮМИНИЙ — АЛЮМИНИЙ, алюмний муж., хим. щелочной металл глиний, основа глинозема, глины; также, как основа ржавчины, железо; а яри медь. Алюминит муж. ископаемое, похожее на квасцы, водный сернокислый глинозем. Алюнит муж. ископаемое, весьма близкое к… … Толковый словарь Даля
алюминий — (серебристый, легкий, крылатый) металл Словарь русских синонимов. алюминий сущ., кол во синонимов: 8 • глиний (2) • … Словарь синонимов
АЛЮМИНИЙ — (лат. Aluminium от alumen квасцы), Al, химический элемент III группы периодической системы, атомный номер 13, атомная масса 26,98154. Серебристо белый металл, легкий (2,7 г/см³), пластичный, с высокой электропроводностью, tпл 660 .С.… … Большой Энциклопедический словарь
Алюминий — Al (от лат. alumen название квасцов, применявшихся в древности как протрава при крашении и дублении * a. aluminium; н. Aluminium; ф. aluminium; и. aluminio), хим. элемент III группы периодич. системы Mенделеева, ат. н. 13, ат. м. 26,9815 … Геологическая энциклопедия
АЛЮМИНИЙ — АЛЮМИНИЙ, алюминия, мн. нет, муж. (от лат. alumen квасцы). Серебристо белый ковкий легкий металл. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
АЛЮМИНИЙ
АЛЮМИНИЙ
Al
(от лат. aluminium), химический элемент IIIA подгруппы периодической системы элементов (B, Al, Ga, In, Tl), наиболее распространенный металл в земной коре, встречается в большом количестве минералов, например в глине и граните. Основным сырьем для производства алюминия служат бокситы - руда, представляющая собой в основном гидратированный оксид алюминия Al2O3Ч2H2O. Мировым лидером по производству алюминия являются США, затем Россия, Канада и Австралия. Алюминий наиболее известен как сырье для производства сплавов, используемых для изготовления пищевых емкостей (бидонов, баллонов, банок и т.п.), легкой кухонной посуды и другой домашней утвари. Неочищенный алюминий был впервые выделен Х.Эрстедом в 1825, хотя еще в 1807 Х.Дэви обнаружил неизвестный металл при обработке глины серной кислотой. Дэви не смог выделить металл из соединений, но назвал его алюминум (от лат. alumen - квасцы), а его оксид - глиноземом (alimina); вскоре это название металла по аналогии с названиями других металлов изменили на "алюминий", что стало общепринятым.
Свойства. Замечательным свойством алюминия является его легкость; плотность алюминия примерно в три раза меньше, чем у стали, меди или цинка. Чистый алюминий - мягкий металл, но образует сплавы с другими элементами, что обеспечивает большой диапазон полезных свойств. В ряду величин теплопроводности и электрической проводимости алюминий стоит после серебра и меди. Алюминий отличается высокой реакционной способностью, поэтому он не встречается в природе в свободном состоянии. Металлический алюминий быстро растворяется в соляной кислоте с образованием хлорида AlCl3, медленнее - в серной с образованием сульфата Al2(SO4)3, но с азотной кислотой реагирует только в присутствии солей ртути. В реакции со щелочами он образует алюминаты, например, с NaOH образует NaAlO2. Алюминий проявляет амфотерные свойства, так как он реагирует и с кислотами, и со щелочами. На воздухе алюминий быстро покрывается прочной защитной пленкой оксида Al2O3, предохраняющей его от дальнейшего окисления. Поэтому алюминий стабилен на воздухе и в присутствии влаги даже при умеренном нагревании. Если защитная пленка оксида нарушена, то при нагревании на воздухе или в кислороде он сгорает ярким белым пламенем. При нагревании алюминий активно реагирует с галогенами, серой, углеродом и азотом. Расплавленный алюминий реагирует с водой со взрывом. СВОЙСТВА АЛЮМИНИЯ
Атомный номер 13 Атомная масса 26,9815 Изотопы
Температура плавления, ° С 660 Температура кипения, ° С 2467 Плотность, г/см3 2,7 Твердость (по Моосу) 2,0-2,9 Содержание в земной коре, % (масс.) 8,13 Степени окисления +3
Применение. С давних времен квасцы применяли в медицине как вяжущее средство, в крашении для протравы, и для дубления кожи. Квасцами часто называют смешанные сульфаты одно- и трехвалентного металлов, например алюминия и калия (минерал сольфатерит). Римский ученый Плиний Старший (1 в. н.э.) в своей Естественной истории упоминает о квасцах как о солях, свойства которых изучали алхимики. Впервые для дубления кожи и в медицинских целях квасцы применили египтяне; они, а также лидийцы, финикийцы и иудеи, знали, что некоторые краски, например индиго и кошениль, лучше сохраняются, если их смешивать или пропитывать квасцами. Кристаллический оксид алюминия, встречающийся в природе под названием корунд, используется как абразив, благодаря высокой твердости. Рубин и сапфир - разновидности корунда, окрашенные примесями, являются драгоценными камнями.
Применение металлического алюминия. Алюминий - один из наиболее легких конструкционных металлов (см. табл.). Сплавы, получаемые из алюминия после термообработки, наряду с низкой плотностью отличаются высокой прочностью и другими важными механическими свойствами, что делает алюминий незаменимым для изготовления деталей транспортных средств (поршни и картеры, блоки и головки цилиндров авиационных и автомобильных двигателей, подшипники, силовой набор и обшивка фюзеляжей и пр.). Алюминий легко подвергается волочению и вытяжке, что используется в производстве пищевых емкостей. Удельная электропроводность алюминия составляет ок. 61% электрической проводимости меди, но плотность алюминия в три раза меньше. Сочетание хорошей проводимости с высокой коррозионной стойкостью на воздухе расширяет возможности использования алюминиевых кабелей, часто упрочняемых сталью, для высоковольтных электропередач. Алюминий отличается также и высокой теплопроводностью, что используется в двигателях, системах охлаждения и других устройствах. Металл легко полируется механически и электролитически, поэтому его применяют также для отражателей телескопов и аналогичных целей. Алюминий широко используется как упаковочный материал и имеет максимальный среди других упаковочных материалов коэффициент извлечения при вторичной переработке. Рекуперация алюминиевого вторсырья позволяет экономить энергию, так как ее расход в этом случае меньше, чем при производстве алюминия из руды. В 1981 доля рекуперированного алюминия в производстве пищевых емкостей составляла 53,2%, а к 1991 достигла 62,4% и продолжает расти. Алюминий отличается высокой коррозионной стойкостью благодаря образованию на его поверхности оксидной пленки и поэтому используется как кровельный материал, обшивка, а также в рефлекторах дневного и ИК-света. Коррозионную стойкость его можно еще повысить методом электролитического анодного окисления, известного как анодирование, в результате чего увеличиваются толщина и сцепление оксидной пленки. Анодированная поверхность легко окрашивается, такой способ часто применяют для архитектурных панелей
(см. также КОРРОЗИЯ МЕТАЛЛОВ).
Коррозионная стойкость алюминия в сочетании с красивым внешним видом обеспечивает его широкое применение в холодильной технике. Алюминий - сильный восстановитель, и его используют для выделения менее активных металлов, а также в качестве антиоксиданта в производстве стали и взрывчатых веществ. Алюминиевый порошок применяют в отделочных работах. Алюминиевая краска устойчива к действию промышленных выбросов и выхлопных газов, поэтому широко применяется как защитное покрытие на фасадных частях металлоконструкций, нефтяных танков, в железнодорожном оборудовании и других конструкциях. Алюминиевая фольга - блестящий изолирующий материал, используемый для упаковки пищевых продуктов и для заворачивания их при кулинарной обработке, как декоративное покрытие книг, буквенных знаков, а также в производстве электроконденсаторов. Алюминиевый порошок применяется в порошковой металлургии для изготовления точных деталей, а также служит добавкой в твердых топливах ракетных двигателей. Термитная смесь широко используется как сварочный материал для ремонта толстостенных конструкций, например для сварки стальных рельс
(см. также ПОРОШКОВАЯ МЕТАЛЛУРГИЯ).
Сплавы. Чистый алюминий, мягкий и пластичный, малопригоден для прямого технического применения. Для получения широкого спектра легких алюминиевых сплавов применяется процесс Холла - Эру (см. также АЛЮМИНИЕВАЯ ПРОМЫШЛЕННОСТЬ). Нужды воздухоплавания во времена Первой мировой войны способствовали интенсивному развитию технологии алюминиевых сплавов. Сегодня развивается область специальных сплавов с помощью различных технологий. Из некоторых алюминиевых сплавов получают листовой прокат и профиль, из других тянут пруток, трубы, изготовляют брус с заданным углом, сложные секции и заготовки для обработки давлением. Многие сплавы можно прессовать, вытягивать, волочить и штамповать при комнатной температуре, другие обрабатывают только при повышенной температуре (см. также СПЛАВЫ).
Термообработка. Наиболее важным в технологии сплавов алюминия было открытие А.Вильма в 1911 того, что у некоторых сплавов улучшаются механические свойства в результате специальной термообработки, известной как старение. Впервые это было установлено для сплавов с медью и магнием, а затем и для всех сплавов. Старение проводят в две стадии; на первой сплав нагревают до температуры несколько ниже температуры плавления алюминия, при этом такие компоненты, как медь, образуют твердый раствор. При быстрой закалке компоненты сплава остаются в твердом растворе. На второй стадии при сравнительно низком нагреве растворенные компоненты сплава выделяются в виде чрезвычайно мелких частиц в алюминиевой матрице, улучшая механические свойства сплава. Но не все эффекты увеличения прочности являются следствием термообработки; некоторые из них объясняются тем, что компоненты сплава образуют твердые растворы или интерметаллические соединения.
См. также МЕТАЛЛОВ ТЕРМИЧЕСКАЯ ОБРАБОТКА.
Литье и обработка давлением. Отливка в землю (точнее, в глинисто-песчаные формы) используется для изготовления массивных деталей типа блока цилиндров двигателей, а для массового производства мелких деталей применяется литье в стандартные формы, в том числе и литье под давлением. Широко используются формы для отливок, сделанные из керамики, стали или чугуна (литье в постоянную форму, или кокильное литье). Обычный литьевой сплав может содержать до 8% Cu или до 13% Si. Наиболее распространенные алюминиевые литьевые сплавы содержат добавки Mg, Ni, Fe, Mn или Zn. Низкая температура плавления алюминия и его хорошие литьевые свойства способствуют широкому применению алюминиевого литья.
См. также МЕТАЛЛОВ ЛИТЬЕ. Кроме того, используют алюминиевые заготовки, которые приобретают превосходные качества после термообработки и обработки давлением. Ранее широко применялся дюраль - сплав алюминия с 4% меди, предварительно подвергнутый тепловой и механической обработке. Теперь дюрали - это широкий набор высокопрочных алюминиевых сплавов, содержащих кроме меди также марганец, магний, кремний и др. Эти сплавы имеют прочность на разрыв до 414 МПа (42,2 кг/мм2), близкую к прочности низкоуглеродистой стали. Более современный сплав, содержащий цинк, при комнатной температуре имеет прочность на разрыв до 690 МПа (70,3 кг/мм2). Эти сплавы используются в производстве деталей самолетов и могут заменять некоторые старые медьсодержащие сплавы.
Сплавы горячей и холодной обработки. Алюминий и его сплавы можно подвергать холодной и горячей обработке. При горячей обработке происходит разрушение структуры слитка и превращение ее в однородную мелкозернистую структуру с улучшенными свойствами. Горячая формовка и штамповка позволяют изготавливать тонкие заготовки, которые невозможно получать при холодной обработке. Таким способом получают пруток, проволоку, катанку, лист и другой специальный профиль. Холодная обработка производится на конечной стадии для получения в основном листа, прутка, проволоки и труб. При холодной обработке увеличивается прочность и твердость изделия. В общем, горячая обработка используется для первичной обработки слитка, а холодная имеет преимущество на последней стадии обработки.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Беляев А.И. Металлургия легких металлов. М., 1970 Промышленные алюминиевые сплавы. М., 1984
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
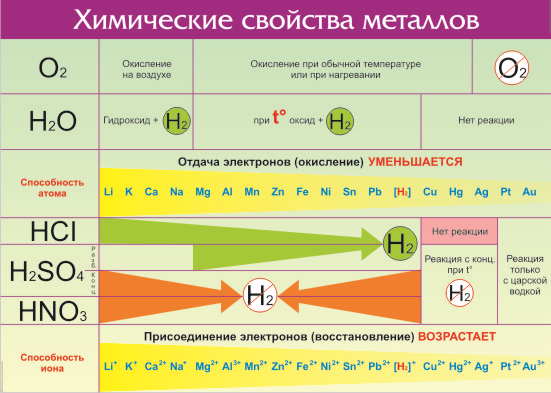
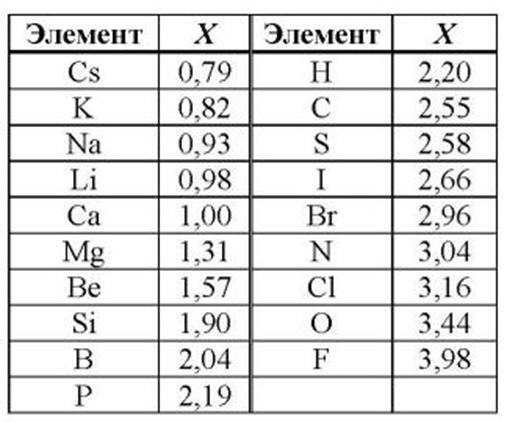
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Алюминий это металл или неметалл

Алюминий это металл или неметалл
Один из самых распространенных в строительстве и технике металлов — алюминий. Он используется не только в чистом виде, но и в составе различных сплавов. В земной коре он тоже достаточно широко распространен, занимая почетное третье место, отставая только от кремния и кислорода. Если отдельно взвесить все компоненты, составляющие земную кору, то на алюминий придется 8% от общей массы.
Найти алюминий в периодической системе элементов можно в главной подгруппе III группы, или по новой классификации — в 13 группе. Кто знаком с основами построения таблицы, то безошибочно определит, что этот элемент — металл. В чистом виде найти алюминий не получится, он находится в виде соединений с другими элементами — полевой шпат, квасцы, бокситы, слюда, корунд. Даже в рубинах и сапфирах есть атомы алюминия.
Производится алюминий в промышленных масштабах из бокситов, сначала получают оксид алюминия, сильно нагревая сырье, затем подвергают расплав гидролизу. На катоде оседает металл, на аноде выделяется кислород в виде газа. Фильтрацией или другим способом чистый алюминий получить не удается.
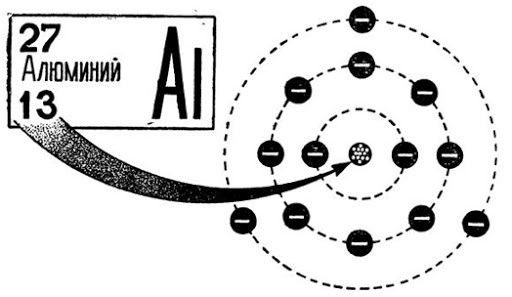
Как устроен атом алюминия
В периодической системе алюминию присвоен 13 номер. В ядре элемента находится 13 нейтронов и 14 протонов. Электронная конфигурация элемента имеет вид 1s 2 2s 2 2p 6 3s 2 3p 1 , а конфигурация электронного распределения — +13Al)2)8)3. Три электрона из последней орбиты легко отделяются, что определяет высокий уровень окисления +3.
В естественном состоянии чистый алюминий существовать не может, поверхность слитка или изделия сразу же покрывается пленкой окислов, образующих герметичную оболочку. Это объясняет, почему алюминий не реагирует с водой и не поддается коррозии.
Физические и химические свойства алюминия
Если рассматривать физические свойства металла, то алюминий обладает небольшой массой, пластичен и хорошо проводит электричество. В нормальных условиях металл мгновенно покрывается защитной пленкой и не вступает в реакцию ни с водой, ни с кислотами. Это определяет популярность алюминиевой тары для транспортировки этих химических веществ. Кристаллическая структура определяет высокую пластичность металла.
Оксидная пленка снимается солями аммония, горячими щелочами и сплавами ртути, после чего металл вступает в реакцию со многими веществами, в частности с галогенами при комнатной температуре, а при нагревании — с фосфором, серой, азотом, углеродом. С водородом в реакцию металл не вступает. Степень окисления алюминия в соединениях всегда +3, в элементарном состоянии — 0.
Применение алюминия
Популярность металла во многом определена еще одним свойством, он не намагничивается. Это позволяет использовать его для изготовления корпусов различных машин, приборов, проводов. Отличная электропроводимость делает алюминий идеальным материалом для производства кабелей.
Алюминий плавиться при температуре 658 0 С, в расплаве легко вступает в реакцию с другими элементами, меняя свою структуру и свойства. Сплавы на основе алюминия обладают таким же небольшим весом, но значительно тверже, легче в обработке и долговечнее, чем чистый металл.
Одна из форм использования элемента в технике и быту — алюминиевая пудра. Это измельченный до мелкодисперсного состояния чистый алюминий, смешанный с 3 – 3,5 % жирных веществ. Частицы металла имеют чешуйчатую форму, при использовании пудры в качестве краски, они ложатся плоской стороной на поверхность, создают прочную антикоррозионную защиту и придают изделию декоративный вид.
Кроме чистого алюминия в порошке могут находиться железо, кремний, медь в количестве 0,01 – 0,5%. Это просто примеси, которые не вступают с алюминием в реакцию и не оказывают влияния на свойства пудры. Мелкодисперсный металл также используется при производстве взрывчатки, смесей для фейерверков, газообразующих компонентов легких бетонов.
Алюминаты
В природе часто встречаются соли ортоалюминиевой H3 AlO3 и металюминиевой кислот HAlO2. Это различные вещества, в которых алюминий полностью потерял свои металлические свойства и приобрел новые. Так алюминат натрия NaAlO2 используется в промышленности как протравочный реактив, другие соединения, как добавки для бетонов и растворов, ускоряющее отвердевание и повышающие пластичность. Металлические свойства алюминия в этих соединениях никак не проявляются. Степень окисления алюминия в метаалюминиевой кислоте и солях такой же, как и в оксидах +3.
В природе алюминаты находятся в виде минералов, не зная их химических формул сложно сказать, что в их составе находится один из самых распространенных металлов на Земле. Это минералы шпинель, ганит, герценит, хризоберилл. Сама по себе металюминиевая кислота неустойчива, а вот соли вполне самостоятельные твердые вещества с хорошо выраженными свойствами.
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.

Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.

Природные соединения
- Al2O3 - корунд
- 3BeO*Al2O3*6SiO2 - берилл (аквамарин - примесь Fe и изумруд - примесь Cr2O3)
- Al2O3*Cr2O3 - красный рубин
- Al2O3 с примесью Fe +2 /Fe +3 /Ti
- Al2O3*H2O - боксит

Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом - методом электролиза их оксидов и солей.
Химические свойства
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)

Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι - двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде - выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется - вместо них образуются (в рамках ЕГЭ) средние соли - алюминаты (академически - сложные окиселы):
При комнатной температуре не идет из-за образования оксидной пленки - Al2O3 - на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) - реакция идет.

Алюминотермия (лат. Aluminium + греч. therme - тепло) - способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.

Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом - на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)

Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок - гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание - Li3[Al(OH)6] - гексагидроксоалюминат лития)

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
