Анод растворяется на катоде выделяется металл и водород
Обновлено: 02.07.2024
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
На аноде окисляются хлорид-ионы до молекулярного хлора:
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Электролиз расплавов и растворов

Электролиз расплавов и растворов встречается в заданиях на ЕГЭ, а значит, если вы планируете сдавать экзамен по химии, эту тему нужно знать на отлично. Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:

Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
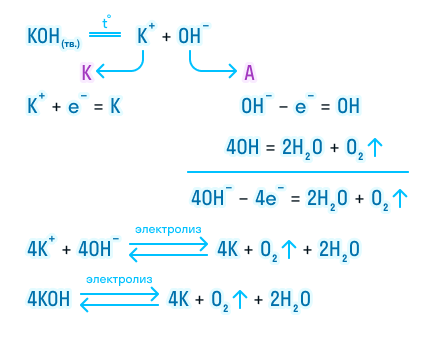
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH - как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:

Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
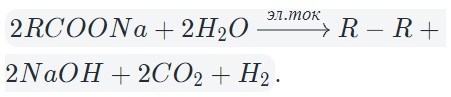
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Электролиз

Электролизом называется окислительно-восстанови-тельный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. Химические реакции протекают на электродах за счет электрической энергии. При электролизе катод является восстановителем, так как он отдает электроны, а анод — окислителем, так как он принимает электроны от анионов.
Например, если в раствор хлорида меди опустить электроды и пропустить постоянный электрический ток, то ионы меди будут двигаться к катоду, а ионы хлора — к аноду. На катоде происходит процесс восстановления: Cu2f + 2ё « Си, а на аноде — окисления: 2СГ - 2ё- С12. В итоге на катоде будет выделяться медь, а на аноде — хлор. Восстановительное и окислительное действие электрического тока во много раз сильнее химических восстановителей и окислителей.
Ни один химический окислитель не может отнять у иона фтора его электрон. Окислить ион фтора удалось лишь при электролизе расплава смеси безводного жидкого фтороводорода с фторидом калия. На угольном аноде выделяется фтор: 2F" - 2ё = F2, а на никелевом катоде — водород: 2Н+ + 2ё = Н2. Различают электролиз расплавов и растворов электролитов. Процессы в расплавленных электролитах — наи- более простой случай электролиза.
Так, в расплаве хлорида натрия содержатся ионы Na+ и С Г. При пропускании через него электрического тока ионы Na+ у катода присоединяют электроны и восстанавливаются до атомов натрия, ионы хлора СГу анода отдают электроны и окисляются до атомов хлора, которые затем образуют молекулы. Пример 1 Схема электролиза расплава NaCl расплав 2 процесс восстановления 1 процесс окисления электролиз 2NaCl -Г 2Na + CLf. Пример 2 Схема электролиза расплава СаВг2 1 процесс восстановления 1 процесс окисления электролиз СаВг2 Са + Вг2. Пример 3
Схема электролиза расплава КОН КОН К+ + ОН". расплав 4 процесс восстановления 1 процесс окисления электролиз — ионное уравнение электролиз — молекулярное урав- нение Если электролизу подвергается расплав, который содержит несколько различных катионов, то в этом случае последовательность восстановления определяется электродным потенциалом металла в данных условиях. В первую очередь восстанавливаются катионы металлов, обладающие большим значением электродного потенциала.
Более сложные процессы протекают при электролизе водных растворов электролитов, поскольку в этих процессах принимает участие вода. Рассмотрим электролиз концентрированного раствора хлорида натрия. В этом случае в растворе, кроме гидратированных ионов натрия и хлора, присутствуют молекулы воды и продукты ее диссоциации, которые участвуют в электродных реакциях. При прохождении тока через раствор к катоду будут двигаться катионы натрия и водород, а к аноду — хлорид и гидроксид-ионы. По этой причине реакции, протекающие на электродах, будут существенно отличаться от реакций, идущих в расплаве соли.
Возможно вам будут полезны данные страницы:
На катоде, вместо ионов натрия, будут восстанавливаться молекулы воды и ионы водорода, поскольку они обладают большей окислительной способностью с ионами натрия. На аноде происходит окисление хлорид-ионов (обладающих большей восстановительной способностью по сравнению с гидроксид-ионами). Пример 4 Схема электролиза раствора NaCl , расплав 1 процесс восстановления 1 процесс окисления электролиз электролиз 2NaCl + 2Н20 — Н2| + С12| + 2NaOH — молекулярное уравнение.
Последовательность, в которой происходит разряд ионов на катоде из растворов солей, определяется рядом стандартных электродных потенциалов, в котором металлы располагаются в ряд по нарастанию алгебраической величины их нормальных электродных потенциалов. Поясним, как образуется ряд стандартных электродных потенциалов. Погружение металла в раствор одноименной соли приводит к процессам перехода ионов металла с поверхности металла в раствор — растворение металла, или из раствора в металл — осаждение металла.
Вследствие этих процессов поверхность металла (электрода) приобретает положительный или отрицательный заряд, причем его величина и знак будут определяться природой металла, концентрацией соли в растворе и температурой. Гидратированные катионы и анионы, находящиеся в растворе, притягиваются заряженными поверхностями металлов, в результате чего на поверхности раздела металл-раствор образуется два слоя с противоположными зарядами — так называемый двойной электрический слой.
Разность потенциалов этого слоя носит название электродного потенциала. Непосредственно измерить величину потенциала отдельного электрода не представляется возможным. Поэтому электродные потенциалы измеряют путем сопоставления с потенциалом принятого для сравнения электрода. В качестве последнего обычно применяют стандартный водородный электрод, величину потенциала которого условно принимают за ноль. Этот электрод состоит из платиновой пластинки, покрытой платиновой чернью (электролитически осажденной платиной), которая погружена в 1 М раствор серной кислоты и омывается струей газообразного водорода под давлением 1 атм.
Если теперь пластинку любого металла, погруженную в раствор его соли, содержащий 1 моль ионов металла в 1000 г воды, соединить с водородным электродом с помощью так называемого «электролитического ключа», то получится гальванический элемент, электродвижущую силу которого (ЭДС) легко измерить. Эта ЭДС, измеренная при 25 °С, называется стандартным электродным Ряд стандартных электродных потенциалов металлов потенциалом данного металла.
Располагая металлы в порядке возрастания алгебраической величины их стандартных электродных потенциалов, получают ряд стандартных электродных потенциалов металлов.- Чем левее металл в ряду стандартных потенциалов, тем труднее его ион разряжается при электролизе. При этом возможны три случая: (TJ Катионы металлов, имеющих стандартный потенциал больший, чем у водорода (от Си2+ до Аи3+), прн электролизе практически полностью восстанавливаются на катоде.
(Т) Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до А13+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды. [з] Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от А13+ до Н2), при электролизе на катоде восстанавливаются одновременно с молекулами воды. Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической величины стандартного электродного потенциала соответствующего металла.
Так, из смеси катионов Ag+, Cu2+, Zn2+ сначала будут восстанавливаться катионы серебра, затем катионы меди и последними — катионы цинка. Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Аноды бывают нерастворимые и растворимые. Первые изготавливаются из угля, графита, платины (в процессе электролиза они не переходят в раствор в виде ионов); вторые — из меди, серебра, цинка, кадмия, никеля и др. металлов (в процессе электролиза переходят в раствор в виде ионов, т. е. разрушаются).
На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот и их солей (СГ, Br", I", S2") окисляются у анода. При электролизе водных растворов щелочей кислоро-досодержащих кислот и их солей (S042~, N03", С032~, Р043~), а также фторидов на аноде происходит электрохимическое окисление воды с выделением кислорода. Рассмотрим возможные случаи электролиза раствора солей на угольных электродах (электроды не участвуют в окислительно-восстановительных реакциях). Электролиз раствора соли, образованной активным металлом, стоящим в ряду напряжений до алюминия и кислотным остатком кислородосодержащей кислоты сводится к электролизу воды.
Пример 5 Схема электролиза водного раствора MgS04 MgS04 т± Mg2+ + SO2", раствор электролиз Учитывая, что 4Н+ + 40Н" — 4Н20, электролиз 2Н20 - 2H2t+02|. Электролиз раствора соли, образованной малоактивным металлом, стоящим в ряду напряжений после водорода, и кислотным остатком кислородосодержащей кислоты. В данном случае при электролизе получается металл, кислород, а в катодно-анодном пространстве образуется соответствующая кислота. Пример 6 Схема электролиза водного раствора CuS04 CuS04 Cu2+ + SO2", процесс восстановления 1 процесс окисления K(-): Cu2+ + 2ё Си0 электролиз электролиз 2CuS04 + 2Н20 — 2Cu + 021 + 2H2S04.
Электролиз раствора соли, образованной активным металлом (до А1) и кислотным остатком галогено-водородной кислоты. При электролизе получается водород, галоген, в катодно-анодном пространстве — щелочь. Пример 7 Схема электролиза водного раствора СаС12 СаС12 Са2+ + 2СГ, раствор НОН Н+ + ОН~. 1 процесс восстановления 1 процесс окисления электролиз , электролиз Электролиз раствора соли, образованный малоактивным металлом и кислотным остатком галоге-новодородной кислоты.
При электролизе получается металл и галоген. Пример 8 Схема электролиза водного раствора , раствор 1 процесс восстановления А(+): 2С1 - 2ё С12 1 процесс окисления лектролиз электролиз Если соль образована металлом, стоящим в ряду напряжения от алюминия до водорода и в процессе восстановления принимает участие вода, то процесс электролиза идет в зависимости от концентрации раствора соли. Чем менее концентрированный раствор, тем менее интенсивно восстанавливается металл. P^J Пример 9 Схема электролиза водного раствора Ni(N03)2 раствор 1 процесс окисления электролиз '2 2 1 1 ' электролиз P^l Пример 10 I
Схема элек электролиза водного раствора NaOH NaOH Na+ 4- ОН", раствор НОН Н+ 4- ОН". > 1 процесс восстановления / электролиз электролиз 2Н20 -V 2H?t + 0„t • 2 процесс восстановления 1 процесс окисления Пример 11 Схема электролиза водного раствора HgSC^ H2S04 2Н* + so;-, раствор НОН Н+ + ОН". nsr 2 процесс восстановления 1 процесс окисления электролиз электролиз 2На0 - 2H2t+02t-Растворимый анод при электролизе сам подвергается окислению (растворению), т. е. посылает электроны во внешнюю цепь.
Так, при электролизе раствора сульфата никеля с никелевым анодом процесс сводится к выделению никеля на катоде и постепенному растворению анода. Количество сульфата никеля в растворе остается неизменным. Пример 12 Схема электролиза водного раствора NiS04 с растворимым анодом раствор Количественно процесс электролиза описывается законами Фарадея: |Т) Количество вещества, восстановленного на катоде или окисленного на аноде, пропорционально количеству прошедшего через раствор или расплав электричества: m-kM^Q, где т — масса окисленного или восстановленного вещества; его молярная масса эквивалента;.
Q — количество электричества, прошедшего через электролит; к — коэффициент пропорциональности. [2] Количество окисляющихся или восстанавливающихся на электродах веществ при пропускании одного и того же количества электричества пропорциональны их молярным массам эквивалентов. Оба закона Фарадея можно выразить общей формулой: где F — число Фарадея. Учитывая, что количество электричества Q равно произведению силы тока J в амперах на время т в секундах, формулу можно написать так:
Величина Е называется электрохимическим эквивалентом вещества и характеризует собой массу вещества, которое восстанавливается на катоде или окисляется на аноде при прохождении через электролит одного кулона электричества. Молярная масса эквивалента связана с электрохимическим эквивалентом отношением: - EF.
Пример 13 Вычислите объем кислорода, выделившегося на угольном аноде при пропускании через разбавленный раствор серной кислоты тока силой 5 А в течение часа.
Дано: Найти: У(02) Решение: 1) Уравнение электролиза: электролиз 2) Находим количество электричества: ? = /• г; Q = 5 • 3600 = 18 ООО Кл. 3) Определим массу кислорода, выделившегося на аноде: 4) Найдем, какой объем при н. у. займет 1,492 г кислорода. Для этого сначала найдем количество вещества: 1,492 Y(Oz) - 32 - 0,047 моль. Откуда V(02) = 0,047 • 22,4 = 1,044 л. Ответ: V(02) = 1,044 л. Пример 14 Рассчитайте время, необходимое для полного выделения хлора, содержащегося в 2 л 0,5 Н раствора хлорида калия при электролизе этого раствора током силой 5 А. Дано: V(C\2) - 2 л СН(КС1) = 0,5 1=5 А
Найти: Решение: Определяем, что в 2 л 0,5 Н раствора хлорида калия содержится: 2 • 0,5 e 1 моль • экв. соли, для разложения которой требуется 96 500 Кл. Исходя из этого: Q 96 500 т = —, т = ——— = 321,8 мин = 5,3 ч. • I 5 • 1 Ответ: т= 5,3 час. Пример 15 Между какими из следующих попарно взятых веществ, формулы которых даны ниже (электролит берется в виде водного раствора), будет протекать реакция замещения: а) А1 + Cu(N03)2; б) Zn + MgS04.
Напишите уравнения реакции в ионной форме. Решение: В рассматриваемых реакциях замещения свободный металл будет вытеснять металл из соли в раствор в том случае, если он обладает большей восстановительной способностью по сравнению с металлом, образующим соль. Сравнивая пары металлов— А1 и Си; Zn и Mg, мы видим из их положения в электрохимическом ряду напряжений, что реакция замещения возможна только в первом случае и она отразится следующим уравнением: 2А1° + 3Cu2f - 3Cu° + 2AI8*. Применение электролиза расплавов и растворов огромно.
Такие ценные металлы, как алюминий, натрий, цинк, олово, свинец, кадмий, серебро, золото, получают исключительно путем электролиза. В производстве никеля, магния, меди, белой жести электрохимическая продукция составляет 80-90 %. Хлор и его кислородные соединения в промышленности получают также электрохимически. Все шире развиваются электрохимические методы получения органических соединений. Электролиз начинают применять для обессоливания воды, для укрепления грунтов за счет удаления воды (электроосмос).
Его развитие тесно связано с проблемой получения чистых и особо чистых материалов. Ни одна отрасль машиностроения не может обойтись без электрохимических методов обработки поверхности металлических изделий. Электрохимическим методом наносят металлические покрытия, которые предохраняют металл от ржавчины. Электролиз используют для получения точных копий с различных предметов — гальванопластика. Предмет, с которого хотят получить копию, покрывают воском и получают матрицу.
| Поверхность восковой матрицы покрывают |
тонким слоем графита, делая ее проводящей электрический ток. Графитовый катод опускают в ванну с раствором сульфата меди, анодом служит медь. При электролизе медный анод растворяется, а на катоде осаждается медь. С помощью гальванопластики изготавливаются клише для печати матрицы грампластинок, металлизируют различные предметы. Электролиз используют для очистки металлов от примесей. Рафинирование (очистка) меди основано на анодном растворении металла.
В больших ваннах подвешивают ряд пластин из черновой меди, а между ними — тонкие пластинки чистой меди, заливают электролит и пропускают ток. Анод — черновая медь — растворяется, а на пластинках из чистой меди, которые служат катодом, нарастает слой очищенной меди. Электролитическая медь содержит 99,97 % чистой меди. Вопросы и задачи для самостоятельного решения 1. Укажите отличие проводников первого рода от проводников второго рода.
2. Укажите, от каких факторов зависит последователь- ность расположения металлов по величинам их электродных потенциалов. 3. Объясните, почему электродные потенциалы металлов имеют положительный или отрицательный знак. 4 Объясните, почему последовательность изменения активности металлов в ряду стандартных электродных потенциалов не совпадает с последовательностью изменения активности металлов в группах и периодах периодической системы.
5. Цинковые пластинки опущены в растворы нитратов калия, кальция, никеля и свинца. В каких случаях будут протекать химические реакции? Напишите соответствующие уравнения процессов в молекулярной и ионно-молекулярной формах. 6. Какая масса технического цинка, содержащего 2 % примесей, требуется для вытеснения из раствора нитрата меди (II) 6,35 г меди? Ответ: 6,67 г. 7. Какие процессы, протекающие на электродах, объединяются общим названием * электролиз*?
8. Чем вызвана необходимость пространственного разделения процессов, протекающих на электродах? 9. Объясните, чем определяется последовательность восстановления катионов на катоде при электролизе растворов электролитов? 10. Какие факторы предопределяют выбор материала для электродов при проведении процесса электролиза? 11. Какими показателями оценивается эффективность процессов электролиза?
12. При получении каких веществ в народном хозяйстве используется электролиз? 13. Составьте схемы электролиза водного раствора нитрата цинка, если: а) анод угольный; б) анод цинковый. 14. Какие химические процессы происходят у катода и у анода при электролизе раствора иодида натрия. 15. Чем отличается электролиз расплава едкого натра "От электролиза его раствора? Какие вещества и в каком количестве выделяются при электролизе раствора едкого натра, если через раствор пропускают ток силой 10 А в течение 10 ч 44 мин? Ответ: 44,8 л Н2 и 22,4 л 02 (н. у.).
16. Какое количество продуктов будет получено при электролизе расплава едкого натра током силой 0,6 А в течение Зч? Ответ: 1,54 г Na; 0,38 л 02 (н. у.). 17. Будет ли меняться в ходе электролиза водного раствора гидроксида калия: масса гидроксида калия в растворе; концентрация раствора? Почему? 18. Какое количество электричества необходимо пропустить через раствор поваренной соли для получения 1 г едкого натра? Ответ: 2412,5 Кл. 19. С каким полюсом батареи — положительным или отрицательным — должна быть соединена металлическая деталь при ее хромировании?
20. Определите объем водорода, выделившегося на катоде (н. у.) при электролизе водного раствора серной кислоты, если известно, что при этом вступило в реакцию 1,505' 1024 электронов. Ответ: 28 л. 21. При прохождении через раствор соли трехвалентного металла тока силой ЗА в течение 15 мин на катоде выделилось 1,071 г металла. Определите атомную массу металла. Ответ: 114,9. 22.
При электролизе раствора нитрата хрома (III) током силой 1 А масса хромового катода возросла на 10 г. Какое количество электричества было пропущено через раствор и в течение какого времени? Ответ: 55700 Кл; 15 ч 28 мин. 23. Через раствор нитрата никеля (II) в течение 2 ч 27 мин пропускали ток силой 3,5 А. Определите, на сколько граммов за это время уменьшилась масса никелевого анода. Ответ: 9,4 г. 24. При электролизе током силой 2 А в течение 40 мин на катоде выделилось 4,542 г некоторого металла. Определите молярную массу эквивалента этого металла. Ответ: 91,3 г.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Электролиз (греч. elektron - янтарь + lysis — разложение) - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).

Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы - положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) - на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды - выделяется водород.
В случае, если на катод поступают ионы водорода - H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + - 2e = H2
К аноду притягиваются анионы - отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl - , Br - , I - , F - , S 2- , CH3COO - .

При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- - на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор - если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор - самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ - CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.

Теперь вы точно будете знать, что выделяется на катоде ;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись "NaOH", не подвергая его дальнейшему электролизу)
Натрий - активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген - хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно :) Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача - получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
