Анодные и катодные покрытия на металле
Обновлено: 05.07.2024
8.3 ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Применение различных методов защиты металлов от коррозии позволяет в какой-то степени свести к минимуму потери металла от коррозии. В зависимости от причин, вызывающих коррозию, различают следующие методы защиты.
1) Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Например, для удаления из воды кислорода используют специальные вещества или кипячение. Удаление кислорода из коррозионной среды называется деаэрацией. Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
2) Защитные покрытия. Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Последние по характеру защитного действия можно разделить на анодные и катодные.
Анодные покрытия . Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии * разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент *:
на аноде: Cr – 2e → Cr 2+
Cr 2+ + 2 OH – → Cr (OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr (OH)3:
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Катодные покрытия . У катодного покрытия стандартный электродный потенциал * более положителен , чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае.
на аноде: Fe – 2e → Fe 2+
Fe 2+ + 2 OH – → Fe (OH)2
Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
3) Электрохимическая защита. Различают два вида электрохимической защиты: катодная и протекторная. В обоих случаях создаются условия для возникновения на защищаемом металле высокого электроотрицательного потенциала.
Протекторная защита . Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению (рисунок 8.3).
Рисунок 8.3 – Схема протекторной защиты. А – трубопровод;
Б – протектор; В – проводник
Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите * (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока (рисунок 8.4).
Рисунок 8.4 – Схема катодной защиты. А – конструкция; Б – протектор
Металлический лом подвергается разрушению, предохраняя тем самым от разрушения защищаемую конструкцию.
Во многих случаях металл предохраняет от коррозии образующаяся на его поверхности стойкая оксидная пленка (так, на поверхности алюминия образуется Al2O3, препятствующий дальнейшему окислению металла). Однако некоторые ионы, например Cl – , разрушают такие пленки и тем самым усиливают коррозию.
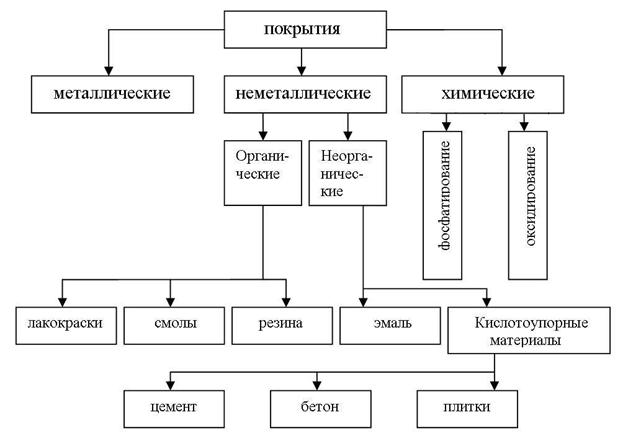
Методы изоляции металла от окружающей среды
Изоляцию защищаемого металла от окружающей среды производят, используя различные покрытия (рис. 10), которые либо наносятся на поверхность металла (металлические и неметаллические), либо образуются при химической обработке поверхности (химические покрытия).
Металлические покрытия слоем более химически стойкого металла являются одним из наиболее распространенных способов защиты металлов от коррозии.
Способы нанесения металлических покрытий. В зависимости от способа получения металлического покрытия различают: 1) гальванические покрытия, 2) горячие покрытия, 3) металлизацию, 4) контактные покрытия.
Получение гальванических покрытий происходит в процессе электролиза. Покрытия получаются наиболее равномерными, что улучшает стойкость против коррозии. Используя гальванические покрытия, можно улучшить декоративные качества изделия.
Издавна известны горячее лужение и цинкование стали. Например, при горячем цинковании стальное изделие погружают в ванну с расплавленным цинком. После охлаждения цинк кристаллизуется на поверхности стального изделия красивыми узорами.
 |
| Рис. 10. Защитные покрытия |
Метод металлизации используют с целью экономии металла. Распыление расплавленного металла на защищаемую поверхность производят с помощью струи сжатого воздуха из распыляющего устройства. Этот метод позволяет защищать от коррозии крупногабаритные изделия.
Контактные покрытия получаются в ходе химических реакций в растворе солей на поверхности защищаемого металла,
например:
Железо, как более активный металл, восстанавливает ионы меди из раствора. Однако использование этого метода не гарантирует надежной защиты, так как покрытия получаются неплотные, неравномерные.
Анодные и катодные покрытия. Это деление основано на том, как ведут себя металлические покрытия при электрохимической коррозии.
К катодным относятся покрытия, выполненные из тех металлов, электродные потенциалы которых имеют более положительное значение, чем у защищаемого металла, например, медь, никель, серебро. При повреждении покрытия возникает гальванопара, в которой основной материал является анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород. Поэтому катодные покрытия, обеспечивающие хорошую защиту при газовой коррозии, ненадежны в электропроводящих средах, так как повреждение покрытия приводит к усиленной коррозии.
Например, лужение железных изделий заключается в нанесении слоя малоактивного, и потому устойчивого к коррозии олова. При повреждении покрытия образуется гальванопара:
Стандартный электродный потенциал железа Е 0 Fe 2+ /Fe= – 0,44 B, олова Е 0 Sn 2+ /Sn = – 0,136 B. Роль анода в данной коррозионной гальванопаре играет железо как более электроотрицательный (более активный) металл, а роль катода — олово. В процессе работы гальванопары железо окисляется, а на олове (на катоде) в кислой среде происходит восстановление ионов водорода из раствора:
Анод: Fe – 2ē = Fe 2+ (окисление);
Катод: 2H + + 2ē = H2 (восстановление).
Суммарное уравнение: Fe + 2H + = Fe 2+ +H2.
Продукт коррозии: FeCl2.
Чтобы удостовериться в протекании коррозии лужёного железа по указанной схеме, в раствор добавляют гексацианоферрат (III) калия K3[Fe(CN)6]. Это характерный реактив для обнаружения ионов Fe 2+ , с которыми гексацианоферрат-ион образует окрашенное в темно-синий цвет комплексное соединение (тривиальное название турнбулева синь):
В случае нарушения покрытия в месте повреждения появляется темно-синее окрашивание, свидетельствующее, что в растворе в результате коррозии появляются ионы Fe 2+ , а значит, коррозии подвергается железо, а не олово.
Анодные покрытия изготавливаются из металлов, Е 0 которых имеют более положительное значение, чем у защищаемого металла, например, цинк на железе. В этом случае основной металл является катодом и не корродирует до тех пор, пока не окислится весь цинк. Таким образом, слой цинка работает сначала как изолирующее покрытие, а при повреждении еще и как протектор.
Стандартный электродный потенциал железа Е 0 Fe 2+ /Fe= – 0,44 B, олова Е 0 Zn 2+ /Zn = – 0,76 B. Роль анода выполняет цинк, как более электроотрицательный металл, роль катода — железо.
В кислой среде образуется гальванопара:
Анод: Zn – 2ē = Zn 2+ (окисление);
Суммарное уравнение: Zn + 2H + = Zn 2+ +H2.
Продукт коррозии: ZnCl2.
Неметаллические покрытия могут быть по своей природе как 1) неорганическими, так и 2) органическими. Защитное действие этих покрытий сводится, в основном, к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора, кислотоупорные материалы (цемент, бетон, плитки) и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Химические покрытия получают в ходе процессов фосфатирования и оксидирования (для второго процесса часто используют термин пассивирование) защищаемой поверхности металла.
Перед окрашиванием железных предметов их подвергают фосфатированию — обработке кислыми растворами солей фосфорной кислоты, например дигидрофосфатов железа (II) и марганца (II). В результате окисления железа на его поверхности появляется прочно с ним связанная пористая пленка фосфата железа (III), являющаяся хорошим грунтом для масляных красок.
Оксидирование металлов заключается в создании на поверхности плотных пленок их оксидов, что осуществляется 1) химическим или 2) электрохимическим путем.
В случае химической обработки очищенную от продуктов коррозии и обезжиренную деталь погружают на определенное время враствор окислителя, который вызывает пассивацию металла за счет образования на поверхности металла слоя продуктов окисления (пассивной плёнки)Так, железо пассивируется серной кислотой, если её концентрация превышает 75%. Также, используя способ химического оксидирования, проводят воронение стали, для чего стальной предмет выдерживают в растворе (г/л): 50 NaNO3, 200 NaNO2, NaOH в течение 90 мин. Затем изделие подвергается термической обработке при температуре 140°С.
В случае электрохимической обработки металл помещают в окислительный раствор и для интенсификации его окисления подключают к положительному полюсу (аноду) источника тока. Так, например, получают оксидированный (также используют термин анодированный) алюминий.
Маркировка анодных и катодных покрытий. Надежная защита

Как известно, металлы под действием внешней среды могут покрываться ржавчиной. Поэтому их нужно защищать антикоррозионными оболочками. В статье мы хотели бы вам рассказать о том, что такое маркировка анодных и катодных покрытий. Получив эту информацию, вы сможете понять, есть ли на металле защитный слой. И чем он, собственно говоря, покрыт.
Способ получения металла и его функциональные свойства
Итак, существует много методов анодной и катодной защиты. Если говорить об анодировании, то к популярной его разновидности стоит отнести создание оксидной плёнки на металле или сплаве. Делается это через поляризацию металла в проводящей среде. А обозначается такое покрытие маркировкой Ан.Окс. Реечный потолок Бард_многослойное покрытие
Наряду с анодным окислением, конечно, есть и другие методы защиты от коррозии:
- во-первых, катодное восстановление – маркировка у покрытий, прошедших этот вид обработки, отсутствует;
- во-вторых, катодное распыление – Кат-рас.;
- в-третьих, горячий метод (нанесение защиты в ванне с расплавленным металлом) – гор;
- в-четвёртых, диффузия – диф;
- в-пятых, эмалирование – эм;
- а также много других способов.
Как определить, чистый металл перед вами или сплав? Очень просто! Металлы без примесей обозначаются так: А – алюминий, М – медь, Х – хром. А вот компоненты сплавов перечисляются через чёрточку. К примеру, сплав из золота, серебра и меди маркируется как Зл-Ср-М. А сплав, в чьём составе имеется олово и никель, записывается как О – Н.
Ещё есть маркировка металла, которая относится к его функциональным свойствам. Для анодно-оксидных оболочек это следующие обозначения:
- Ан.окс.э – электропроводные;
- Ан.окс.эиз – защита с электроизоляцией;
- Ан.окс.т – твёрдые.
Если на покрытии слово «Аноцвет», то что это означает? Данная запись свидетельствует о том, что это цветной металл. Получают его из ванны расплавленного защитного металла по той же технологии анодного окисления.
Маркировка анодных и катодных покрытий с обработкой
Надо сказать, что иногда в маркировке указывается и дополнительная обработка покрытий. Например, Ан.окс.нв и Ан.окс.нхр – это 2 разных вида анодирования. Первый вариант – это наполнение в воде. Второй – в растворах хроматах.
Вот, кстати, ещё несколько примеров:
- прп – пропитки в виде лаков, эмульсий и клеёв;
- прм – пропитка с помощью масла;
- тн – тонирование изделия;
- т – термическая обработка.
Допустим, маркировка металла содержит цвет. Что это означает? Это признак того, что покрытие – декоративное. К примеру, запись Ан.окс.хром гласит, что изделие получено в электролите с хромом. А Ан.окс.красный – это, соответственно, про покрытия, наполненные в растворах с красным красителем.
Невозможно не сказать и о том, как понять, что за фактура и текстура у покрытия. И есть ли у него блеск… Для того и другого тоже придумали обозначения. Ш – это шероховатое покрытие. С – слоистое. Зк – зеркальное. Б – блестящее.
Если не указана маркировка металла, как понять, есть ли на нём защита?
На вид это, разумеется, не просто. Здесь, как правило, требуются тесты и испытания. Однако мы можем рассказать вам о новых свойствах металлических предметов. После электрохимической обработки они:
- с одной стороны, перестают шелушиться;
- с другой стороны, не трескаются;
- не так интенсивно истираются;
- и, конечно же, не подвергаются коррозии.
Ах, да, вот ещё что… При анодном окислении изделия меняют свои размеры. За счёт защитного слоя их толщина, безусловно, растёт. Таким слоем защищают профиль у павильонов для бассейна.
Анодные и катодные покрытия
Как было указано выше, при защите железа от коррозии покрытием из других металлов следует руководствоваться положением этих металлов в ряду напряжений, относительно железа, т. е. нужно учитывать, будет ли металл покрытия более электроотрицателен или более электроположителен, чем железо.
В зависимости от характера защиты покрытия разделяются на анодные и катодные. Анодными покрытиями будут такие, у которых электродный потенциал в данных условиях более отрицателен, чем потенциал защищаемого металла. К катодным покрытиям относятся те металлы, у которых потенциал выше потенциала защищаемого металла.
При покрытии какого-либо металла более электроотрицательным металлом в случае возникновения коррозии покрывающий металл будет играть роль анода, переходить в раствор и разрушаться, а основной металл станет катодом и тем самым будет предохраняться от коррозии.
Схема коррозии анодного покрытия показана на фиг .6.
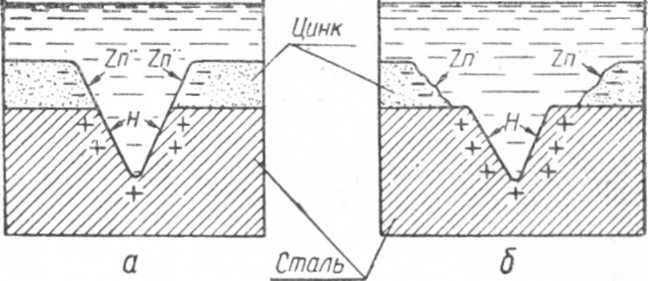
Фиг. 6. Схема коррозии анодного покрытия: а — начало коррозии; б — результат коррозии.
К другого рода покрытиям относятся покрытия, где основной металл покрыт более электроположительным металлом. Например, в случае нанесения хромового покрытия на сталь в образовавшейся гальванической паре хром будет катодом, а сталь, которая является по отношению к хрому анодом, будет разрушаться, что приведет к отслаиванию хрома
При покрытии электроположительным металлом можно получить только механическую защиту, т. е. покрытие будет хорошо предохранять железо только до тех пор, пока оно будет сплошным и не нарушится его слой.
По отношению к стали катодными покрытиями будут, например, являться покрытия из никеля, хрома, олова, свинца, меди, серебра и др.
Схема коррозии катодного покрытия показана на фиг. 7.

Фиг. 7. Схема коррозии катодного покрытия: а — начало коррозии; б — результат коррозии.
На практике более широко применяют катодные защитные покрытия, используя для этой цели высокую химическую стойкость и хорошие механические свойства некоторых металлов. Основным требованием при этом будет создание сплошных беспористых покрытий, хорошо изолирующих сталь (или другой защищаемый металл) от коррозионной среды.
Коррозионные процессы возникают также (особенно часто в промышленных условиях) при погружении металлов в раствор электролита, содержащего ионы других металлов. При этом возникает электродный потенциал (но не равновесный), величина которого зависит от разнообразных причин: состояния поверхности металла, температуры и т. д. Поверхность технических металлов, будучи неоднородной физически и химически, приводит к образованию на отдельных участках разных электродных потенциалов. Места, где происходит растворение металла, будут анодными участками, места, где будут разряжаться положительно заряженные ионы, — катодными участками. Таким образом, будут возникать гальванические микроэлементы, дающие электрический ток и вызывающие разрушение металла, в случае, если он станет анодом.
Коррозия металлов и сплавов рассматривается, согласно электрохимической теории, как процесс разрушения, вызванный действием огромного количества микроэлементов — гальванических пар. [7]
Качество металлических покрытий. Качество металлического покрытия, получаемого гальваническим путем, характеризуется структурой осадка, толщиной и равномерностью его распределения на поверхности изделия и другими факторами.
Гальваническое покрытие металлами рассматривается как явление кристаллизации, в результате которого под действием тока на поверхности металла зарождаются отдельные кристаллы. Продолжая расти, эти кристаллы образуют на поверхности детали или изделия сплошное покрытие. Под структурой этого покрытия понимается размер и форма кристаллов, а также расположение их по отношению к поверхности покрываемого металла. Размер и форма кристаллов зависят в основном от скорости образования отдельных кристаллов и их роста.
На структуру металлических покрытий, полученных гальваническим методом, большое влияние оказывает такой фактор, как режим электролиза. Повышение плотности тока приводит к уменьше нию величины кристаллов в осадке. Однако в некоторых случаях такая закономерность замечается только с достижением определенной плотности тока. Повышать плотность тока можно только до определенного предела, после которого в обычных условиях наступает нарушение процесса. Вследствие большого обеднения прикатодного слоя ионами металла наблюдается отложение металла на некоторых выступающих участках катода, где образуются так называемые дендриты. При еще более высокой плотности тока катод покрывается губчатой порошкообразной массой, состоящей из мелких отдельных кристаллов или их сростков, непрочно связанных между собой и основой.
Для защитно-декоративной отделки изделий наиболее пригодными являются мелкокристаллические покрытия, как обладающие наименьшей пористостью и тем самым лучше защищающие изделия от коррозии. В последнее десятилетие в гальванотехнике нашел применение метод отложения металлических осадков токами переменной полярности. Периодическое изменение направления тока при повышенных его плотностях позволяет получать мелкокристаллические гладкие осадки. Объясняется это следующим: во-первых, при этом ликвидируется обеднение прикатодного слоя за счет растворения покрытия, во время переключения катода на анод и соответственно снижается концентрационная поляризация. Во-вторых, те микровыступы (вершины кристаллов), которые образуются на катоде вследствие большой скорости роста на них кристаллов при переключении на анод растворяются в первую очередь, что обеспечивает образование более равномерных, гладких, в некоторых случаях блестящих осадков. [8]
Назначение и толщина металлических покрытий. В соответствии с их назначением гальванические покрытия можно разделить на следующие основные группы:
1) коррозиеустойчивые, или защитные;
Защитные свойства коррозиеустойчивого металлического покрытия определяются:
а) величиной электродного потенциала металла покрытия, сравнительно с электродным потенциалом защищаемого металла, т. е. будет ли металл покрытия при образовании гальванической пары катодом или анодом. Исключение представляют металлы, склонные покрываться пассивной пленкой (алюминий, хром). Разность между потенциалом металла покрытия и потенциалом защищаемого металла и контактирующимися с ним незащищаемыми металлами должна быть возможно наименьшей;
б) химической стойкостью металла покрытия против воздействия той среды, в которой находится изделие. В связи с этим защитные свойства покрытия зависят от того, как по своей химической природе металл покрытия будет относиться к таким химическим реагентам, как влажный воздух, морская вода, кислоты, щелочи и др.;
в) достаточной толщиной, сплошностью и сцепляемостью покрытия, а также его твердостью и сопротивляемостью механическим воздействиям. Исключительно большое значение для противокоррозионной защиты имеет качество сцепления покрытия с основным металлом, выражающееся в сращивании покрытия с основой по всей поверхности изделия. Сцепление покрытия с покрываемым металлом зависит от ряда условий, куда относятся химические свойства основного металла и металла покрытия, режим и условия процесса осаждения и главное — качество подготовки поверхности изделия в механических и гальванических цехах.
Основным требованием к коррозиеустойчивым и защитно-декоративным покрытиям является наличие достаточной для данных условий эксплуатации изделия толщины слоя покрытия.
Выбор покрытий и их толщина зависят от назначения изделий и условий их эксплуатации. Минимальные значения толщин покрытий после их отделки предусматриваются Государственными стандартами.
В зависимости от условий работы изделия устанавливаются три группы покрытий:
группа Л — для легких условий работы. Эта группа предназначена для эксплуатации изделий в закрытых, сухих, отапливаемых и вентилируемых помещениях (аналогичных жилым);
группа С — для средних условий работы. Эта группа предназначена для эксплуатации изделий в условиях закрытых помещений и наружной атмосферы, загрязненных промышленными газами, пылью, а также содержащих аэрозоли или испарения морской воды. При этом изделия не должны подвергаться непосредственному воздействию дождя или снега;
группа Ж — для жестких условий работы. Эта группа предназначена для эксплуатации изделий в условиях закрытых помещений и наружной атмосферы, загрязненных значительным количеством промышленных газов и пыли, а также при непосредственном периодическом воздействии дождя, снега или брызг морской воды.
Толщина покрытия в ряде случаев (например, с целью защиты от коррозии в жидких средах или агрессивных газах, при повышении износостойкости поверхности металла и др.) не может быть стандартизована. В каждом отдельном случае здесь необходимо учитывать интенсивность воздействия коррозионной среды, конструктивные особенности изделия, срок службы и требования к покрытию, обусловленные технологией изготовления деталей. [4]
ПОДГОТОВКА ПОВЕРХНОСТИ МЕТАЛЛИЧЕСКИХ ИЗДЕЛИЙ ПЕРЕД НАНЕСЕНИЕМ ГАЛЬВАНИЧЕСКИХ ПОКРЫТИЙ
Поверхность металлических изделий и деталей перед нанесением гальванических покрытий должна быть тщательно подготовлена и очищена от различного рода загрязнений. Окислы металла (окалина и ржавчина), минеральные масла, технические жиры, а также ранее нанесенные покрытия, шлаковые включения, другими словами, все загрязнения, препятствующие осаждению и прочному сцеплению покрытия с металлом, должны быть удалены с поверхности изделий.
Устранение неровностей, шероховатостей, пленки окалины, шлаковых включений и придание поверхности гладкого и блестящего вида достигают механической обработкой — шлифованием и полированием. Однако поверхность металлических изделий и деталей, приобретая в результате механической обработки декоративный вид, остается еще недостаточно чистой, чтобы можно было ее подвергнуть гальваническим покрытиям. Даже незначительные загрязнения, как, например, следы от пальцев на поверхности изделий, сильно ухудшают качество гальванических покрытий и ведут к различного рода дефектам. Поэтому, кроме механической обработки, необходимо применять еще очистку поверхности от окислов и жировых загрязнений химическим путем, дающую требуемую степень чистоты для гальванического покрытия. Это достигается травлением поверхности в кислотах и обезжириванием ее в растворителях и щелочных растворах с последующей промывкой водой. [1]
Читайте также:
