Атомная масса металла формула
Обновлено: 17.05.2024
1. Ознакомить студентов с основными химическими законами и единицами массы.
2. С помощью математической обработки подученных студентами экспериментальных данных сделать вывод о названии металла, данного для работы и его положении в периодической таблице Д.И. Менделеева.
ОСНОВНЫЕ ПОНЯТИЯ
Вспомним основные частицы вещества:
Молекула – наименьшая частица вещества, обладающая его химическими свойствами и состоящая из атомов. Атом – наименьшая частица элемента, обладающая его химическими свойствами. Химический элемент можно определить как вид атомов, характеризующийся определенной совокупностью свойств.
Простейшим примером сказанному может служить молекула хлористого водорода ( HCl ). Водород и хлор, вступая в реакцию, теряют свои свойства, характерные для газообразных Н2 и Cl2, поэтому считается, что в состав хлористого водорода входят элементы – водород и хлор.
Масса атомов и молекул выражается в атомных единицах массы (а.е.м.), принятых в 1961 г. За одну атомную единицу массы принимается 1/12 часть массы атома изотопа углерода 12 С. Таким образом, масса атома или молекулы любого вещества представляется относительной величиной, показывающей, во сколько раз масса данного атома (молекулы) тяжелее выбранной атомной единицы массы.
Так, относительная атомная масса цинка (Ar) равна 65.38 а.е.м., относительная молекулярная масса воды (Mr) равна 1,008 ∙ 2 + 15,9994 = 18,0154 а.е.м. и т.д.
Однако при решении задач и в расчетах по уравнениям реакций гораздо чаще пользуются понятием «моль».
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 граммах изотопа углерода 12 C.
Применяя слово «моль», необходимо в каждом случае точно указывать, какие единицы входят в данное вещество. Существует понятия «моль атомов», «моль молекул» и т.д. Масса одного моля взятого вещества называется его молярной массой. Она выражается в г/моль.
Числовое значение молярной массы вещества в г/моль равно относительной молекулярной массе Mr, если вещество состоит из молекул, или относительной атомной массе Ar, если вещество состоит из атомов. Например, молярная масса атомарного кислорода равна ~16 г/моль, молекулярного кислорода ~32 г/моль.
Моль любого вещества содержит совершенно одинаковое количество структурных единиц. Это число называет числом Авогадро, его значение принимают равным 6,02·10 23 .
Часто в химических расчетах используется понятие эквивалента.
Эквивалентом вещества называется такое его количество, которое соединяется без остатка с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Например, в соединениях HCl, H2S и NH3 эквивалент элементов хлора, серы и азота соответственно равен 1 моль, ½ моля и 1/3 моля. Масса одного эквивалента называется его эквивалентной массой или молярной массой эквивалента.Выражается в г/моль.
Так, в приведенных примерах эквивалентные массы хлора, серы и азота легко подсчитать, используя атомные массы этих элементов, они соответственно равны mэ(Cl) = 35,5 г/моль; mэ(S) = 32:2 = 16 г/моль; mэ(N) = 14:3 = 4,7 г/моль. Из разобранных примеров видно, что эквивалентная масса элемента находится из соотношения
Эквивалентная масса или .
Понятие об эквивалентах и эквивалентных массах распространяется также на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества.
1. Эквивалентная масса оксида складывается из значений эквивалентных масс, составляющих оксид элементов.
а) Эквивалентные массы металла и кислорода в оксиде ZnO, соответственно, равны половине молярных масс атомов:
б) Валентность серы в оксиде SO3 равна 6, следовательно
2. Эквивалентная масса кислоты равна её молярной массе, деленной на основность кислоты (число атомов водорода в молекуле кислоты).
а) Молярная масса HNO3 равна 63 г/моль. Кислота одноосновная, следовательно .
б) Молярная масса H3PO4 равна 98 г/моль. Основность равна 3.
3. Эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание.
Молярная масса Mg(OH)2 равна 58 г/моль, валентность цинка 2. .
4. Эквивалентная масса соли равна отношению её молярной массы к произведению валентности металла на число его атомов в молекуле.
а) Молярная масса Na2CO3 равна 106 г/моль. Валентность металла I, число его атомов 2.
5. Эквиваленты одних и тех же сложных веществ и их эквивалентные массы могут иметь различные значения, если их рассматривать не как отдельные вещества, а составные части химических реакций, в которых они участвуют.
| H2CO3 + 2NaOH = Na2CO3 + 2H2O | (1) |
| H2CO3 + NaOH = NaHСO3 + H2O | (2) |
эквивалент H2CO3 и его масса зависит от количества атомов водорода, участвующих в реакции и соответственно равны:
| , – по уравнению (1); | (1) |
| , – по уравнению (2); | (2) |
| Cr(OH)3 + 2HCl = CrOHCl2 + 2H2O; | (3) |
| Cr(OH)3 + 3HCl = CrCl3 + 3H2O; | (4) |
| , – по уравнению (3); | (3) |
т.к. в реакции было замещено только две гидроксидных группы на кислотный остаток.
| , – по уравнению (4); | (4) |
т.к. произошло замещение всех трех гидроксогрупп.
Известно несколько способов определения эквивалента.
I. Прямое или непосредственное определение эквивалента из соединения элементов с водородом или кислородом.
Пример 1. Рассчитать эквивалент железа в его оксиде FeO.
Эквивалент кислорода по определению равен ½ моля атомов, эквивалентная масса кислорода равна 16 : 2 = 8 г/моль. В данном соединении на ½ моля атомов кислорода приходится столько же, т.е. ½ моля атомов железа. Следовательно, эквивалент железа в данном оксиде равен ½ моля, а его эквивалентная масса 56 : 2 = 28 г/моль.
II. Определение эквивалента с помощью закона эквивалентов.
Закон эквивалентов (эквивалентных масс), предложенный в 1803-1814 гг. Дальтоном и Рихтером: Элементы и вещества соединяются друг с другом, а также замещают друг друга, в химических реакциях в строго определенных весовых количествах, прямо пропорциональных их эквивалентам.
Математическая запись закона такова:
где m1 и m2 – массы взаимодействующих элементов или веществ, г;
mЭ1 и mЭ2 – соответственно эквивалентные массы этих веществ, г/моль.
Пример 2. Определить эквивалентную и молярную массы 3-валентного металла, зная, что 0,52 г его при окислении образуют 0,98 г оксида.
Решение. В соответствии с законом эквивалентов
Массу кислорода определим по разности масс оксида и металла
mO = 0,98 – 0,52 = 0,46 г.
Эквивалентная масса кислорода известна, она равна 8 г/моль.
Т.к. валентность металла равна 3, то его молярная масса
Пример 3. Вычислить эквивалентную массу металла, если в его хлориде массовая доля хлора 79,78 %, эквивалентная масса хлора равна 53,45 г/моль.
Решение. Массовая доля w металла в хлориде равна
w = 100 - 79,78 = 20,22 %.
Согласно закону эквивалентов, отношение массы металла и массы хлора в соединении должно быть равно отношению их эквивалентных масс
Пример 4. Определите молярную массу двух валентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла.
Эквивалентная масса сульфата металла равна .
Согласно закону эквивалентов
Т.к. валентность металла равна 2, то его молярная масса равна:
A = 27,5 · 2 = 55 г/моль.
III. Если в химической реакции одно из участвующих веществ находится в газообразном состоянии, то запись закона эквивалентов выражается формулой
где соответственно m(Me) и mэ(Me) – масса металла и его эквивалентная масса, а V и Vэ - объем вступившего в реакцию газа и объем эквивалентной массы этого газа.
Для расчета объемов реагирующих газов необходимо знание Закона Авогадро и его следствий.
Закон Авогадро (1911): В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Следствия из закона Авогадро:
1. Один моль любого газа при нормальных условиях (н.у.) –температура 0 ºС и давление 760 мм.рт.ст. занимает один и тот же объем равный 22,4 литра. Этот объем называют – молярным объемом газа VМ = 22,4 л/моль.
2. Один моль любого газа содержит одно и то же число молекул, а именно NA = 6,02 · 10 23 моль -1 .
3. Относительная плотность одного газа по другому равна отношению их молярных (M) или относительных молекулярных масс
На основании этих следствий можно рассчитать количество вещества
Пример 5. Рассчитать массу 3 л хлора, взятого при н.у.
Решение. Т.к. молярная масса хлора (Cl2) равна 35,5 ∙ 2 = 71 г/моль то из соотношения (IV) легко найти массу искомого объема
Пример 6. Сколько молей и сколько молекул содержится в 2,2 г углекислого газа? Какой объем они занимают при н.у.?
Решение. Т.к. молярная масса углекислого газа (СО2) равна 44 г/моль, то
Найдем объем газа при н.у.
Пример 7. Определите массу молекулы газа, если масса 2 л газа (н.у.) равна 0,357 г.
Решение. Исходя из молярного объема газа определим молярную массу газа
Число молекул в 1 моль любого вещества равно постоянной Авогадро. Следовательно, масса молекул газа (m) равна
Первое следствие из закона Авогадро позволяет рассчитать объемы эквивалентных масс различных газов:
Так, если эквивалентная масса водорода равна 1,008 г/моль, то её объем равен
Подобным образом находится объем эквивалентной массы кислорода, который оказывается равным
Пример 8. При растворении 0,506 г металла в серной кислоте выделилось 100,8 мл водорода, измеренного при н.у. Определить эквивалентную массу металла.
Задачу можно решить двумя способами:
а) прямой подстановкой данных в формулу (II).
б) используя формулу (I), откуда
, где mэ(H) = 1,008 г/ моль.
Для решения задачи в этом случае надо найти m(H2). Согласно следствию из закона Авогадро
Теперь найденное значение m(H2) подставим в формулу (I)
Значения эквивалентных масс позволяют определить атомную массу металлов по формуле:
A = тэ · В, (V)
где В – валентность металла
А – его атомная масса, в г/моль.
Если же валентность металла неизвестна, то атомную массу можно определить через удельную теплоемкость. В данных расчетах используется правило Дюлонга и Пти: Произведение удельной теплоемкости простого твердого вещества на его атомную массу для большинства элементов приблизительно одинаково. Полученная величина имеет среднее значение, равное 26,8 Дж/моль·К (6,3 кал/моль·град). Она носит название атомной теплоемкости металлов (СА) и представляет собой количество тепла, необходимого для нагревания 1 моля атомов металла на один Кельвин. Математически это правило имеет вид
| СА = А · С ~ 26,8 Дж/моль·К | (VI) |
где С – удельная теплоемкость металла, Дж/г·К;
А – атомная масса взятого металла, г/моль.
Под удельной теплоемкостью понимается то количество тепла, которое необходимо затратить для нагревания 1 г вещества на 1 Кельвин.
Пример 9. При окислении 0,16 г металла образовалось 0,223 г оксида. Вычислить точную атомную массу металла, зная, что удельная теплоемкость 0,635 Дж/г·К.
Решение. По правилу Дюлонга и Пти найдем приближенное значение атомной массы данного металла
По формуле (1) найдем эквивалентную массу этого металла. Масса кислорода 0,223 г. – 0,16 г. = 0,063 г.
Зная приближенную атомную массу металла и его эквивалентнуюмассу, можно найти валентность этого металла.
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.

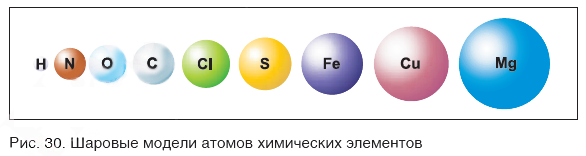
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
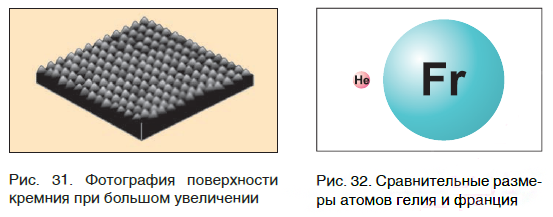
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.

Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
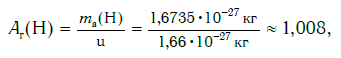
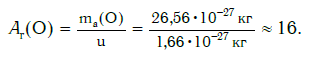
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u .
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Формула молекулярной массы
Массы атомов и молекул очень малы, поэтому в качестве единицы измерения удобно выбрать массу одного из атомов и выражать массы остальных атомов относительно нее. Именно так и поступал основоположник атомной теории Дальтон, который составил таблицу атомных масс, приняв массу атома водорода за единицу.
До 1961 года в физике за атомную единицу массы (а.е.м. сокращенно) принимали 1/16 массы атома кислорода 16 О, а в химии – 1/16 средней атомной массы природного кислорода, который является смесью трех изотопов. Химическая единица массы была на 0,03% больше, чем физическая.
В настоящее время за в физике и химии принята единая система измерения. В качестве стандартной единицы атомной массы выбрана 1/12 часть массы атома углерода 12 С.
1 а.е.м. = 1/12 m( 12 С) = 1,66057×10 -27 кг = 1,66057×10 -24 г.
Относительная атомная и молекулярная масса элемента
Относительная атомная масса элемента (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12 С.
При расчете относительной атомной массы учитывается распространенность изотопов элементов в земной коре. Например, хлор имеет два изотопа 35 Сl (75,5%) и 37 Сl (24,5%).Относительная атомная масса хлора равна:
Ar(Cl) = (0,755×m( 35 Сl) + 0,245×m( 37 Сl)) / (1/12×m( 12 С) = 35,5.
Из определения относительной атомной массы следует, что средняя абсолютная масса атома равна относительной атомной массе, умноженной на а.е.м.:
m(Cl) = 35,5 ×1,66057×10 -24 = 5,89×10 -23 г.
Относительная молекулярная масса вещества (Mr) – это безразмерная величина, равная отношению массы молекулы вещества к 1/12 массы атома 12 С.
Относительная молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы, например:
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Моль – это количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12 С.
Масса одного атома 12 С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12 С равно:
NA = 12 г / 12 × 1,66057×10 -24 г = 1/1,66057×10 -24 = 6,0221×10 -23 .
Таким образом, моль вещества содержит 6,0221×10 -23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль -1 . Число 6,0221×10 -23 называют числом Авогадро.
Молярная масса вещества
Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным.
Урок 7. Относительная молекулярная и относительная формульная массы
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.

Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr .
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
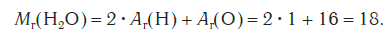
Относительная молекулярная масса серной кислоты H2SO4:

Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u . Например, если Mr (H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr . При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
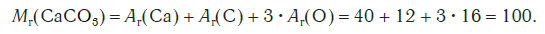
Относительная формульная масса вещества Al2(SO4)3 равна:
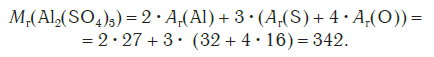
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u .
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля ( w ) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А ;
Ar(А) — относительная атомная масса элемента А ;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy .
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4

- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Читайте также:
