Атомно эмиссионный анализ металлов
Обновлено: 21.09.2024
Аннотация.В лекции рассматриваются теоретические основы метода атомно-эмиссионной спектроскопии, устройство и принцип действия атомно-эмиссионных спектрометров, возможности метода атомно-эмиссионной спектрометрии с использованием различных источников излучения: пламен, плазмы, электрической дуги и электрической искры, а также с различными диспергирующими устройствами.
Ключевые слова:атомно-эмиссионная спектрометрия, терм, пламена, плазма, дуга, искра, лампа тлеющего разряда, монохроматор, полихроматор, призма, дифракционная решетка.
Рассматриваемые вопросы:
1 вопрос. Теоретические основы метода атомно-эмиссионной спектрометрии.
2 вопрос. Источники излучения, используемые в атомно-эмиссионной спектрометрии.
3 вопрос. Спектрометры для атомно-эмиссионной спектрометрии.
4 вопрос. Возможности метода атомно-эмиссионной спектрометрии.
Цели и задачи изучения модульной единицы.В результате изучения данной модульной единицы студенты должны освоить теоретические основы метода атомно-эмиссионной спектроскопии, познакомиться с устройством и принципом действия атомно-эмиссионных спектрометров, знать возможности метода атомно-эмиссионная спектрометрии с использованием различных источников излучения: пламен, плазмы, электрической дуги и электрической искры, а также с различными диспергирующими устройствами.
2.1.1. Принцип метода.
Атомно-эмиссионная спектрометрия – метод качественного и количественного элементного анализа, основанный на получении и детектировании линейчатых спектров, возникающих в результате перехода внешних электронов атомов в возбужденное состояние и последующего самопроизвольного перехода этих электронов на более низкие и основные уровни с испусканием (эмиссией) избыточной энергии в виде квантов электромагнитного излучения.
Линейчатый спектр специфичен для данного элемента, поэтому надлежащий выбор данной линии и ее выделение с помощью диспергирующей системы позволяет аналитику проверить присутствие этого элемента и определить его концентрацию.
1.1.2. Атомные спектры испускания.
Каждый элемент периодической системы имеет определенное число электронов, равное его атомному номеру. Электроны с определенной вероятностью расположены на уровнях и подуровнях вокруг ядра в соответствии с квантовой теорией. Квантовая теория была создана Планком, который предположил, что электромагнитная энергия поглощается или испускается дискретно; это означает, что энергия не непрерывна. Энергетическое состояние каждого электрона в свободном атоме характеризуется четырьмя квантовыми числами:
· главное квантовое число п (n принимает значения от 1 до 7 для атомов в основном состоянии).
· орбитальное квантовое число l (l = 0,1,2. ,n-1) соответствует подуровням s, р, d, f.
· магнитное квантовое число m (любое целое, удовлетворяющее условию –l < m +l ).
· спиновое квантовое число s (s = ±1/2).
Полный угловой момент количества движения электрона как от орбитального, так и от спинового квантового числа. Для характеристики полного углового момента количества движения электрона вводится еще одно квантовое число – полное или внутреннее квантовое число j. Для атома, имеющего один валентный электрон j = l + s = l ± ½. Если орбитальное квантовое число больше нуля, то внутренне квантовое число имеет два значения, что соответствует двум различным энергетическим состояниям.
Если заряд ядра атома невелик (меньше 35), а число валентных электронов — два или более, то для совокупности этих валентных электронов вводятся новые квантовые числа, которые определяются как суммы соответствующих квантовых чисел отдельных электронов:
L= Sli; S= Ssi; J= L+ S
Группа энергетических состояний, характеризующихся одними и теми же величинами LиS,имеет близкую энергию и образует один терм.
При записи символа терма прежде всего указывают его основную характеристику: квантовое число суммарного орбитального момента L. Если L= 0, то в символе терма записывают прописную букву S, если L= 1, то пишут Р. L, равные 2 и 3, обозначают буквами D и F соответственно. Слева в виде верхнего индекса указывают число близких по энергии состояний, которые образует данный терм, то есть его мультиплетность. Мультиплетность равна 2S+ 1, где S –суммарный спин атома. Таким образом, мультиплетность на единицу больше, чем число неспаренных электронов в атоме. Если мультиплетность терма равна 1, то его называют одиночным или синглетным термом. Терм с мультиплетностью, равной 2, называют двойным или дублетным. Справа внизу от буквенного обозначения Lв виде индекса записывают значения j. Перед обозначением терма указывают значение главного квантового числа n. Для полностью заполненных электронных подуровней (s 2 , p 6 , d 10 ) L+ Sравно 0.
Например, в атоме натрия первый и второй энергетические уровни заполнены полностью, поэтому термы этого атома определяются его единственным валентным электроном. В основном состоянии этот электрон находится на 3s-подуровне. В этом случае терм атома натрия обозначается так:
3 2 S1/2. Следует обратить внимание на левый верхний индекс 2, который свидетельствует о формальной мультиплетности этого терма. На самом же деле все термы S являются синглетными (одиночными). При возбуждении атома натрия электрон с подуровня 3s переходит на более высокие подуровни. Первое возбужденное состояние соответствует переходу электрона на подуровень 3р. В этом случае терм атома натрия записывают как 3 2 Р3/2, 1/2. Такая запись соответствует следующим значениям квантовых чисел: n = 3, l = 1, j =3/2 или ½. Этот терм – дублет. Энергетические подуровни атома натрия показаны на рис. 1.1.
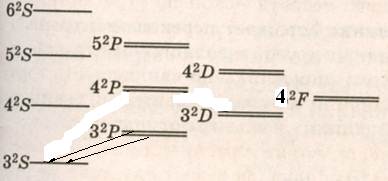
Рис. 1.1. Термы атома натрия. Стрелками показаны переходы, вызывающие появление в спектре натрия дублета с длинами волн 588,996 и 588,593 нм.
Каждая спектральная линия отражает переход электрона с одного энергетического уровня на другой. Однако не все переходы разрешены. Существуют правила отбора, указывающие, между какими энергетическими уровнями переходы возможны, а между какими – нет. Возможные переходы называют разрешенными, а невозможные – запрещенными. Перечислим основные правила отбора:
1. Разрешены переходы, при которых терм меняется на единицу. Согласно этому правилу возможны переходы P-S, D-P, но невозможны переходы P-P, D-D или D-S.
2. Внутренне квантовое число при переходе может меняться только на ±1 или совсем не меняться. Запрещены переходы, при которых DJ= ±2.
3. Разрешены переходы без изменения мультиплетности.
Например, в атоме натрия разрешен переход с подуровня 3р(дублетный терм 3 2 Р3/2,1/2)на подуровень 3s (синглетный терм 3 2 S1/2). Этот переход вызывает появление в спектре натрия двойной желтой линии (дублета). Этот переход полностью соответствует правилам отбора. В соответствии с первым правилом разрешены переходы Р –S. Согласно второму правилу DJ может равняться ±1, как при переходе 3 2 Р3/2 - 3 2 S1/2, или 0, как при переходе 3 2 Р1/2 - 3 2 S1/2. Не нарушается и третье правило, так как формальная мультиплетность терма 3 2 S1/2 равна 2.
Наиболее яркой линией в спектре является линия, вызванная переходом с первого возбужденного уровня на основной. Такую линию называют резонансной.
Спектр атома любого элемента существенно отличается от спектра его иона в связи с изменением числа оптических электронов в результате ионизации. В таблицах спектральных линий рядом с символом химического элемента приводят римскую цифру, по которой можно судить о кратности ионизации. Цифра Iотносится к нейтральному атому, цифра II– к однократно ионизированному атому, т.е. катиону с зарядом +1.
В соответствии с правилами отбора и возможными возбужденными уровнями каждый элемент периодической системы может проявлять набор линий (спектр), специфичный для этого элемента. Это объясняет, почему комбинации линий элемента позволяет провести качественный анализ.
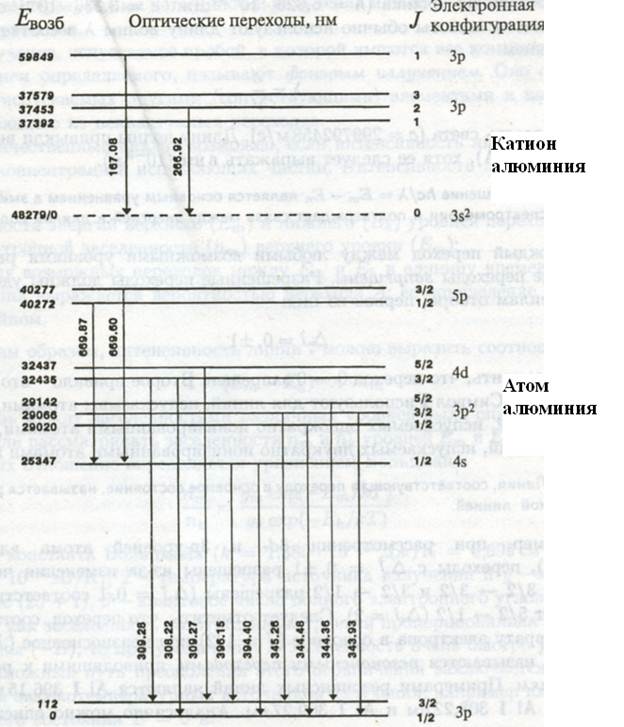
Рис. 2.2. Основные и возбужденные состояния атома и катиона алюминия. Показаны разрешенные оптические переходы.
Например, у атома алюминия (рис. 2.2) 46 электронных уровней ниже энергии ионизации, соответствующие примерно 118 линиям в диапазоне 176-1000 нм. Для однозарядного иона А1 существует 226 уровней, они дают примерно 318 линий в диапазоне 160-1000 нм. Частицы А1 I и А1 II испускают относительно простые спектры, т. е. с ограниченным числом линий. В таком же диапазоне длин волн уран может испускать несколько десятков тысяч линий, что приводит, вероятно, к наиболее сложному из наблюдаемых спектров. Однако, если резонансные линии можно наблюдать в любом источнике излучения, то линии, возникающие из высоковозбужденных состояний, можно наблюдать только с высокотемпературными источниками излучения или при специальных условиях возбуждения.
Излучение, испускаемое пробой, в которой имеются все компоненты за исключением определяемого, называют фоновым излучением. Оно состоит из линий, испускаемых другими (сопутствующими) элементами и континуума, возникающего из неквантуемых переходов.
2.1.3. Интенсивность спектральных линий.
Количественный анализ возможен, если интенсивность линии можно связать с концентрацией испускающих частиц. Интенсивность линии пропорциональна:
1) разности энергий верхнего (Em ) и нижнего (Еk) уровней перехода;
2) электронной заселенности (nm) верхнего уровня (Ет);
3) числу возможных переходов между Ет н Еk в единицу времени. Эта величина выражается вероятностью перехода А; ее определение дано Эйнштейном.
Таким образом, интенсивность линии I можно выразить соотношением
Связь между заселенностями различных уровней была описана Больцма-ном. Если рассматривать заселенности пт и пk уровней Ет и Ek соответственно, то их отношение определяется уравнением Больцмана:
где k — константа Больцмана (k = 1,380×10 -23 Дж/К = 0,695см -1 × К -1 = 0,8617× 10-4 эВ/К), Т — температура источника излучения и g — статистический вес (2J + 1), J — квантовое число полного электронного углового момента.
Так как заселенность возбужденных уровней пропорциональна экспоненте величины (— Е), то при увеличении Е заселенность очень быстро уменьшается. Возможный путь преодоления этого ограничения заключается в использовании высокотемпературных источников излучения, например плазмы. Для основного состояния Е = 0 и:
Чтобы получить отношение пт кобщей заселенности уровней атома (или иона) N
N = n0 + n1 + . + nm + .
можно просуммировать члены типа gтехр(—Ет/kТ> для всех возможных уровней и определить статистическую сумму по состояниям (Z) в следующем виде:
Уравнение Больцмана принимает вид:
Статистическая сумма по состояниям есть, следовательно, функция температуры. Однако в диапазоне температур большинства источников излучения, используемых в аналитических приложениях, т. е, 2000-7000 К, эти изменения малы или даже ничтожны.
Значит, интенсивность линии может быть записана в виде:
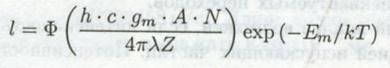
где Ф – коэффициент пересчета с учетом изотропности по телесному углу 4p стерадиан.
Из этого уравнения видно, что интенсивность линии l пропорциональная числу атомов N.
Когда источник излучения достаточно стабилен и сохраняет постоянную температуру, статистическая сумма по состояниям Z будет оставаться постоянной и число атомов (ионов) N будет пропорционально концентрации с. Для данной линии определяемого элемента gm, А, l и Ет постоянны. Следовательно, интенсивность линии l пропорциональна с, что позволяет проводить количественное определение, В относительном количественном анализе используют ряд образцов сравнения для построения градуировочного графика, т. е. зависимости интенсивности от концентрации определяемого элемента. Интенсивность линии определяемого элемента в неизвестной пробе используют для нахождения его концентрации по градуировочпому графику. Теоретически возможно выполнить также абсолютныйколичественный анализ, т. е. анализ без использования процедуры градуировки. Однако абсолютный количественный анализ требует знания температуры, телесного угла испускания и т. д. Эти измерения в рутинном анализе осуществить нелегко.
Следует отметить, что в случае постоянной концентрации определяемого элемента, любые малые изменения характеристик источника излучения могут приводить к изменениям температуры и последующим изменениям интенсивности линии из-за изменения заселенности возбужденного уровня. При рассмотрении резонансной линии Аl I 396,15им (Ет = 25347см" 1 ) увеличение температуры источника излучения на 100 К соответствует увеличению экспоненциального члена (—Ет/kТ) примерно на 50% и 5% при 3000 К и 6000 К соответственно. Это объясняет, почему для получения хорошей воспроизводимости и сходимости, а также во избежание дрейфа аналитического сигнала, требуется высокая стабильность источника.
В атомно-эмиссионной спектрометрии источник фактически играет двоякую роль: первый этап состоит в атомизации анализируемой пробы с целью получить свободные атомы, обычно в основном состоянии; второй — в возбуждении атомов в более высоколежащие энергетические состояния. Идеальный источник для эмиссионной спектрометрии должен проявлять отличные аналитические и инструментальные характеристики. Аналитические характеристики включают число элементов, которые могут быть определены, правильность и воспроизводимость, селективность, отсутствие физических и химических помех, долговременную стабильность, концентрационный динамический диапазон и пределы обнаружения. Более того, эмиссионная система должна быть способна работать с пробами любого типа, независимо от их формы (жидкой, твердой или газообразной), с возможностью использовать ограниченное количество пробы. Инструментальные характеристики, представляющие интерес, включают простоту работы и обслуживания, автоматизацию, производительность, надежность и размеры системы. Следуеттакже уделить некоторое внимание капиталовложениям и стоимости работы.
Атомно эмиссионный спектральный анализ
Атомно-эмиссионные спектрометры, которым посвящен настоящий сайт, реализуют в своей работе принципы атомно-эмиссионного спектрального анализа (АЭСА). Эти приборы являются наиболее распространенными аналитическими приборами и в мире, и в нашей стране. Они предназначены для анализа (чаще всего элементного анализа) состава самых различных веществ в различных агрегатных состояниях.
Часто, особенно за рубежом, эти спектрометры называют оптико-эмиссионными спектрометрами (optical-emission spectrometers или OE-spectrometers). Такое название применяется, чтобы подчеркнуть отличие от рентгено-флуоресцентных спектрометров ( X-ray fluorescence spectrometers или XRF Spectrometers). Принцип действия последних также основан на регистрации эмиссионного спектра, но другого диапазона длин волн — рентгеновского, а не оптического. Везде в дальнейшем при употреблении общего названия «АЭ- спектрометр» всегда имеется ввиду именно оптико-эмиссионный спектрометр.
Также такие приборы иногда называют просто эмиссионными спектрометрами. Кроме того, широко используют названия, в которых явным образом обозначают тип применяемого источника возбуждения спектров.
- Например, искровой или дуговой спектрометр для атомно-эмиссионного спектрометра с искровым или дуговым источником возбуждения спектров, соответственно.
- Или ИСП-спектрометр (ICP Spectrometer или ICP) — это атомно-эмиссионный спектрометр с источником возбуждения спектров в виде т.н. индуктивно-связанной плазмы.
- Для спектрометров с лазерными источниками возбуждения спектров используют названия лазерный или лазерно-искровой спектрометр.
Сущность атомно-эмиссионного спектрального анализа
Иногда спрашивают, относятся ли атомно-эмиссионные спектрометры к приборам для неразрушающего контроля.

Под неразрушающим контролем подразумевается такая процедура контроля свойств и параметров объекта, при которой не нарушается пригодность объекта к дальнейшему использованию и эксплуатации.
С другой стороны, например, ИСП-спектрометры в классическом своем варианте применяются для спектрального анализа проб в жидкой фазе. Поэтому спектральный анализ на этих приборах твердых проб требует их предварительного химического растворения, т.е. разрушения. Но если применять для анализа твердых проб ИСП-спектрометры, оснащенные искровым или лазерным аблятором, то такой комбинированный АЭ- спектрометр уже можно снова отнести к приборам для неразрушающего контроля.
Методы и принципы
Атомно-эмиссионный спектральный анализ состава вещества, в свою очередь, основан на двух фундаментальных принципах:
- спектр, испускаемый предварительно возбужденными атомами и ионами данного химического элемента, строго индивидуален (т.е. характерен только для данного химического элемента);
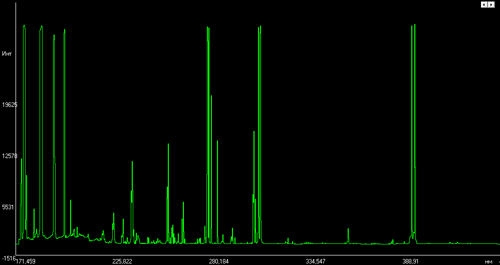
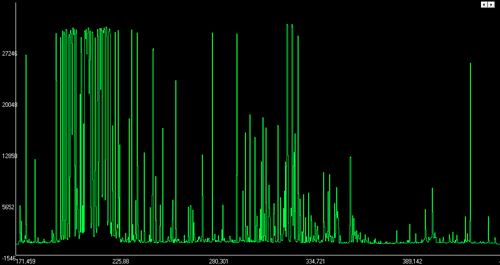
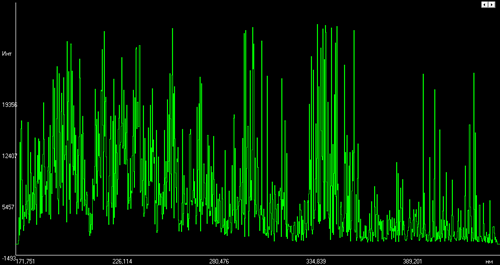
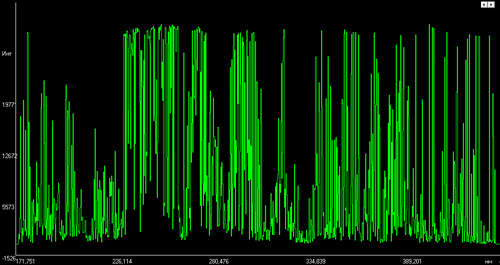
Рисунки иллюстрируют, насколько сильно отличаются друг от друга спектры различных элементов (в данном примере это алюминий, медь, вольфрам и железо).
По оси ординат - интенсивность I в условных единицах. По оси абсцисс - длина волны λ в нанометрах, спектральный диапазон 172-441 нм. Спектры сняты на искровом спектрометре. ![Эмиссионный спектр алюминия]()
Спектр алюминия.
Образец — алюминиевый деформируемый марки АД31,
содержание Al около 98%![Эмиссионный спектр меди]()
Спектр меди.
Спектр снят со стандартного образца VSM14-4,
содержание Cu около 99,95%содержанием W около 90%' rel="lightbox-aes"> ![Эмиссионный спектр вольфрамового сплава]()
Спектр вольфрамового сплава.
Образец — сплав вольфрама
с содержанием W около 90%![Эмиссионный спектр железа]()
Спектр железа.
Спектр снят со стандартного образца углеродистой низколегированной стали УГ2и,
содержание Fe около 99,5% - интенсивность линий этого спектра зависит от концентрации этого элемента, определение которой и является целью анализа.
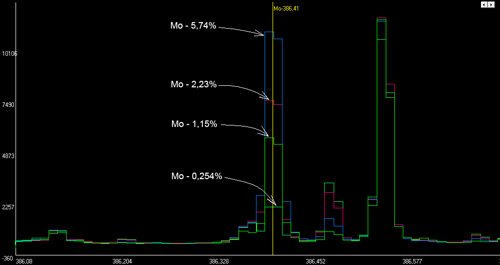
На рисунке представлены спектры четырех стандартных образцов инструментальной стали с разной концентрацией молибдена, наложенные друг на друга для наглядности. Четко видно, что аналитическая линия молибдена имеет разную интенсивность (высоту) на всех спектрах. Причем, чем больше концентрация молибдена, тем выше интенсивность аналитической линии.
Образцы: РГ15 (Mo-5,74%), РГ14 (Mo-2,23%), РГ18 (Mo-1,15%), РГ13 (Mo-0,254%).
Линия Мо-368,410 нм, участок спектра шириной 0,6 нм.![Линия молибдена 368,410 нм, участок спектра шириной 0,6 нм.]()
Для получения эмиссионного спектра атомам анализируемого вещества необходимо придать дополнительную энергию так, чтобы электроны перешли на более высокие орбиты, т.е. перевести атомы в «возбужденное» состояние. (Термин «возбужденное» состояние является устоявшимся в атомно эмиссионном спектральном анализе и далее будет применяться без кавычек).
С этой целью анализируемую пробу вводят в источник возбуждения спектров, где она подвергается абляции (т.е. «вырыванию» с поверхности микрочастиц), нагреву и испарению. Источник возбуждения спектров тем или иным способом формирует насыщенную энергией область пространства с достаточно высокой температурой.
Попавшие в эту высокотемпературную область пространства микрочастицы анализируемой пробы распадаются на атомы. Эти атомы пробы при столкновениях с другими частицами переходят в возбужденное и ионизированное состояния. В таком состоянии атомы и ионы могут находиться очень короткое время (10 -8 – 10 -7 с). Самопроизвольно возвращаясь в нормальное или промежуточное состояние, они испускают избыточную энергию в виде фотонов, совокупность которых и образует эмиссионный спектр.
Измеряя интенсивность линий спектра атомов (или ионов) того или иного химического элемента, определяют концентрацию этого химического элемента в анализируемой пробе. Читать дальше
Спектрометры во вторичной металлургии. Обзор
Определить на глаз тип стали или сплава лома цветных металлов не способен даже опытный приемщик. На практике атомно-эмиссионный анализ необходим для эффективного и быстрого решения задач по разбраковке сталей и сплавов цветных металлов. Спектрометры требуются для идентификации марок сталей на месте складирования.
Благодаря атомно-эмиссионному спектральному анализу можно узнать тип стали и марку, а также определить количественное содержание примесей в металле и в конечном итоге стоимость материала.
Применение атомно-эмиссионной спектроскопии в процессах вторичной металлургии

Порядок использования атомно-эмиссионного спектрометра во вторичной металлургии:
- С помощью спектрометра определяют химический состав ломов, с последующим распределением по группам.
- После переплавки, берется проба расплава, которая остужается и анализируется точным количественным методом определения состава химических веществ. По результатам анализа металла, решается вопрос добавления необходимого количества легирующих элементов с целью получения необходимой марки сплава.
- Отработанные методики и подобранные стандарты проверки позволяют добиться оперативного, надежного и простого процесса анализа.
Более подробно о методах анализа написано в статье, рассказывающей об оценке точности спектрального анализа.
Особенности регистрации спектра атомно-эмиссионными спектрометрами
Атомно-эмиссионная или как ее еще называют оптико-эмиссионная спектроскопия работает с оптическим спектром излучения атомов и ионов в исследуемом пробном образце. В спектрометре Искролайн 100 в качестве источника возбуждения излучения используется низковольтная униполярная искра в атмосфере аргона.
Приборы серии Искролайн позволяет определяет концентрации примесей в диапазонах от 0,0001-0,001% до 90%, особенно во время проверки металлического лома, где важно выяснить содержание таких элементов как фосфор, углерод и сера.
Для регистрации спектра необходимо подготовить исследуемую пробу проведя механическую обработку поверхности.
Количественный анализ пробы металла выполняется с использованием калибровок, основанных на применении стандартных образцов проб с известным содержанием определяемых химических элементов.
Результаты количественного анализа могут быть использованы для подтверждения сертификатов (паспортов) проверяемых изделий.
Использование спектрометров серии Искролайн для решения проблем вторичной металлургии
Атомно-эмиссионные спектрометры серии Искролайн – анализаторы металлов, предназначенные для идентификации сплавов на основе Fe, Cu, Al, Ti, Pb, Sn, Mg и др. Кроме того, они определяют в составе стали “легкие” химические элементы типа углерод, сера, фосфор мышьяка и др.
В приборах серии Искролайн в качестве плазмообразующего газа используют аргон, поскольку это обусловлено его инертностью и легкостью ионизации. Благодаря этому прибор способен определять содержание углерода и мышьяка в металле, которые в обычной плазме не детектируются.
Приборы серии Искролайн отличает широкий диапазон калибровок, доступность любых спектральных линий в диапазоне 120 – 930 нм с разрешением 0,02 – 0,04 нм. Для достоверной аналитической проверки правильности показаний, приборы обеспечены стандартными образцами сравнения.
Атомно-эмиссионные приборы серии Искролайн зарекомендовали себя надежными и стабильными рабочими устройствами.
Искровой метод анализа хоть относится к разрушающим методам, но сопровождается лишь незначительным испарением металла в месте проведения измерения. Ввиду чего изделие может беспрепятственно эксплуатироваться и дальше.
Анализ металлического сырья долго находившегося или хранившегося в ненадлежащих условиях проводится после специальной пробоподготовки пробы, что позволяет добиваться стабильных результатов анализа.
Достоинства атомно-эмиссионного анализа приборами серии Искролайн
- Стабильность источника возбуждения спектров.
- Высокая чувствительность. Предел обнаружения по некоторым элементам достигает 0,000001-0,00001 %.
- Возможность одновременного определения более 70 элементов.
- Практически неограниченный диапазон определяемых концентраций одновременно на нескольких аналитических линиях определяемых элементов различной степени интенсивности.
- Высокая точность и стабильность анализов анализа.
- Случайная относительная погрешность анализа менее значительно превосходит ГОСТ погрешность и зависит от конкретной методики анализа, проверяемого металла, качества эталонов ГСО (стандартных образцов по ГОСТ), величины массовой доли.
- Скорость обнаружения большого количества элементов не превышает 1-2 минуты.
Приборы серии Искролайн благодаря универсальности, диапазону определяемых содержаний, многоэлементности, доступности аппаратуры, простоте проведения анализов, повышенной производительности и экономичности считается востребованным методом анализа металлов вторичной металлургии.
АТОМНО-ЭМИССИОННАЯ СПЕКТРОСКОПИЯ. ФОТОМЕТРИЯ ПЛАМЕНИ
Атомно-эмиссионная спектроскопия – группа методов анализа, основанных на измерении длины волны и интенсивности светового потока, излучаемого возбужденными атомами в газообразном состоянии.
При эмиссионном анализе определяемое вещество, находящееся в газовой фазе, подвергают возбуждению, сообщая системе энергию в виде ЭМИ. Валентные электроны атома переходят на более высокий энергетический уровень. Энергия, необходимая для перехода атома из нормального в возбужденное состояние, называется энергией возбуждения (потенциалом возбуждения). В возбужденном состоянии атом находится 10 –9 –10 –8 с, затем, возвращаясь на низкий энергетический уровень, испускает квант света строго определенной частоты и длины волны. Приборами фиксируют длину волны испускаемую атомом и получают линейчатый атомный спектр, который состоит из набора отдельных линий.
Элементы, содержащиеся в пробе, идентифицируют по набору спектральных линий (на основании частот или длин волн) испускаемого ЭМИ. Количественный анализ основан на измерении интенсивности спектральных линий элементов.
Общая схема спектральных приборов
СВП – система ввода пробы (компрессор для получения аэрозоля).
СВС – система выделения спектра
СРС – система регистрации
Фотометрия пламения – метод анализа, основанный на фотометрировании излучения возбужденных в пламени атомов. Вследствие невысокой температуры в пламени возбуждаются спектры элементов, имеющих низкую энергию возбуждения, – щелочные и щелочноземельные металлы.
При использовании наиболее распространенного пламени природного газа в смеси с воздухом (t = 1700–1900 О С) определяют 12 щелочных и щелочноземельных металлов, медь, серебро (табл. 3). Изменяя характеристику пламени, можно увеличить число определяемых элементов (табл. 4).
Аналитические линии важнейших элементов
| Элемент | Длина волны, нм | Евозб, эВ | Еи, эВ | Характеристика (окраска) линии |
| Калий | 766,50 | 1,62 | 4,34 | Темно-красная линия |
| Натрий | 588,99 | 2,10 | 5,14 | Желтая линия |
| Литий | 670,78 | 1,85 | 5,39 | Красная линия |
| Магний | 285,20 | 4,37 | 7,65 | Фиолетовая линия |
| Кальций | 422,67 | 3,10 | 6,11 | Фиолетовая линия |
| Барий | 553,55 | 2,24 | 5,21 | Желто-зеленая линия |
| Медь | 515,50 | 4,52 | 7,72 | Зеленая линия |
| Горючий газ | Окислитель | t, 0 С | Возбуждаемые элементы |
| Природный газ (пропан-бутан) | Воздух | Щелочные металлы | |
| Ацетилен | Воздух | Щелочные и щелочноземельные металлы | |
| Водород | Кислород | Щелочные, щелочноземе-льные и тяжелые металлы | |
| Ацетилен | Кислород | Ag, Cu, Mn | |
| Ацетилен | Оксид азота N2O | Тяжелые металлы (Pb, Cr, Cd, Fe, Sn) |
Возбуждению атомов в пламени предшествуют другие процессы, происходящие в пламени: испарение растворителя, кристаллизация пробы, сублимация (возгонка) твердого вещества, термическая диссоциация (распад молекулы на атомы). Под действием температуры пламени атомы металла переходят в возбужденное состояние (Me • Ме*), рис. 1. При переходе атома из возбужденного в нормальное состояние происходит эмиссия. Возбуждению атомов может сопутствовать ионизация, приводящая к завышению результатов анализа, т.к. энергия излучения ионов накладывается на излучение определяемых элементов. Кроме того, энергия, излучаемая возбужденными атомами, может поглощаться невозбужденными атомами и другими частицами, не попадая на фотоэлемент (самопоглощение). Это явление приводит к заниженным результатам анализа. Для получения достоверных данных необходимо устранить явления ионизации атомов и самопоглощения.
Рис. 1. Схема процессов и физических явлений, происходящих в пламени
Качественный анализ проводят по окраске перлов пламени и характерным спектральным линиям элементов (табл. 3). Количественный анализ основан на эмпирической зависимости интенсивности спектральной линии (I) определяемого элемента от его концентрации в пробе (с), которая описывается уравнением Ломакина-Шейбе:
где а – коэффициент, зависящий от режима работы источника возбуждение (температуры и стабильности пламени); b – коэффициент самопоглощения.
Для определения концентрации металла в пробе применяют методы градуировочного графика и добавок.
Устройство пламенного фотометра.
Схема пламенного фотометра представлена на рис. 2. Анализируемый раствор через капилляр 1 под действием сжатого воздуха от компрессора 2 всасывается в распылитель 3 и в виде мелкодисперсного аэрозоля поступает в пламя горелки 5, предварительно смешиваясь с горючим газом. Конденсат выводится из распылителя и собирается в сосуде 4.
Возбужденные в пламени атомы элементов излучают свет определенной длины волны. Для устранения мешающего влияния излучения других элементов в приборе имеется система чувствительных селективных светофильтров 6, позволяющих выделить из общего светового потока излучение определяемого элемента. Монохроматический световой поток, попадая на фотоэлемент 7, вызывает фототок, интенсивность которого регистрирует микроамперметр 8. Измеряемая прибором величина – интенсивность излучения I, мкA.
Рис. 2. Схема пламенного фотометра: 1 – сосуд с анализируемым раствором; 2 – трубопровод от компрессора; 3 – распылитель; 4 – сосуд с конденсатом; 5 – пламя; 6 – светофильтр; 7 – фотоэлемент; 8 – микроамперметр
Читайте также: