Атомно кристаллическое строение металлов и сплавов
Обновлено: 05.07.2024
Физико-механические свойства металлов тесно связаны с особенностями их кристаллического строения. В твердом состоянии атомы всех металлов и металлических сплавов располагаются в строгом порядке, образуя в пространстве правильную кристаллическую решетку. В промышленных металлах наиболее распространены следующие кристаллические решетки (рис. 11.2): кубическая объемно-центрированная, кубическая гранецентрированная и гексагональная. В элементарной кубической объемно - центрированной решетке находится девять атомов (восемь в вершинах куба и один в центре). Такую решетку имеет железо при температуре до 910°С и выше 1390°С, хром, вольфрам, ванадии и др. В кубической гране центрированной решетке 14 атомов (восемь в вершинах куба и по одному в центре каждой грани). Такую решетку имеют: железо при температуре 910-1390°С, медь, никель, алюминий и др. В гексагональной решетке, имеющей форму шестигранной призмы, 17 атомов (12 в вершинах, два в центре оснований и три внутри призмы). Данная решетка имеется у магния, цинка и других металлов.

Возможны и другие формы кристаллических решеток. Атомы в решетке находятся на определенных расстояниях один от другого. Эти расстояния очень малы и вычисляются в нанометрах (1 нм = 10 -9 м). Расположение атомов, межатомные расстояния, насыщенность атомами все, что влияет на качество металлов.
Размеры кристаллической решетки характеризуются параметрами (периодами) – расстояниями между центрами атомов, расположенных в узлах элементарной ячейки. Например, для железа эти параметры равны 28,4 - 36,3 нм. При этом плотность и степень упаковки атомов кристаллической решетки характеризуется отношением объема, занятого атомами, к объему кристаллической решетки.
В зависимости от формы кристаллической ячейки и степени ее упаковки каждый атом имеет различное число взаимных контактов с другими атомами. Эта величина характеризуется координационным числом – числом атомов, находящихся на наиболее близком равном расстоянии от данного атома: при кубической объемно-центрированной решетке – К18; при кубической гранецентрированной – К12 и др. Каждый металл имеет свою характерную кристаллическую ячейку, которая многократно повторяется и образует решетку его структуры.
В металлах действуют различные виды физико-химической связи: металлическая, ван-дер-ваальсовая, ионная и ковалентная. В переходных металлах, к которым относится сталь, преобладает металлическая связь, возникающая за счет сил притяжения между решеткой из положительно заряженных ионов и окружающим их «газом » свободных электронов.
При отсутствии внешней нагрузки атомы в кристалле находятся на равновесных расстояниях. Если приложить сжимающую нагрузку, то атомы будут сближаться до такого расстояния, при котором внутренние отталкивающие силы уравновесят внешние сжимающие силы. При растяжении кристалла расстояние между атомами увеличивается до тех пор, пока силы притяжения не уравновесят внешнюю нагрузку. Сопротивление деформированию определяется сопротивлением сдвигу одного атомного слоя относительно другого, соседнего. В случае приложения внешней силы наряду со сдвигом разрушение может произойти путем отрыва одной части кристалла от другой. Теоретически вычисленные напряжения, необходимые для отрыва одного атомного слоя от другого, на несколько порядков выше, чем прочность реальных кристаллов.
Столь большое расхождение между теоретической и реальной прочностью металлов обусловлено дефектами кристаллов. Дефекты, в кристаллах по геометрическим признакам разделяют на точечные, линейные, поверхностные и объемные. Точечные имеют размер порядка диаметра атома. К ним относят чужеродные атомы (примеси), вакансии, межузельные атомы и др. Линейные дефекты обладают сечением порядка атома и одним протяженным размером. Это дислокации различных типов, цепочки вакансий, межузельных атомов. К поверхностным дефектам причисляют границы зерен и блоков, свободные поверхности кристаллов и др., они имеют только один малый размер – толщину. К объемным дефектам относят в кристаллах микротрещины, поры, различные включения.
Рекомендуемые материалы



Дислокации играют главную роль в процессах пластической деформации металлов, они в значительной мере определяют их реальную прочность. Дислокации бывают краевые, винтовые и смешанные криволинейные. Возникают они в металлах в процессе кристаллизации, пластической деформации и по другим причинам, вызывающим создание в кристаллической решетке полей напряжений, приводящих к соответствующим локальным деформациям и смещениям. Краевые, или линейные, дислокации характеризуются появлением в кристалле добавочной незавершенной атомной плоскости (экстраплоскости). Дислокация называется положительной (рис. 11.3), если экстраплоскость лежит в верхней части кристалла, и отрицательной, если она расположена в нижней части кристалла.
Винтовая дислокация (рис. 11.4) появляется, если в кристалле сделать надрез и сдвинуть вниз одну часть кристалла относительно другой на одно межатомное расстояние (на рис. 11.4 плоскость сдвига заштрихована). Как видно из рисунка, смещение уменьшается от точки А к точке В, что вызывает изгиб атомных плоскостей. Несовершенная область вокруг линии ВС называется винтовой дислокацией, так как после появления такого несовершенства атомные плоскости кристалла закручиваются подобно винтовой лестнице.
Дефекты кристаллического строения возникают уже в процессе кристаллизации металла. Взаимодействие дефектов между собой приводит к образованию новых несовершенств. Нарушения правильности кристаллического строения приводят к изменению свойств металла.
Дислокации оказывают большое влияние на прочностные характеристики металла. На рис. 11.5 показана обобщенная зависимость между прочностью и плотностью дислокаций D. Идеальные (бездефектные) кристаллы имеют теоретическую прочность. К этому значению приближается прочность сверхтонких кристаллов с диаметром порядка 1 мкм и менее, практически не содержащих дислокаций. Такие кристаллы получили название нитевидных (НК).
Достигнув минимального значения при некоторой критической плотности дислокаций, реальная прочность вновь начинает возрастать. Повышение реальной прочности с возрастанием плотности дислокаций выше D кр объясняется тем, что при этом возникают не только параллельные друг другу дислокации, но и дислокации в разных плоскостях и направлениях. Такие дислокации будут мешать друг другу перемещаться, т. е. в элементарный акт пластической деформации будет вовлекаться одновременно все большее число атомов, и реальная прочность металла повысится. Традиционными способами упрочнения металлов, ведущими к увеличению плотности дислокаций, являются механический наклеп, измельчение зерна и общее фрагментирование кристаллов в результате термообработки.
Пространственные кристаллические решетки образуются в металле при его переходе из жидкого состояния в твердое. Этот процесс называется кристаллизацией. Превращения, происходящие в процессе кристаллизации, имеют важное значение, так как в значительной степени определяют свойства металла. Кристаллизация состоит в следующем. В жидком металле атомы непрерывно движутся. По мере понижения температуры движение замедляется, атомы сближаются и группируются в кристаллы. Эта первичная группа кристаллов получила название центров кристаллизации. Далее к этим центрам присоединяются вновь образующиеся кристаллы. Одновременно продолжается образование новых центров. Таким образом, кристаллизация состоит из двух стадии: образования центров кристаллизации и роста кристаллов вокруг этих центров.

На рис. 11.6 показан механизм кристаллизации. Сначала рост кристаллов не встречает препятствий (рис. 11.6, а,б), и растущие кристаллы сохраняют правильность строения кристаллической решетки. При дальнейшем движении кристаллы сталкиваются, и образовавшиеся зерна имеют уже неправильную форму, но сохраняют правильность строения внутри каждого кристалла. Такие группы кристаллов называют зернами (рис. 11.6, в-д). На рис. 11.6, е показаны границы зерен различных размеров. Размеры зерен зависят от природы металла и условий его кристаллизации.

При охлаждении расплава металла с началом его кристаллизации падение температуры прекращается, на кривой охлаждения (рис. 11.7) образуется горизонтальный участок (см. левый график). Это объясняется тем, что группировка атомов идет с выделением теплоты. По окончании затвердевания температура снова понижается. По закону кристаллизации чистых металлов каждый металл кристаллизуется при строго индивидуальной температуре.
Температуру, при которой металл переходит из жидкого состояния в твердое, называют температурой первичной кристаллизации. Кроме первичной кристаллизации, возможна и вторичная – изменение кристаллического строения металлов в твердом состоянии.
При быстром отводе теплоты некоторые металлы способны определенное время находиться в жидком состоянии при температуре ниже границы первичной кристаллизации. Это явление объясняют следующим образом. В результате быстрого отвода теплоты образуется много центров кристаллизации и происходит их интенсивный рост, что приводит к выделению значительного количества теплоты, способной некоторое время поддерживать металл в жидком состоянии и даже повышать его температуру.

Металлы обладают свойствами аллотропии, т. е. способностью одного и того же химического элемента при различной температуре иметь разную кристаллическую структуру. Аллотропические превращения сопровождаются выделением или поглощением теплоты. Железо имеет четыре аллотропические формы: -Fe; -Fe. Практическое значение имеют только -Fe так как -Fe и
Температура, при которой происходит переход металла из одной аллотропической формы в другую, называется критической. Точки этих температур видны на диаграмме охлаждения чистого железа (см. рис. 11.8) как температуры горизонтальных участков, свидетельствующих о том, что фазовые превращения происходят с выделением теплоты.
Технические металлы и сплавы представляют собой поликристаллические тела, т. е. тела, состоящие из большого числа различно ориентированных кристаллических зерен; поперечные размеры этих зерен 0,001-0,1 мм.
Поэтому в целом металлы и сплавы можно считать условно изотропными телами, т. е. обладающими одинаковыми свойствами по всем направлениям.
Лекция 3. Атомно – кристаллическое строение металлов и сплавов
Атомно – кристаллическое строение металлов и сплавов. Основные типы кристаллических решеток: объемно - центрированная кубическая, гранецентрированная кубическая, гексагональная плотноупакованная, тетрагональная решетки. Параметры кристаллических решеток. Кристаллографические плоскости и направления. Определение индексов кристаллографических плоскостей и направлений. Реальное строение металлов. Классификация дефектов кристаллического строения. Их краткая характеристика.
Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном, переходы между которыми (так называемые фазовые переходы) сопровождаются скачкообразными изменениями свободной энергии F (F = U — TS, где U — внутренняя энергия; Т —температура; S — энтропия), энтропии, плотности и других физических свойств. Четвертым агрегатным состоянием часто называют плазму — сильно ионизированный газ (т. е. газ заряженных частиц — ионов, электронов), образующийся при высоких температурах (свыше 10 5 К). Однако это утверждение неточно, так как между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющимся на больших расстояниях.
Реализация того или иного агрегатного состояния вещества зависит главным образом от температуры и давления, при которых оно находится.
Т.о. можно отметить, что в газообразном состоянии атомы расположены хаотически, в жидком состоянии имеют близкий порядок в расположении атомов, а в кристаллическом состоянии имеется и ближний и дальний порядок в расположении атомов.
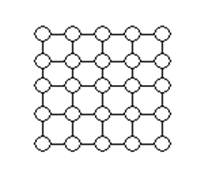
Правильное, закономерное расположение частиц в пространстве и характеризует кристаллическое состояние. Кристаллическое состояние можно представить в виде плоской решетки, в узлах которой расположены атомы (рисунок 11) Такое изображение решетки называется кристаллографической плоскостью.
Это обуславливает то, что в кристалле каждый атом имеет одно и тоже ближайшее количество атомов – соседей, расположенных на Одинаковом расстоянии.
Кристаллическая решетка – это неоднократное повторение кристаллографической плоскости во всех направлениях.
Кристаллическую решетку можно «построить», выбрав для этого определенный «строительный блок» (аналогично постройке стены из кирпичей) и многократно смещая этот блок по трем непараллельным направлениям. Такая «строительная» единица кристаллической решетки имеет форму параллелепипеда и называется элементарной ячейкой. Все элементарные ячейки, составляющие кристаллическую решетку, имеют одинаковую форму и объемы. Атомы могут располагаться как в вершинах элементарной ячейки, так и в других ее точках (в узлах кристаллической решетки). В первом случае элементарные ячейки называются простыми (примитивными), во втором — сложными. Если форма элементарной ячейки определена и известно расположение всех атомов внутри нее, то имеется полное геометрическое описание кристалла, т.е. известна его атомно-кристаллическая структура.
В кристаллографии рассматривают 14 типов элементарных ячеек. Их называют пространственными решетками Бравэ. Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки а, Ь, с и три угла между ними. Эти величины называются параметрами элементарной ячейки (кристаллической решетки). Все 14 решеток Бравэ распределены по семи кристаллическим системам (сингониям) в соответствии с ориентацией и относительными величинами параметров решетки (рис. 12). Каждая кристаллическая система включает одну или несколько типов пространственных кристаллических решеток. В простой решетке атомы располагаются только по вершинам решетки, в объемноцентри-рованной еще один атом в центре решетки, в гранецентрированной еще по одному атому в центре каждой грани, и в базоцентрированной еще по одному атому в центрах пары параллельных граней.
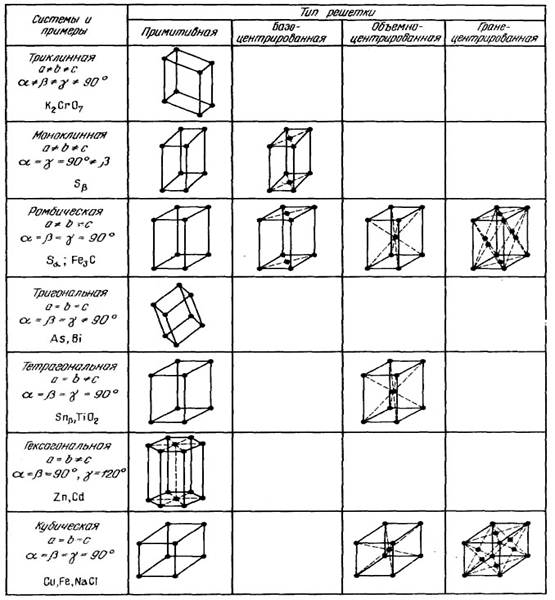
Рисунок 12 – Основные типы кристаллических решеток и их характеристики
Наиболее распространенными среди металлов являются гексагональная плотноупакованная решетка (ГПУ) –Mg, Zn, Co, Ti; гранецентрированная кубическая решетка (ГЦК) – Fe, Ni, Cu, Al, Pb, Ag, Au; объемно-центрированная кубическая решетка (ОЦК) – Fe, Cr, W, V, Mo (рисунок 13).
Компактность структуры является одним из факторов, уменьшающим свободную энергию твердого тела, т. е. обеспечивающим его равновесное состояние и следствием особенностей электронной структуры металлов и характером их межатомного взаимодействия. Поэтому основной характеристикой кристаллической решетки является координационное число. За координационное число принято число ближайших соседей данного атома, находящихся от него на одинаково близком расстоянии.
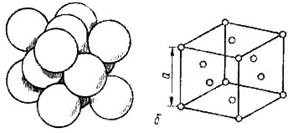
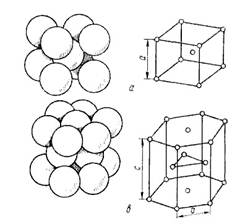
Рисунок 13- Основные виды кристаллических решеток и расположение в них атомов.
Точечное расположение атомов в кристаллических решетках, приведенных на рисунке 3, является условным, так как в действительности атомы имеют определенный размер и могут соприкасаться друг с другом. Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Параметры элементарной ячейки а, Ь, с и атомные радиусы измеряются в ангстремах (1Å – 10 -8 см). Параметры решетки металлов (их также называют периодами решетки) находятся в пределах 0,2—6,7 Å и определяются методом рентгеноструктурного анализа с точностью до третьего, а при необходимости и до четвертого или даже пятого знака после запятой.
Атомно-кристаллическое строение металлов
Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
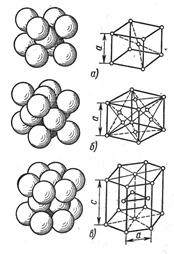
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Расстояния между центрами соседних атомов в кристаллической решетке называется периодом (а, b, с). Расстояния между атомами измеряются в ангстремах - , 1 = 1•10 -8 см.
Базис кристаллической решетки - это число атомов, принадлежащих одной элементарной кристаллической ячейке; для ОЦК базис равен 2, для ГЦК – 4, ГПУ – 6.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
Металлические материалы. 83 из известных 112 химических элементов таблицы Менделеева Д. И. являются металлами. Они обладают рядом характерных свойств:
- высокой тепло- и электропроводностью;
- положительным коэффициентом электросопротивления (с повышением температуры электросопротивление растет);
- термоэлектронной эмиссией (испусканием электронов при нагреве);
- хорошей отражательной способностью (блеском);
- способностью к пластической деформации;
Наличие перечисленных свойств обусловлено металлическим состоянием вещества, главным из которых является наличие легкоподвижных коллективизированных электронов проводимости.
Металлическое состояние возникает в совокупности атомов, когда при их сближении внешние (валентные) электроны теряют связь с отдельными атомами, становятся общими и свободно перемещаются между положительно заряженными, периодически расположенными ионами. Силы притяжения (силы связи) в твердых телах существенно отличаются по своей природе. Обычно рассматривают четыре основных типа связей в твердых телах: ван-дер-ваальсовые, ковалентные, металлические, ионную.
Под атомно-кристаллической структурой понимают взаимное расположение атомов в кристалле. Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях. Наименьший комплекс атомов, который при многократном повторении в пространстве позволяет воспроизвести пространственную кристаллическую решётку, называют элементарной ячейкой.
Для характеристики элементарной ячейки используют параметры кристаллической решётки: три ребра а, в, с, измеряемых в ангстремах (1Å = 1* 10 -8 см) или в килоиксах – kX (1kX = 1,00202 Å) и три угла a, b, g, а также компактность структуры h - отношение объема, занимаемого атомами, к объёму ячейки ( для решётки ОЦК h = 64 %, для решётки ГЦК h = 74 %) и координационное число К - число ближайших соседей данного атома: для решётки ОЦК это число равно 8, т.е. атомы, находящиеся в вершине, принадлежат восьми элементарным ячейкам (рис.2.1.а), для решётки ГЦК это число равно 12, т.е. атомы, находящиеся в вершине, принадлежат двенадцати элементарным ячейкам (рис. 2.1.б).
Рис.2.1. Схема определения координационного числа кристаллической решётки: а – ГЦК; б – ОЦК; в – ГПУ
Простейшим типом кристаллической ячейки является кубическая решётка. В простой кубической решётке атомы расположены (упакованы) недостаточно плотно.
Стремление атомов металла занять места, наиболее близкие друг к другу, приводит к образованию решеток других типов (рис. 2.2):
- объёмноцентрированной кубической решётки (ОЦК) (рис.2.2а) с параметром
а = 0,28 – 0,6мм = 2,8 – 6,0 Å
- гранецентрированной кубической решётки (ГЦК) (рис.2.2б) с параметром
- гексагональной плотно упакованной решётки (ГПУ) (рис.2.2в) с параметром
Рис. 2.2. Кристаллические решётки: а – гранецентрированный куб (ОЦК); б – объемноцентрированный куб (ГЦК); в- гексагональная плотно упакованная (ГПУ)
Узлы (положения атомов), направления в плоскости и в пространстве обозначаются с помощью так называемых индексов Миллера (рис. 2.3). Индексы узла записываются – (mnp), индексы направления - [mnp], индекс плоскости - (hk1).

Рис. 2.3. Символы некоторых важнейших узлов, направлений и плоскостей в кубической решётке
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решётки многие свойства отдельно взятого кристалла (химические, физические, механические) по данному направлению отличаются от свойств в другом направлении и, естественно, зависят от того, сколько атомов встречается в этом направлении. Различие свойств в зависимости от направления испытания носит название анизотропии. Все кристаллы анизотропны. Анизотропия – особенность любого кристалла, характерная для кристаллического строения.
Технические металлы являются поликристаллами, т.е. состоят из совокупности кристаллитов с различной ориентацией. При этом свойства во всех направлениях усредняются.
2.1. Строение реальных кристаллов
Реальный кристалл состоит из скопления большого числа мелких кристаллов неправильной формы, которые называются зернами или кристаллитами (рис. 2.4).

Рис. 2.4. Блочная структура кристалла: схема (а); реальная блочная структура в алюминии (б), наблюдаемая в электронном микроскопе на просвет, (х 35000)
Зерно не является монолитным кристаллом, построенным из строго параллельных атомных слоев. В действительности оно состоит как бы из мозаики отдельных блоков, кристаллографические плоскости в которых повернуты друг относительно друга на небольшой угол – порядка нескольких минут. Такое строение зерна носит название мозаичной структуры, а составляющие ее блоки называются блоками мозаики.
Часто блоки объединяются в более крупные агрегаты – так называемые фрагменты. Фрагменты в свою очередь разориентированы относительно друг друга в несколько градусов. Зерна ориентированы случайно по отношению друг к другу. Преимущественная ориентация зерен называется текстурой. Поверхность раздела зерен называется границей.
Технические металлы являются поликристаллами, т.е. состоят из совокупности кристаллитов с различной ориентацией, что приводит к изменению свойств металлов при различных процессах их обработки.
При определенных условиях, обычно при очень медленном контролируемом отводе тепла при кристаллизации, может быть получен кусок металла, представляющий собой один кристалл, который называют монокристаллом.
2.2. Дефекты кристаллического строения
Строение реальных кристаллов отличается от идеальных. Реальные кристаллы всегда содержат несовершенства (дефекты) кристаллического строения, которые нарушают связи между атомами и оказывают влияние на свойства металлов.
Дефекты в кристаллах принято классифицировать по характеру их измерения в пространстве:
1. Точечные. Точечными дефектами называются нарушения периодичности кристалла, размеры которых сопоставимы с размерами атома во всех измерениях.
К точечным дефектам относятся вакансии, межузельные атомы, примеси замещения, примеси чужеродных атомов внедрения (рис. 2.5).

Рис. 2.5.Точечные дефекты в кристаллической решетке: а- вакансия;
б - межузельный атом; в- дефект Френкеля; г- примесные атомы замещения (большой) и внедрения (маленький).
Стрелками указаны направления смещений атомов в решетке.
Вакансии и межузельные атомы появляются в кристаллах при любой температуре выше абсолютного нуля из-за тепловых колебаний атомов. Каждой температуре соответствует равновесная концентрация вакансий, а также межузельных атомов. Например, в меди при температуре 20-25 о С содержится 10 -13 ат. % вакансий, а вблизи точки плавления - уже 0,01 ат. % (одна вакансия приходится на 10 4 атомов).
Пересыщение точечными дефектами достигается при резком охлаждении после высокотемпературного нагрева, при пластическом деформировании и при облучении нейтронами. Чем выше температура, тем больше концентрация вакансий и тем чаще они переходят от узла к узлу. Вакансии являются самой важной разновидностью точечных дефектов; они ускоряют все процессы, связанные с перемещениями атомов: диффузию, спекание порошков и т. д.
2. Линейные. Линейные дефекты в кристаллах характеризуются тем, что их поперечные размеры не превышают нескольких межатомных расстояний, а длина может достигать размера кристалла. К линейным дефектам относятся дислокации – линии, вдоль и вблизи которых нарушено правильное периодическое расположение атомных плоскостей кристалла.
Важнейшие виды линейных несовершенств - краевые и винтовые дислокации (рис.2.6).

Рис. 2.6. Схема дислокаций: а – краевая; б - винтовая
Краевая дислокация в сечении представляет собой край «лишней » полуплоскости в решетке (рис.2.7)

Рис. 2.7. Сечение простой кубической решетки: а - с краевой дислокацией; б - без дислокации.
Вокруг дислокаций решетка упруго искажена. Схема образования атмосферы Коттрелла в кристалле представлена на рисунке 2.8.
Рис. 2.8. Образование атмосферы Коттрелла: а – атомы примеси замещения (заштрихованы) и внедрения беспорядочно расположены в решетке; б, в – атомы примеси переместились к дислокации, в результате чего энергия решетки понизилась.
3. Поверхностные (двумерные). Под этими дефектами понимают нарушения, которые обладают большой протяженностью в двух измерениях и протяженностью лишь в несколько межатомных расстояний в третьем измерении.
К поверхностным дефектам относятся дефекты упаковки, двойниковые границы, границы зерен.
4.Объемные (трехмерные). Под ними понимают нарушения, которые в трех измерениях имеют неограниченные размеры. К таким нарушениям относят трещины, поры, усадочные раковины.
2.3. Превращения в твердом состоянии. Полиморфизм
Атомы данного элемента могут образовать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
Так, разные металлы образуют разные виды кристаллической решетки:
- Li, Na, K, Mo, W – ОЦК;
- Al, Ca, Cu, Au, Pt – ГЦК;
- Mg, Zr, Hf, осмий – ГПУ.
Однако в ряде случаев при изменении температуры или давления может оказаться, что для одного и того же металла более устойчивой будет другая решетка, чем та, которая существует при данной температуре или давлении. Так, например, существует железо с решетками объемно-центрированного и гранецентрированного кубов, обнаружен кобальт с гранецентрированной и с гексагональной решетками.
Существование одного и того же металла (вещества) в нескольких кристаллических формах носит название полиморфизма или аллотропии. Различные кристаллические формы одного вещества называются полиморфными или аллотропическими модификациями (таблица 2.1).
Читайте также:
