Азот с активными металлами
Обновлено: 14.05.2024
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 вместо предполагаемой формулы 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 . Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(NH3)2]Cl и [Cu(NH3)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400 о С образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400 о С образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 о С может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d 10 4s 2 . Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900 o C (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 , т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
Раскаленный до температуры более 600 o С порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 o C соответственно):
С бромом же хром реагирует при температуре красного каления (850-900 o C):
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 o С:
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
С водородом хром не реагирует.
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 , то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» H2FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Либо же при избытке серы дисульфид железа:
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =t o => 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =t o => 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =t o => 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Взаимодействие с кислотами-окислителями
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 о С). т.е.:
2.3.3. Химические свойства азота и фосфора.
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
А также растворами кислот, например:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 о С и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным. Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение. Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
а при недостатке кислорода оксид фосфора (III):
Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
Фосфиды активных металлов подобно нитридам гидролизуются водой:
А также водными растворами кислот-неокислителей:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1:
При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит:
Азотная кислота
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:


Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:

Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.

Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азот с активными металлами

В этой статье мы рассмотрим характеристики азота в химии, узнаем, какие степени окисления может иметь азот и поговорим о важнейших соединениях, в состав которых входит этот химический элемент.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s 2 2s 2 2p 3 , в сокращенном виде — [He]2s 2 2p 3 . На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
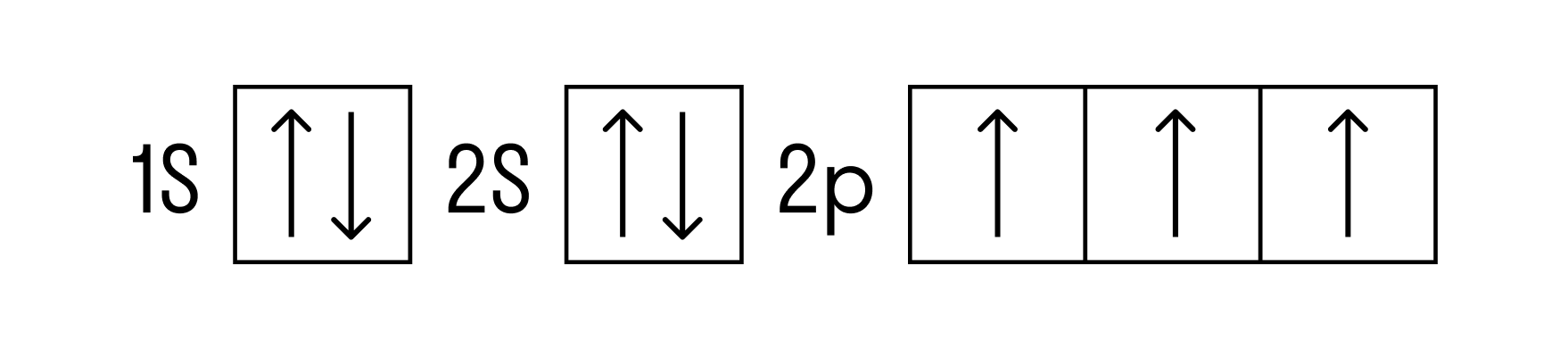
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.

Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
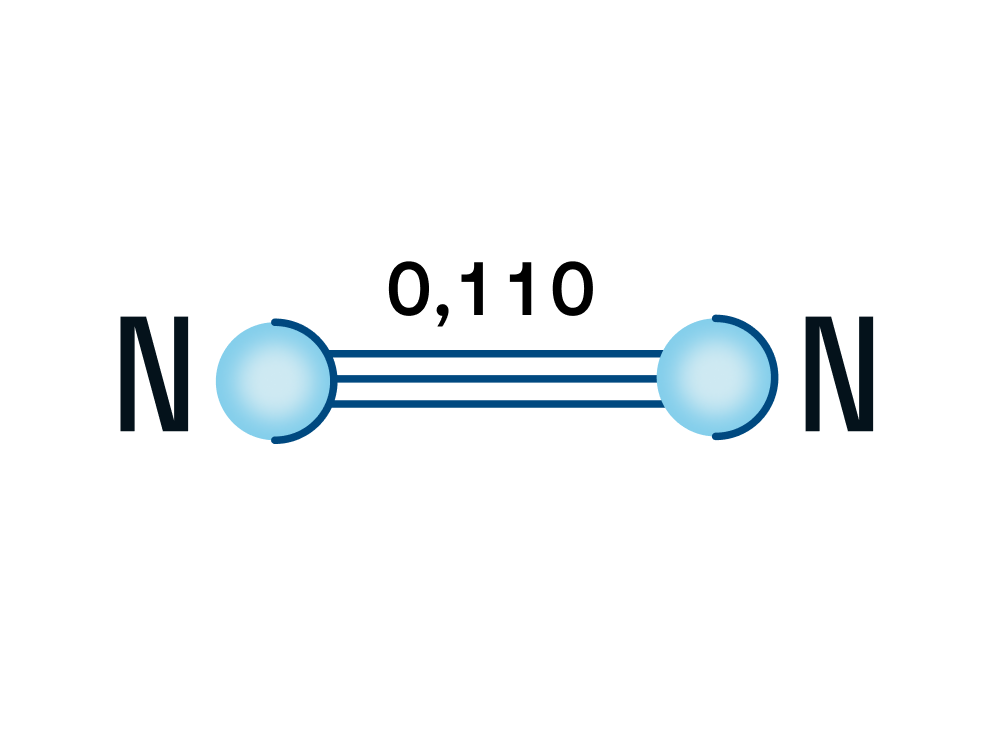
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
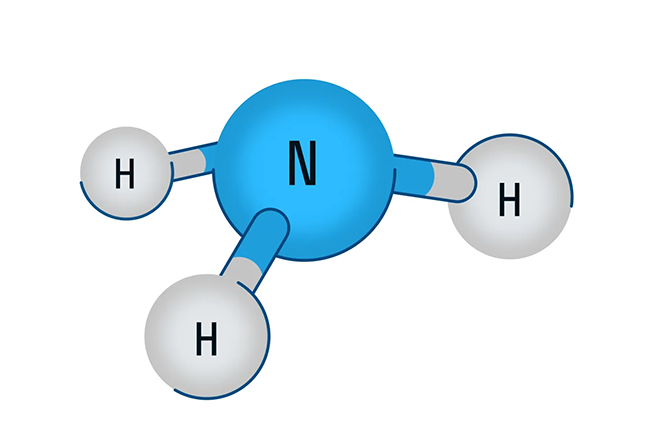
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
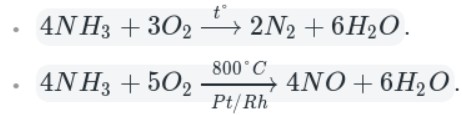
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
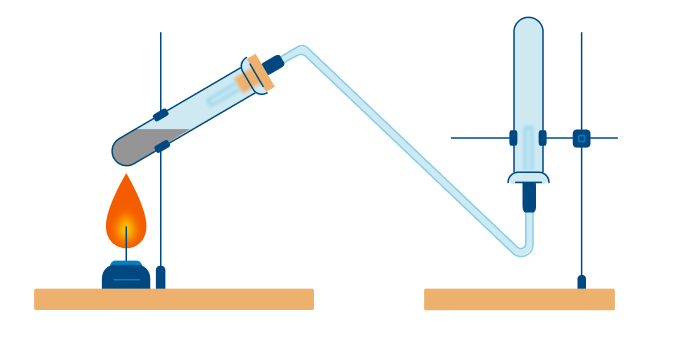
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
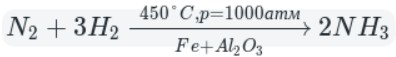
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O
Окисление оксида азота (II)
2NO + O2 = 2NO2
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
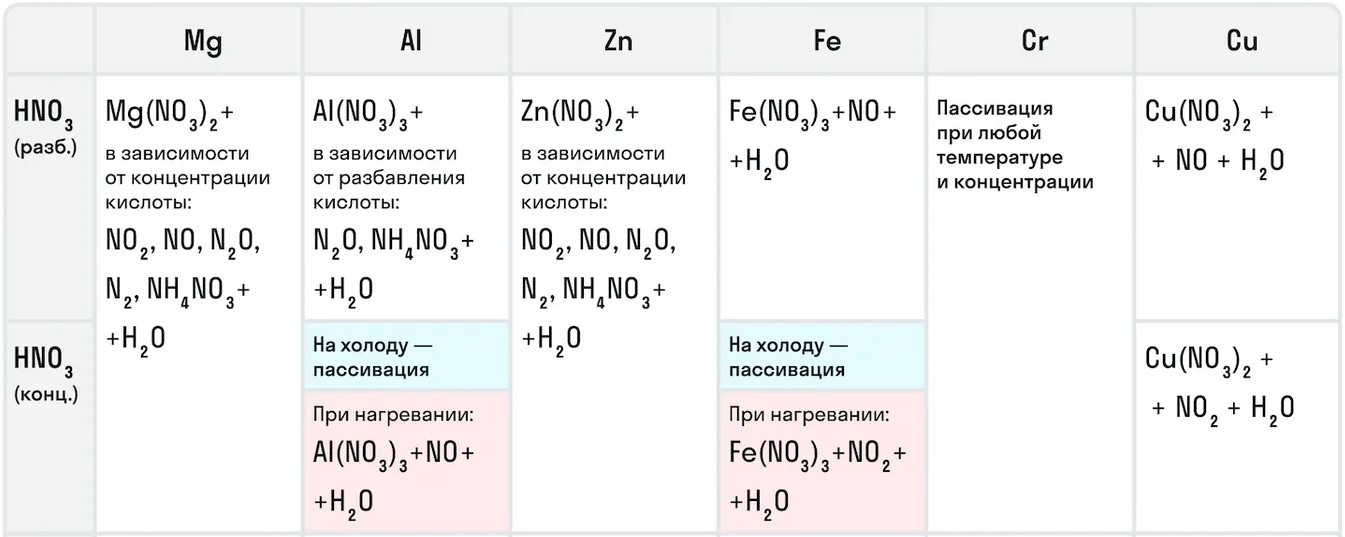
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
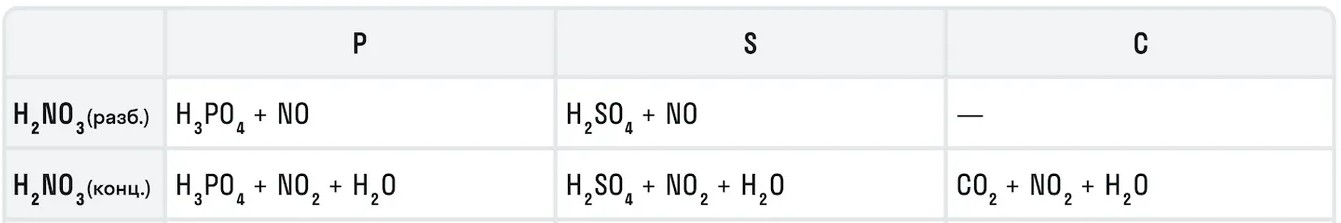
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
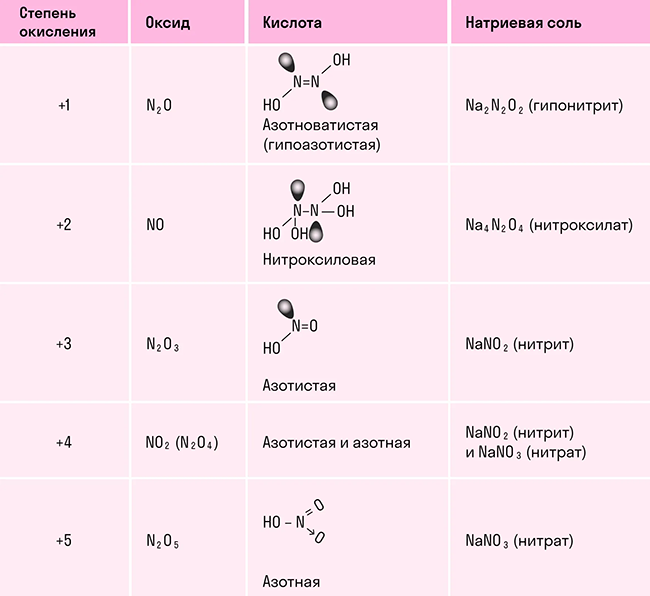
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная - до NO.

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Соли азотной кислоты - нитраты NO3 -
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.

Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота - до +2.
- Реакции с металлами, основаниями и кислотами
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Нитраты разлагаются в зависимости от активности металла, входящего в их состав.


Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Азотная кислота
Холодная концентрированная азотная кислота не вступает в реакцию с алюминием, происходит пассивирование.
2. Реакция концентрированной азотной кислоты с малоактивными металлами сопровождается выделением газа
В реакциях концентрированной азотной кислоты и малоактивных металлов преимущественно выделяется NO2.
3. Если в результате реакции активного металла с азотной кислотой выделилось твердое вещество, то речь идет о
Твердый продукт, образовавшийся в ходе реакции с азотной кислотой, нитрат аммония - NH4NO3
Разложение нитрата аммония протекает по схеме: AgNO3 → Ag + NO2 + O2
Азотной кислотой окрашивает пораженную в результате ожога кожу в желтый цвет.
Читайте также:
