B металл или неметалл
Обновлено: 22.09.2024
Бор — элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 5. Обозначается символом B (лат. Borum ). В свободном состоянии бор — бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен [1] .
Содержание
История и происхождение названия
Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бурак (араб. بورق ) или персидского бурах (перс. بوره ) [2] , которые использовались для обозначения буры [3] .
Нахождение в природе
Среднее содержание бора в земной коре 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется прежде всего тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространенных аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л [4] ), в водах соляных озёр, горячих источников и грязевых вулканов.
Основные минеральные формы бора:
Также различают несколько типов месторождений бора:
- Месторождения боратов в магнезиальных скарнах:
- людвигитовые и людвигито-магнетитовые руды;
- котоитовые руды в доломитовых мраморах и кальцифирах;
- ашаритовые и ашарито-магнетитовые руды.
- Месторождения боросиликатов в известковых скарнах (датолитовые и данбуритовые руды);
- Месторождения боросиликатов в грейзенах, вторичных кварцитах и гидротермальных жилах (турмалиновые концентрации);
- Вулканогенно-осадочные:
- борные руды, отложенные из продуктов вулканической деятельности;
- переотложенные боратовые руды в озёрных осадках;
- погребённые осадочные боратовые руды.
- Галогенно-осадочные месторождения:
- месторождения боратов в галогенных осадках;
- месторождения боратов в гипсовой шляпе над соляными куполами.
Крупнейшее месторождение России находится в Дальнегорске (Приморье). Оно относится к боросиликатному типу. В этом одном компактном месторождении сосредоточено не менее 3 % всех мировых запасов бора. На действующем при месторождении горно-химическом предприятии, выпускается боросодержащая продукция, которая удовлетворяет потребности отечественной промышленности. При этом 75 % продукции идёт на экспорт в Корею, Японию и Китай [5] [неавторитетный источник?] .
Получение
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
1. Метод металлотермии (чаще восстановление магнием или натрием):
2. Термическое разложение паров бромида бора на раскаленной (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
Физические свойства


Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
В природе бор находится в виде двух изотопов 10 В (20 %) и 11 В (80 %) [6] .
10 В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10 В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности.
Химические свойства

По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
.
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты Оксид бораПри взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO3 3− ), а тетрабораты, например:
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Бор применяется и в медицине при бор-нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей) [7] .
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2 − ) Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, «не содержащие хлор» («персиль», «персоль» и др.).
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода [8] . Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике [9] .
Борная кислота (H3BO3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде, применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путем изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Нитрид бора активированный углеродом является люминофором с свечением в УФ от синего до жёлтого цвета и обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но являлся широкой любительской практикой в первой половине XX века.
Бороводороды и борорганические соединения
Ряд производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Боразон и его гексагидрид
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, чем-то подобные органическим.
Так, гексагидрид боразона (H3BNH3, похож на этан по строению) при обычных условиях твёрдое соединение с плотностью 0,78 г/см 3 , содержит почти 20 % водорода по массе. Его могут использовать водородные топливные элементы, питающие электромобили [10] .
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)·10 −4 % бора , в костной ткани (1,1—3,3)·10 −4 % , в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора [11] .
Стоимость
Бор 80%-го обогащения по изотопу 10 В можно было купить [когда?] по цене 2-3 тыс. $ США/кг. [источник не указан 292 дня]
Неметаллы
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
| Группа | III | IV | V | VI | VII | VIII |
| 2-й период | B | C | N | O | F | Ne |
| 3-й период | Si | P | S | Cl | Ar | |
| 4-й период | As | Se | Br | Kr | ||
| 5-й период | Te | I | Xe | |||
| 6-й период | At | Rn |
Кроме того, к неметаллам относят также водород [источник?] и гелий.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Неметаллы" в других словарях:
НЕМЕТАЛЛЫ — НЕМЕТАЛЛЫ, химические элементы, которые не обладают свойствами, характерными для металлов. Неметаллы как правило плохие проводники тепла и электричества (они обычно являются изоляторами тепла и электричества). К неметаллам относятся углерод,… … Научно-технический энциклопедический словарь
НЕМЕТАЛЛЫ — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твердые тела бор,… … Большой Энциклопедический словарь
НЕМЕТАЛЛЫ — хим. элементы, которые образуют в свободном состоянии простые вещества, не обладающие физ. и хим. свойствами (см.); устаревшее название металлоиды. К Н. принято относить 22 элемента Периодической системы элементов Д. И. Менделеева (см.): водород … Большая политехническая энциклопедия
неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твёрдые тела бор,… … Энциклопедический словарь
Неметаллы — [nonmetals, metalloids] химические элементы, которые образуют простые тела, не обладающие характерными для металлов свойствами. К неметаллам относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии Н, N, О, F, Cl … Энциклопедический словарь по металлургии
Неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов (См. Металлы). Название Металлоиды, которое иногда применяют для Н., выходит из употребления. К Н. относятся 22 элемента. Из них при… … Большая советская энциклопедия
НЕМЕТАЛЛЫ — простые в ва, не обладающие св вами металлов. Хотя резкой границы между металлами и Н. провести нельзя, к Н. принято относить благородные газы, водород, галогены, кислород, халькогены, азот, фосфор, мышьяк, углерод, кремний и бор … Большой энциклопедический политехнический словарь
НЕМЕТАЛЛЫ — хим. элементы, к рые образуют простые тела, не обладающие свойствами, характерными для металлов. К Н. обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; тв. тела бор, углерод, кремний, фосфор,… … Естествознание. Энциклопедический словарь
НЕМЕТАЛЛЫ — простые вещества, не обладающие свойствами металлов: они не имеют металлического блеска, нековки, плохо проводят теплоту и электричество. Резкой границы между неметаллами и металлами нет. К неметаллам относятся 22 элемента. Из них при нормальной… … Металлургический словарь
Неорганическая химия — Неорганическая химия раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических… … Википедия
Бор

Бор (B, лат. borum ) — химический элемент 13-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе III группы, или к группе IIIA) с атомным номером 5. Бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Получение
- 4 Физические свойства
- 4.1 Изотопы бора
- 7.1 Элементарный бор
- 7.2 Соединения бора
- 7.3 Бороводороды и борорганические соединения
- 7.4 Боразон и его гексагидрид
![Бор]()
Впервые получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Хэмфри Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бурак (араб. بورق ) или персидского бурах (перс. بوره ), которые использовались для обозначения буры.
Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется, прежде всего, тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространённых аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л), в водах соляных озёр, горячих источников и грязевых вулканов.
![Бор]()
- Месторождения боратов в магнезиальных скарнах:
- людвигитовые и людвигито-магнетитовые руды;
- котоитовые руды в доломитовых мраморах и кальцифирах;
- ашаритовые и ашарито-магнетитовые руды.
- борные руды, отложенные из продуктов вулканической деятельности;
- переотложенные боратовые руды в озёрных осадках;
- погребённые осадочные боратовые руды.
- месторождения боратов в галогенных осадках;
- месторождения боратов в гипсовой шляпе над соляными куполами.
Крупнейшее месторождение России находится в Дальнегорске (Приморье). Оно относится к боросиликатному типу. В этом одном компактном месторождении сосредоточено не менее 3 % всех мировых запасов бора. На действующем при месторождении горно-химическом предприятии выпускается боросодержащая продукция, которая удовлетворяет потребности отечественной промышленности. При этом 75 % продукции идёт на экспорт в Корею, Японию и Китай.
- Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
- Метод металлотермии (чаще восстановление магнием или натрием):
- Термическое разложение паров бромида бора на раскалённой (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
![Бор]()
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора — самый высокий предел прочности на разрыв 5,7 ГПа.
Изотопы бора
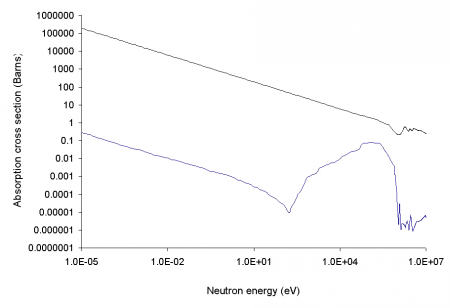
В природе бор находится в виде двух изотопов 10 B (19,8 %) и 11 B (80,2 %).
10 B имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуются два нерадиоактивных ядра (альфа-частица и литий-7), очень быстро тормозящиеся в среде, а проникающая радиация (гамма-кванты) при этом отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
10 B + n → 11 B* → α + 7 Li + 2,31 МэВ.
Поэтому 10 B в составе борной кислоты и других химических соединений применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор применяется в нейтрон-захватной терапии рака.
Кроме двух стабильных, известно ещё 12 радиоактивных изотопов бора, из них самым долгоживущим является 8 B с периодом полураспада 0,77 с.
Происхождение
Все изотопы бора возникли в межзвёздном газе в результате расщепления тяжелых ядер космическими лучами, или при взрывах сверхновых.
![Бор]()
При отсутствии окислителей бор устойчив к действию растворов щелочей. Растворяется в расплаве смеси гидроксида и нитрата калия:
В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице.
Также бор часто используют в электронике в качестве акцепторной добавки для изменения типа проводимости кремния.
Бор применяется и в медицине при бор-нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей).
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2 − ) [B4O12H8] − ) применяются как окислительные агенты. Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, не содержащие хлор («персиль», «персоль» и др.).
Отдельно также стоит указать на то, что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (B(OH)3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путём изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Борная кислота применяется также в медицине и ветеринарии.
Нитрид бора, активированный углеродом, является люминофором со свечением от синего до жёлтого цвета под действием ультрафиолета. Обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но широко практиковалось химиками-любителями в первой половине XX века.
Боросиликатное стекло — стекло обычного состава, в котором заменяют щелочные компоненты в исходном сырье на окись бора (B2O3).
Фторид бора BF3 при нормальных условиях является газообразным веществом, используется как катализатор в оргсинтезе, а также как рабочее тело в газонаполненных детекторах тепловых нейтронов благодаря захвату нейтронов бором-10 с образованием ядер лития-7 и гелия-4, ионизирующих газ (см. реакцию выше).
Ряд производных бора (бороводороды) являются эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения бора с водородом и углеродом стойки к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, в чём-то подобных органическим.
Так, гексагидрид боразона (H3BNH3, похож на этан по строению) при обычных условиях твёрдое соединение с плотностью 0,78 г/см 3 , содержит почти 20 % водорода по массе. Его могут использовать водородные топливные элементы, питающие электромобили.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)⋅10 −4 % бора , в костной ткани (1,1—3,3)⋅10 −4 % , в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г. ЛД₅₀ ≈ 6 г/кг массы тела.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
![Таблица Менделеева]()
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
![]()
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
![]()
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
![]()
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Щелочные металлы Щелочноземельные металлы Литий Li 3 Бериллий Be 4 Натрий Na 11 Магний Mg 12 Калий K 19 Кальций Ca 20 Рубидий Rb 37 Стронций Sr 38 Цезий Cs 55 Барий Ba 56 Франций Fr 87 Радий Ra 88 Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Лантаниды Актиниды Лантан La 57 Актиний Ac 89 Церий Ce 58 Торий Th 90 Празеодимий Pr 59 Протактиний Pa 91 Неодимий Nd 60 Уран U 92 Прометий Pm 61 Нептуний Np 93 Самарий Sm 62 Плутоний Pu 94 Европий Eu 63 Америций Am 95 Гадолиний Gd 64 Кюрий Cm 96 Тербий Tb 65 Берклий Bk 97 Диспрозий Dy 66 Калифорний Cf 98 Гольмий Ho 67 Эйнштейний Es 99 Эрбий Er 68 Фермий Fm 100 Тулий Tm 69 Менделевий Md 101 Иттербий Yb 70 Нобелий No 102 Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Галогены Благородные газы Фтор F 9 Гелий He 2 Хлор Cl 17 Неон Ne 10 Бром Br 35 Аргон Ar 18 Йод I 53 Криптон Kr 36 Астат At 85 Ксенон Xe 54 — Радон Rn 86 Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Переходные металлы Скандий Sc 21 Титан Ti 22 Ванадий V 23 Хром Cr 24 Марганец Mn 25 Железо Fe 26 Кобальт Co 27 Никель Ni 28 Медь Cu 29 Цинк Zn 30 Иттрий Y 39 Цирконий Zr 40 Ниобий Nb 41 Молибден Mo 42 Технеций Tc 43 Рутений Ru 44 Родий Rh 45 Палладий Pd 46 Серебро Ag 47 Кадмий Cd 48 Лютеций Lu 71 Гафний Hf 72 Тантал Ta 73 Вольфрам W 74 Рений Re 75 Осмий Os 76 Иридий Ir 77 Платина Pt 78 Золото Au 79 Ртуть Hg 80 Лоуренсий Lr 103 Резерфордий Rf 104 Дубний Db 105 Сиборгий Sg 106 Борий Bh 107 Хассий Hs 108 Мейтнерий Mt 109 Дармштадтий Ds 110 Рентгений Rg 111 Коперниций Cn 112 Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Металлоиды Бор B 5 Кремний Si 14 Германий Ge 32 Мышьяк As 33 Сурьма Sb 51 Теллур Te 52 Полоний Po 84 Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Постпереходные металлы Алюминий Al 13 Галлий Ga 31 Индий In 49 Олово Sn 50 Таллий Tl 81 Свинец Pb 82 Висмут Bi 83 Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Неметаллы Водород H 1 Углерод C 6 Азот N 7 Кислород O 8 Фосфор P 15 Сера S 16 Селен Se 34 Флеровий Fl 114 Унунсептий Uus 117 А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
B металл или неметалл
![бор химический элемент]()
Бор — пятый химический элемент, принадлежит к третьей группе главной подгруппе периодической системы Д. И. Менделеева. Он проявляет свойства, как металлов, так и неметаллов. В обычном состоянии это — кристаллическое вещество бледно-коричневого цвета. Название бора происходит от арабского слова «борак», обозначающего одно из самых часто встречающихся в природе соединений бора — минерал бура. Если бор без примесей, то он бесцветный. В природе встречается в различных вулканических и осадочных породах. Соединения бора с примесями также часто обнаруживают в виде боросиликатов, боратов и других минералов, в которых он содержится в небольших концентрациях. Его соединения присутствуют в большинстве термальных источников, морской воде, а также в сопровождающих нефтяные месторождения водах. Кроме того, бор часто входит в состав многих типов почвы.
Исторические факты
Впервые бор в свободном состоянии был получен в 1808 году. Французские химики Жозеф Гей-Люссак и Луи Жак Тенар, восстанавливая борный ангидрид, предварительно полученный в результате прокаливания борной кислоты, смогли получить новый элемент. Однако полученное вещество содержало огромное число примесей. Через 50 лет физиохимиком Анри Сент-Клер Девилем и Фридрихом Вёлером было установлено, что бор может существовать в двух модификациях: в кристаллической алмазоподобной форме и аморфной форме, больше всего похожей на графит. Однако в 1876 году публикуется статья, в которой немецкий химик Л. Гампе утверждает, что кристаллический бор вовсе не элементарен, а представляет собой лишь соединение борида алюминия AlB12. Такая участь постигает и графитоподобный бор, французский химик К. Жоли приводит странную формулу B48C2Al, никак не состыковывающуюся с классической теорией валентности элементов. Позже, в 1908 году американец Эзекил Вейнтрауб подтвердил положение Гампе об алмазоподобном боре и смог первым выделить этот химический элемент 99%-ной чистоты.
Химические свойства бора
В нормальных условиях бор не проявляет особых свойств и поэтому считается инертным элементом, вступает в реакцию лишь с фтором. Аморфный бор более активен, чем кристаллический. Однако с увеличением температуры активность бора возрастает, так, например, при достаточно высоких температурах бор начинает реагировать с серой, кислородом, некоторыми галогенами. Бор начинает гореть красным пламенем при повышении температуры до 700⁰C. В процессе горения образуется ангидрид бора, представляющий собой прозрачную стеклоподобную массу. При дальнейшем росте температуры бор вступает в реакции с азотом, образуя нитрит бора, с углеродом — карбид, а также с металлами — бориды. Бор не растворяется в кислотах при нормальной температуре, исключение составляет лишь концентрированная азотная кислота. С растворами щелочей бор ведет себя более активно, медленно растворяясь, он образует бораты. При детальном рассмотрении у бора обнаруживается множество общих с кремнием свойств, например, борная кислота, как и кремниевая, обладает слабыми кислотными свойствами и растворяется в фтороводороде, при этом образуются газообразные соединения бора и кремния соответственно.
Применение бора
Бор используется в различных сплавах стали для улучшения тех или иных качеств материала, а также устойчивости к коррозии. Изотоп бора 10 В способен задерживать тепловые нейтроны, благодаря этой особенности его используют для создания специальных стержней, регулирующих работу атомных реакторов. Газообразное соединение бора BF3 нашло применение в качестве нейтронных счётчиков. Бор и такие соединения как карбиды, нитриды, фосфиды и подобные им широко используются как диэлектрики и входят в состав полупроводниковых материалов. Борная кислота вместе с солями используется в органических реакциях в роли катализатора. Также производные соединения бора входят в состав многих видов ракетного топлива.
Особый интерес представляет такое соединение как нитрид бора, который может образовывать целые группы соединений схожих с органическими углеродными веществами. Например, гексагидрид нитрида бора имеет очень много общего в строении с этаном. Он применяется в качестве топлива для электромобилей.
![борное мыло]()
Борное мыло
Читайте также: