Что называется металлами материаловедение
Обновлено: 05.10.2024
Несмотря на все более широкое использование неметаллических материалов, металлы и сплавы останутся и в ближайшем бедующем основным конструкционным и инструментальным материалом. Поэтому в курсе “Материаловедение” основное внимание уделено металлам.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
- «металлический блеск» (хорошая отражательная способность);
(В таблице Менделеева около 80 % металлы)
Благодаря многообразию обладают очень широким диапазоном свойств:
Температура плавления: Ртуть - -38,97ºС; Вольфрам - 3422 ºС
Плотность: Литий – 534 кг/м 3 ; Осьмий – 22500 534 кг/м 3
Электропроводность: Серебро – наилучшая; Титан – в 300 раз ниже
1. Классификация металлов
Все металлы и сплавы принято делить на две группы:
Черные металлы имеют темно - серый цвет, большую плотность, высокую температуру плавления, относительно высокую твердость и во многих случаях обладают полиморфизмом.
Цветные металлы чаще всего имеют характерную окраску: красную, желтую, белую. Обладают большой пластичностью, низкой твердостью, относительно низкой температурой плавления, для них характерно отсутствие полиморфизма.
Черные металлы в свою очередь можно подразделить на:
- железные (Fe, Co, Ni) – ферромагнетики и Mn
- тугоплавкие (Cr, W, Mo, Ta) - tпл > 1540 о С (Железо)
- Редкоземельные металлы (РЗМ) – (лантан, церий, неодим, празеодим и др.), объединённые под названием лантаноидов, и сходные с ними по свойствам иттрий и скандий;
- щелочноземельные (К,Са, Na)
- легкие металлы (Mg, Ве, Аl, Ti);
- благородные (Ag, Au, Pt, Pd, Родий)
- легкоплавкие (Zn (410 C), Pb (327 C) , Sn (232 C))
2. Кристаллическое строение металлов
Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность
обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Кристаллическая решетка - это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов,
многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры ребер элементарной ячейки. a, b, c – (периоды решетки) – расстояния между центрами ближайших атомов.
В одном направлении выдерживаются строго определенными.
Для характеристики используют 1А = 10 -8 см = 0,1Нм
- углы между осями.
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток.
Что такое металлы и их строение
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
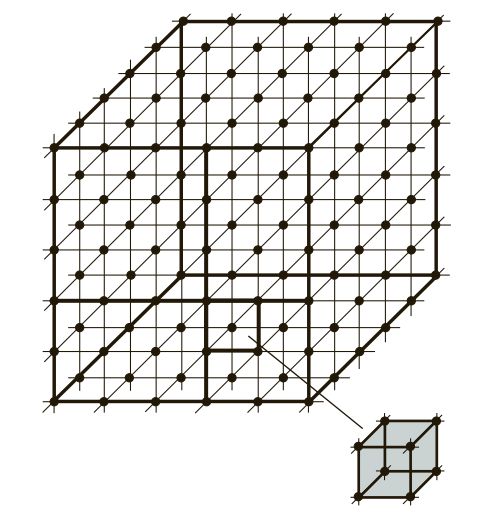
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
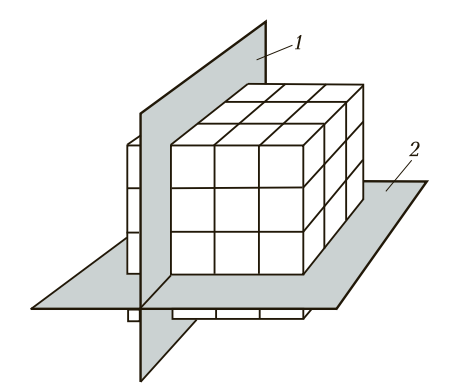
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
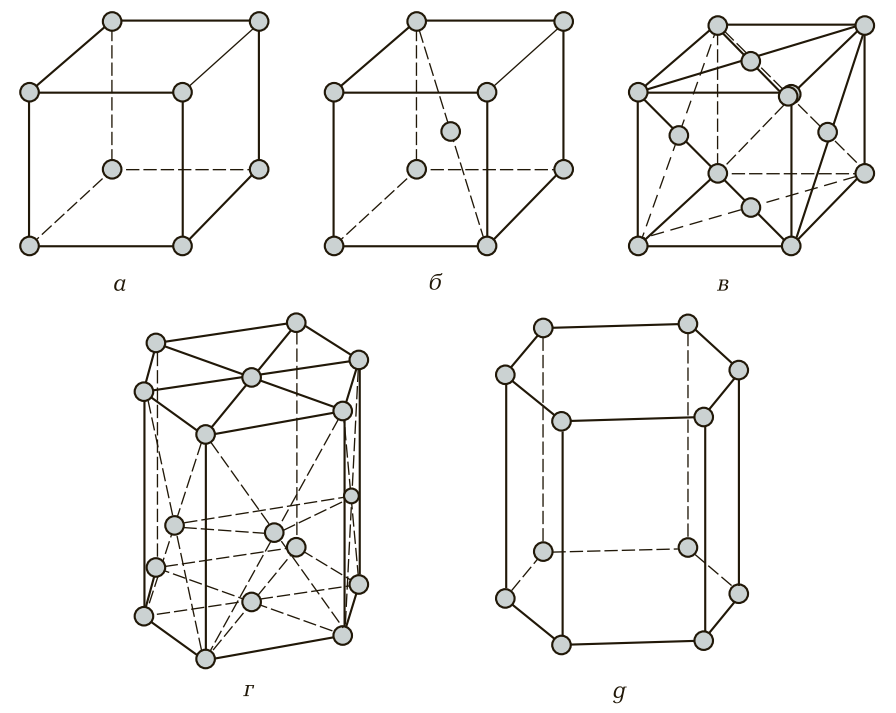
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
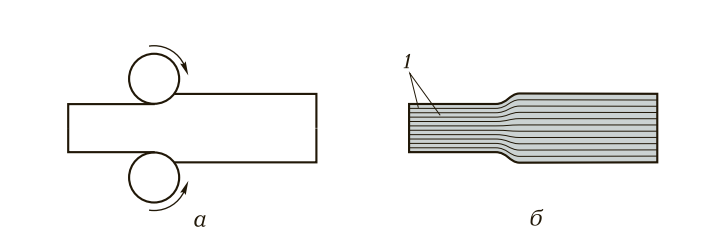
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
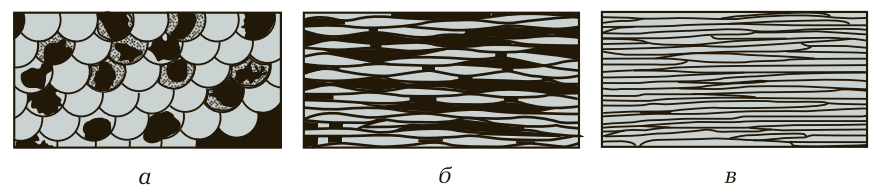
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
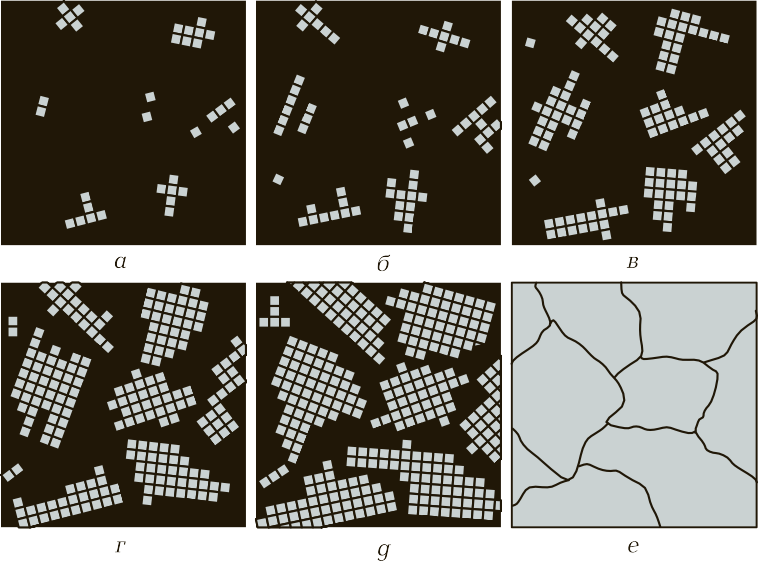
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
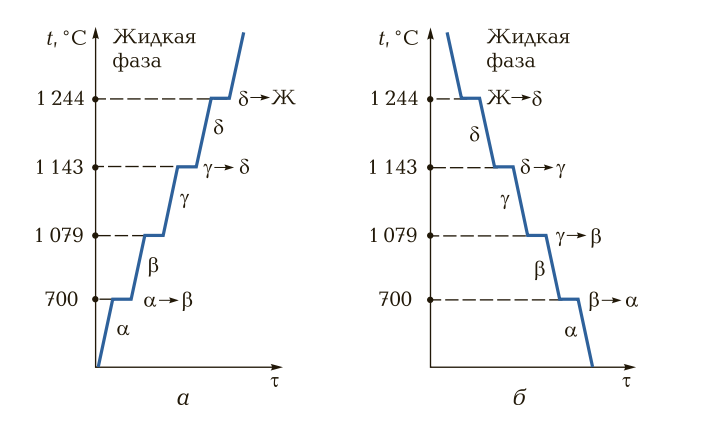
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Материаловедение
Материаловедение — междисциплинарный раздел науки, изучающий изменения свойств материалов, как в твёрдом, так и в жидком состоянии в зависимости от некоторых факторов. К изучаемым свойствам относятся структура веществ, электронные, термические, химические, магнитные, оптические свойства этих веществ. Материаловедение можно отнести к тем разделам физики и химии, которые занимаются изучением свойств материалов. Кроме того, эта наука использует целый ряд методов, позволяющих исследовать структуру материалов. При изготовлении наукоёмких изделий в промышленности, особенно при работе с объектами микро- и наноразмеров необходимо детально знать характеристику, свойства и строение материалов. Решить эти задачи и призвана наука — материаловедение.
Знание структуры и свойств материалов приводит к созданию принципиально новых продуктов и даже отраслей индустрии. Однако и классические отрасли также широко используют знания, полученные учёными-материаловедами для нововведений, устранения проблем, расширения ассортимента продукции, повышения безопасности и понижения стоимости производства. Эти нововведения были сделаны для процессов литья, проката стали, сварки, роста кристаллов, приготовления тонких плёнок, обжига, дутья стекла и др.
Содержание
Направления исследований материаловедения
- Космическое материаловедение — создание и изучение материалов которые пригодны для использования в космическом пространстве. [1] — создание и изучение материалов и конструкций размерами порядка нескольких нанометров. — изучение физики кристаллов, включает:
- — изучение нарушений структуры кристаллов, включения посторонних частиц и их влияние на свойства основного материала кристалла;
- технологии дифракции, такие как рентгеноструктурный анализ, используемые для изучения фазового состояния вещества.
- создание и изучение материалов для электроники, например, полупроводники;
- структурная керамика, занимающаяся композитными материалами, напряжёнными веществами и их трансформациями.
Разделы наук, на которых базируется материаловедение
- — для изучения стабильности, изменений фаз, для построения фазовых диаграмм. , термогравиметрия — для изучения изменения свойств материалов при воздействии температуры и при взаимодействии с различными газами. — при изучении изменений фазового состояния вещества, термического разложения структуры и диффузии. — для изучения химических процессов, проходящих в твёрдой фазе. — для изучений квантовых эффектов в твёрдых материалах, например, исследование полупроводников и сверхпроводников.
Примечания
См. также
Ссылки
| Теоретическая химия • Координационная химия • Прикладная неорганическая химия • Неорганический синтез |
| Теория атома • Атомная спектроскопия • Рентгеноспектральный анализ • Радиоспектроскопия • Физика атомных столкновений |
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Материаловедение" в других словарях:
материаловедение — материаловедение … Орфографический словарь-справочник
МАТЕРИАЛОВЕДЕНИЕ — МАТЕРИАЛОВЕДЕНИЕ, материаловедения, мн. нет, ср. Наука о материалах (см. материал в 1 знач.). Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МАТЕРИАЛОВЕДЕНИЕ — [рья ], я, ср. Наука о прочности и деформируемости материалов (в 1 знач.). | прил. материаловедческий, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
материаловедение — сущ., кол во синонимов: 7 • биоматериал (2) • керамика (18) • кристаллография (5) … Словарь синонимов
материаловедение — Наука о строении и св вах металлич. и неметаллич. (керамич., полимер., композиц. и др.) конструкц. материалов. Осн. задачи м.: установление законом, связей между составом, строением (включая дефекты строения) и св вами разных конструкц.… … Справочник технического переводчика
Материаловедение — – наука, изучающая и устанавливающая взаимосвязь между составом, строением и свойствами современных машиностроительных материалов, а также о методах изменения этих свойств. [Энциклопедический словарь. 2009 г.] Рубрика термина: Общие термины … Энциклопедия терминов, определений и пояснений строительных материалов
МАТЕРИАЛОВЕДЕНИЕ — я; ср. Наука о прочности и деформируемости материалов какой л. области производства. ◁ Материаловедческий, ая, ое. * * * МАТЕРИАЛОВЕДЕНИЕ МАТЕРИАЛОВЕДЕНИЕ, научная дисциплина, изучающая закономерности образования различных материалов… … Энциклопедический словарь
Материаловедение — наука, изучающая строение, свойства, ассортимент материалов и т. д. в какой л. области производства. Текстильное материаловедение наука о строении, свойствах и оценке качества текстильных материалов, т. е. материалов, которые состоят из… … Энциклопедия моды и одежды
материаловедение — Material Science Материаловедение, наука о материалах Наука, изучающая связь между строением (структурой) и свойствами материала, а также их изменения при внешних воздействиях. Наука о керамике, стекле, металлах, пластмассах, полупроводниках … Толковый англо-русский словарь по нанотехнологии. - М.
Материаловедение — ср. 1. Научная дисциплина, изучающая материалы [материал I], используемые в какой либо области производства, деятельности. 2. Учебный предмет, содержащий теоретические основы данной дисциплины. 3. разг. Учебник, излагающий содержание данного… … Современный толковый словарь русского языка Ефремовой
Общие сведения о металлах
Дисциплина «Материаловедение и технология конструкционных материалов» состоит из двух основополагающих при подготовке инженера технических дисциплин.
Первая из них – материаловедение. Это наука, изучающая взаимосвязь между составом, строением и свойствами материалов, применяемых в технике.
Цель преподавания материаловедения – дать знания о строении, физических, механических и технологических свойствах металлов и неметаллических материалов, а также о возможности управления свойствами материалов через упрочняющую или разупрочняющую обработку.
Вторая дисциплина – технология конструкционных материалов – дает знания о современных методах обработки материалов, т. е. о том, как получают заготовки и детали машин заданной формы и размеров. Она включает основы металлургии, обработку металлов давлением и резанием, получение заготовок литьем и сваркой, а также формирование поверхностей современными электрофизическими способами.
Взаимосвязь двух этих отраслей знаний очевидна: новые материалы порождают новые технологии и целые новые отрасли.
Главной задачей материаловедения является создание материалов с заранее
рассчитанными свойствами применительно к заданным параметрам и условиям работы.
Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и
высокие температуры и давление).
Важное значение имеет устранение отставания нашей страны в области использования новых материалов взамен традиционных (металлических)-пластмасс, керамики, материалов порошковой металлургии, особенно композиционных материалов, что экономит дефицитные металлы, снижает затраты энергии на производство материалов, уменьшает массу изделий.
Расчетами установлено, что замена ряда металлических деталей легкового автомобиля на углепластики из эпоксидной смолы, армированной углеродными волокнами, позволит уменьшить массу машины на 40%; она станет более прочной; уменьшится расход топлива, резко возрастет стойкость против коррозии.
Знания основ материаловедения необходимы каждому инженеру, работающему в области создания и эксплуатации современных машин. Лишь зная свойства материалов, можно научно обоснованно выбрать их для того или иного использования, правильно спроектировать технологический процесс их обработки с высокими технико-экономическими показателями.
Общие сведения о металлах
Металлы—простые вещества, обладающие высокой тепло- и электропроводностью, ковкостью, металлическим блеском, непрозрачностью и другими свойствами, характерными для металлов. Металлы и сплавы на их основе обладают комплексом механических, физических, химических и технологических свойств, обеспечивающих широкое их применение в различных отраслях техники. Все металлы условно делят на черные (железо и сплавы на его основе — сталь, чугун) и цветные (все остальные).
Кристаллическая структура металлов. Общая характеристика и классификация металлов
В технике под металлами понимают материалы, обладающие целым комплексом специфических физических, химических, технологических, эксплуатационных и механических свойств.
Физические свойства отражают поведение материалов в различных тепловых, электромагнитных и гравитационных полях. К наиболее характерным физическим свойствам металлов следует отнести металлический блеск, высокую электро- и теплопроводность, способность испускать электроны при нагреве, а также сравнительно высокую плотность большинства металлов.
Химические свойства отражают способность материалов взаимодействовать с другими веществами. С точки зрения химических свойств металлы это химические элементы, расположенные в левой части таблицы Менделеева. Атомы этих элементов содержат на внешней электронной оболочке небольшое число электронов, слабо связанных с ядром. Вступая в химические взаимодействия с неметаллами, атомы металлов легко отдают им свои внешние валентные электроны и становятся положительно заряженными ионами.
Технологические свойства отражают способность материалов подвергаться тому или иному виду обработки. К наиболее характерным технологическим свойствам металлов следует отнести их относительно хорошую деформируемость (в частности, штампуемость и ковкость), а также хорошую свариваемость и возможность получать изделия методом литья.
Эксплуатационные свойства характеризуют поведение материалов в реальных условиях эксплуатации. Среди эксплуатационных свойств металлов можно выделить их неплохую износостойкость.
Механические свойства отражают способность материалов сопротивляться деформации и разрушению под воздействием различного рода нагрузок. К наиболее характерным механическим свойствам металлов относят их достаточно высокую пластичность и вязкость, а также твёрдость и прочность.
Физические и химические свойства металлов наиболее подробно изучаются в рамках дисциплин «Физика» и «Химия». Материаловедение большее внимание уделяет механическим и технологическим свойствам материалов.
Все металлы делят на две большие группы: на чёрные металлы и цветные металлы.
Чёрные металлы отличаются специфическим темно-серым цветом, высокой температурой плавления и относительно высокой твёрдостью. Цветные металлы имеют характерную белую, желтую или красную окраску, и отличаются от чёрных металлов большей пластичностью, меньшей твёрдостью и невысокой температурой плавления.
Чёрные металлы, в свою очередь, подразделяют на 5 групп:
1. Металлы группы железа – Fe, Cо, Ni и Mn.
Fe составляет основу самых распространённых в промышленности сплавов – сталей и чугунов. Остальные металлы этой группы применяются либо в качестве добавок к железоуглеродистым сплавам, либо в качестве основы для соответствующих сплавов (кобальтовых, никелевых и т.п.).
2. Тугоплавкие металлы – Ti, V, Cr, Mo, W и др.
Металлы этой группы имеют температуру плавления выше, чем у железа, т.е. более 1539°С. Их обычно используют в качестве добавок к легированным сталям, либо в качестве основы для специальных сплавов (например, титановых или хромовых). Вольфрам в чистом виде используют для изготовления нитей накала электроламп.
3. Урановые металлы или актиноиды – Ac, Th и т.д. Применяются, как правило, для изготовления сплавов, используемых в атомной энергетике.
4. Редкоземельные металлы или лантаноиды – La, Ce и т.д. Эти металлы обычно встречаются в смешанном виде и имеют близкие свойства. Их используют для изготовления специальных сплавов, обладающих особыми физическими и иными свойствами.
5. Щелочные металлы – Li, Na, K и т.д. Отличаются высокой химической активностью и поэтому в свободном виде не используются.
Цветные металлы подразделяют на 3 группы:
1. Легкие металлы – Al, Mg, Be. Обладают сравнительно низкой плотностью. Al из-за своей высокой электропроводности широко применяется для изготовления электропроводов. Кроме того, Al используют для получения алюминиевых сплавов, широко применяемых в машиностроении.
2. Благородные металлы – Ag, Au, Pt и т.д. в том числе Cu. Данные металлы отличаются высокой пластичностью, электропроводностью и коррозионной стойкостью. Благодаря этим свойствам они широко применяются в микроэлектронике и ювелирном деле. Медь используют также для получения бронз и латуней. Слитки благородных металлов, размещённые в банках, играют роль фактических денег.
3. Легкоплавкие металлы – Sn, Pb, Zn, Hg и т.д. Имеют сравнительно низкую температуру плавления. Температура плавления ртути (Hg) ниже комнатной и поэтому данный металл в обычных условиях является жидким. Sn и Pb используют для изготовления припоев, те сплавов, служащих для соединения деталей методом пайки.
Наиболее распространенным металлом на земном шаре является алюминий (8,8%). На втором месте находится железо (4,65%), которое к тому же является одним из наиболее дешёвых металлов.
2.2 Металлическая межатомная связь и модель «электронного газа»
Вышеназванные характерные свойства металлов, в большинстве своём, могут быть объяснены спецификой межатомного взаимодействия и особенностями структуры металлов. Атомы металлов, находящихся в твёрдом стоянии, связаны между собой особым типом химической связи, которую называют металлической связью. Такая связь устанавливается посредством обобществления всех валентных электронов атомами материала. Валентные электроны, потерявшие связь со своими атомами, оказываются принадлежащими всему металлу в целом и, будучи относительно свободными, образуют в объёме металла так называемый «электронный газ» или точнее «электронную жидкость». Сами же атомы при этом становятся положительно заряженными ионами. Таким образом, на атомарном уровне металлы выглядят как совокупность расположенных в узлах кристаллической решётки положительно заряженных ионов, которые омываются газом относительно свободных электронов или иначе «электронной жидкостью» (рис. 7).
Рис. 7. Модель «электронного газа (жидкости)»
Наличием в объёме металла электронного газа или жидкости объясняются многие свойства металлов. Так, если к металлу приложить разность потенциалов, то под воздействием электрического поля относительно свободные электроны наряду с хаотическим движением приобретут направленное движение в сторону от минуса к плюсу. Другими словами в металле возникнет электрический ток. Поскольку в металлах свободных носителей заряда, т.е. электронов, достаточно много, их электропроводность оказывается очень высокой. Эти же электроны проводимости весьма эффективно могут переносить тепловую энергию от разогретого участка металла к более холодным областям, и этим объясняется высокая теплопроводность металлов. Кроме того, электронная жидкость хорошо отражает фотоны, т.е. частицы света, и тем самым обеспечивает металлам характерный блеск.
При пластическом деформировании металлов наблюдается сдвиг атомных слоёв относительно друг друга и металлическая связь способствует этому процессу. В данном случае электронная жидкость играет роль своеобразного клея, соединяющего атомные слои, и одновременно роль своеобразной смазки, облегчающей процесс скольжения этих слоёв. В результате металлы оказываются достаточно пластичными материалами.
Металлическая связь, в отличие от ковалентной связи, не является строго направленной в пространстве и допускает произвольное число взаимодействующих частиц. В результате атомы металлов, стремясь к более выгодной и устойчивой конфигурации, обладающей меньшей свободной энергией, располагаются в пространстве наиболее компактным образом. Этим, в частности, объясняется относительно высокая плотность большинства металлов. Плотным атомным упаковкам металлов соответствуют следующие типы кристаллических структур:
1. Объёмоцентрированная кубическая структура или ОЦК-структура. Такую структуру описывает ОЦК-решётка, элементарная ячейка которой выглядит следующим образом:
Рис. 8. Элементарная ячейка ОЦК-структуры.
В узлах этой кристаллической решётки располагаются атомы, а точнее ионы, соответствующего металла. Координационное число в данном случае равно 8 (на ближайшем равном расстоянии от любого атома находится 8 аналогичных атомов). Коэффициент компактности равен 0,68. Это означает, что 68% объёма металла занято атомами, а остальную его часть составляют пустоты. Это достаточно плотное расположение атомов. Базис образуют два атома соответствующего металла (один атом, расположенный в центре ОЦК-ячейки, полностью ей принадлежит, и ещё один атом (8 по ⅛) дают узлы, расположенные в вершинах ячейки). ОЦК-структура наблюдается у таких металлов как Cr, Mo, W, V и др.
2. Гранецентрированная кубическая структура или ГЦК-структура. Эту структуру описывает ГЦК-решётка, элементарная ячейка которой выглядит следующим образом:
Рис. 9. Элементарная ячейка ГЦК-структуры.
В узлах решётки также располагаются атомы соответствующих металлов. Координационное число здесь равно 12, а коэффициент компактности имеет значение 0,74. Базис образуют четыре атома металла (каждый атом, расположенный в центре грани принадлежит ячейке только наполовину, а поскольку таких атомов 6, то получается ровно 3; плюс один атом дают вершины ячейки). ГЦК-структура характерна для Al, Cu, Ni, Ag, Au и Pt.
3. Гексагональная плотноупакованная структура или ГПУ-структура. Эту структуру описывает соответствующая ГПУ-решётка. Хотя ГПУ-решётку можно построить и с помощью меньшей по объёму ячейки, в данном случае в качестве элементарной ячейки лучше подойдёт шестигранная призма, которая нагляднее отражает гексагональную симметрию структуры (рис. 10).
Рис. 10. Элементарная ячейка ГПУ-структуры.
Координационное число для такой структуры равно 12 (если за начало отсчёта принять атом, расположенный в центре грани, то на равном ближайшем расстоянии от него находится 6 атомов, плюс по 3 атома сверху и снизу). Коэффициент компактности, как и у ГЦК-структуры, имеет значение 0,74. Это наивысшая степень упаковки атомов. Базис образуют 6 атомов соответствующего металла (3 атома внутри призмы полностью ей принадлежат; атомы в центре верхней и нижней грани принадлежат ячейке только наполовину, а каждый из 12 атомов в вершинах призмы принадлежит рассматриваемой ячейке лишь на 1/6 часть, поскольку находится на пересечении 6 аналогичных ячеек). ГПУ-структура наблюдается у таких металлов как Mg, Zn, Be и др.
Иногда у металлов наблюдается тетрагональная или простая гексагональная структура, но гораздо реже, чем три вышеназванные структуры.
Читайте также:
