Что такое аллотропические превращения в металлах
Обновлено: 15.05.2024
В металловедении под полиморфизмом понимают любые изменения в кристаллографической форме решётки материала. Поэтому аллотропическое или полиморфное превращение играет важную роль в свойствах и использовании металлов, склонных к подобным изменениям.
Суть явления
Полиморфные превращения происходят в ответ на изменения внешних факторов – температуры, давления, либо того и другого вместе.
Так, например, происходит с углеродом, который встречается в двух различных полиморфных формах- графита с гексагональной структурой и алмаза - с изометрической. Вещество FeS2 чаще всего встречается в виде пирита с изометрической структурой, но оно также может иметь ромбическое внутреннее расположение, и тогда его называют марказитом. Существуют и другие примеры.
Свойства вещества определяются не только его химическим составом, но и геометрией составляющих атомов и ионов, а также природой связывающих их электрических сил.
Большинство минералов представляют собой соединения, состоящие из двух или более элементов; их формулы получены на основе количественного химического анализа и указывают относительные пропорции составляющих элементов. Поэтому наблюдаются значительные вариации в ионах, которые занимают определенные атомные позиции в их структуре. Например, содержание железа в родохрозите (MnCO3) может варьироваться в широких пределах, поскольку двухвалентное железо (Fe 2+ ) замещает катионы марганца (Mn 2+ ) в структуре родохрозита.
Поэтому формула данного минерала может быть дана в более общих терминах, а именно (Mn, Fe) CO3. Она показывает, что, хотя количество марганца и железа меняется, но отношение катиона к отрицательно заряженной анионной группе остается фиксированным: один атом Mn 2+ или Fe 2+ к одной группе CO3. Такое изменение является результатом замены одного иона или ионной группы другим в конкретной структуре. Это явление называется ионным замещением или твердым раствором. Возможны три типа твердого раствора:
- замещающий;
- промежуточный;
- упущенный.
Замещающий твердый раствор является наиболее распространенной разновидностью: пример с родохрозитом это подтверждает. Однако на степень замещения могут влиять и другие факторы, наиболее важным из которых является размер иона. Ионы двух разных элементов могут свободно заменять друг друга, только если их ионные радиусы различаются примерно на 15 процентов или меньше.
На аллотропические превращения влияет также температура, соответствующая началу роста кристаллов. Чем выше температура, чем более обширен термический беспорядок в кристаллической структуре и тем менее требовательны требования к пространству. В результате ионное замещение, которое не могло произойти в кристаллах, выращенных при низких температурах, может присутствовать в кристаллах, выращенных при более высоких температурах. Так, высокотемпературная форма KAlSi3O8 (санидин) может содержать больше натрия вместо калия, чем низкотемпературные аналоги данного минерала.
Дополнительным фактором, влияющим на ионное замещение, является поддержание баланса между положительными и отрицательными зарядами в структуре. Замена одновалентного иона (например, Na + ) двухвалентным ионом (например, Ca 2+ ) требует дополнительных замен, чтобы структура оставалась электрически нейтральной.
Условия для полиморфного превращения
Стабильность химических связей атомов и ионов металлов определяют электрические силы. Физические и химические свойства минералов по большей части объясняются типами этих связывающих сил, среди которых:
- твёрдость:
- температура начала плавления;
- электропроводность;
- теплопроводность;
- коэффициент теплового расширения.
Твёрдость и температура плавления кристалла увеличиваются (а коэффициент теплового расширения уменьшается) пропорционально прочности такой связи. Чем сильнее электрические связи, тем большее количество тепла потребуется для их разделения.
Электрические силы, называемые химическими связями, можно разделить на пять типов:
- ионные;
- ковалентные;
- металлические;
- ван-дер-ваальсовы;
- водородные.
Такая классификация в значительной степени обусловлена целесообразностью, поскольку химические связи в данном металле могут фактически обладать характеристиками более чем одного типа связи.
Ионные связи проявляются в тенденции атомов металлов приобретать или терять электроны, пока их внешние орбитали не станут стабильными; Обычно это достигается за счет заполнения этих орбиталей максимально допустимым числом валентных электронов.
Кристаллы с ионной связью обычно обладают умеренной твёрдостью и удельным весом, довольно высокими температурами плавления и плохой теплопроводностью и электропроводностью.
Ковалентные связи образуются только между резко полярными веществами, которых среди металлов практически не встречается. В отличие от солей, металлы обладают высокой пластичностью, прочностью, пластичностью и проводимостью. Многие из них характеризуются более низкой твёрдостью и более высокими температурами плавления и кипения, чем, например, материалы с ковалентной связью. Все эти свойства являются результатом металлического механизма связи, который можно представить как набор положительно заряженных ионов, погруженных в облако валентных электронов. Притяжение между катионами и электронами удерживает кристалл вместе.
Электроны не связаны с каким-либо конкретным катионом и, таким образом, могут свободно перемещаться по структуре. У некоторых металлов (натрий, цезий, рубидий и калий) лучистая энергия света может вызвать полное удаление электронов с их поверхностей Этот результат известен как фотоэлектрический эффект. Подвижность электронов отвечает за способность металлов проводить тепло и электричество.
Самородные металлы - единственные минералы, демонстрирующие чистую металлическую связь.
Связи Ван-дер-Ваальса и водородные связи характерны для газов, органических жидкостей и некоторых твёрдых тел, поэтому здесь не рассматриваются.
Механизм превращения
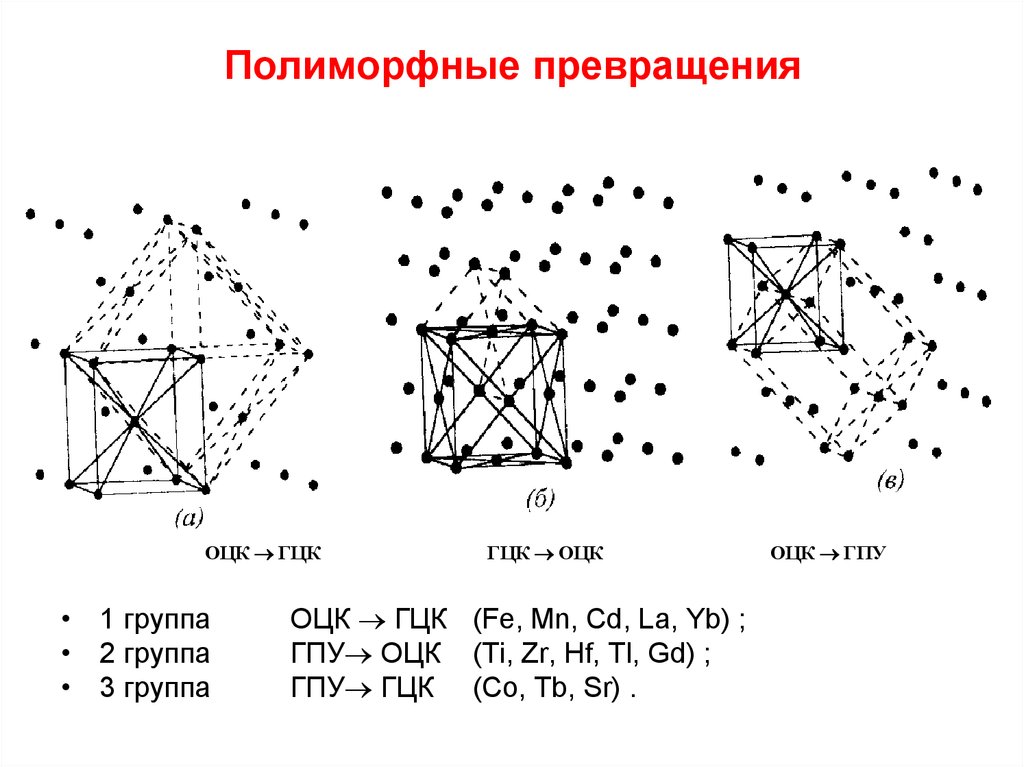
Наибольшей интенсивностью полиморфных превращений обладают самородные металлы, которые объединяются в три группы:
- Группа золота, состоящая из золота, серебра, меди и свинца;
- Платиновая группа, состоящая из платины, палладия, иридия и осмия;
- Группа железа, содержащая железо и никель.
Гораздо слабее полиморфизм выявляется у ртути, тантала, олова и цинка.
Золото, серебро и медь являются членами одной группы (столбца) периодической таблицы элементов и, следовательно, имеют схожие химические свойства. В некомбинированном состоянии их атомы соединены довольно слабой металлической связью. поэтому атомы расположены в простом кубическом расположении с плотной упаковкой. И золото, и серебро имеют атомный радиус 1,44 × 10 –7 мм, что позволяет твёрдому раствору полностью образовываться между ними. Радиус меди значительно меньше (1,28 Å), и поэтому медь только в ограниченной степени заменяет золото и серебро. Из-за схожей кристаллической структуры металлы группы золота обладают схожими физическими свойствами, поэтому хорошо кристаллизуются в изометрической системе и имеют высокую плотность упаковки.
Аналогичен механизм аллотропного превращения у металлов платиновой группы..
Металлы группы железа изометричны и имеют простую кубическую упакованную структуру, чем объясняется лёгкость происходящих полиморфных превращений.
Почему полиморфное превращение также называют перекристаллизацией?
Полиморфизм - это способность вещества кристаллизоваться в различные кристаллические формы, которые называются кристаллическими модификациями. Полиморфы имеют одинаковое жидкое или газообразное состояние, но в твёрдом состоянии ведут себя по-разному.
Для всех металлов, испытывающих аллотропические превращения, кристаллические структуры подвижны и могут видоизменяться в нескольких разных пропорциях.
Некоторые полиморфные формы могут быть стабильными только в том случае, когда при кристаллизации присутствует небольшое количество растворителя.
Таким образом, перекристаллизация – процесс перестройки одной кристаллической решётки в другую – обязательно сопровождается и определёнными полиморфными превращениями.
Аллотропия металлов
Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки. Аллотропические превращения имеют многие металлы: железо, олово, титан и др.
Файлы: 1 файл
Аллотропи металлов.docx
аллотропический физический свойство металл
Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки. Аллотропические превращения имеют многие металлы: железо, олово, титан и др. Например, железо в интервале температур 911 -1392°С имеет гранецентрированную кубическую решетку (ГЦК) г-Fe (рис. 7). В интервалах до 911°С и от 1392 до 1539°С железо имеет объемно-центрированную кубическую решетку (ОЦК) - б-Fe. Аллотропические формы металла обозначаются буквами а, в, г и т. д. Существующая при самой низкой температуре аллотропическая форма металла обозначается через букву б, которая в виде индекса добавляется к символу химического элемента металла и т. д.
При аллотропических превращениях происходит изменение свойств металлов - изменение объема металлов (особенно характерно для олова) и растворимости углерода (характерно для железа).
Методы изучения строения металлов
Изучение строения металлов и сплавов производится методами макро- и микроанализа, рентгеновского, а также дефектоскопии (рентгеновской, магнитной, ультразвуковой).
Методом макроанализа изучается макроструктура, т. е. структура, видимая невооруженным глазом или с помощью лупы, при этом выявляются крупные дефекты: трещины, усадочные раковины, газовые пузыри и т. д., а также неравномерность распределения примесей в металле. Макроструктуру определяют по изломам металла, по макрошлифам. Макрошлиф - это образец металла или сплава, одна из сторон которого отшлифована, тщательно обезжирена, протравлена и рассматривается с помощью лупы с увеличением в 5 -10 х .
Микроанализ выявляет структуру металла или сплава по микрошлифам, приготовленным так же, как и для макроанализа, но дополнительно отполированным до зеркального блеска. Шлифы рассматривают в отраженном свете под оптическим микроскопом при увеличении до 3000 х . Из-за различной ориентировки зерен металла они травятся не в одинаковой степени и под микроскопом свет также отражается неодинаково. Границы зерен благодаря примесям травятся сильнее, чем основной металл, и выявляются более рельефно. В сплаве структурные составляющие травятся также различно. В электронном микроскопе рассматривают реплику - слепок с особо тонкой структуры блоков, фрагментов, дислокации при увеличениях до 100000 х . Этот важнейший анализ определяет размеры и форму зерен, структурные составляющие, неметаллические включения и их характер (трещины, пористость и т. д.), качество термической, обработки. Зная микроструктуру, можно объяснить причины изменения свойств металла.
С помощью рентгеновского анализа изучают атомную структуру металлов, типы и параметры кристаллических решеток, а также дефекты, лежащие в глубине. Этот анализ, основанный на дифракции (отражении) рентгеновских лучей рядами атомов кристаллической решетки, позволяет обнаружить дефекты (пористость, трещины, газовые пузыри, шлаковые включения и т. д.), не разрушая металла. В местах дефектов рентгеновские лучи поглощаются меньше, чем в сплошном металле, и поэтому на фотопленке такие лучи образуют темные пятна, соответствующие форме дефекта.
Для исследования структуры металла и дефектов изделий широко применяют гамма-лучи, которые проникают в изделие на большую глубину, чем рентгеновские.
Магнитным методом исследуют дефекты в магнитных металлах (сталь, никель и др.) на глубине до 2 мм (трещины различного происхождения, неметаллические включения и т. д.). Для этого испытуемое изделие намагничивают, покрывают его поверхность порошком железа, осматривают поверхность и размагничивают изделие. Вокруг дефекта образуется неоднородное поле, вследствие чего магнитный порошок повторяет очертания дефекта. Другой метод - магнитный индукционный - часто используют для оценки полноты структурных превращений в сплавах (изделиях) после их термической обработки.
Ультразвуковым методом осуществляется эффективный контроль качества металла изделий и заготовок практически любых размеров. В импульсных ультразвуковых дефектоскопах ультразвуковая волна от щупа - излучателя распространяется в контролируемом изделии и при встрече с каким-либо дефектом отражается от него. При этом отраженные волны принимаются, усиливаются и передаются на показывающий индикатор. Ультразвук используют для контроля качества роторов, рельсов, поковок, проката и других изделий при необходимости сохранения целостности изделий.
Физические и химические свойства
Физические свойства. К физическим свойствам металлов относят цвет, плотность, температуру плавления, теплопроводность, тепловое расширение, теплоемкость, электропроводность, магнитные свойства и др.
Цветом называют способность металлов отражать световое излучение с определенной длиной волны. Например, медь имеет розово-красный цвет, алюминий - серебристо-белый.
Плотность металла характеризуется его массой, заключенной в единице объема. По плотности все металлы делят на легкие (менее 4500 кг/м 3 ) и тяжелые. Плотность имеет большое значение при создании различных изделий. Например, в самолето- и ракетостроении стремятся использовать более легкие металлы и сплавы (алюминиевые, магниевые, титановые), что способствует снижению массы изделий.
Температурой плавления называют температуру, при которой металл переходит из твердого состояния в жидкое. По температуре плавления различают тугоплавкие металлы (вольфрам 3416° С, тантал 2950°С, титан 1725°С. и др.) и легкоплавкие (олово 232°С, свинец 327°С, цинк 419,5°С, алюминий 660°С). Температура плавления имеет большое значение при выборе металлов для изготовления литых изделий, сварных и паяных соединений, термоэлектрических приборов и других изделий. В единицах СИ температуру плавления выражают в градусах Кельвина (К).
Теплопроводностью называют, способность металлов передавать тепло от более нагретых к менее нагретым участкам тела. Серебро. медь, алюминий обладают большой теплопроводностью. Железо имеет теплопроводность примерно в три раза меньше, чем алюминий, и в пять раз меньше, чем медь. Теплопроводность имеет большое значение при выборе материала для деталей. Например, если металл плохо проводит тепло, то при нагреве и быстром охлаждении (термическая обработка, сварка) в нем образуются трещины. Некоторые детали машин (поршни двигателей, лопатки турбин) должны быть изготовлены из материалов с хорошей тeплопpoводностью. В единицах СИ теплопроводность имеет размерность Вт/ (м*К).
Тепловым расширением называют способность металлов увеличиваться в размерах при нагревании и уменьшаться при охлаждении. Тепловое расширение характеризуется коэффициентом линейного расширения б = (l2 -l 1)/ [l 1 (t 2 - t 1)], где l 1 и l 2 длины тела при температурах t 1 и t 2. Коэффициент объемного расширения равен 3 б. Тепловые расширения должны учитываться при сварке, ковке и горячей объемной штамповке, изготовлении литейных форм, штампов, прокатных валков, калибров, выполнении точных соединений и сборке приборов, при строительстве мостовых ферм, укладке железнодорожных рельс.
Теплоемкостью называют способность металла при нагревании поглощать определенное количество тепла. В единицах СИ имеет размерность Дж/К. Теплоемкость различных металлов сравнивают по величине удельной теплоемкости - количеству тепла, выраженному в больших калориях, которое требуется для повышения температуры 1 кг металла на 1°С (в единицах СИ - Дж/(кг.К).
Электрическая проводимость оценивается в системе СИ в сименсах (См), удельная электропроводность - в См/м.
Электросопротивление выражают в Омах (Ом), а удельное электросопротивление - в Ом/м.
Хорошая электропроводность необходима, например, для токоведущих проводов (медь, алюминий). При изготовлении электронагревателей приборов и печей необходимы сплавы с высоким электросопротивлением (нихром, константан, манганин). С повышением температуры металла его электропроводность уменьшается, а с понижением - увеличивается.
Магнитные свойства характеризуются абсолютной магнитной проницаемостью или магнитной постоянной, т. е. способностью металлов намагничиваться. В единицах СИ магнитная постоянная имеет размерность Гн/м. Высокими магнитными свойствами обладают железо, никель, кобальт и их сплавы, называемые ферромагнитными. Материалы с магнитными свойствами применяют в электротехнической аппаратуре и для изготовления магнитов.
Химические свойства. Химические свойства характеризуют способность металлов и сплавов сопротивляться окислению или вступать в соединение с различными веществами: кислородом воздуха, растворами кислот, щелочей и др. Чем легче металл вступает в соединение с другими элементами, тем быстрее он разрушается. Химическое разрушение металлов под действием на их поверхность внешней агрессивной среды называют коррозией.
Металлы, стойкие к окислению при сильном нагреве, называют жаростойкими или окалиностойкими. Такие металлы применяют для изготовления деталей, которые эксплуатируются в зоне высоких температур.
Сопротивление металлов коррозии, окалине-образованию и растворению определяют по изменению массы испытуемых образцов на единицу поверхности за единицу времени.
Химические свойства металлов обязательно учитываются при изготовлении тех или иных изделий. Особенно это относится к изделиям или деталям, работающим в химически агрессивных средах.
Способность металла сопротивляться воздействию внешних сил характеризуется механическими свойствами. Поэтому при выборе материала для изготовления деталей машин необходимо прежде всего учитывать его механические свойства: прочность, упругость, пластичность, ударную вязкость, твердость и выносливость. Эти свойства определяют по результатам механических испытаний, при которых металлы подвергают воздействию внешних сил (нагрузок). Внешние силы могут быть статическими, динамическими или циклическими (повторно-переменными). Нагрузка вызывает в твердом теле напряжение и деформацию.
Напряжение - величина нагрузки, отнесенная к единице площади поперечного сечения испытуемого образца. Деформация - изменение формы и размеров твердого тела под влиянием приложенных внешних сил. Различают деформации растяжения (сжатия), изгиба, кручения, среза (рис. 8).
В действительности материал может подвергаться одному или нескольким видам деформации одновременно.
Для определения прочности, упругости и пластичности металлы в виде образцов круглой или плоской формы испытывают на статическое растяжение. Испытания проводят на разрывных машинах. В результате испытаний получают диаграмму растяжения. По оси абсцисс этой диаграммы откладывают значения деформации, а по оси ординат - нагрузки, приложенные к образцу.
Прочность - способность материала сопротивляться разрушению под действием нагрузок оценивается пределом прочности и пределом текучести. Важным показателем прочности материала является также удельная прочность - отношение предела прочности материала к его плотности. Предел прочности у в (временное сопротивление) - это условное напряжение в Па (Н/м 2 ). соответствующее наибольшей нагрузке, предшествующей разрушению образца: у в = P max / F о, где Рmах - наибольшая нагрузка, Н; Fо - начальная площадь поперечного сечения рабочей части образца, м 2 .
Истинное сопротивление разрыву S к - это напряжение, определяемое отношением нагрузки Рк в момент разрыва к площади минимального поперечного сечения образца после разрыва F к (S к = Р к/ F к).
Предел текучести (физический) у т - это наименьшее напряжение (в МПа), при котором образец деформируется без заметного увеличения нагрузки:
у т = Р т F о, где Р т - нагрузка, при которой наблюдается площадка текучести, Н.
Площадку текучести имеют в основном только малоуглеродистая сталь и латуни. Другие сплавы площадки текучести не имеют. Для таких материалов определяют предел текучести (условный), при котором остаточное удлинение достигает 0,2 % от расчетной длины образца: у 0,2 = P 0,2 / F 0.
Упругость - способность материала восстанавливать первоначальную форму и размеры после прекращения действия нагрузки Р уп оценивают пределом пропорциональности у пц и пределом упругости у ун.
Предел пропорциональности у пц - напряжение (МПа), выше которого нарушается пропорциональность между прилагаемым напряжением и деформацией образца у пц = Р пц / Р 0.
Предел упругости (условный) у 0,05 - это условное напряжение в Мпа, соответствующее нагрузке, при которой остаточная деформация впервые достигает 0,05 %, от расчетной длины образца lo: у 0,05 = P 0,05 / F 0, где P 0,05 - нагрузка предела упругости, Н.
Пластичность, т.е. способность материала принимать новую форму и размеры под действием внешних сил не разрушаясь, характеризуется относительным удлинением и относительным сужением.
Относительное удлинение (после разрыва) д - это отношение приращения (l k - lo) расчетной длины образца после разрыва к его первоначальной расчетной длине lo, выраженное в процентах: д = ((1к -1о)/1о] 100 %.
Относительное сужение (после разрыва) Ш - это отношение разности начальной и минимальной площадей (Fo - Fк) поперечного сечения образца после разрыва к начальной площади Fo поперечного сечения, выраженное в про центах: Ш = [( F 0 - F k) / Fо] 100%.
Многие твердые тела способны существовать при различных условиях температуры и давления в нескольких кристаллических разновидностях (модификациях). О таких телах говорят, что они полиморфны или обладают полиморфизмом. Углерод, например, может существовать в двух полиморфных формах или модификациях: в виде алмаза с весьма сложной кристаллической решеткой (решетка типа алмаза) и графита (гексагональная решетка). Применительно к простым кристаллическим образованиям, типичным для металлов, принято говорить не о полиморфизме, а об аллотропии и об аллотропических модификациях.
Аллотропия свойственна не менее чем двенадцати металлам, Ряд из которых имеют важнейшее техническое значение (Sn, Ti, Zr. Сг, Mn, Fe, Co, Ni, V, Np, Pu).
Аллотропические модификации, число которых в некоторых случаях доходит до пяти, принято обозначать греческими буквами а, р, у, 8, « с добавлением символа элемента, например a-Sn, y-Fe, e-Pu и т. д.
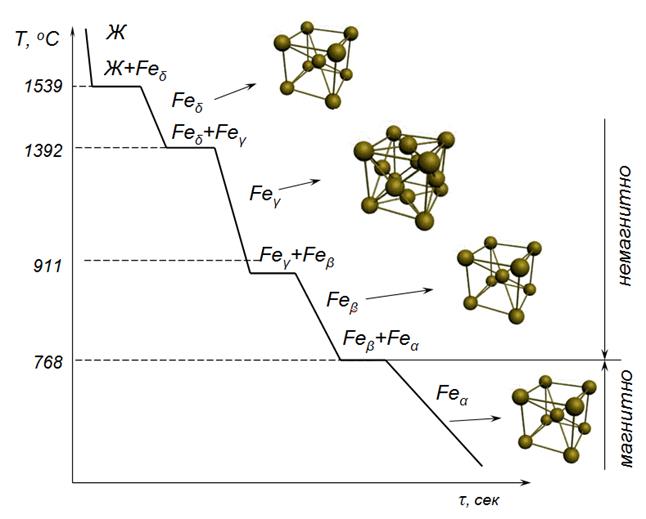
Железо при разных температурах способно кристаллизоваться в кубической объемноцентрированной и в кубической гране-центрированной решетках. Оно находится в виде аллотропической модификации альфа (объемноцентрированный куб) в пределах от абсолютного нуля до 910°, модификации гамма (гране-центрированный куб) в пределах от 910 до 140Г и от 1401 до точки плавления 1539° — вновь в виде модификации альфа.
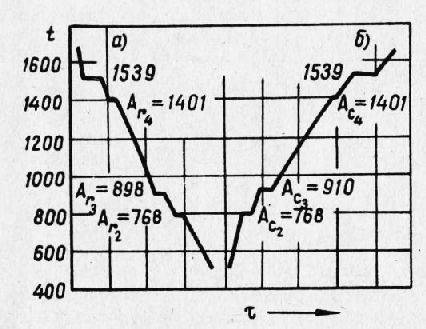
При нагревании и охлаждении чистого железа на кривых температура—время (рис. 1) при переходе одной аллотропической модификации в другую наблюдаются температурные точки скачкообразного превращения в виде горизонтальных участков.
На кривой нагревания заметны две такие остановки: первая наблюдается при 910°, где а-железо переходит в у-железо, и вторая при 1401°, где Т-железо вновь превращается в a-железо. Остановки при 768° и при 1539° не являются точками аллотропических превращений, так как первая остановка сопровождается не перестройкой решетки, а лишь потерей железом магнитных свойств. Вторая остановка при 1539° характеризует не перестройку решетки, а ее разрушение, т. е. переход металла в жидкое состояние.
Из изложенного следует, что на кривой нагревания имеется четыре критические точки:
1) при 768° точка магнитного превращения, при которой железо в процессе нагревания утрачивает магнитность (международное обозначение Асг);
2) при 910° точка аллотропического превращения а-железа немагнитного в т-железо (обозначение Ас3);
3) при 1401° точка аллотропического превращения у-железа вновь в a-железо немагнитное (Ас4);
4) при 1539° точка плавления.
При охлаждении превращения идут в обратном порядке. Критическими точками окажутся: точка затвердевания при 1539°; точка Аг4 при 1401°, точка Аг3 при 898° вместо 910° вследствие температурного отставания или гистерезиса и точка Агг при 768°.
Кобальт при температурах до 419° имеет гексагональную решетку (а-Со), а от 419 и до точки плавления 1492° — гране-центрированную кубическую (р-Со). Олово при комнатных и более высоких температурах существует в виде модификации fi-Sn (белое олово) с тетрагональной решеткой, а при температурах ниже 13,2° — в виде модификации a-Sn (серое олово) со сложной пространственной решеткой типа решетки алмаза.
Полиморфизм (аллотропия) присущ всем химическим элементам, с изменением температуры изменяющим свою валентность, т. е. способным отдавать в среду электронного газа переменное число электронов.
Такое изменение электронного газа сопровождается перестройкой пространственной решетки, причем новая модификация, как обладающая меньшим запасом свободной энергии, оказывается в данной температурной области более устойчивой по сравнению с прежней.
Аллотропные модификации - определение, характеристика и примеры
Свойства материалов в большинстве случаев отличаются постоянством, но ряд веществ меняет характеристики, в зависимости от состояния. Аллотропия в химии — это нахождение одного простого элемента в двух формах состояния, которые различаются кристаллическим строением. Аллотропные модификации выражают взаимное термодинамическое превращение между фазами вещества.
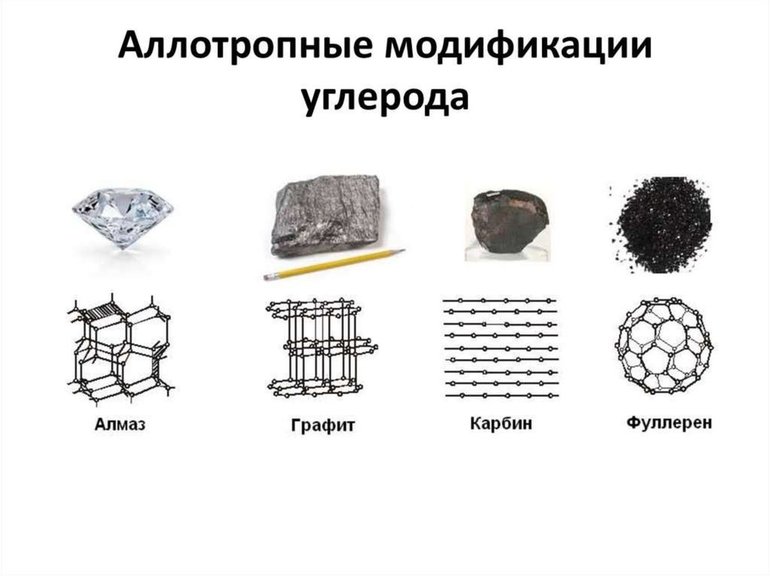
Общее понятие
Аллотропия проявляется, благодаря разному составу микрочастиц простой материи и координируется вариантом размещения молекул и атомов в кристаллической решетке. Вещество кристаллизуется в нескольких модификациях, при этом два параметра простой ячейки совпадают. Изменение состояния происходит из-за отличия третьего показателя, который учитывает расстояние между сопредельными слоями.
Явление часто обнаруживается в структурах, которые равнозначны гексагональному и кубическому расположению атомов. Соседняя атомная среда представляет эквивалентное окружение, а различия проявляются на удаленных сферах. Энергетические характеристики решеток приблизительно равны, поэтому физические свойства разных состояний одного элемента остаются похожими.
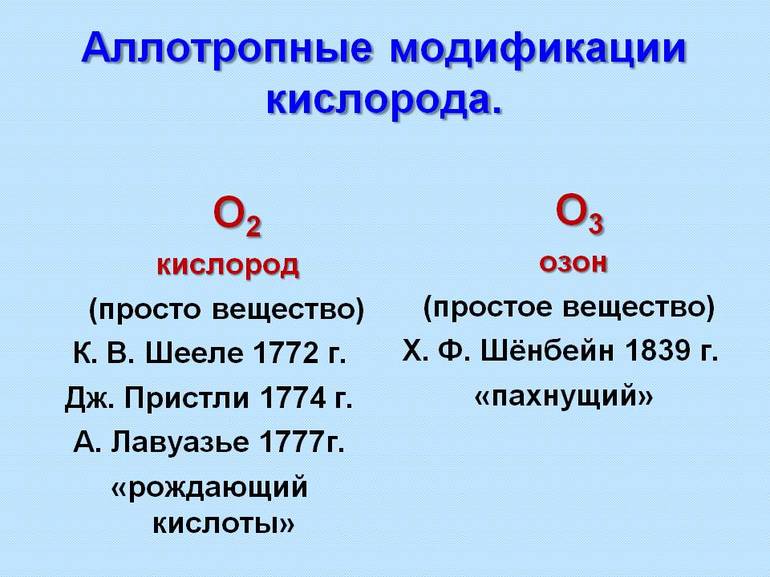
Первые примеры аллотропных модификаций показал шведский минералог и химик Берцелиус середине XIX века для выделения различных форм нахождения элемента. Через 2 десятка лет была принята гипотеза итальянского химика А. Авогадро о многоатомных молекулах и стало видно, что от строения частиц зависит проявление элемента в материи. Например, О3 — озон, а О2 — кислород.
В 1912 году ученые определили, что различия в структуре простых элементов, например, фосфора или углерода, относятся к первопричинам существования двух и более состояний. В настоящее время аллотропией называется видоизменение простых материй, независимо от агрегатного вида. Изменения в твердых состояниях сложных и простых веществ имеет название полиморфизма. Два определения совпадают, если речь идет о простых материалах в твердом виде (железо, сера в кристаллах, фосфор).
Реорганизация веществ
Продолжаются открытия видов простых материалов, способных к аллотропии, несмотря на то, что список образовательных веществ уже превышает 400 материалов. Типы химических связей в элементарных частицах зависят от строения атома, вместе эти характеристики определяют возможность вещества образовывать разные аллотропные формы.
Компоненты, которые могут изменять показатель координационного числа и стадии окисления, образовывают большее количество аллотропных состояний. Важным фактором разнообразия форм является способность элемента к образованию гомоцепных решеток (состоящих из однотипных атомов).
Преобразование простых элементов
Более выраженными являются аллотропные модификации неметаллов, но среди веществ этой группы имеются исключения, например, благородные газы и галогены. Некоторые состояния отличаются температурной стабильностью, другие характеризуются фазовой динамикой. Такие различия объясняются затратами некоторой энергии при изменении кристаллической решетки в результате плавления.
Примеры реорганизации неметаллов:
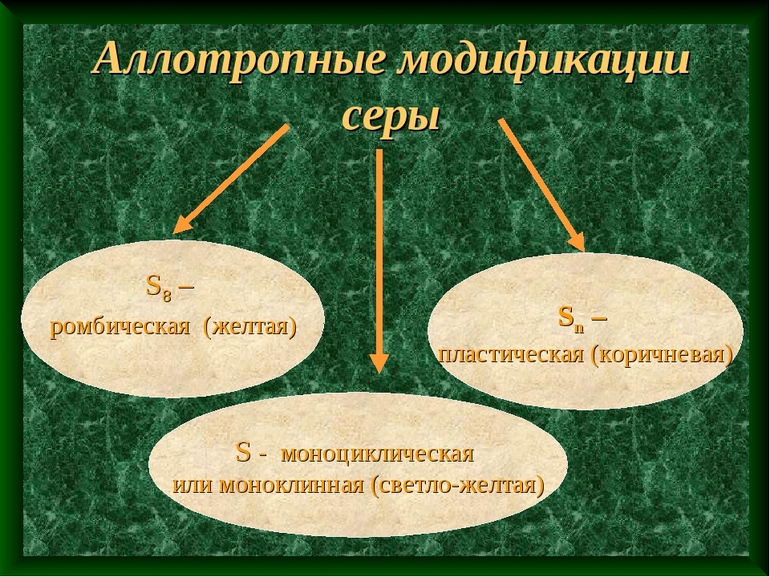
- Водород. Может быть в форме пара- и ортоводорода на молекулярном уровне. В первой макромолекуле отмечаются антипараллельные импульсные моменты электронов, а в частицах второго типа проявляются параллельные ядерные спины.
- Углерод. Элемент встречается в виде графена, алмаза, нанотрубок, графита, лонсдейлита и др. Точное количество состояний не поддается учету из-за того, что существует большое многообразие связей атомов друг с другом. Нанотрубки и фуллерены относятся к наиболее многочисленным структурам.
- Фосфор. Вещество насчитывает 11 видов аллотропных форм. Черный, белый и красный фосфор относятся к основным модификациям. Первый вид включается в группу инертных и токопроводящих материалов. Белый фосфор отсвечивает в темноте, ядовит и способен к самостоятельному возгоранию. Красный вид не опасен для человека, не воспламеняется и не светится в сумраке.
- Кислород. В природе бывает в виде озона с ярко выраженным запахом слабо фиолетового цвета или в форме кислорода, который не пахнет и без видимого колера.
- Селен. Представлен в двух видах. Первый — черный селен, второй — серый полимер.
- Сера. По количеству аллотропных состояний находится на 2 месте после углерода. Распространенными видами является моноклинная, пластическая и ромбическая сера.
Разные состояния одного компонента обозначаются строчными литерами греческой латиницы для написания в формулах. Низкотемпературные формы отмечаются буквой α, следующие состояния по показателям обозначаются β и дальше по такому принципу.
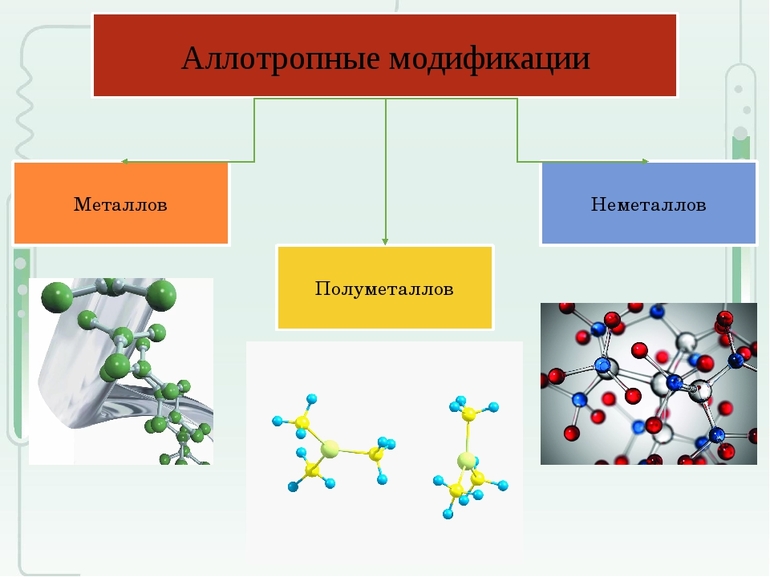
Модификации полупроводников
К этой группе относятся элементы, располагающиеся в таблице на переходе от металлов к неметаллам. У материалов присутствует кристаллическая ковалентная решетка, чаще они характеризуются проводимостью по типу металлов. Иногда материалы работают как полупроводники.
Примеры трансформации неметаллов:

- Бор. Существует в природе в кристаллической и аморфной форме, первый тип имеет черный, а второй — бурый колер. Наука знает о более 10 аллотропных состояний бора, которые встречаются в тетрагональном и ромбическом соединении. В некоторых модификациях имеется несколько открытых слоев, образующих бесконечное строение.
- Кремний. Свойства кристаллической формы обусловлены алмазоподобной атомной решеткой, выделяется моно- и поликристаллический кремний. В природе встречается в виде песка, кварцита, полевого шпата, силикатов.
- Мышьяк. Распространены 3 основные аллотропные формы. Серый полимер относится к классу полуметаллов, желтый мышьяк входит в группу неметаллов, черный вид по структуре напоминает красный фосфор.
- Германий. Существует в форме полуметалла с кристаллической решеткой по типу алмаза и в фазе металла с токопроводящими качествами.
- Сурьма. Известно 4 модификации материала в форме металлов, из которых наиболее стабильной является серебристо-белое вещество с голубым оттенком. Аморфные аллотропии существуют в виде желтой, взрывчатой и черной сурьмы.
- Полоний. Находится в 2 металлических разновидностях. Низкотемпературная форма отличается кубическим строением решетки, высокотемпературный вид имеет ромбическую структуру.
К особенностям относится слабое сочетание зоны проводимости и валентной области. Это обеспечивает электропроводность до того времени, пока температура не снизится до 0ºС. Нагревание способствует увеличению электронных дырок (обладателей тока), но видоизменение идет слабо. Положительные квазичастицы в полуметаллах активно двигаются при малой полезной массе. По этой причине материалы больше других веществ подходят для изготовления фазовых переходов в магнитных полях большой силы, наблюдения квантовых и классических размерных эффектов.
Особенности видоизменения металлов
Металлы образовывают различные состояния при увеличении давления или в случае технологической обработки. Аллотропной модификацией металлов называется возможность материала в твердой форме образовывать различные виды кристаллических решеток. Процесс перехода от одной структуры к другой рассматривается в виде превращения.
Обследование структуры производится способом микроанализа, делается ультразвуковая, магнитная и рентгеновская дефектоскопия.
Микроанализ проводится на основе снятия микрошлифов, которые перед исследованием полируются до блеска. Вывод о структуре делается после рассмотрения срезов под микроскопом после травления. Шлифы показывают границы зерен из-за неодинаковой обработки основного слоя и рельефных выступов. Анализ выявляет форму и размеры частиц, инородные включения.
Рентген дает понятие об атомном строении материала, типе кристаллической структуры, дефектах решеток. Для исследования используется свойство рядов отражать гамма-лучи. При магнитном способе поверхность металла намагничивается и покрывается железным порошком. После размагничивания слой показывает очертания решетки.
Ультразвук применяется для эффективного обнаружения качественного преобразования металла в требуемую аллотропную модификацию. Волновое излучение распространяется внутрь и отражается от элементов решетки.
Примеры аллотропии
При нагревании металлов в процессе превращения поглощается тепло, при этом изменение решеточной конструкции происходит при одной и той же температуре. Аллотропным модификациям подвергаются многие металлы, например, титан, железо, олово и др. Железо при нагревании до +1390ºС характеризуется гранецентрированной решеткой. Повышение температуры до +1540ºС ведет к перестройке до центрировано-кубической структуры.
Аллотропные модификации металлов:

Определенные свойства твердых элементов зависят не только от строения решетки и дефектов, но и от структуры микрочастиц, их состава, размера и формы. Конструкция кристаллов оказывает влияние на физические характеристики тела и предопределяет пределы деформационной пластики, твердость материала.
Обратимые и непоправимые переходы
В случае изменения температурных показателей и параметров давления твердые материалы переходят из одной структуры в другую без перемены количественного состава элементов. Предпосылками является подвижность частиц решетки и перенос некоторого количества вещества, вызванный дефектами строения твердого состояния.
Примеры переходов:
- энантиотропные преобразования (обратимые);
- монотропные видоизменения (необратимые).

Проводят разработанную методику трехфазной реакции для направленного получения требуемой решеточной структуры. Выбор нагревательного режима и продолжительность повышения температуры ускоряет рост кристаллов до больших зерен, что улучшает качество. Изменение способа обработки направляется иногда на снижение активности катализаторов в результате процесса рекристаллизации.
Энантиотропное видоизменение возникает при нулевой температуре и выбранном давлении. Иногда аллотропное преобразование относится к необратимым и одно из состояний материала является неустойчивым в термическом плане. Эта фаза сохраняется на всем температурном интервале от абсолютного нуля и называется монотропным. При получении серого олова из белого происходит обратимое преобразование, а превращение алмаза в графит становится необратимым.

Отличие этих типов превращений — в технологических особенностях проведения. Энантиотропные переходы модификации А чаще получаются методом постепенного охлаждения сплава. Сначала масса кристаллизуется в виде состояния Б, которое затем видоизменяется в устойчивую фазу к низким температурам.
При монотропном переходе в случае охлаждения сплава образуется только вещество в состоянии А. Требуется особый технологический режим со строгим дозированием понижения температуры и давления для получения модификации Б. Примером служит получение стабильного черного фосфора из белого путем нагревания до + 200ºС и повышения давления до 1,25 ГПа. После помещения полученного образца в нормальные условия обратного преобразования не происходит.
Читайте также:
