Что такое блеск металлов
Обновлено: 02.07.2024
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
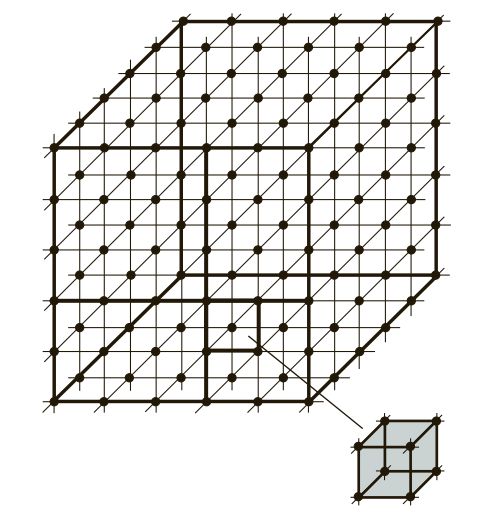
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
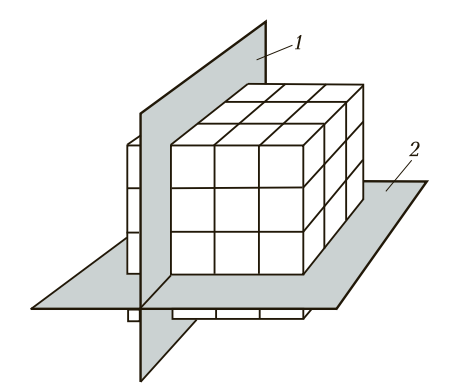
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
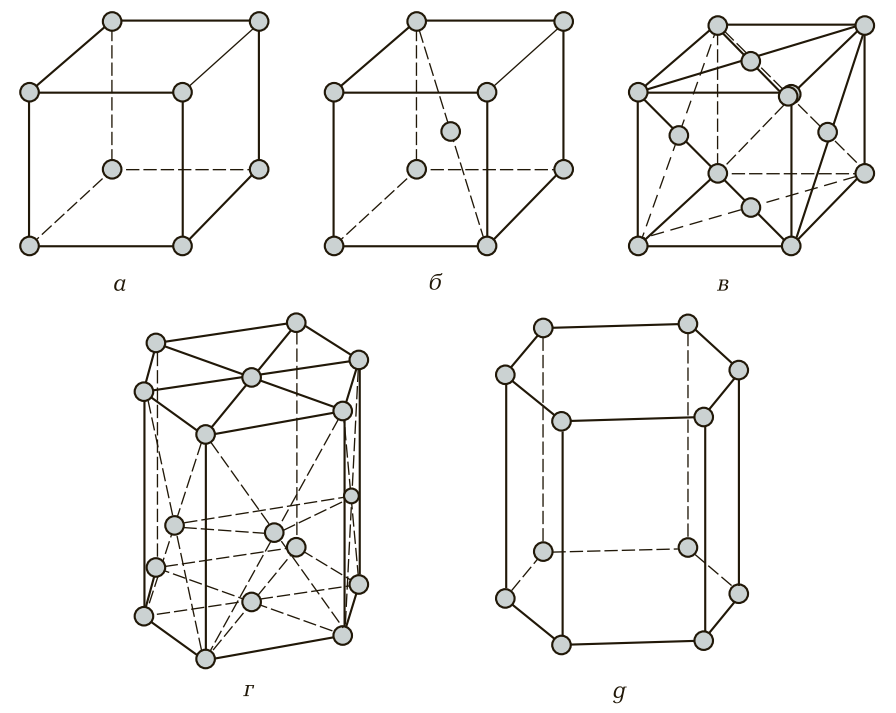
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
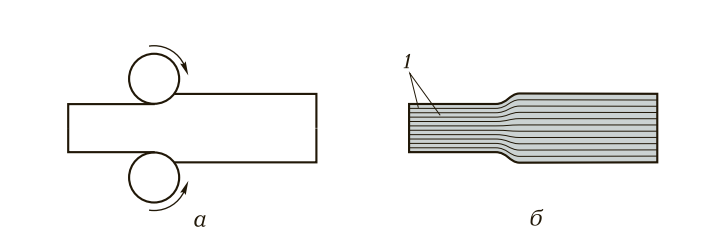
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
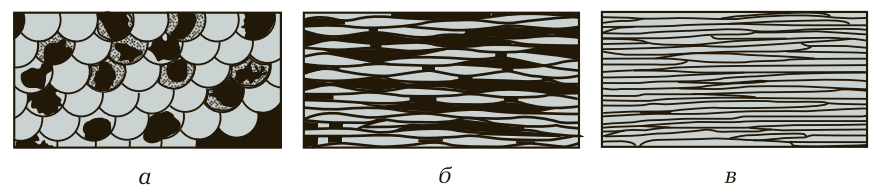
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
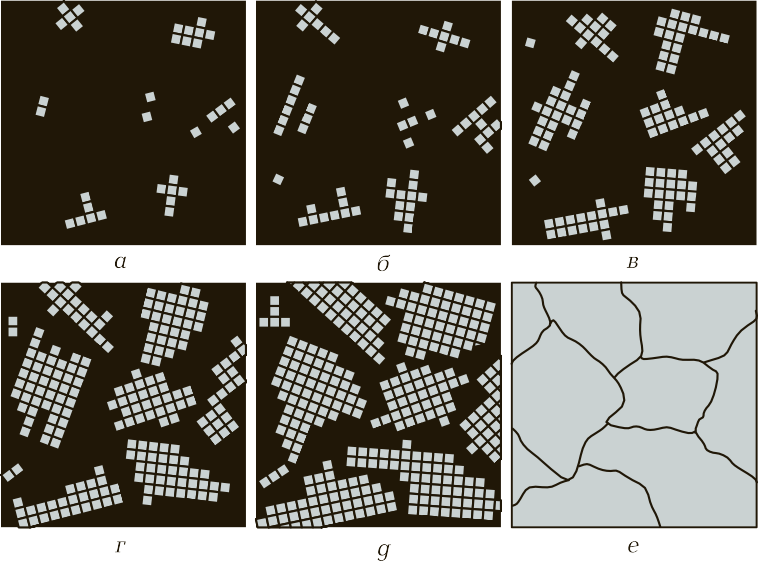
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
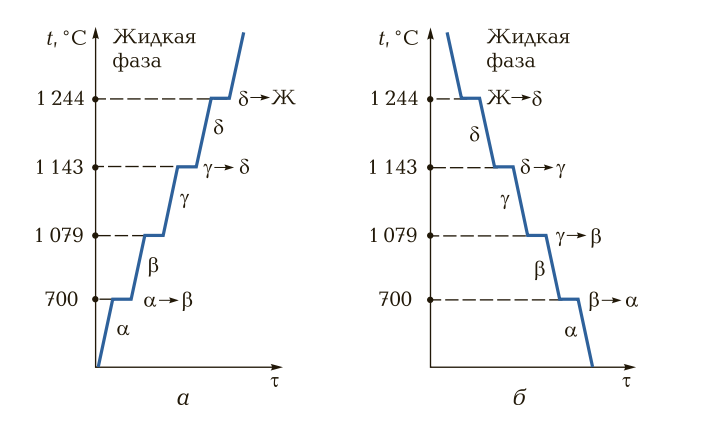
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Блеск (обычное)
Блеск, глянец — характеристика свойства поверхности, отражающей свет.
Строго научного определения понятия блеска не существует.
Содержание
Природа явления
Блеск обусловлен зеркальным отражением света от поверхности, большей частью происходящим одновременно с рассеянным (диффузным) отражением. Глаз человека воспринимает зеркальное отражение на фоне диффузного, и количественная оценка блеска определяется соотношением между интенсивностями зеркально и диффузно отражённого света. Нередко блеск характеризуется качественными признаками (Блеск минералов).
Классификация
Стеклянный блеск
Стеклянный блеск характерен для веществ, плохо проводящих электрический ток.Пример- Кварц,Кальцит,полевой шпат,Флюорит и т.д.Похож на блеск стекла.
Металлический блеск
Металлический блеск обычно наблюдается у металлов, но некоторые вещества с относительно высокой электропроводностью, например пирит, сфалерит, халькопирит также имеют металлический блеск.Похож на блеск металла.
Полуметаллический блеск
Что-то как тусклое металлическое. Пример - Графит.
Алмазный Блеск
Выглядит как яркий Стеклянный блеск . Пример- Алмаз , Сфалерит.
Жирный Блеск
Не яркий , не очень заметный.Похож на блеск жира(сало).Пример - Сера.
Особые виды блеска
Перламутровый. Разнообразен.Яркий пример - Слюда.
Шелковый.Блеск нитевидных волокон.Примеры- Селенит , Асбест.
Матовый- почти нет блеска.
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Блеск (обычное)" в других словарях:
Феодализм — Содержание [О Ф. во Франции см. соотв. ст.]. I. Сущность Ф. и его происхождение. II. Ф. в Италии. III. Ф. в Германии. IV. Ф. в Англии. V. Ф. на Пиренейском полуострове. VI. Ф. в Чехии и Моравии. VII. Ф. в Польше. VIII. Ф. в России. IX. Ф. в… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Переменная звезда — У этого термина существуют и другие значения, см. Переменная звезда (значения). Переменная звезда звезда, блеск которой изменяется со временем в результате происходящих в её районе физических процессов. Строго говоря, блеск любой звезды… … Википедия
Звезда — У этого термина существуют и другие значения, см. Звезда (значения). Плеяды Звезда небесное тело, в котором идут, шли или будут идти … Википедия
Звёздная величина — Звёздная величина, (блеск) безразмерная числовая характеристика яркости объекта. Обычно термин применяется к небесным светилам. Звёздная величина характеризует поток энергии (энергию всех фотонов в секунду) на единицу площади от… … Википедия
Вселенная — Крупномасштабная структура Вселенной как она выглядит в инфракрасных лучах с длиной волны 2,2 мкм 1 600 000 галактик, зарегистри … Википедия
Шлифование — Шлифовáние механическая или ручная операция по обработке твёрдого материала (металл, стекло, гранит, алмаз и др.). Разновидность абразивной обработки, которая, в свою очередь, является разновидностью резания. Механическое шлифование обычно… … Википедия
Папство — Содержание: внешняя история папства. Папские выборы. Список пап. Развитие теории папской власти. Внешняя история. Титул Папа (греч. πάππας = отец) до конца V в. употреблялся как почетное наименование всех епископов; с конца V в. он относился,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ГЛАЖЕНИЕ — белья и верхней одежды производится различными утюгами. Наиболее удобны электрические утюги, особенно с терморегулятором и подпаривателем, исключающим необходимость предварительного увлажнения (см. Утюг). Так как разные ткани (хлопок, шерсть,… … Краткая энциклопедия домашнего хозяйства
Толстой Лев Николаевич — Толстой (граф Лев Николаевич) знаменитый писатель, достигший еще небывалой в истории литературы XIX в. славы. В его лице могущественно соединились великий художник с великим моралистом. Личная жизнь Толстого, его стойкость, неутомимость,… … Биографический словарь
Пушкин, Александр Сергеевич — — родился 26 мая 1799 г. в Москве, на Немецкой улице в доме Скворцова; умер 29 января 1837 г. в Петербурге. Со стороны отца Пушкин принадлежал к старинному дворянскому роду, происходившему, по сказанию родословных, от выходца "из… … Большая биографическая энциклопедия
Большая Энциклопедия Нефти и Газа
Металлический блеск проявляют лишь компактные массы металла. Так, при восстановлении водородом окиси меди медь получается в виде порошка, лишенного металлического блеска, но достаточно утрамбовать этот порошок и отшлифовать его, чтобы метал лический блеск появился. [1]
Металлический блеск , сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [2]
Металлический блеск металлы проявляют в компактной своей массе. Так, пластинка платины имеет серебристо-белый цвет и металлический блеск, тогда как в мелкораздробленном состоянии этот металл черного цвета и без металлического блеска. Металлы, отражающие примерно в одинаковой степени все лучи видимого спектра, имеют серебристо-белый цвет. [3]
Металлический блеск , появляющийся на некоторых пленках красок, не содержащих металлических пигментов, и маскирующий обычный цвет покрытия при наблюдении его вблизи к углам возникновения блеска68, называется бронзированием, так как отраженный свет при этом окрашен обычно в желтоватый цвет. Это, по-видимому, обусловлено очень высоким показателем преломления пигмента по отношению к узкому диапазону длин волн падающего света33, вследствие чего для этих длин волн пигмент более непрозрачен, чем для других. [5]
Металлический блеск - сильный блеск, свойственный металлам. Им обладают непрозрачные минералы, дающие в большинстве случаев черную черту на фарфоровой пластинке. Таким блеском обладают самородные металлы ( золото, серебро, платина), многие сульфиды и окислы железа. [6]
Металлический блеск имеют, например, галенит пирит. Все минералы с металлическим блеском непрозрачные, цвет их черты черный или темноокрашенный. [7]
Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. [8]
Металлический блеск , сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [9]
Металлический блеск наблюдается обычно только в том случае, когда металл образует компактную массу. Только магний и алюминий в виде порошков имеют металлический блеск. Блеск металлов обусловлен отражением падающего на металл света от электронов в его поверхностном слое. [11]
Металлический блеск проявляют лишь компактные массы металла. Так, при восстановлении водородом окиси меди медь получается в виде порошка, лишенного металлического блеска, но достаточно утрамбовать-этот порошок и отшлифовать его, чтобы металлический блеск - появился. Лишь два металла сохраняют металлический блеск и в порошкообразном состоянии: магний и алюминий. Поэтому алюминиевая пыль применяется в качестве серебряной краски. [13]
Металлическим блеском различной степени интенсивности обладают некоторые минералы, например графит, пирротин, пирит, никелин, арсенопирит. [14]
Кроме металлического блеска и пластичности, все металлы обладают выср-кой электропроводностью и теплопроводностью. [15]
Блеск
Субъективно блеск зависит не только от гладкости поверхности, но и от коэффициента отражения.
- Гладкость поверхности. Если размер неровностей поверхности меньше длины волны, то доля зеркально отражённого света по отношению к диффузному велика. Если размер неровностей поверхности намного больше длины волны (шероховатая поверхность), то велика доля диффузно отражённого света. . Коэффициент отражения — это доля падающего света, которая отражается от поверхности. Чем больше отражается света, тем больше света отражается зеркально.
Стеклянный блеск характерен для веществ, плохо проводящих электрический ток. Например, кварц, кальцит, полевой шпат, флюорит и т. д. Похож на блеск стекла.
Металлический блеск обычно наблюдается у металлов, но некоторые вещества с относительно невысокой электропроводностью, например пирит, сфалерит, халькопирит также имеют металлический блеск. Похож на блеск металла, что обусловлено наличием в кристаллической решётке кристаллов относительно свободных электронов.
Как что-то тусклое металлическое. Пример — графит.
Выглядит как яркий стеклянный блеск. Пример — алмаз, сфалерит.
Не яркий, не очень заметный. Похож на блеск жира, сала. Пример — сера.
- Перламутровый. Разнообразен. Яркий пример — слюда.
- Шёлковистый. Блеск нитевидных волокон. Примеры — селенит, асбест.
- Матовый — почти нет блеска.
Ссылки
Смотреть что такое "Блеск" в других словарях:
блеск — блеск, а и у … Русский орфографический словарь
блеск — блеск/ … Морфемно-орфографический словарь
блеск — сущ., м., употр. часто Морфология: (нет) чего? блеска и блеску, чему? блеску, (вижу) что? блеск, чем? блеском, о чём? о блеске 1. Блеском обладают яркие предметы, например те, которые отражают солнечный свет. Блеск бриллиантов. | Солнечный,… … Толковый словарь Дмитриева
БЛЕСК — БЛЕСК, блеска, мн. нет, муж. 1. Яркий, сияющий свет. Блеск солнца. Блеск молнии. Блеск штыков. 2. перен. Пышность, великолепие. Блеск наряда. Блеск славы. || перен. Яркие внешние достоинства (об уме, речи и т.п.). Блеск остроумия. Блеск… … Толковый словарь Ушакова
блеск — См … Словарь синонимов
блеск — а ( у); м. 1. Яркий, искрящийся, сияющий свет, отсвет. Б. молнии. Б. росы. Б. пуговиц. Солнечный, янтарный б. До блеска начистить чайник. Наводить б. на что л. (чистить так, чтобы блестело, сверкало). * Он сохранил и блеск лазурных глаз, И… … Энциклопедический словарь
БЛЕСК — БЛЕСК, а ( у), муж. 1. Яркий искрящийся свет, отсвет. Б. лучей. Б. молнии. Б. штыков. 2. перен. Великолепие, яркое проявление чего н. Б. славы. Б. остроумия. С блеском (превосходно, очень хорошо). Во всём блеске (полностью обнаруживая свои… … Толковый словарь Ожегова
блеск — БЛЕСК, а, м.. 1. Что л. высокого качества, хорошее, блестящее. У Ленки Полина Осиповна блеск, а не маман (мама). 2. в зн. межд. (или шик блеск красота). Прекрасно, ну и ну, ай да вещь! С нечеловеческим (или со страшным, с нестерпимым, с диким и т … Словарь русского арго
БЛЕСК — качественная характеристика свойств поверхности, отражающей свет. Строгое научное определение понятия блеск отсутствует … Большой Энциклопедический словарь
БЛЕСК — «БЛЕСК» (Shine) Австралия, 1996, 106 мин. Драма, музыкальный фильм. В течение первых сорока минут можно только недоумевать по поводу того, как такая совершенно обычная, ничем не примечательная картина из Австралии удостоилась семи номинаций на… … Энциклопедия кино
БЛЕСК — и нищета куртизанок. Разг. 1. О жизни проституток. 2.Об антагонистических противоречиях, разных сторонах одного явления. 3. О помпезности при материальной или духовной бедности. /em> Название романа О. де Бальзака из цикла «Сцены парижской жизни» … Большой словарь русских поговорок
Изучая твердые вещества, не имеющие характерного металлического блеска , мы замечаем, что их электропроводность очень низкая. К ним относятся вещества, которые мы называем ионными - хлористый натрий, хлористый кальций, нитрат серебра и хлористое серебро, а также молекулярные кристаллы, например лед. Лед, изображенный на рис. 5 - 3, состоит из тех же молекул, которые существуют в газовой фазе, но упорядочение расположенных в кристаллической решетке. Эти плохие проводники электрического тока сильно отличаются от металлов почти по всем свойствам. Таким образом, электропроводность может быть использована для классификации веществ, которая является однош из наиболее обоснованных. [17]
Металлами называются простые кристаллические вещества, имеющие характерный металлический блеск , хорошо проводящие тепло и электрический ток, способные изменять свою форму под действием внешних усилий и сохранять ее после снятия нагрузки без каких-либо признаков разрушения. Из всего количества химических элементов, известных в настоящее время, восемьдесят элементов относятся к металлам. Наиболее распространенными в земной коре металлами в виде химических соединений являются алюминий, железо, магний, калий, натрий и кальций. Чистые металлы имеют ограниченное применение в технике, так как в природе встречаются крайне редко, а получение их из химических соединений ( руд) связано с большими трудностями. [18]
В результате водородной коррозии поверхность стали теряет характерный металлический блеск и становится матовой. [20]
Полимеры представляют собой тонкодисперсные окрашенные порошки с характерным металлическим блеском , растворимые лишь в концентрированной серной кислоте. [21]
Все d - элементы являются металлами с характерным металлическим блеском . По сравнению с s - металлами их прочность значительно выше. [22]
Не растворившийся иод образует хорошо видимую пленку с характерным металлическим блеском ( плавающую на поверхности раствора) или собирается на дне колбы в виде черных частичек. Так как раствор иода окрашен в интенсивно красный цвет и почти не прозрачен, рассматривать его нужно очень тщательно, держа колбу против яркой электрической лампы, висящей на потолке. Для этого нужно встать под лампой, держа колбу за горло в наклонном положении между лампой и лицом, и стараться увидеть в ней яркое изображение лампы. На таком фоне не растворившиеся кристаллы иода хорошо заметны. Тогда кристаллы обоих веществ соберутся в одном месте и вокруг кристаллов иода создастся зона концентрированного раствора KJ, в котором иод быстро растворится. [23]
Все щелочные металлы - вещества серебристо-белого цвета, с характерным металлическим блеском , хорошей электро - и теплопроводностью, низкими температурами плавления и сравнительно низкими температурами кипения, малой плотностью и большим объемом атомов. В парообразном состоянии их молекулы одноатомны; ионы бесцветны. [25]
По внешнему виду темно-фиолетовые, почти черные кристаллы с характерным металлическим блеском . Хорошо растворяется в воде. Марганцовокислый калий относится к числу сильных окислителей, чем и обусловлены его дезинфекционные свойства. [26]
Благодаря коллективизированным электронам металлы обладают электро - и теплопроводностью, характерным металлическим блеском и некоторыми другими чисто металлическими свойствами. Например, блеск объясняется отражением световых лучей от коллективизированных электронов. [28]
Графит имеет цвет от серебристо-серого и темно-свинцового до черного с характерным металлическим блеском . [29]
Металлами называются химические элементы, отличительными признаками которых являются непрозрачность, характерный металлический блеск , свойство коваться, вытягиваться в нить и проволоку, свариваться, хорошо проводить тепло и электричество. Химические элементы, не обладающие перечисленными свойствами, называются неметаллами. [30]
Читайте также:
