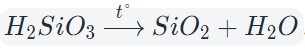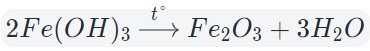Что такое окислы металла
Обновлено: 05.10.2024
Окси́д (о́кисел, о́кись) — соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространенный тип соединений, содержащихся в земной коре и во вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Окислами называется класс минералов, представляющих собой соединения металла с кислородом (см. Категория:Окислы).
Соединения, содержащие атомы кислорода, соединённые между собой, называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов.
Содержание
Классификация
В зависимости от химических свойств различают:
- солеобразующие оксиды
- основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO); Оксиды металлов, валентность которых I-II, кроме ZnO.
- кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2); Оксиды металлов с валентностью V-VII и оксиды неметаллов.
- амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3); Оксиды металлов с валентностью III-IV и ZnO.
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент образует несколько оксидов, то в их названиях указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, моноокисью или закисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распостранены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
Химические свойства: Основные оксиды.
Примечание:кислота ортофосфорная или сильная.
2. Сильноосновный оксид + вода = щелочь
3. Сильноосновный оксид + кислотный оксид = соль
4. Основный оксид + водород = металл + вода
Примечание: металл менее активный, чем алюминий.
Химические свойства: Кислотные оксиды.
Некоторые оксиды, например SiO2, с водой не реагируют, поэтому их кислоты получают косвенным.
2. Кислотный оксид + основной оксид = соль
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
4. Нелетучий оксид + соль1 = соль2 + летучий оксид
Химические свойства: Амфотерные оксиды.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O = K2[Zn(OH)4)] (в водном растворе)
ZnO + CaO = CaZnO2 (при сплавлении)
Получение оксидов
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
2. Обжиг или горение бинарных соединений в кислороде:
3. Термическое разложение солей:
4. Термическое разложение оснований или кислот:
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
6. Взаимодействие некоторых металлов с водой при высокой температуре:
7. Взаимодействие солей с кислотными оксидами при нагревании с выделением летучего оксида:
9. При действии водоотнимающих веществ на кислоты и соли:
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Окисел" в других словарях:
окисел — оксид, ангидрид Словарь русских синонимов. окисел сущ., кол во синонимов: 2 • ангидрид (1) • оксид … Словарь синонимов
ОКИСЕЛ — ОКИСЕЛ, принятое в прошлом наименование оксидов … Научно-технический энциклопедический словарь
ОКИСЕЛ — ОКИСЕЛ, окисла, муж. (хим.). Соединение химического элемента с кислородом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ОКИСЕЛ — ОКИСЕЛ, сла, муж. (спец.). Соединение химического элемента с кислородом, оксид. Природные окислы. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
окисел — окисел, сла … Русский орфографический словарь
окисел — oksidas statusas T sritis chemija apibrėžtis Elemento junginys su deguonimi. atitikmenys: angl. oxide rus. окисел; окись; оксид … Chemijos terminų aiškinamasis žodynas
окисел — oksidas statusas T sritis fizika atitikmenys: angl. oxide vok. Oxyd, n rus. окисел, m; окись, f pranc. oxyde, m … Fizikos terminų žodynas
окисел-катализатор — окисел катализатор, окисла катализатора … Орфографический словарь-справочник
окисел металла — metalo oksidas statusas T sritis chemija apibrėžtis Metalo junginys su deguonimi. atitikmenys: angl. metal oxide rus. окисел металла … Chemijos terminų aiškinamasis žodynas
Окисел — м. Химическое соединение какого либо элемента с кислородом. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
окисел — окисел, окислы, окисла, окислов, окислу, окислам, окисел, окислы, окислом, окислами, окисле, окислах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Окислы
Смотреть что такое "Окислы" в других словарях:
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
ОКИСЛЫ — м лы, являющиеся соединениями металлов и неметаллов с кислородом. В зависимости от хим. свойств их делят на: 1) кислотные или ангидриты (SiO2 и др.); 2)основные (СаО и др.); 3) амфотерные (Al2O3 и др.); 4) безразличные, или индифферентные (редки) … Геологическая энциклопедия
ОКИСЛЫ — (устаревшее название) то же, что (см.) … Большая политехническая энциклопедия
ОКИСЛЫ — согласно международной химической номенклатуре окислы называют оксидами … Металлургический словарь
Окислы и гидроокислы — Окислы и гидроокислы минералы, являющиеся соединениями металлов и неметаллов с кислородом. Классификация В зависимости от химических свойств окислы разделяют Кислотные или ангидриты (SiO2 и другие). Основные (СаО и другие). Амфотерные… … Википедия
Окислы и гидроокислы (минералы) — Окислы и гидроокислы минералы, являющиеся соединениями металлов и неметаллов с кислородом. Классификация В зависимости от химических свойств окислы разделяют Кислотные или ангидриты (SiO2 и другие). Основные (СаО и другие). Амфотерные… … Википедия
Окислы азота — Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания Источник: ГОСТ 24585 81: Дизел … Словарь-справочник терминов нормативно-технической документации
Окислы природные — группа минералов, представляющих собой природные химические соединения элементов с кислородом, с гидроксильной группой (т. и. гидроокислы или гидроксиды), а также с О и OH вместе (т. н. оксигидраты). В качестве катионов в составе О. п.… … Большая советская энциклопедия
Окисление металлов
реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). В более широком смысле О. м. — реакции, в которых атомы теряют электроны и образуются различные соединения, например хлориды, сульфиды и т.п. В природе металлы находятся почти исключительно в окисленном состоянии (в виде руд), поэтому их производство основано на процессах восстановления различных соединений. Металлы и сплавы, используемые на практике, вследствие воздействия окружающей среды подвергаются постепенному окислению — коррозии (См. Коррозия). Направление процессов О. м. определяется как термодинамическим фактором — изменением свободной энергии при реакции, так и кинетическим — скоростью её протекания, которая в значительной степени зависит от природы продуктов окисления и характера их взаимодействия с металлом. При производстве металлургической продукции О. м. может привести к образованию окалины (См. Окалина), потере ценных легирующих элементов и железа. В ряде же случаев проводят преднамеренное О. м. в защитных или декоративных целях (см. Оксидирование).
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Смотреть что такое "Окисление металлов" в других словарях:
окисление металлов — Процесс взаимодействия твердого или жидкого металла (сплава) с кислородом, сопровождаемый образованием оксидов. В более широком смысле окисление металлов — реакции, в которых атомы теряют электроны и образуют соединения, например, хлориды,… … Справочник технического переводчика
Окисление металлов — [oxydation of metals] процесс взаимодействия твердого или жидкого металла (сплава) с кислородом, сопровождающий образование оксидов. В более широком смысле окисление металлов реакции, в которых атомы теряют электроны и образуются соединения,… … Энциклопедический словарь по металлургии
ОКИСЛЕНИЕ МЕТАЛЛОВ — [oxydation of metals] процесс взаимодействия твердого или жидкого металла (сплава) с кислородом, сопровождаемый образованием оксидов. В более широком смысле окисление металлов реакции, в которых атомы теряют электроны и образуют соединения,… … Металлургический словарь
окисление металлов — ▲ окисление ↑ металл ↓ патина. патинировать. позеленеть. окалина. | оксидирование … Идеографический словарь русского языка
Окисление - восстановление — Окисление восстановление, окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
Окисление-восстановление — окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел (См. Окислительное число) атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
МЕТАЛЛОВ ОКИСЛЕНИЕ — подразделяется на химическое и электрохимическое. Для хим. окисления используют обычно газообразные реагенты, для электрохим. водные р ры. М. о. газообразными реагентами протекает при газовой коррозии, получении оксидов или галогенидов металлов… … Химическая энциклопедия
окисление-восстановление — [redox] химические реакции, сопровождаемые изменением окислительных чисел атомов. Согласно кислородной теории горения А. Лавуазье (кон. XVIII в.) окисление называл только реакции соединения с кислородом, восстановлением отнятие кислорода. С… … Энциклопедический словарь по металлургии
окисление-восстановление — Химические реакции, сопровождающиеся изменением окислительных чисел атомов. Согласно кислородной теории горения А. Лавуазье (кон. XVIII в.) окислением называются только реакции соединения с кислородом, восстановлением — отнятие кислорода. С … Справочник технического переводчика
Окисление — – процесс образования окислов металлов. [Блюм Э. Э. Словарь основных металловедческих терминов. Екатеринбург, 2002 г.] Рубрика термина: Общие термины Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги … Энциклопедия терминов, определений и пояснений строительных материалов
Оксиды
![]()
Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
О чем эта статья:
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
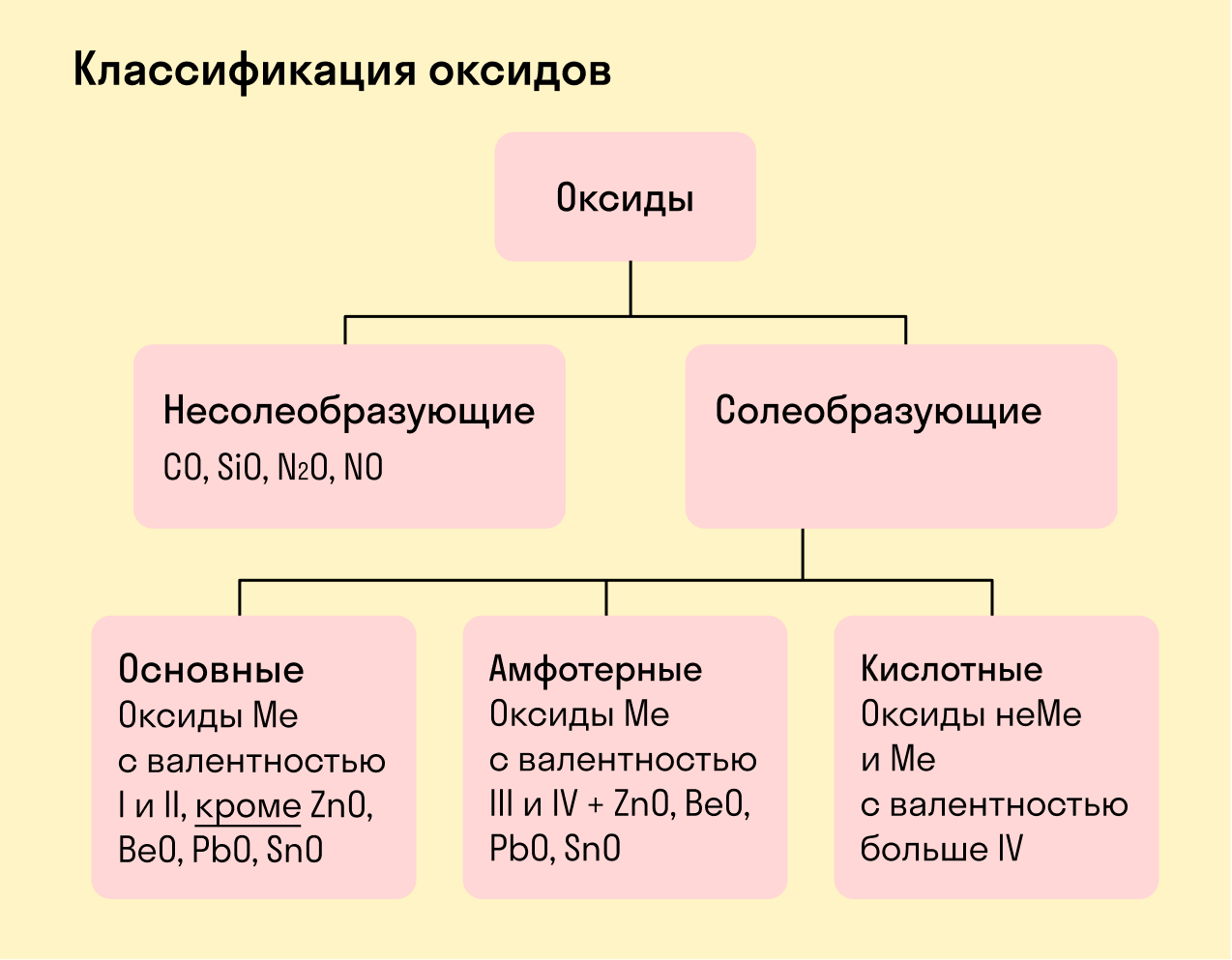
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
![Классификация оксидов]()
Номенклатура оксидов
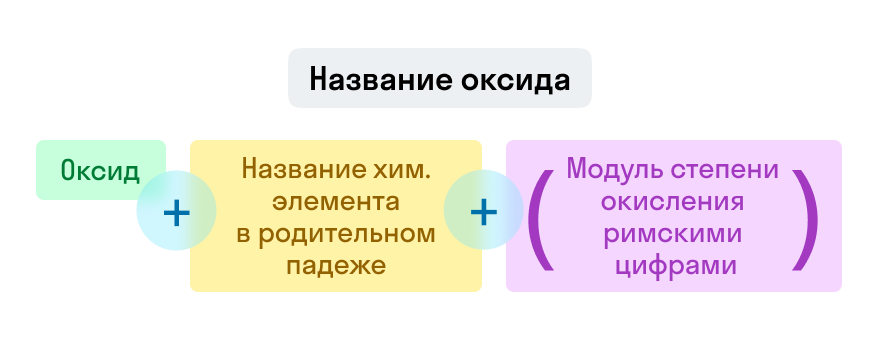
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
![Номенклатура оксидов]()
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
![Разложение кремниевой кислоты при нагревании]()
![Разложение гидроксида железа (III) при нагревании]()
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Коррозия металлов
![]()
Всякое явление или процесс вокруг нас связан с химией. Скажем, ржавление железа. Хоть раз в жизни вы наверняка задумывались, почему одни металлы ржавеют и разрушаются, а другие — нет. И что такого особенного в нержавеющей стали, что этот процесс ей нипочем? Обо всем это мы и поговорим в сегодняшней статье.
Коротко о главном
Коррозия металлов или ржавление в химии — это явление, которое возникает из-за взаимодействия металлической пластинки с веществами окружающей среды (кислородом воздуха или кислотами, с которыми может реагировать металлическое изделие).
Обычно окисляются металлы, включая железо, которые находятся левее водорода в ряду напряжений.
![Ряд активности металлов]()
Чаще всего встречаются химическая и электрохимическая коррозии. Чтобы понять, чем они отличаются друг от друга, давайте сравним их по нескольким критериям в таблице ниже.
Таблица 1. Сравнение химической и электрохимической коррозии металлов
Признаки сравнения
Химическая коррозия
Электрохимическая коррозия
Разрушение металлов в из-за взаимодействия с газами или растворами, которые не проводят электрический ток
Разрушение металла, при котором возникает электрический ток в воде или среде другого электролита
При контакте железа с цинком коррозии подвергается цинк:
Zn 0 - 2e - = Zn 2+ .
Защитить металл от коррозии можно по-разному: покрытием защитными материалами, электрохимическими методами, шлифованием и т. д. Далее — подробно обо всем этом.
Что такое коррозия
Коррозия — это самопроизвольное разрушение элементов, чаще всего металлов, под действием химического или физико-химического влияния окружающей среды.
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии. Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама. Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Виды коррозии металлов
Химическая коррозия
Химическая коррозия — это процесс разрушения металла, который связан с реакцией между металлом и коррозионной средой.
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
газовая коррозия — металл корродирует под воздействием различных газов при высоких температурах;
коррозия в жидкостях — неэлектролитах.
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород. В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла, которое протекает при его взаимодействии с окружающей средой электролита.
Этот вид коррозии считают наиболее распространенным. Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики. Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
Гомогенный механизм электрохимической коррозии
Гетерогенный механизм электрохимической коррозии
Поверхность металла рассматривается как однородный слой.
У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке.
Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов.
Неоднородность можно наблюдать при наличии в сплаве каких-либо включений.
Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса.
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Как защитить металлы от коррозии
От коррозии можно и нужно защищаться. Чтобы уберечь металлы от этой реакции, их покрывают защитными материалами, обрабатывают электрохимическими методами, шлифованием и т. д. Рассмотрим все эти способы подробнее.
Способ № 1. Защитные покрытия.
Для защиты от коррозии металлические изделия покрывают другим металлом, т. е. производят никелирование, хромирование, цинкование, лужение и т. д. Еще один вариант защиты — покрыть поверхность металла специальными лаками, красками, эмалями.
Способ № 2. Легирование.
Легирование — это введение добавок, которые образуют защитный слой на поверхности металла. Например, при легировании железа хромом и никелем получают нержавеющую сталь.
Способ № 3. Протекторная защита.
Протекторная защита — это способ уберечь металл от коррозии, при котором металлическое изделие соединяют с более активным металлом. Этот второй металл в итоге и разрушается в первую очередь.
Способ № 4. Электрохимическая защита.
Чтобы защитить металлы от электрохимической коррозии, нейтрализуют ток, который возникает при ней. Это делают с помощью постоянного тока, который пропускают в обратном направлении.
Способ № 5. Изменение состава среды путем добавления ингибиторов.
Для защиты от коррозии используют специальные средства, которые ее замедляют — ингибиторы. Они изменяют состояние поверхности металла — образуют труднорастворимые соединения с катионами металла. Защитные слои, образованные ингибиторами, всегда тоньше наносимых покрытий.
Способ № 6. Замена корродирующего металла на другие материалы: керамику и пластмассу.
Способ № 7. Шлифование поверхностей изделия.
Проверьте себя
Что такое коррозия?
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
Гидроксид железа Fe(OH)3 называют:
Что является причиной возникновения коррозии?
Чем отличаются химический и электрохимический типы коррозии?
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их. Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!
Читайте также: