Цинк это сплав или металл
Обновлено: 18.05.2024
Благодаря археологическим раскопкам было обнаружено, что изделия из цинка стали применять примерно с 7 века нашей эры. Этот металл был очень распространен за счет ряда полезных свойств. Цинковый сплав может изготавливаться из различных веществ, от чего зависят его характеристики. Такой материал применяется в различных отраслях, в том числе и в бижутерии.
Свойства и характеристики цинка и цинковых сплавов
Характеристики цинковых сплавов во многом обусловлены свойствами цинка. Это металл голубоватого цвета, не встречается в чистом виде, обычно содержит примеси, из-за которых меняются его свойства. Чистый металл получается в результате нескольких реакций.
Цинк обладает следующими химическими свойствами:
- При нагревании реагирует с сероводородом и водой с выделением водорода.
- Не реагирует с азотом и углеродом.
- Со щелочами реагирует с образованием солей цинковой кислоты – цинкатов.
Цинк – это очень прочный материал. Его пластичность увеличивается при нагревании. Если его нагреть больше чем на 210 градусов, от этого может поменяться его форма. При низких температурах вещество плавится.

Как выглядит цинковый сплав
Количество примесей зависит от методов добычи металла, особенностей его обработки и пороты цинка. Чаще всего можно встретить примеси в виде никеля, хлора, фтора и свинца. Обычно при создании цинковых сплавов используют чистый цинк, так как наличие примесей ухудшает качество материала:
- олово делает сплав слишком хрупким и ломким;
- при присутствии кадмия снижается пластичность материала;
- свинец повышает межкристальную коррозию материала, способствует его растворению в кислотах;
- наличие железа повышает твердость сплавов, но снижают их пластичность;
- из-за мышьяка сплав становится хрупким и непластичным.
Поэтому для улучшения характеристик цинковых сплавов цинк сначала очищают от примесей. А в дальнейшем используют чистый металл, который сплавляют с разными компонентами.
Плюсы и минусы
Большинство цинковых сплавов имеют следующие преимущества:
- они очень прочные, не повреждаются при механических воздействиях;
- устойчивы к коррозии;
- имеют хорошие литейные качества, могут использоваться для создания даже мелких элементов;
- со временем практически не подвергаются старению.
Однако примеси даже в незначительном количестве ухудшают характеристики сплава. Приводят к снижению жидкоплавкости, к набуханию, способствуют появлению трещин. Поэтому цинковые сплавы должны создаваться с соблюдением всех технологий, а количество примесей в них не должно превышать 0,005%.
Многие спрашивают, темнеют или нет цинковые сплавы? В этом еще один недостаток материала. Цинковые сплавы могут темнеть с течением времени. Притом потемнения обычно распространяются на всю поверхность материала. Это обуславливается образованием оксидной пленки на поверхности материала. Она формируется при комнатной температуре после контакта с воздухом или водой. Поэтому во избежание этого требуется нанесение гальванических покрытий.
Разновидности цинковых сплавов
Цинк могут сплавлять с различными веществами, отчего будут зависеть свойства полученного материала. Сплавление чистого цинка с медью, алюминием и оловом может улучшить его характеристики. Полученный состав будет более качественным, нежели чистое вещество.
Медь и цинк
Медно-цинковый сплав называется латунью. Такой сплав известен уже очень давно. Сначала его изготавливали посредством сплавления цинковой руды и меди. И только в 18 веке впервые был создан сплав из меди и металлического цинка.
Притом оба компонента могут брать в разных пропорциях. В результате этого отличают несколько разновидностей латуни:
- Зеленая. Содержит 60% меди и 40% цинка.
- Золотистая. В ее состав входит 75% меди и 25% цинка.
- Желтая. Содержит 67% меди и 33% цинка.
Латунь отлично поддается обработке давлением. Характеризуется высокими механическими свойствами, неплохой коррозионной устойчивостью. Но на воздухе, в соленой воде и углекислых растворах латунь неустойчива, быстро покрывается темной кислородной пленкой.
Внешне латунь выглядит красивее меди, характеризуется лучшей коррозионной стойкостью. Но с ростом температуры интенсивность коррозии также увеличивается. Ее могут спровоцировать повышенная влажность воздуха, наличие в нем аммиака или сернистого газа. Поэтому для предотвращения коррозии материал подвергают низкотемпературному обжигу.
Латуни не теряют своих свойств при понижении температуры. Это позволяет использовать их, как конструкционный материал. Но при высоких температурах (более 200 градусов) могут наблюдаться явления хрупкости латуни.
Олово и цинк
Сплав цинка с оловом характеризуется высокими защитными свойствами. Ржавеет или нет цинковый сплав с оловом? Такой материал получается очень устойчивым к коррозии. Самыми лучшими антикоррозионными свойствами обладает сплав с 20-25% цинка и 75-80% олова. Поэтому его можно применять в условиях высокой влажности, со временем его внешний вид не ухудшится. Чем выше содержание цинка в сплаве, тем ниже его коррозионная устойчивость. Если сплав содержит 50% и более цинка, его корозионная стойкость приближена к стойкости чистого цинка.
Сплав олова с цинком обладает следующими преимуществами:
- Он очень пластичен, хорошо подается пайке.
- Полировка осадка сохраняется на протяжении долгого времени.
- Имеет высокую коррозионную стойкость.
За счет наличия вышеперечисленных свойств сплав олова и цинка обычно применяют в электро- и радиопромышленности. Изделия из него получаются очень прочными и устойчивыми к внешним воздействиям.
Алюминий и цинк
Чаще всего создается сплав из цинка, алюминия и меди, который называют ЦАМ. Также в его состав входит небольшое количество магния.
Такой сплав имеет небольшую температуру плавления, хорошо подается литью. Изделия из него получаются очень прочными и устойчивыми к окружающей среде.
Есть несколько качественных сплавов цинка с алюминием, которые обозначаются через ЦАМ 4-1, ЦАМ 4-3, ЦАМ 10-5 и другие. Они содержат примерно одинаковое количество алюминия, но разное – магния, никеля и меди. Стоимость сплава алюминия с цинком ниже, чем олова с цинком. Поэтому изделия из него стоят в разы дешевле.
Сфера применения
Цинковые сплавы получили широкое применение. Их используют в таких отраслях:
- В автомобилестроении. Из цинковых сплавов изготавливают дверные ручки, зеркала, создают детали для декора салона автомобиля.
- При создании ювелирных украшений. Цинк сплавляют с золотом, за счет чего повышается его пластичность и ковкость. Это позволяет легко соединить мелкие детали друг с другом.
- В медицине. Цинковые сплавы используются для изготовления медицинской мебели и приборов. А окись цинка является хорошим антисептическим средством, поэтому его добавляют в различные мази и лекарства.
Таким образом, цинк и его соединения используются во многих областях. Но наибольшее применение вещество получило в автомобилестроении.
Виды цинковых сплавов по назначению
По назначению сплавы цинка могут быть нескольких видов:
- Деформируемые.15% – алюминий, 5%- медь, более 1% – магний. Изготавливается в виде листов или прутьев. По свойствам схожи с латунью.
- Литейные. Их изготавливают путем добавления в цинк 3-4% меди и алюминия, а также 0,05% магния. Имеют хорошую текучесть. Поэтому их изготавливают посредством литья под давлением или литья в формы.
- Антифрикционные. В их состав входит 10% алюминия, 5% меди и 0,1% магния. Изготавливаются посредством литья под давлением. Имеют низкий коэффициент трения и используются в автомобилестроении.
- Припои. Их используют для пайки алюминиевых деталей. Обычно включают в себя примеси – металлы. От этого повышается их прочность.
- Типографические. В их состав входит 7,5% алюминия, 2% магния и примерно 4% меди. Такие сплавы очень прочные, отлично льются в формы.
- Протекторные. В их состав входит не более 1% алюминия и мизерное количество кремния и магния. Устойчивы к коррозии даже во влажной среде. Поэтому такие сплавы применяются в качестве защитных материалов.
Цинковые сплавы хорошо себя зарекомендовали и получили широкое распространение. Но при их создании должны точно учитываться пропорции, иначе будет получен материал плохого качества.
Цинковый сплав в бижутерии
Внешне цинковые сплавы напоминают благородные металлы. Поэтому их используют в бижутерии для создания недорогих украшений. Бижутерия из цинкового сплава выглядит дорого, но легко создается.
Вреден ли цинковый сплав? На самом деле, он никак не влияет на организм человека. Но, тем не менее, лучше приобретать бижутерию хорошего качества. Обычно для создания украшений используется особый сплав, который так и называется – бижутерный. Чаще всего применяется латунь или сплав с алюминием. Внешне такие изделия напоминают золотые и серебряные.
Вреден ли цинковый сплав в бижутерии? Нет, поэтому изделия из него можно смело покупать. Ведь если бы он негативно воздействовал, изготовление украшений из него было бы запрещенным.
Таким образом, цинк и цинковые сплавы широко распространены. Их используют в медицине, автомобилестроении и даже в бижутерии. Это качественные и устойчивые материалы, которые практически не меняются под воздействием условий окружающей среды.
Цинк это сплав или металл
Zn, химический элемент II группы периодической системы Менделеева; атомный номер 30, атомная масса 65,38, синевато-белый металл. Известно 5 стабильных изотопов с массовыми числами 64, 66, 67, 68 и 70; наиболее распространён 64 Zn (48,89%). Искусственно получены 9 радиоактивных изотопов, среди которых наиболее долгоживущий 65 Zn с периодом полураспада T1/2 = 245 сут; применяется как изотопный индикатор (См. Изотопные индикаторы).
Историческая справка. Сплав Ц. с медью — латунь — был известен ещё древним грекам и египтянам. Чистый Ц. долгое время не удавалось выделить. В 1746 А. С. Маргграф разработал способ получения металла прокаливанием смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров Ц. в холодильниках. В промышленном масштабе выплавка Ц. началась в 17 в.
Распространение в природе. Среднее содержание Ц. в земной коре (кларк) — 8,3․10 -3 % по массе, в основных изверженных породах его несколько больше (1,3․10 -2 %), чем в кислых (6․10 -3 %). Известно 66 минералов Ц., важнейшие из них — Цинкит, Сфалерит, Виллемит, Каламин, Смитсонит, франклинит ZnFe2O4. Ц. — энергичный водный мигрант; особенно характерна его миграция в термальных водах вместе с Pb; из этих вод осаждаются сульфиды Ц., имеющие важное промышленное значение (см. Полиметаллические руды). Ц. также энергично мигрирует в поверхностных и подземных водах; главным осадителем для него является H2S, меньшую роль играет сорбция глинами и др. процессы. Ц. — важный биогенный элемент; в живом веществе содержится в среднем 5․10 -4 % Ц., но имеются и организмы-концентраторы (например, некоторые фиалки).
Физические и химические свойства. Ц. — металл средней твёрдости. В холодном состоянии хрупок, а при 100—150 °С весьма пластичен и легко прокатывается в листы и фольгу толщиной около сотых долей миллиметра. При 250 °С вновь становится хрупким. Полиморфных модификаций не имеет. Кристаллизуется в гексагональной решётке с параметрами а = 2,6594 Å, с = 4,9370 Å. Атомный радиус 1,37 Å; ионный Zn 2+ — 0,83 Å. Плотность твёрдого Ц. 7,133 г/см 3 (20 °С), жидкого 6,66 г/см 3 (419,5 °С); tпл 419,5 °С; tкип 906 °С. Температурный коэффициент линейного расширения 39,7․10 -6 (20—250 °С), коэффициент теплопроводности 110,950 вт/(м․К) 0,265 кал/см․сек․°С (20 °С), удельное электросопротивление 5,9․10 -6 ом․см (20 °С), удельная теплоёмкость Ц. 25,433 кдж/(кг․К) [6,07 кал/г․ о С)]. Предел прочности при растяжении 200—250 Мн/м 2 (2000—2500 кгс/см 2 ), относительное удлинение 40—50%, твёрдость по Бринеллю 400—500 Мн/м 2 (4000—5000 кгс/см 2 ). Ц. диамагнитен, его удельная магнитная восприимчивость — 0,175․10 -6 .
Внешняя электронная конфигурация атома Zn 3d 10 4s 2 . Степень окисления в соединениях +2. Нормальный окислительно-восстановительный потенциал, равный 0,76 в, характеризует Ц. как активный металл и энергичный восстановитель. На воздухе при температуре до 100 °С Ц. быстро тускнеет, покрываясь поверхностной плёнкой основных карбонатов. Во влажном воздухе, особенно в присутствии СО2, происходит разрушение металла даже при обычных температурах. При сильном нагревании на воздухе или в кислороде Ц. интенсивно сгорает голубоватым пламенем с образованием белого дыма цинка окиси (См. Цинка окись) ZnO. Сухие фтор, хлор и бром не взаимодействуют с Ц. на холоду, но в присутствии паров воды металл может воспламениться, образуя, например, ZnCl2. Нагретая смесь порошка Ц. с серой даёт сульфид Ц. ZnS. Сульфид Ц. выпадает в осадок при действии сероводорода на слабокислые или аммиачные водные растворы солей Zn. Гидрид ZnH2 получается при взаимодействии LiAIH4 с Zn (CH3)2 и др. соединениями Ц.; металлоподобное вещество, разлагающееся при нагревании на элементы. Нитрид Zn3N2 — чёрный порошок, образуется при нагревании до 600 °С в токе аммиака; на воз духе устойчив до 750 °С, вода его разлагает. Карбид Ц. ZnC2 получен при нагревании Ц. в токе ацетилена. Сильные минеральные кислоты энергично растворяют Ц., особенно при нагревании, с образованием соответствующих солей. При взаимодействии с разбавленными HCl и H2SO4 выделяется H2, а с HNO3 — кроме того, NO, NO2, NH3. С концентрированными HCl, H2SO4 и HNO3 Ц. реагирует, выделяя соответственно H2, SO2, NO и NO2. Растворы и расплавы щелочей окисляют Ц. с выделением На и образованием растворимых в воде цинкатов (См. Цинкаты). Интенсивность действия кислот и щелочей на Ц. зависит от наличия в нём примесей. Чистый Ц. менее реакционноспособен по отношению к этим реагентам из-за высокого перенапряжения на нём водорода. В воде соли Ц. при нагревании гидролизуются, выделяя белый осадок гидроокиси Zn (OH)2 (см. Амфотерность). Известны Комплексные соединения, содержащие Ц., например [Zn (NH3)4] SO4 и др.
Получение. Ц. добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое (См. Кипящий слой), переводя сульфид Ц. в окись ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты (См. Серная кислота). От ZnO к Zn идут двумя путями. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °С: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда (см. Огнеупоры), затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов Ц. получают в шахтных печах с дутьём. Производительность постепенно повышалась, но Ц. содержал до 3% примесей, в том числе ценный кадмий. Дистилляционный Ц. очищают ликвацией (т. е. отстаиванием жидкого металла от железа и части свинца при 500 °С), достигая чистоты 98,7%. Применяющаяся иногда более сложная и дорогая очистка ректификацией (См. Ректификация) даёт металл чистотой 99,995% и позволяет извлекать кадмий.
Основной способ получения Ц. — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Ц. осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного Ц. 99,95%, полнота извлечения его из концентрата (при учёте переработки отходов) 93—94%. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Применение. Около половины производимого Ц. расходуется на защиту стали от коррозии (см. Цинкование).
Поскольку Ц. в ряду напряжений стоит до железа, то при попадании оцинкованного железа в коррозионную среду разрушению подвергается Ц. Благодаря хорошим литейным качествам и низкой температуре плавления из Ц. отливают под давлением различные мелкие детали самолётов и др. машин. Сплавы меди с Ц. — Латунь, Нейзильбер, а также Ц. со свинцом и др. металлами широко применяются в технике (см. Цинковые сплавы). Ц. даёт с золотом и серебром интерметаллиды (нерастворимые в жидком свинце) и поэтому Ц. применяется для рафинирования свинца от благородных металлов. В виде порошка Ц. служит восстановителем в ряде химико-технологических процессов: в производстве гидросульфита, при осаждении золота из промышленных цианистых растворов, меди и кадмия при очистке растворов цинкового купороса и др. Многие соединения Ц. являются люминофорами (См. Люминофоры), например три основных цвета на экране кинескопа зависят от ZnS․Ag (синий цвет), ZnSe․Ag (зелёный цвет) и Zn3(PO4)2․Mn (красный цвет). Важными полупроводниковыми материалами (См. Полупроводниковые материалы) служат соединения Ц. типа A II B VI — ZnS, ZnSe, ZnTe, ZnO. Магнитно-мягкими ферритами отечественных марок МН и HH являются соответственно марганец- и никель-цинковые шпинели.
Наиболее распространённые химические источники тока (например, Лекланше элемент, Окиснортутный элемент) имеют в качестве отрицательного электрода Ц.
Ц. в организме. Ц. как один из биогенных элементов (См. Биогенные элементы) постоянно присутствует в тканях растений и животных. Среднее содержание Ц. в большинстве наземных и морских организмов — тысячные доли процента. Богаты Ц. грибы, особенно ядовитые, лишайники, хвойные растения и некоторые беспозвоночные морские животные, например устрицы (0,4% сухой массы). В зонах повышенных содержаний Ц. в горных породах встречаются концентрирующие Ц. т. н. Галмейные растения. В организм растений Ц. поступает из почвы и воды, животных — с пищей. Суточная потребность человека в Ц. (5—20 мг) покрывается за счёт хлебопродуктов, мяса, молока, овощей; у грудных детей потребность в Ц. (4—6 мг) удовлетворяется за счёт грудного молока.
Биологическая роль Ц. связана с его участием в ферментативных реакциях, протекающих в клетках. Он входит в состав важнейших ферментов: карбоангидразы, различных дегидрогеназ, фосфатаз, связанных с дыханием и др. физиологическими процессами, протеиназ и пептидаз, участвующих в белковом обмене, ферментов нуклеинового обмена (РНК- и ДНК-полимераз) и др. Ц. играет существенную роль в синтезе молекул информационной РНК на соответствующих участках ДНК (транскрипция), в стабилизации рибосом и биополимеров (РНК, ДНК, некоторые белки).
В растениях наряду с участием в дыхании, белковом и нуклеиновом обменах Ц. регулирует рост, влияет на образование аминокислоты триптофана. повышает содержание гиббереллинов. Ц. стабилизирует макромолекулы различных биологических мембран и может быть их интегральной частью, влияет на транспорт ионов, участвует в надмолекулярной организации клеточных органелл. В присутствии Ц. в культуре Ustilago sphaerogena формируется большее число митохондрий, при недостатке Ц. у Euglena gracilis исчезают рибосомы. Ц. необходим для развития яйцеклетки и зародыша (в его отсутствии не образуются семена). Он повышает засухо-, жаро- и холодостойкость растений. Недостаток Ц. ведёт к нарушению деления клеток, различным функциональным болезням — побелению верхушек кукурузы, розеточности растений (См. Розеточность растений) и др. У животных, помимо участия в дыхании и нуклеиновом обмене, Ц. повышает деятельность половых желёз, влияет на формирование скелета плода. Показано, что недостаток Ц. у грудных крыс уменьшает содержание РНК и синтез белка в мозге, замедляет развитие мозга. Из слюны околоушной железы человека выделен цинксодержащий белок; предполагается, что он стимулирует регенерацию клеток вкусовых луковиц языка и поддерживает их вкусовую функцию. Ц. играет защитную роль в организме при загрязнении среды кадмием.
Медицинское значение Ц. Дефицит Ц. в организме ведёт к карликовости, задержке полового развития; при его избыточном поступлении в организм возможны (по экспериментальным данным) канцерогенное влияние и токсическое действие на сердце, кровь, гонады и др. Производственные вредности могут быть связаны с неблагоприятным воздействием на организм как металлического Ц., так и его соединений. При плавке цинкосодержащих сплавов возможны случаи литейной лихорадки (См. Литейная лихорадка). Препараты Ц. в виде растворов (сульфат Ц.) и в составе присыпок, паст, мазей, свечей (окись Ц.) применяют в медицине как вяжущие и дезинфицирующие средства.
Лит.: Краткая химическая энциклопедия, т. 5, М., 1967; Лакерник М. М., Пахомова Г. Н., Металлургия цинка и кадмия, М., 1969; Севрюков Н. Н., Кузьмин Б. А., Челищев Е, В., Общая металлургия, М., 1976; Парибок Т. А., О роли цинка в метаболизме, в сборнике: Биологическая роль микроэлементов и их применение в сельском хозяйстве и медицине, М., 1974; Ковальский В. В., Геохимическая экология, М., 1974; Школьник М. Я., Микроэлементы в жизни растений, Л., 1974; Пейве Я. В., Микроэлементы и ферменты, в сборнике: Физиологическая роль и практическое применение микроэлементов, Рига, 1976; Bowen Н. J. М., Trace elements in biochemistry, L. — N. Y., 1966; Движков П. П., Соединения цинка, в кн.: Многотомное руководство по патологической анатомии, под ред. А. И. Струкова, т. 8, кн. 1, М., 1962; Вредные вещества в промышленности, под ред. Н. В. Лазарева, [т.] 2, М. — Л., 1965.
старинный духовой музыкальный инструмент. Прямой или изогнутый рог из дерева или слоновой кости с 6 отверстиями для изменения высоты звуков. В 16—17 вв. использовался в камерной светской и церковной музыке, применялся также (до 19 в.) городскими трубачами в качестве сигнального инструмента.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Цинк и его сплавы: химический состав, физические свойства, применение

Цинк — хрупкий голубовато-белый металл. В природе без примесей не встречается. В 1738 году Уильям Чемпион добыл чистые пары цинка с помощью конденсации. В периодической системе Менделеева находится под номером 30 и обозначается символом Zn.
Свойства цинка
Химические свойства цинка
Цинк — активный металл. При комнатной температуре тускнеет и покрывается слоем оксида цинка.
- Вступает в реакцию со многими неметаллами: фосфором, серой, кислородом.
- При повышении температуры взаимодействует с водой и сероводородом, выделяя водород.
- При сплавлении с щелочами образует цинкаты — соли цинковой кислоты.
- Реагирует с серной кислотой, образуя различные вещества в зависимости от концентрации кислоты.
- При сильном нагревании вступает в реакции со многими газами: газообразным хлором, фтором, йодом.
- Не реагирует с азотом, углеродом и водородом.
Физические свойства цинка
Цинк — твердый металл, но становится пластичным при 100–150 °C. При температуре выше 210 °С может деформироваться. Температура плавления — очень низкая для металлов. Несмотря на это, цинк имеет хорошую электропроводность.
- Плотность — 7,133 г/см³.
- Теплопроводность — 116 Вт/(м·К).
- Температура плавления цинка — 419,6 °C.
- Температура кипения — 906,2 °C.
- Удельная теплота испарения — 114,8 кДж/моль.
- Удельная теплота плавления — 7,28 кДж/моль.
- Удельная магнитная восприимчивость — 0,175·10-6.
- Предел прочности при растяжении — 200–250 Мн/м 2 .
Подробный химический состав цинка различных марок указан в таблице ниже.
| Обозначение марок | Цинк, не менее | Примесь, не более | |||||||
| свинец | кадмий | железо | медь | олово | мышьяк | алюминий | всего | ||
| ЦВ00 | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 |
| ЦВ0 | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| ЦВ | 99,99 | 0,005* | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| Ц0А | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| Ц0 | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| Ц1 | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0,01 | 0,010** | 1,3 |
| Ц3 | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | - | 2,5 |
| * В цинке, применяемом для производства сплава марки ЦАМ4-1о, массовая доля свинца должна быть не более 0,004%. ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%. | |||||||||
Содержание примесей в цинке зависит от способа производства и качества сырья.
В России основной процент цинка получают гидрометаллургическим способом — металл восстанавливают из солей в растворах. Такой способ позволяет получить наиболее чистый металл. Но часть цинка обрабатывают при высоких температурах. Такой метод называют пирометаллургическим.
Свинец — особая примесь в цинке, так как основная его часть оседает из-за нерастворимых анодов, содержащихся в металле. Катодный цинк, помимо всех указанных примесей, состоит из хлора и фтора.
Как примеси изменяют свойства цинка
Производители ограничивают содержание кадмия, олова и свинца в литейных сплавах цинка, чтобы подавить межкристаллитную коррозию.
Олово — вредная примесь. Металл не растворяется и выделяется из расплава — способствует ломкости цинковых отливок. Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Железо повышает твердость цинка, но снижает его прочность. Вместе с тем оно усложняет процесс заполнения форм при литье.
Медь увеличивает твердость цинка, но уменьшает его пластичность и стойкость при коррозии. Содержание меди также мешает рекристаллизации цинка.
Наиболее вредная примесь — мышьяк. Даже при небольшом ее количестве металл становится хрупким и менее пластичным.
Чтобы избежать растрескивания кромок при горячей прокатке цинка, содержание сурьмы не должна быть выше 0,01%. В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
Сплавы цинка
Сплавы на цинковой основе с добавлением меди, магния и алюминия имеют низкую температуру плавления и обладают хорошей текучестью. Они легко поддаются обработке, свариванию и паянию.
Латунь
Различают латуни двухкомпонентные и многокомпонентные.
Двухкомпонентная латунь — сплав цинка с высоким содержанием меди. Существует желтая латунь с медью в количестве 67%, золотистая медь или томпак — 75%, и зеленая — 60%. Такие сплавы могут деформироваться при температуре 300 °C.
Многокомпонентные латуни, помимо 2-х основных металлов, состоят из других добавок: никеля, железа, свинца или марганца. Каждый из элементов влияет на свойства сплава.
ЦАМ — семейство цинковых сплавов. В их состав входят магний, алюминий и медь. Такие сплавы цинка используются в литейном производстве. В них содержится алюминий в количестве 4%.
Основная область применения сплавов ЦАМ — литье цинка под давлением. Сплавы этого семейства обладают низкой температурой плавления и хорошими литейными свойствами. Их высокопрочность позволяет производить прочные и сложные детали.
Вирениум
Сплав состоит из цинка (24,5%), меди (70%), никеля (5,5%).
Производств цинка
Добыча металла
Цинк как самородный металл в природе не встречается. Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).

Концентраты цинка обжигают в печах. Сульфид цинка переводится в оксид ZnO. При этом выделяется сернистый газ SO2, который используется в производстве серной кислоты.
Получение металла
Существуют два способа получения чистого цинка из оксида ZnO.
Самый древний метод — дистилляционный. Обожженный концентрированный состав подвергают термообработке, чтобы придать ему зернистость и газопроницаемость.
Затем концентрат восстанавливают коксом или углем при температуре 1200–1300 °C. В процессе образуются пары металла, которые конденсируют и разливают в изложницы. Жидкий металл отстаивают от железа и свинца при температуре 500 °C. Так достигается цинк чистотой 98,7%.
Иногда используется сложная и дорогая обработка цинка ректификацией — разделением смесей за счет обмена теплом между паром и жидкостью. Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Второй метод производства цинка — электролитический. Обожженный концентрат обрабатывается серной кислотой. Готовый сульфатный раствор очищается от примесей, после чего подвергается электролизу в свинцовых ваннах. Цинк дает осадок на алюминиевых катодах. Полученный металл удаляют с ванн и плавят в индукционных печах. После этого получается электролитный цинк чистотой 99,95%.
Литье металла
Горячий цинк — жидкий и текучий металл. Благодаря таким свойствам он легко заполняется в литейные формы.
Примеси влияют на величину натяжения поверхности цинка. Технологические свойства металла можно улучшить, добавив небольшое количество лития, магния, олова, кальция, свинца или висмута.

Чем выше температура перегрева цинка, тем лучше он заполняет формы. При литье металла в чугунные изложницы его объем уменьшается на 1,6%. Это затрудняет получение крупных и длинных цинковых отливок.
Применение цинка
Для защиты металлов от коррозии
Чистый цинк используется для защиты металлов от коррозии. Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
В автомобильной отрасли
Сплавы на цинковой основе используют для оформления декора автомобильного салона, в производстве ручек дверей, замков, зеркал и корпусов стеклоочистителей.
В автомобильные покрышки добавляют окись цинка, которая повышает качество резины.
В батарейках, аккумуляторах и других химических источниках тока цинк используется как материал для отрицательного электрода. В производстве электромобилей применяются цинк-воздушные аккумуляторы, которые обладают высокой удельной энергоемкостью.
В производстве ювелирных украшений
Ювелиры добавляют цинк в сплавы на основе золота. В итоге они легко поддаются ковке и становятся пластичными — прочно соединяют мелкие детали изделия между собой.
Металл также осветляет ювелирные изделия, поэтому его часто используют в изготовлении белого золота.
В медицине
Окись цинка применяется в медицине как антисептическое средство. Окись добавляют в мази и другие составы для заживления ран.
Благодаря своим свойствам, цинк широко применяется в различных областях промышленности. Металл пользуется спросом из-за относительно низкой цены и хороших физических свойств.

Цинк — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Эссенциальный (незаменимый) микроэлемент тканей человека. По количественному соотношению в организме занимает второе, после железа, место. Ему принадлежит ключевая роль в регенерации поврежденных тканей, так как без цинка нарушается синтез нуклеиновых кислот и белка.
Смотрите так же:
СТРУКТУРА
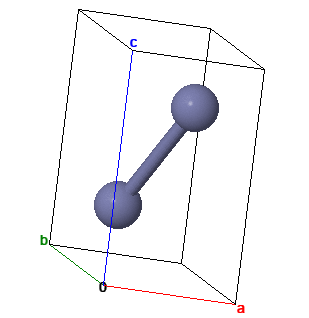
Кристаллы цинка имеют гексагональную упаковку атомов. Но в отличие от плотнейшей гексагональной упаковки сферических атомов решетки цинка вытянуты в одном направлении. Каждый атом окружен шестью другими атомами, лежащими в одной плоскости или слое. Расстояние между центрами соседних атомов в этом плоском слое а равно 0,26649 нм. Внешняя электронная конфигурация атома 3d 10 4s 2 . Не полиморфен.
СВОЙСТВА

При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). Имеет низкую температуру плавления. Объем металла при плавлении увеличивается в соответствии со снижением плотности. С повышением температуры уменьшается кинетическая вязкость и электропроводность цинка и возрастает его удельное электрическое сопротивление. При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Является диамагнетиком.
ЗАПАСЫ И ДОБЫЧА

Среднее содержание цинка в земной коре — 8,3·10 -3 %, в основных извержённых породах его несколько больше (1,3·10 -2 %), чем в кислых (6·10 -3 %). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»
Цинк добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах.
ПРОИСХОЖДЕНИЕ

Цинк в природе как самородный металл не встречается. Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
ПРИМЕНЕНИЕ

Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.

Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.

Хрупкий металл голубовато-белого цвета
Цинк / Zincum (Zn), 30
1,65 (шкала Полинга)
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum ). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Содержание
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в.
Происхождение названия
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II [2] . Это слово, вероятно, восходит к нем. Zinke , означающее «зубец» (кристаллиты металлического цинка похожи на иглы) [3] .
Нахождение в природе
Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Цинк — важный биогенный элемент, в живых организмах содержится в среднем 5·10 -4 % цинка. Но есть и исключения — так называемые организмы-концентраторы (например, некоторые фиалки).
Месторождения
Месторождения цинка известны в Австралии, Боливии [4] . В России крупнейшим производителем свинцово-цинковых концентратов является ОАО "ГМК Дальполиметалл" [5] [неавторитетный источник? 156 дней] .
Получение
Цинк в природе как самородный металл не встречается. Цинк добывают из полиметаллических руд, содержащих 1-4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Собственная концентрация носителей заряда в цинке 13,1·10 28 м −3
Химические свойства
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
Оксид цинка реагирует как с растворами кислот:
Цинк обычной чистоты активно реагирует с растворами кислот:
и растворами щелочей:
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn 2+ образуют аквакомплексы [Zn(H2O)4] 2+ и [Zn(H2O)6] 2+ .
Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км).
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, -5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Сульфид цинка используется для синтеза люминофоров временного действия и разного рода люминесцентов на базе смеси ZnS и CdS. Люминофоры на базе сульфидов цинка и кадмия, также применяются в электронной промышленности для изготовления светящихся гибких панелей и экранов в качестве электролюминофоров и составов с коротким временем высвечивания.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники.
На разные применения цинка приходится:
- цинкование — 45-60 %
- медицина (оксид цинка как антисептик) — 10 %
- производство сплавов — 10 %
- производство резиновых шин — 10 %
- масляные краски — 10 %
Мировое производство
Производство цинка в мире за 2009 год составило 11,277 млн т, что на 3,2 % меньше чем в 2008 г. [6]
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов») [7] :
Биологическая роль
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 11 мая 2011.
- необходим для продукции спермы и мужских гормонов [9]
- необходим для метаболизмавитамина E.
- важен для нормальной деятельности простаты.
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста [9] .
- необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы. [9]
Содержание в продуктах питания
Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах. Однако в тыквенных семечках содержится всего на 26 % меньше цинка, чем в устрицах. Например, съев 45 граммов устриц, человек получит столько же цинка, сколько содержится в 60 граммах тыквенных семечек. Практически во всех хлебных злаках цинк содержится в достаточном количестве и в легкоусваиваемой форме. Поэтому, биологическая потребность организма человека в цинке обычно полностью обеспечивается ежедневным употреблением в пищу цельнозерновых продуктов (нерафинированного зерна).
- ~0,25 мг/кг — яблоки, апельсины, лимоны, инжир, грейпфруты, все мясистые фрукты, зелёные овощи, минеральная вода.
- ~0,31 мг/кг — мёд.
- ~2—8 мг/кг — малина, чёрная смородина, финики, большая часть овощей, большинство морских рыб, постная говядина, молоко, очищенный рис, свёкла обычная и сахарная, спаржа, сельдерей, помидоры, картофель, редька, хлеб.
- ~8—20 мг/кг — некоторые зерновые, дрожжи, лук, чеснок, неочищенный рис, яйца.
- ~20—50 мг/кг — овсяная и ячменная мука, какао, патока, яичный желток, мясо кроликов и цыплят, орехи, горох, фасоль, чечевица, зелёный чай, сушёные дрожжи, кальмары.
- ~30—85 мг/кг — говяжья печень, некоторые виды рыб.
- ~130—202 мг/кг — отруби из пшеницы, проросшие зёрна пшеницы, тыквенные семечки, семечки подсолнечника.
Основные проявления дефицита цинка
Недостаток цинка в организме приводит к ряду расстройств. Среди них раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, накопление в организме некоторых элементов (железа, меди, кадмия, свинца), снижение уровня инсулина, аллергические заболевания, анемия и другие [10] .
Для оценки содержания цинка в организме определяют его содержание в волосах, сыворотке и цельной крови.
Токсичность
При длительном поступлении в организм в больших количествах все соли цинка, особенно сульфаты и хлориды, могут вызывать отравление из-за токсичности ионов Zn 2+ . 1 грамма сульфата цинка ZnSO4 достаточно, чтобы вызвать тяжелое отравление. В быту хлориды, сульфаты и оксид цинка могут образовываться при хранении пищевых продуктов в цинковой и оцинкованной посуде.
Отравление ZnSO4 приводит к малокровию, задержке роста, бесплодию.
Отравление оксидом цинка происходит при вдыхании его паров. Оно проявляется в появлении сладковатого вкуса во рту, снижении или полной потере аппетита, сильной жажде. Появляется усталость, чувство разбитости, стеснение и давящая боль в груди, сонливость, сухой кашель.
Читайте также:
