Действие электролита на металл
Обновлено: 20.09.2024
Самопроизвольное растворение поверхности металла в результате взаимодействия с газовой (SO2) или жидкой (H2S) средой, приводящее к уменьшению массы (толщины) металла, называют коррозией. Различают химическую и электрохимическую, равномерную и сосредоточенную коррозию.
Химическая коррозия имеет место при контакте метала с горячими сухими газами или неэлектропроводными жидкостями. Ее результатом является образование оксидной пленки, рост пленки по толщине, отслаивание и дальнейшее окисление. Пленки, образующие плотный сплошной слой, обладают защитными свойствами. Окалиностойкие стали содержат 12 % хрома, а также кремний, алюминий.
Электрохимическая коррозия - это растворение металла в электропроводных средах - электролитах вследствие самопроизвольного перехода системы в состояние с большей энтропией. (Кристаллический порядок переходит в беспорядок раствора.) Электролитами являются вода, содержащая воздух, раствор солей в воде, в том числе морская вода, различные кислоты и щелочи и
Рис. 8.18. Схема коррозионного взаимодействия электролита с поверхностью металла: переход ионов Fe в (водорода и т. п.): электролит на аноде А, со-
их водные растворы. Схема электрохимической коррозии представлена на рис. 8.18. Она объединяет два параллельных процесса - анодный, т. е. процесс перехода атомов металла в раствор в виде гидратированных ионов, обогащающих металл электронами, и катодный - процесс нейтрализации этих электронов положительно заряженными частицами раствора
единение ионов Н с электронами на катоде К
Если два различных металла контактируют между собой и электролитом, то возникает гальванический элемент, приводящий к протеканию электрического тока в замкнутой цепи металл - электролит - металл 2 - металл 7.
Разность потенциалов между металлами 7 и 2 измеряют путем наложения внешнего потенциала, при котором ток между металлами 7 и 2 равен нулю. Эта измеренная разность потенциалов будет максимальной, т. е. электродвижущей силой ДЕ гальванического элемента. Она может быть вычислена по формуле
где п - валентность иона, перешедшего в раствор; F - число Фарадея.
Электродвижущая сила определяет потенциал растворения данного металла в расплаве в сравнении с эталонным, т. е. со стеклянно-натриевым электродом. Например, АЕ магния в расплаве хлоридов равна +0,66 В, а алюминия +1,36 В, т. е. в 2 раза выше.
На потенциал растворения влияют температура и активная концентрация ионов в электролите. Кроме того, он зависит от уровня остаточных или внешних упругих напряжений. Они определяют энергию Геймгольца AF, аккумулированную металлом, которая снижает энергию Гиббса, что усиливает растворение:
где AG - значение энергии Гиббса для напряженного металла;
AG0 - стандартное значение энергии Гиббса.
Если в металле возникли участки с различным уровнем напряжений, то они могут при контакте с электролитом создать замкнутую электрическую цепь, т. е. гальванический элемент, вызывающий в одном участке растворение металла (переход положительных ионов металла в электролите, поляризацию системы), а в других участках - переход положительных ионов из электролита на поверхность металла, т. е. деполяризацию системы:
Сосредоточенное растворение металла возможно, если участок металла, погруженного в электролит, обладает макро - или микронеоднородностью, приводящей к различному электрохимическому потенциалу. Основными причинами сосредоточенного растворения являются включения, (карбиды, интерметаллиды, оксиды), примеси, неодинаковый наклеп, границы зерен и т. п.
Растворение металла усиливается на участках искажения кристаллической решетки, где ослаблены или нарушены связи поверхностных атомов с металлом. Такими участками являются границы зерен. Растворение резко усиливается, если по границам зерен расположены избыточные фазы или неметаллические включения (сульфиды, карбиды, интерметаллиды). В этом случае растворение, т. е. коррозия, металла переходит от равномерной, поверхностной к локальной межкристаллической коррозии (МКК) с резким изменением скорости коррозии соответственно от
0,1 мм/год до 10 мм/год.
В сварных соединениях имеет место резко выраженная локализация коррозии в зоне термического влияния в результате нагрева, роста зерен, сегрегации углерода на границах зерен, а также вследствие выпадения карбидов (Сг2зС6) и обеднения периферии зерен хромом.
Главный метод борьбы с МКК - обеспечение однородности структуры стали, содержащей свыше 12 % хрома. Этого достигают путем подавления роста зерен, уменьшения внутренних напряжений, снижения температуры и длительности перегрева, а также термической обработкой после сварки, приводящей к растворению карбидов и развитию выравнивающей диффузии.
Разъедает ли электролит металл
Аккумуляторный электролит приготовляют из аккумуляторной кислоты путем ее разведения дистиллированной водой в стеклянной, керамической или эбонитовой посуде, которая не разъедается серной кислотой. Абсолютно недопустимо применение стальной, медной или цинковой посуды. Кислоту следует осторожно вливать тонкой струей в воду, а не наоборот. Дело в том, что при смешении серной кислоты с водой происходит интенсивное выделение тепла, а серная кислота тяжелее, чем вода; при заливке кислоты в воду она, смешиваясь с водой и образуя тяжелый раствор, опускается на дно сосуда и постепенно смешивается со всей массой жидкости, образуя равномерный раствор. [1]
Аккумуляторный электролит разбавляют до плотности 1 12 кг / л при температуре 15 С, причем удельный вес контролируют по ареометру. Разбавленный точно до этого удельного веса электролит после охлаждения до 25 — 30 С уже может быть употреблен для заливки свинцовых аккумуляторов. [2]
Аккумуляторный электролит приготовляют из аккумуляторной кислоты путем ее разведения дестиллированпой водой в стеклянной, керамической или эбонитовой посуде, которая не разъедается серной кислотой. Абсолютно недопустимо применение стальной, медной или цинковой посуды. Кислоту следует осторожно вливать тонкой струей в воду, а не наоборот. Дело в том, что при смешении серной кислоты с водой происходит интенсивное выделение тепла, а серная кислота тяжелее, чем вода; при залкв ке кислоты в-воду она, смешиваясь с водой и образуя тяжелый раствор, опускается на дно сосуда и постепенно смешивается со всей массой жидкости, образуя равномерный раствор. Если же наливать воду в серную кислоту, что ни при каких обстоятельствах недопустимо, горячая смесь будет в первые моменты находиться на поверхности жидкости, не будет достаточно отдавать тепло всей массе холодной жидкости и вследствие этого будет вскипать и разбрызгиваться, что может вызвать тяжелые ожоги работающих. [3]
Аккумуляторный электролит разбавляют до плотности 1 12 кг ] л при температуре 15 С, причем удельный вес контролируют по ареометру. Разбавленный точно до этого удельного веса электролит после охлаждения до 25 — 30 С уже может быть употреблен для заливки свинцовых аккумуляторов. [4]
Растворы серной кислоты, в том числе и аккумуляторный электролит , вызывают тяжелую и быструю коррозию металлов. При полной смене электролита приходится удалять кубометры этого раствора. Если его просто слить в заводскую или городскую канализацию, то это может вызвать повреждение системы канализации и нарушение ее работы. Поэтому перед полной сменой электролита необходимо с помощью химиков разработать порядок нейтрализации удаляемого электролита. При удалении малых количеств электролита его перед сливом в канализацию нейтрализуют раствором кальцинированной соды. [5]
При хранении, транспортировании и разведении серной кислоты и вообще при работе с кислотным аккумуляторным электролитом и со свинцовыми аккумуляторами необходимо соблюдать исключительную осторожность, так как серная кислота является весьма едким и ядовитым веществом. При попадании на кожу человека она может вызвать весьма тяжелые ожоги. Кислота может также разъедать одежду — особенно сильно она разрушает целлюлозные материалы ( хлопчатобумажные ткани, а также бумагу, картон и пр. Недопустимо заливать пролитую серную кислоту водой, так как при этом ( выделяется тепло и кислота может разбрызгиваться. [6]
При хранении, транспортировании и разведении серной кислоты и вообще при работе с кислотным аккумуляторным электролитом и со свинцовыми аккумуляторами необходимо соблюдать исключительную осторожность, так как серная кислота является весьма едким и ядовитым веществом. Кислота может также разъедать одежду — особенно сильно она разрушает целлюлозные материалы ( хлопчатобумажные ткани, а также бумагу, картон и пр. Недопустимо заливать пролитую серную кислоту водой, так как при этом выделяется тепло и кислота может разбрызгиваться. [7]
Участок для подзарядки аккумуляторных батарей оснащают высокоэффективным преобразовательным оборудованием и системами вентиляции, а также оборудованием для приготовления необходимого для работы аккумуляторного электролита . [8]
Белый кристаллический порошок, сильная щелочь, хорошо растворимая в воде. Литий едкий предназначен в качестве облагораживающего добавления в аккумуляторный электролит для увеличения зарядной емкости аккумулятора и удлинения срока его службы. Литий едкий аккумуляторный упаковывают в железные барабаны или мешки из пластиката. [9]
Интересным оказался прибор, использующий пьезоэлектрический эффект — специалисты фирмы VDO считают его весьма перспективным [2] и надеются применить для контроля уровня охлаждающей и омывающей жидкостей, масла, бензина и даже таких агрессивных жидкостей, как тормозная смесь и аккумуляторный электролит . Подробностей конструкции фирма, как обычно, не освещает, однако догадаться, как датчик действует, можно. [10]
При разрушении стеклянных сосудов, течи деревянных баков, неаккуратной замене пластин и откачке шлама электролит разливается по полу аккумуляторного помещения. Ходить по лужам электролита в кожаной обуви нельзя — кожа кислотой разрушается. В аккумуляторном хозяйстве должен быть запас сухих древесных опилок. Разлитый электролит засыпается опилками. После того как электролит впитается, опилки собирают и удаляют из аккумуляторного помещения. Пол, где был разлит электролит, и стеллажи, если они были загрязнены электролитом, нейтрализуют раствором кальцинированной соды, промывают водой и досуха вытирают тряпкой. Растворы серной кислоты, в том числе и аккумуляторный электролит , вызывают тяжелую и быструю коррозию металлов. При полной смене электролита приходится удалять кубометры этого раствора. Если просто слить его в заводскую или городскую канализацию, то это может вызвать повреждение системы канализации и нарушение ее работы. Поэтому перед полной сменой электролита необходимо с помощью химиков разработать порядок нейтрализации удаляемого электролита. При удалении малых количеств электролита его перед сливом в канализацию нейтрализуют раствором кальцинированной соды. [11]
Искры нет не потому что кислота что-то окислила — она не окисляет в большинстве случаев, а растворяет.. .
Электролит очень неплохо за счет указанного H3O+ переносит ток.. .
Раз получилось так что все залито — произошло просто напросто короткое замыкание.
Если на воздухе — то вместе с кислородом кислота может скушать любое железное изделие.. . Медные провода тоже (кислород помогает) . Хранить его можешь в любой полиэтиленовой емкости. Желательно герметичной.
Неплохой защитой от проливов являются обычные кусочки поролона.
Чтоб не замыкало — оботри весь аккумулятор сначала ненужной тряпкой — сразу в утиль кстати.. .
А потом остатки промой мыльной водой или с добавкой обычного фэйри.. .
Решил поекспериментиаровать.Кинул ржавый болт в акумуляторный електролит…Пролежал он там ноч.После я его промыл и болт стал как новый.
Вопрос.Електролит сьедает ржавчину! а метал он тоже кушает?И что делать что бы он не кушал метал а только растворял ржавчину?
Комментарии 82
Всем спсибо за просмотр и советы в даной теме.Мне было интерестно для себя (НЕ ХИМИКА) узнать мнение людей по поводу очистки деталей автомобильным электролитом.Идея не плохая…Но эта химка жутко портит деталь после того как уже снята вся ржавчина+ надо контролировать саму деталь, переодчески вынимая ее из емкости.Деталь была оставлена на 30минут и покрылась раковинами.Тут идею я эту и отложил.
Часто встречаются детали которые можно и нужно восстанавливать и давать им вторую жизнь.Очень интерестная штука эта-реставрация.Вернулся я к старой теме, а именно очистка ржавчины методом ЭЛЕКТРОХИМИЧЕСКИМ с помощью кальценированой соды, воды и зарядного устройства.Но и тут у многих возникают спори.
Мол даным методом нарушается прочность детали.
Нужно детали песочить а не хомкой мыть.
КАК ВЫ СЧИТАЕТ ТАК ЛИ ОНО?!
И еще…Перед разборкой любого агрегата, буд-то старых зас.аных суппортов, или автомобильных ГБЦ либо блоков цилиндров много где их моют в спец апарате.И после, они выходят чистыми как яйки у коте.
Елси кто шарит, что за стредства там используют?И можно в домашньо-гаражных условиях прокипятить в каком то составе деталь для ее очистки от всякой СРАНИ?!
Я понимаю, что в той ЧУДО машине где закрывают детали идет нагрев жидкости и после под давлением обрабатывают деталюху!
Большая Энциклопедия Нефти и Газа
При действии электролита на металл может оказаться, что силы гидратации действуют на ион-атом сильнее, чем силы, связывающие его с электроном. В этом случае связь между ион-атомом и электроном порвется; ион-атом переходит в электролит и гидратируется. В результате выхода иона из металла в металле образуется избыток электронов и он получает отрицательный заряд, а в электролите образуется избыток положительно заряженных ионов, и он получает положительный заряд. В замкнутом элементе электроны двойного слоя нейтрализуются зарядом катиона электролита. [19]
При действии электролитов наблюдается иногда одно оригинальное явление. Выделяющийся золь собирается сначала в жидкие капельки, образующие вторую жидкую фазу. Капельки укрупняются, и получаются две - несмешивающиеся жидкости: одна из них - концентрированный золь, другая - разбавленный. Процесс коацервации, как и высаливания, связан с гидрофильностью системы, с отнятием свободной воды ( растворителя солью или другим внесенным веществом и трудностью отдачи связанной воды частицами, собирающимися в комок вместе с оставшейся водой. [21]
При действии электролита на металл может оказаться, что силы гидратации действуют на ион-атом сильнее, чем силы, связывающие его с электроном. В этом случае связь между ион-атомом и электроном порвется; ион-атом переходит в электролит и гидратируется. В результате выхода иона из металла в металле образуется избыток электронов и он получает отрицательный заряд, а в электролите образуется избыток положительно заряженных ионов, и он получает положительный заряд. В замкнутом элементе электроны двойного слоя нейтрализуются зарядом катиона электролита. [23]
При действии электролитов на растворы высокомолекулярных соединений иногда типичного высаливания с выделением хлопьев не наблюдается, а появляются многочисленные жидкие капли разных размеров. [24]
При действии электролита на углеродистую сталь анодными участками являются зерна феррита, катодными - всевозможные загрязнения и включения токо-проводящих веществ в структуру металла, а также расположенные на его поверхности окалина и ржавчина, потенциал которых значительно выше потенциала чистого железа. [25]
При действии электролита на углеродистую сталь анодными участками являются зерна феррита, катодными - всевозможные загрязнения и включения в структуру металла токопроводящих веществ, а также расположенные на его поверхности окалина и ржавчина, потенциал которых значительно выше потенциала чистого металла. Если на металле нет защитных пленок, определенное значение может приобрести действие микропар, образованных телом зерна и его границами. В этом случае границы зерен могут выполнять роль анода; катодом же будут сами зерна. Коррозия еще более усиливается при наличии загрязнений металла, как правило, расположенных по границам зерен. [26]
При действии электролита с одноименным ионом солевой эффект также имеет место, однако он перекрывается уменьшением растворимости электролита в результате действия одноименного иона. [27]
Так как действие электролитов связано с разряжением коллоидных частиц, то понятно, что заряд частицы является важным фактором устойчивости. [28]
Способы локализации действия электролита на поверхность полупроводника могут быть весьма разнообразны. Пластину полупроводника помещают в ванну анодной ячейки А, заполненную электролитом. Катодная ячейка К отделена от анодной и соединяется с ней лишь трубкой с электролитом, которая и является в данном случае виртуальным катодом. Таким образом, гальваническая связь между анодной и катодной ячейками осуществляется только через электролит. Если удельное сопротивление электролита существенно больше удельного сопротивления полупроводника, то его растворение происходит только в непосредственной близости от виртуального катода. Изменяя форму выходного отверстия катодной трубки или перемещая ее по заданной программе вдоль поверхности полупроводника, можно с достаточной точностью получать практически любой сложный профиль или вытравливать сквозные отверстия на глубину до 400 мкм. [30]
Электролиз (очистка от ржавчины) в домашних условиях. Краткое пособие без претензии на научную ценность.

Третьего дня занимался своими новыми-старыми суппортами 54-22. В связи с отсутствием лишних средств и реальной возможности (никто не делает) отдать на пескоструйку, а так же по причине личного интереса опробовал интересный метод очистки от ржавчины черных металлов под названием электролиз.
(Кто-то может назвать его иначе, но сути не меняет).
Вскользь я описывал процесс в предыдущих записях, но так как сам при подготовке долго искал инфу, решил вывалить на вас все что мне стало известно в одной записи. Мало-ли, может кому пригодится.
Итак, начнем.
1. Физика процесса. Подчинена простейшему закону гражданина Фарадея:

Как видно из формулы — чем больше ток и время его воздействия, тем больше "ржавчины" перенесет магическая сила электролиза. Из этого можно сделать два важных для нас вывода:
1. По-любому есть какая-то определенная сила тока, оптимальная для очистки. Да, она есть и лежит в пределах 4 — 10А при напряжении 12В. Установлено это экспериментально и не только мной. К тому же при использовании обычного БП от компьютера нагружать его свыше 10-12А… ну я лично не стал бы).
2. Величина тока зависит от площади анода и катода (куска металла и самой детали), а так же от плотности электролита (количества чистящего средства, погруженного в раствор). Таким образом если у вас есть только БП от компа, где ток\напряжение регулировать в стоке невозможно — меняем либо площадь, либо плотность электролита для достижения "золотого тока".
2. Схема подключения.
Ну тут все просто. Минус — на деталь. Плюс на металл. Кстати с металлом попрощайтесь заранее, если только это не нержавейка. Сожрет его ржа)
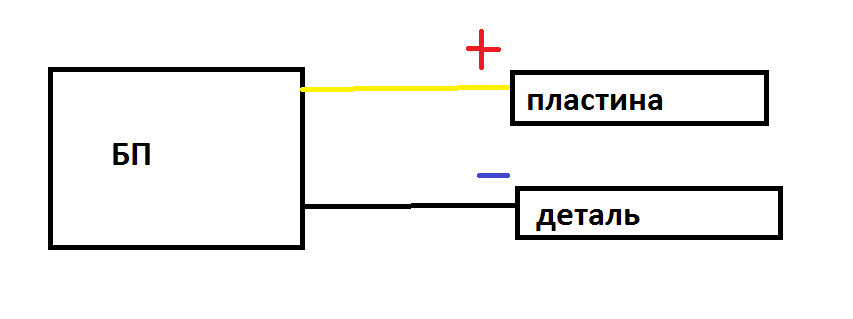
3. Материалы.
1. Понадобится в идеале емкость из нержавейки, но у меня ее нет, поэтому я использую оцинкованные ведра. Надолго их не хватает конечно.

Советую прикупить еще пластиковое ведро, ибо когда из дырок в оцинковке польется ржавая вода прямо на пол будет не очень приятно)

2. Некое вещество, которое поможет создать "очищающий элексир".
Я использовал поначалу "САНОКС". В принципе чистит хорошо, но воняет и оставляет черные окислы в местах, где было совсем уж много ржы. (Хотя возможно я не доварил).


Также пробовал "КРОТ" для очистки труб. Шляпа полная, не чистит по сравнению с САНОКСом вообще. Не рекомендую категорически.
Ну и недавно в магазине, название которого означает "пересечение нескольких дорог" рекламная пауза нашел короля электролиза — пачку кальцинированной соды.

Лучшее из всего что пробовал. Почти не воняет, нет окислов на металле. Чистит лучше санокса. Рекомендую.

3. Соединительные провода на деталь — лучше использовать стальные. Меньше окисляются, как мне кажется. Но темного налета однозначно меньше стало, когда я поменял медные провода на стальные.
4.Щетки ручные для очистки в промежуточных этапах. Лучше парочку с различным "ворсом".
4. Сроки очистки и результаты.
Сроки напрямую зависят от того, как сильно деталь "окружена" анодом — поэтому я использую ведро. Так очистка идет веселее и со всех сторон. Если просто поставить пластинку — обратная к ней сторона будет очищаться медленнее.
Так же, само собой, чем больше ток, тем быстрее очистка. В целом при токе 5-6А на очистку средних размеров суппорта нужно 2-3 дня. Да, вот так)
5. Пример промежуточной очистки и пара заключительных наблюдений.
Берем наш суппорт. Или что вы там собрались чистить) В первую очередь разбираем и вынимаем все резинки. Не скажу, что на них электролиз влияет отрицательно, но санокс точно)))
Читайте также:
