Действие солей тяжелых металлов на белки
Обновлено: 16.05.2024
Цель работы: научиться проводить реакции обратимого и необратимого осаждения белков; актуализировать навыки фильтрования растворов; продолжить формирование навыков фиксации наблюдений. досліди ти вплив со лей важ ких ме талів на білки, оз найо ми ти ся з мож ли -
востями використання денатурації білків у медичній практиці
| № пр | Раствор | Рез-т | Избыток | Рез-т |
| 1 | 2 мл раствора белка + ацетат свинца | белок денатурируется и выпадает в осадок | ацетат свинца | растворение первоначально образовавшегося осадка |
| 2 | 2 мл раствора белка + сульфат меди | белок денатурируется и выпадает в осадок | сульфат меди | растворение первоначально образовавшегося осадка |
Принцип. При действии солей тяжелых металлов на растворы белка происходит денатурация белковой молекулы. Осаждение денатурованного белка обусловлено адсорбцией тяжелого металла на поверхности белковой молекулы и образованием нерастворимых комплексов.
Клинико-диагностическое значение
В медицинской практике используется свойство белков связывать тяжелые металлы. Белки используются как противоядие при отравлении солями ртути, свинца, меди и других металлов. Белок ограничивает всасывание тяжелых металлов путем образования с ними нерастворимых комплексов. Следует отметить, что при осаждении белков некоторыми солями тяжелых металлов (плюмбум(II)ацетата, купрум(II)сульфата), происходит пептизация (растворение ) образовавшегося осадка, что связано с избыточной адсорбцией тяжелого металла на поверхности коллоидной частицы и появлением положительного заряда на молекуле белка. При условии избытка солей серебра и ртути пептизация не происходит. Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
Задание. Выведение из организма токсических веществ, в том числе и соединений металлов, происходит через органы пищеварения, различные железы (потоотделения, слюноотделения), легкие, но особенно через почки. Поэтому при многих отравлениях с помощью специальных средств вызывают усиление мочеотделения, что способствует удалению из организма с мочой ядовитых соединений. В медицине для их выведения используют природные или синтетические химические вещества, называемые антидотами.
Антидоты – вещества, устраняющие последствия воздействия ядов на биологические структуры и инактивирующие яды посредством химической реакции. Механизм их действия при отравлении солями металлов (неорганическими ядами) связывают с образованием малорастворимых или очень прочных соединений. Так, еще в 1806 г. в качестве лечебного средства при отравлении барием были предложены глауберова соль Na2SO4•10H2O и сульфат магния MgSO4. При взаимодействии с солями бария они приводят к образованию сульфата бария, который вследствие малой растворимости не является ядовитым. Известно, что при рентгенологическом исследовании желудка пациента кормят кашей из сульфата бария, замешенного на воде. Как уже было отмечено, сулема HgCl2 является сильнейшим ядом. Хорошо известно, что ртуть (II) образует исключительно малорастворимый сульфид HgS. Поэтому антидотом против сулемы используют раствор сульфида натрия и магния.
Желтая кровяная соль K4[Fe(CN)6] образует малорастворимые соединения с ионами многих тяжелых металлов. Это свойство используют на практике для лечения отравлений солями тяжелых металлов.
Хорошим антидотом при отравлениях соединениями мышьяка, ртути, свинца, кадмия, никеля, хрома, кобальта и других металлов является унитиол.
В виде таких соединений ионы металла и выводятся из организма. Весьма прочные соединения с ионами различных металлов образуют комплексоны, например этилендиаминтетрауксусная кислота (ЭДТА).
Обычно такие соединения обладают очень высокой прочностью. Это означает, что комплексоны могут «отнимать» ионы металлов от биологических систем. По этой причине ЭДТА является хорошим антидотом на соединения свинца и соединения других металлов. Однако при использовании унитиола и комплексонов следует остерегаться передозировки. При их избытке могут связываться, а затем и выводиться из организма жизненно важные микроэлементы.
Универсальным антидотом является молоко. На его противоядные свойства указывал еще в начале новой эры Плиний Второй (23. 73 гг. н.э.). Употребление молока и сливочного масла при отравлении солями рекомендовал также Авиценна в своем знаменитом труде «Канон врачебной науки», созданном в 1012. 1023 гг. Неспроста и в настоящее время сотрудникам химических лабораторий и работникам ряда химических производств в нашей стране в соответствии с нормами техники безопасности бесплатно выдается молоко.
Презентация-лабораторная работа "Действие солей тяжелых металлов на белки"

Цель: изучить воздействие солей тяжелых металлов на
способность белков к денатурации, реакцию осаждения белков куриного яйца под действием аналогов антропогенных химических факторов, находящихся в отходах промышленных предприятий и попадающих в окружающую среду
Оборудование и материалы: пипетка, пробирки, штатив для пробирок; насыщенный р-р купрум(II) сульфата, 2,5 % р-р нитрат серебра, 5% р-р ацетат свинца, р-р яичного белка, чистая вода
- прилагается видеофрагмент*

Теоретические сведения:
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок
Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле
Способность молекул белка прочно связывать ионы тяжелых металлов с образованием нерастворимых в воде осадков используется как противоядие при отравлении солями ртути, меди, свинца и другими металлами

Ход работы:
I. Действие CuSO4 на белки:
+ р-р CuSO4
Помутнение, выпадение голубого осадка
Пробирка с раствором белка
Осадок растворяется в избытке соли


II. Действие AgNO3 на белки
+ р-р AgNO3
Помутнение – выпадение беловатого осадка
Пробирка с раствором белка
Осадок не растворяется в избытке р-ра (отличие от других солей тяжелых металлов)



III. Действие ацетата свинца - Pb(CH3COO)2 на белки
+ р-р ацетата свинца
Образуется осадок
Пробирка с раствором белка
Осадок должен раствориться в избытке раствора соли

Вывод:
воздействие солей тяжелых металлов, содержащихся в воде и пищевых продуктах.
Исследовательская работа "Влияние антропогенных загрязнений на активность белков" (11 класс)
Актуальность. В условиях интенсивного антропогенного загрязнения окружающей среды, вопрос о влиянии загрязняющих веществ на живые организмы, является крайне актуальным. К отрицательным относят все виды воздействия на биосферу, создаваемых человеком и угнетающих природу. Небывалые по мощности и разнообразию негативные антропогенные воздействия, особенно резко стали проявляться во второй половине 20 века. Под их влиянием естественная биота экосистем перестала служить гарантом устойчивости биосферы.
Источниками антропогенного загрязнения, наиболее опасного для популяций любых организмов, являются промышленные предприятия (химические, металлургические, целлюлозно-бумажные, строительных материалов и др.), транспорт, теплоэнергетика, сельскохозяйственное производство. Количество загрязнителей (поллютантов) постоянно растёт по мере развития новых технологических процессов. Суммарный выброс в окружающую среду загрязнителей в России составил 41,8млн.т [3]. Специалисты считают, что в локальном и глобальном масштабах «приоритетными» являются следующие загрязнители: диоксид серы, канцерогенные вещества (бензпирен), нефтепродукты, хлорорганические пестициды, оксид углерода, оксиды азота. К особо опасным загрязнителям относят радиоактивные элементы, диоксины и тяжёлые металлы (ртуть, медь, кобальт, свинец, кадмий).
В то же время многие металлы играют важную роль в жизнедеятельности человека. Они участвуют в структурировании белков, нуклеиновых кислот, активных центров ферментов, активизируют биологические реакции, участвуют в ионной проницаемости клеточных мембран. Но при избыточном поступлении в организм, металлы вызывают глубокую денатурацию белков, образуя нерастворимые соли комплексного характера по анионным центрам радикалов аминокислот. При этом подавляется действие большинства ферментов, поскольку именно радикалы аминокислот участвуют в формировании их активных центров.
Цель работы: выявить влияние аналогов антропогенных загрязнителей на активность растительных и животных белков.
Ознакомиться по литературным источникам с вопросом о негативном влиянии на организм тяжёлых металлов и органических веществ.
Ознакомиться с методикой проведения экологического эксперимента, позволяющего выявить:
а) влияние тяжёлых металлов на активность растительных и животных
б) влияние органических веществ на структуру белков.
3. Определить концентрацию токсикантов, которая вызывает денатурацию
Проанализировать полученные результаты и сделать выводы.
Объект исследования: растительные и животные белки;
Предмет исследования: активность белков;
Проблемный вопрос: какие причины вызывают разрушение белков и приводят к потере активности?
Гипотеза: если воздействовать аналогами антропогенных загрязнений на животные и растительные белки, то они теряют активность и разрушаются.
Методы исследования: эксперимент, анализ литературных источников.
Глава 1. Обзор литературных источников
1.1 Экологические последствия загрязнения атмосферы
Загрязнение атмосферного воздуха воздействует на здоровье человека и окружающую природную среду различными способами – от прямой и немедленной угрозы до медленного и постепенного разрушения различных систем жизнеобеспечения организма. Во многих случаях загрязнение воздушной среды нарушает компоненты экосистемы до такой степени, что регуляторные процессы не в состоянии вернуть их в первоначальное состояние.
Физиологическое воздействие на организм человека главных загрязнителей (поллютантов) чревато самыми серьёзными последствиями. Так, диоксид серы, соединяясь с влагой, образует серную кислоту, которая разрушает лёгочную ткань человека и животных.
Пыль, содержащая диоксид кремния, вызывает тяжёлое заболевание лёгких – силикоз. Оксиды азота раздражают и разъедают слизистые оболочки глаз и лёгких, участвуют в образовании ядовитых туманов. Если они содержатся в воздухе совместно с диоксидом серы, то возникает эффект синергизма, т.е. усиление токсичности всей газовой смеси.
Широко известно действие на организм человека оксида углерода: при отравлении возможен летальный исход. Благодаря низкой концентрации СО в атмосфере он не вызывает массовых отравлений, хотя и опасен страдающим сердечно-сосудистыми заболеваниями [1].
Среди взвешенных твёрдых частиц наиболее опасны частицы размером менее 5 мкм, которые способны проникать в лимфатические узлы, задерживаться в альвеолах лёгких, засорять слизистые оболочки.
Весьма неблагоприятные последствия, которые могут сказываться на огромном интервале времени, связаны и с незначительными по объёму выбросами, как свинец, фосфор, кадмий, кобальт. Они угнетают кроветворную систему, вызывают онкологические заболевания, снижают иммунитет.
Последствия воздействия на организм человека вредных веществ, содержащихся в выхлопных газах автомобилей, весьма серьёзны и имеют широкий диапозон действия: от кашля до летального исхода. Тяжёлые последствия в организме живых существ вызывает ядовитая смесь дыма, тумана и пыли – смог. Смог особенно опасен для людей, страдающих лёгочными заболеваниями [1].
Антропогенные выбросы загрязняющих веществ в больших концентрациях и в течении длительного времени наносят большой вред не только человеку, но и остальной биоте. Известны случаи массового отравления диких животных, особенно птиц и насекомых, при выбросах вредных загрязняющих веществ большой концентрации.
Что касается растений, то выбросы вредных веществ действуют на их зелёные части, попадая через устьица в ткани, разрушая хлорофилл и структуру клеток, а также попадая из почвы через корни. Особенно опасен для растений диоксид серы, под действием которого прекращается фотосинтез и гибнут многие деревья, особенно хвойные: ель, сосна, пихта, кедр [3].
Глобальное загрязнение атмосферы приводит к нарушению озонового слоя и кислотным дождям. «Озоновые дыры» - это значительные пространства в озоновом слое атмосферы на высоте 20-25 км с заметно пониженным содержанием озона (до 50%).
Истощение озонового слоя признано всеми как серьёзная угроза глобальной экологической безопасности. Оно ослабляет способность атмосферы защищать всё живое от жёсткого ультрафиолетового излучения («УФ - радиация»), энергии одного фотона которого достаточно, чтобы разрушить большинство органических молекул. Поэтому в районах с пониженным содержанием озона многочисленны солнечные ожоги, увеличивается количество заболеваний раком кожи.
Антропогенное происхождение «озоновых дыр» связано с повышенным содержанием хлорфторуглеродов (фреонов). Фреоны широко применятся в промышленном производстве и в быту (хлорагрегаты, растворители, распылители, аэрозоли.) В атмосфере фреоны распадаются с выделением оксида хлора, губительно действующего на молекулы озона.
Основными поставщиками фреонов являются США(30,85%), Япония (12,42%), Великобритания (8,65%), Россия (8%) (по данным «Гринпис»).
«Кислотные дожди» образуются при промышленных выбросах в атмосферу диоксида серы и оксидов азота. Соединяясь с атмосферной влагой, диоксид серы и оксид углерода образуют разбавленную серную и азотную кислоты. В результате дождь и снег оказываются подкисленными (рН ниже 5,6) [2].
Суммарные мировые антропогенные выбросы диоксида серы и оксидов азота ежегодно составляют более 255млн т. Закисление природной среды негативно отражается на состоянии экосистем. Под действие кислотных дождей из почвы выщелачиваются не только питательные вещества, но и токсичные металлы6 свинец, кадмий, алюминий и др. Далее они сами и их токсичные соединения усваиваются растениями и почвенными организмами, что ведёт к весьма негативным последствиям [3].
Воздействие кислотных дождей снижает устойчивость лесов к засухам, болезням, природным загрязнениям, что приводит к их деградации как природных экосистем. 50 млн га леса в европейских странах страдают от действия загрязняющих веществ. Гибнут хвойные леса в на Северных Аппалачах, в Баварии. Отмечены случаи поражения хвойных и лиственных лесов в Сибири, Карелии, что свидетельствует о неблагополучном состоянии окружающей среды. В районе г. Норильска и на Северном Урале огромные площади тайги и лесотундры стали почти безжизненными из-за выбросов серы Норильским горно-химическим комбинатом [3].
1.2 Влияние тяжёлых металлов на здоровье человека
Загрязнение окружающей среды тяжёлыми металлами, а особенно свинцом, приобрело огромные масштабы в связи с содержанием в бензине антидетонаторной добавки – тетраэтилсвинца. Вместе с выхлопными газами автомобилей он выбрасывается в атмосферу. Ежегодно мировой парк автотранспорта выбрасывает в воздух свыше 0,4 млн.т свинца [3]. Вследствие этого за последние десятилетия уровень свинца в крови людей увеличился в несколько раз. Накопление свинца в организме приводит к раковым заболеваниям, так как, в несколько раз усиливает действие канцерогенных веществ (диоксины, полициклические углеводороды). В этом проявляется взаимодействие различных ксенобиотиков в окружающей среде либо в организме, с образованием ещё более ядовитых веществ. Масштабы отравления медью наиболее опасны в промышленных медедобывающих районах, где на 1т добытой меди приходится 2т пыли, содержащей 15% меди, 60% - оксидов железа, по 4% мышьяка, ртути, свинца. При избытке меди в организме происходит угнетение многих ферментов, разрушаются железосодержащие белки (гемоглобин, ферритин и др.) в результате замещения железа на медь. Вследствие отравления медью возникает глобинонурия, желтуха, накапливается метгемоглобин (потемнение крови). Избыток ионов меди в организме вызывает заболевания нервной системы, печени, гастриты, язвенную болезнь желудка. В то же время, медь, как и железо, играет важную роль в процессе кроветворения и поддержания нормального состава крови. Недостаток меди в почве может привести к заболеванию животных анемией, а у растений вызвать задержку образования хлорофилла, понизить содержание в них витаминов. Токсичность ртути, свинца и других тяжёлых металлов усиливается в результате их преобразования в окружающей среде в алкильные производные [5].
Метил и фенил-ртуть очень легко проникают в организм. Таким образом, тяжёлые металлы, попавшие в окружающую среду, пагубно влияют на здоровье человека, разрушают белки, в том числе и ферменты, вызывая тяжёлые заболевания.
Несмотря на то, что дефицит лития в организме человека приводит к психическим расстройствам, при повышенной концентрации он очень токсичен. Так избыток лития вызывает общую заторможенность, нарушение дыхания и сердечного ритма, слабость, сонливость, потерю аппетита, жажду, расстройство зрения, а также дерматит лица и рук.
Бериллий принадлежит к числу наиболее токсичных металлов. ПДК бериллия составляет 0,001мг/м, а ртути - 0,01. Бериллий и его соединения обладают аллергическим и канцерогенным действием, раздражают кожу и слизистые оболочки, вызывают дерматозы, конъюктивиты, фарингит, заболевания лёгких и бронхов – трахеобронхит, пневмонию и опухоли лёгких. Заболевания могут возникнуть через 10-15 лет после прекращения контакта с бериллием [1].
Цинк менее токсичен, чем другие металлы, но его избыток в организме может привести к понижению кальция в крови и костной ткани. Присутствие цинка в производственных помещениях в виде пыли вызывает заболевания дыхательных путей, называемое «литейной лихорадкой». С другой стороны цинк - важный микроэлемент. Он входит в состав инсулина, (гормон поджелудочной железы), участвует в переносе углекислого газа кровью позвоночных, стимулирует рост растений [1].
Никель относится к металлам с умеренной токсичностью. ПДК никеля в питьевой воде составляет 0,1мг/л. Аллергическое действие металлического никеля проявляется только при продолжительном контакте кожи человека с декоративными никелевыми покрытиями (корпуса и браслеты часов, оправы очков). В то же время, летучий тетракарбонил никеля – одно из самых ядовитых веществ, известных человеку. ПДК никеля в воздухе производственных помещений 0,0005мг/м. В своё время это соединение состояло в списках отравляющих боевых веществ ряда стран [4].
Кадмий в организме человека в основном накапливается в почках и печени, причём его повреждающее действие наступает, когда концентрация этого химического элемента в почках достигает 200мкг/г живой массы. Попадая с неочищенными стоками промышленных предприятий в водоёмы, растворённый кадмий осаждается и накапливается в донных отложениях. Особенно аккумулируют в своих организмах кадмий водоросли, моллюски и ракообразные. Употребление в пищу этих организмов приводит к заболеваю «итай – итай». В Японии эта болезнь известна с 1955г, когда сточные воды концерна «Мицуй», содержащие кадмий попали в оросительную систему рисовых полей. Это отравление вызвало у людей апатию, повреждение почек, размягчение костей, отмечалось немало смертельных случаев. У японцев, употребляющих в пищу значительное количество риса, содержание кадмия в почках колеблется от 65 до 115 мкг/г, тогда как у европейцев и американцев – от 10 до 30 мкг/г.Источниками кадмия являются газовые выбросы промышленных предприятий, сжигание угля на ТЭС, производство минеральных удобрений, красителей, катализаторов. Усвоение вводно-пищевого кадмия – на уровне 5%, а воздушного – до 80%. К характерным « кадмиевым» болезням горожан относятся: гипертония, ишемическая болезнь сердца, почечная недостаточность. У курящих (табак сильно аккумулирует соли кадмия из почвы) или занятых на производстве с использованием кадмия к раку лёгких добавляется эмфизема лёгких, а для некурящих – бронхиты, фарингиты [1].
Глава 2. Методика исследования и результаты
Прекрасную модель для исследований представляют белки, выделенные из семян бобовых растений и белок куриных яиц. В определённых условиях они длительное время сохраняют свои биологические свойства. В растворах белки вступают во взаимодействие со многими веществами (металлами, спиртами, фенолами и др.) [4].
Оборудование и реактивы: набор химических стеклянных пробирок, 1-2 куриных яйца, 5%, 2,5%, 1,25% растворы солей: сульфата меди, хлорида меди, сульфата натрия, хлорида калия, ацетата натрия, ацетата свинца (или свинцовая примочка), 40% раствор формалина, этиловый спирт, растительный белок (горох), пипетка, фильтровальная бумага.
Приготовление растворов белков
У куриного яйца отделить белок от желтка в мерный стаканчик, размешать его стеклянной палочкой в дистиллированной воде в соотношении 1:10. Затем профильтровать.
Зерновой горох перемолоть в муку, развести в соотношении : 10г. гороховой муки на 50мл 10% раствора хлористого натрия или хлористого калия. Профильтровать.
Опыт №1 Воздействие на белки солей металлов
В 6 пробирок наливаем 1,0-1,5мл раствора белка и медленно по каплям из пипетки при встряхивании приливать растворы сульфата меди и сульфата калия (1 и 2 пробирки), хлорида меди и хлорида натрия (3 и 4 пробирки), ацетата свинца и ацетата натрия (5 и 6 пробирки). В 1, 3, 5 пробирках образуются хлопьевидные осадки в результате образования малорастворимых соединений: с солями меди - голубого цвета, с солью свинца – белого цвета. В остальных пробирках изменений не происходит [4].
Исследовательская работа "Влияние тяжёлых металлов на активность каталазы"
1.1 Биологическая роль ферментов в клетке ……………………… 4с.
1.2 Загрязнение окружающей среды тяжёлыми металлами ………5с.
Глава 2. Методика проведения исследования ……………………………. 8с.
Глава 1. Введение
Актуальность. В условиях интенсивного антропогенного загрязнения окружающей среды, вопрос о влиянии загрязняющих веществ на живые организмы, является крайне актуальным. К отрицательным относят все виды воздействия на биосферу, создаваемых человеком и угнетающих природу. Небывалые по мощности и разнообразию негативные антропогенные воздействия, особенно резко стали проявляться во второй половине 20 века. Под их влиянием естественная биота экосистем перестала служить гарантом устойчивости биосферы.
Источниками антропогенного загрязнения, наиболее опасного для популяций любых организмов, являются промышленные предприятия (химические, металлургические, целлюлозно-бумажные, строительных материалов и др.), транспорт, теплоэнергетика, сельскохозяйственное производство. Количество загрязнителей (поллютантов) постоянно растёт по мере развития новых технологических процессов. Суммарный выброс в окружающую среду загрязнителей в России составил 41,8млн.т (Коробкин В.И. Передельский Л.В.,2004). Специалисты считают, что в локальном и глобальном масштабах «приоритетными» являются следующие загрязнители: диоксид серы, канцерогенные вещества (бензпирен), нефтепродукты, хлорорганические пестициды, оксид углерода, оксиды азота, тяжёлые металлы.
Известно, что металлы играют важную роль в жизнедеятельности организмов. Они входят в состав клеток в виде макроэлементов (кальций, натрий, калий, железо, магний) и микроэлементов (кобальт, медь, цинк¸ молибден, марганец, никель). Металлы участвуют в структурировании белков, нуклеиновых кислот, активных центров ферментов, активизируют биологические реакции, участвуют в ионной проницаемости мембран.
Вместе с тем в условиях интенсивного воздействия человека на окружающую среду (добыча руд, минералов, промышленное и сельскохозяйственное производство, развитие автотранспорта) природная среда интенсивно загрязняется как биогенными, так и чужеродными металлами.
Наибольшую опасность среди них представляют тяжелые металлы: ртуть, свинец, кадмий, медь, цинк. При избыточном поступлении в организм тяжелые металлы вызывают глубокую необратимую денатурацию белков, образуя нерастворимые соли комплексного характера по анионным центром радикалов аминокислот, например SH – и COOH – группам. При этом подавляется действие большинства ферментов, поскольку именно радикалы аминокислот участвуют в формировании их активных центров.
Цель экологического эксперимента : Выявить влияние тяжелых металлов на активность фермента каталаза.
Основные задачи эксперимента:
1. Ознакомиться с методикой эксперимента по исследованию активности каталазы по литературным источникам.
2. Провести практическую часть исследования в соответствии с разработанным планом и методикой.
3. Изучить по литературным источникам о влиянии антропогенного загрязнения на живые организмы.
4. Определить концентрацию токсикантов, которая оказывает угнетающее действие на активность фермента.
5. Проанализировать полученные результаты эксперимента, сравнить токсический эффект ионов свинца и меди на уровне общей активности фермента.
Методы исследования : анализ литературных источников, эксперим
Глава 1. Анализ литературных источников
1.1 Биологическая роль ферментов в клетках
Ферментами называются белковые вещества, ускоряющие жизненно важные химические реакции в клетках организмов. Являясь катализаторами, они образуют с исходными веществами неустойчивые промежуточные соединения: эти соединения, распадаясь, дают конечный продукт данной реакции и освобождают ферменты. Известно много ферментов и каждый из них ускоряет только одну какую-либо реакцию или группу однотипных реакций. Эту особенность ферментов называют специфичностью или селективностью (избирательностью) действия. Направленность их действия позволяет организму быстро и точно выполнять сложную химическую работу по перестройке молекул пищевых веществ – в нужные ему соединения.
Уже во рту во время пережевывания пищи под влиянием фермента амилазы сложные сахара начинают разлагаться на простые вещества. Эта работа в дальнейшем будет продолжена в кишечнике ферментами - карбогидразами. В желудке и кишечнике белки пищи подвергаются разложению с участием пепсина, трипсина, химотрипсина. Жиры разлагаются на глицерин и карбоновые кислоты под влиянием ферментов – липаз. Все эти реакции протекают по одному принципу: разрывается определенная химическая связь в молекуле белка, углевода или жира. Освободившиеся валентности используются для присоединения групп ОН - и иона Н + из молекул воды. Происходит процесс гидролиза. Для молекулы белка эту реакцию можно представить так:
Известны ферменты, которые оказывают иное действие на молекулы. Некоторые из них ускоряют окислительно-восстановительные реакции: они способствуют переносу электрона от одной молекулы (окисляемой) к другой (восстанавливаемой). Существуют ферменты, соединяющие молекулы друг с другом, ферменты, которые переносят большие и сложные группы атомов от одной молекулы к другой. Располагая богатым набором ферментов – катализаторов, клетка разлагает молекулы пищевых белков, жиров, углеводов на небольшие фрагменты и из них заново строит белковые и иные молекулы, которые будут точно соответствовать потребностям организма. Русский физиолог И.П. Павлов назвал ферменты - носителями жизни.
В последние годы широко используются иммобилизованные (неподвижные) ферменты. Для ускорения нужной реакции их закрепляют на поверхности инертного «носителя». В качестве его обычно используют оксид кремня ( IV ) или полимерные материалы. Через эту массу фильтруют исходные вещества. Ферменты быстро и точно производит высокоспецифичную и химическую работу, в результате которой получаются продукты, почти не содержащие посторонних соединений.
Каталаза относится к классу оксидоредуктаз. Она содержится в животных и растительных тканях и включает железо в составе геминовой простатической группы. Фермент имеет белковую природу и является катализатором в клетке. Каталаза проявляет очень высокую активность: одна молекула фермента разлагает до 5 млн. молекул перекиси водорода в минуту при 0 0 С.
Это жизненно важная реакция, так как пероксид водорода (Н2О2) образуется в результате обмена веществ в клетке и оказывает на клетку вредное действие.
Максимальную активность каталаза обнаруживает в интервале от 0 0 до 10 0 С. Оптимальные значения РН действия лежит в пределах 6,0 – 8,0. Активность фермента определяется строением белковой молекулы. Определенное пространственное расположение остатков аминокислот, образующих цепеобразную молекулу белка, создает условия для протекания катализируемой ферментом реакции. Длинная цепочка остатков аминокислот свернута в сложный клубок так, что аминокислоты, расположенные в цепи далеко друг от друга, могут оказаться соседями. Некоторые из возникших таким путем группировок, остатков аминокислот проявляют каталитические свойства и образуют активный центр фермента. Ферменты для проявления активности нуждаются в веществах небелковой природы – кофакторах. Кофактором может быть ион металла (цинк, кальций, марганец) или молекула органического соединения (кофермент). Иногда для действия фермента бывает необходимо присутствие, как ионов металла, так и коферментов. В отдельных случаях кофермент очень прочно соединен с белком, что и наблюдается у каталазы. У каталазы кофермент представляет собой комплексное соединение железа (гемм). В некоторых ферментах коферменты – это вещества, близкие по строению молекулы к витаминам. Витамины, таким образом, являются предшественниками коферментов. Из витамина В1 (тиамин) в клетках образуется тиамин пирофосфат – это кофермент важного фермента (декарбоксилаза), который превращает пировиноградную кислоту в оксид углерода ( IV ) и ацетальдегид. Из витамина В2 получают коферменты флавиновых ферментов – одну из стадий окисления пищевых веществ. Из витамина В12 образуются коферменты, необходимые при образовании клеток крови.
1.2 Загрязнение окружающей среды тяжёлыми металлами
Загрязнение окружающей среды тяжелыми металлами, а особенно свинцом приобрело огромные масштабы, особенно в больших городах и вдоль автострад в связи с содержанием в бензине антидетонаторной добавки – тетраэтилсвинца. Вместе с выхлопными газами автомобилей он выбрасывается в атмосферу. Вследствие этого за последние десятилетия уровень свинца в крови людей увеличился. Накопление свинца в организме приводит к раковым заболеваниям, так как, в несколько раз усиливает действие канцерогенных веществ (диоксины, полициклические углеводороды) в организме. В этом проявляется взаимодействие различных ксенобиотиков в окружающей среде либо в организме с образованием ещё более ядовитых продуктов.
Так, соединения меди весьма токсичны для представителей животного и растительного мира. Избыток ионов меди в человеческом организме вызывает заболевания нервной системы, печени и почек, гастриты, язвенную болезнь желудка. У работающих с медными порошками более 5 лет, снижается жизненная ёмкость лёгких, резко увеличивается содержание гемоглобина, и число эритроцитов в крови, уплотняются корни лёгких, воспаляются дёсна.
Масштабы отравления медью наиболее опасны в промышленных меднодобывающих районах, где на 1т добытой меди приходится 2 т пыли, содержащей 15% меди, 60% - оксидов железа, по 4% мышьяка, ртути, цинка, свинца. При избытке меди в организме происходит угнетение многих ферментов, разрушаются железосодержащие белки (гемоглобин, ферритин и др.) в результате замещения железа на медь, вследствие отравления медью, возникает глобинонурия, желтуха, накапливается метгемоглобин (потемнение крови).
Оксиды меди и соли вызывают аллергию, изъязвление роговицы, дерматиты.
Загрязнение супесчаной почвы (5мг/кг) может привести к угнетению активности нитрифицирующих бактерий. Медь заметно задерживает минерализацию азота.
В то же время, медь, как и железо, играет важную роль в процессе кроветворения и поддержании нормального состава крови. Недостаток меди в почве может привести к заболеванию животных анемией, а у растений вызвать задержку образования хлорофилла, понизить содержание в них витаминов.
Токсичность ртути, свинца и других тяжелых металлов усиливается в результате их преобразования в окружающей среде в алкильные производные.
Hq Hq 2+ ( CH 3 ) Hq
Метил и фенил-ртуть вследствие своей лиофильности очень легко проникают в организм. Таким образом, тяжелые металлы, попавшие в окружающую среду, необратимо разрушают белки, в том числе и ферменты, пагубно влияют на здоровье человека, вызывая тяжелые заболевания.
Ртуть отличается широким спектром и большим разнообразием клинических проявлений токсического действия. В основе механизма действия ртути лежит блокада биологически активных групп белковой молекулы. При отравлениях ртутью отмечается головная боль, общая слабость, боли при глотании, повышенная температура, боли в животе, признаки поражения почек. Известны смертельные случаи при отравлении парами ртути. У рабочих производств отмечаются неврастенический синдром, нарушение психической сферы (повышенная раздражимость, эмоциональная неустойчивость, утомляемость, пониженная умственная работоспособность). Снижается количество гемоглобина и число эритроцитов, кровоточивость дёсен, набухание лимфатических и слюнных желез, воспаление толстого кишечника, язва желудка и двенадцатиперстной кишки, некротические изменения в почках.
Несмотря на то, что дефицит лития в человеческом организме приводит к психическим расстройствам, при повышенной концентрации он токсичен. Так, избыток лития вызывает общую заторможенность, нарушение дыхания и сердечного ритма, слабость, сонливость, потерю аппетита, жажду, расстройство зрения, а также дерматит лица и рук.
Следующий за литием бериллий принадлежит к числу наиболее токсичных металлов (для сравнения приведем ПДК бериллия и ртути в воздухе производственных помещений, составляющие 0,001 и 0,01 мг/м 3 , соответственно). Бериллий и его соединения обладают аллергическим и канцерогенным действием, раздражают кожу и слизистые оболочки, вызывают дерматозы, конъюнктивиты, назофарингит, заболевания легких и бронхов – трахеобронхит, пневмонию и опухали легких. Заболевания могут возникнуть через 10-15 лет после прекращения контакта с бериллием. Металлы, в сравнительно высоких концентрациях отрицательно влияющие на жизнедеятельные процессы, в малых концентрациях абсолютно необходимы для нормального функционирования различных организмов, т.е. относятся к биологически активным элементам.
Цинк менее токсичен, чем медь, однако его избыток в организме может привести к понижению концентрации кальция в крови и костной ткани. Присутствие цинка в воздухе производственных помещений в виде пыли иногда вызывает заболевание дыхательных путей, называемое «литейной лихорадкой». С другой стороны, цинк – важный микроэлемент: он входит в состав инсулина (гормона поджелудочной железы), участвует в переносе углекислого газа кровью позвоночных и, что особенно важно, стимулирует рост растений.
Многочисленные данные свидетельствуют о том, что токсичность тяжелых металлов находится в непосредственной связи с их химической формой существования, с конкретной «химической упаковкой» металла. Общеизвестно, например, что соединения Cr 6+ значительно более токсичны, чем соединения Cr 3+ , что находит отражение в значениях их ПДК в питьевой воде – 0,05 и 0,5 мг/л соответственно.
Никель относится к тяжелым металлам с умеренной токсичностью (ПДК Ni 2+ в питьевой воде составляет 0,1 мг/л). Аллергическое действие металлического никеля проявляется только при продолжительном контакте кожи человека с декоративными никелевыми покрытиями (корпуса и браслеты часов, оправы очков). В то же время, летучий тетракарбонил никеля Ni ( CO )4 (ПДК в воздухе производственных помещений 0,0005 мг/м 3 ) – одно из наиболее ядовитых веществ, известных человеку (в свое время это соединение состояло в списках боевых отравляющих веществ ряда держав).
Кадмий относится к редким, рассеянным элементам: он содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка. Поступая в водоёмы, растворимый кадмий осаждается и накапливается в донных осадках. Он может находиться в почве в виде комплексных соединений (цианиды). Резко выражено загрязнение кадмием водоёмов и почвы в районах размещения металлургических комбинатов, производств красителей, кадмий - никелевых аккумуляторов, минеральных удобрений. Кадмий снижает активность пищеварительных ферментов – трипсина, пепсина, изменяется каталазную активность крови и тканей печени, угнетает синтез гликогена в печени. Вдыхание паров кадмия в концентрации 1мг/м. куб.в течение 8 часов рабочей смены приводит к токсической пневмонии, а затем к отёку лёгких. При этом развивается хронический ринит и фарингит, раздражение гортани, жжение в носу, Носовые кровотечения, образование язв в носовой полости. При случайном отравлении сульфатом кадмия смерть у пострадавшей наступила через 30 часов при нарастании сердечно – сосудистой недостаточности, отёке лёгких.
В Японии была обнаружена болезнь «итай – итай», при которой отмечалась декальцификация скелета, особенно у пожилых людей. Причиной явилось интенсивное загрязнение рисовых полей сточными водами горнометаллургических предприятий. Болезнь протекала с деформацией скелета, снижением роста, болями в пояснице, мышцах ног, переломами рёбер при кашле. Развивалась анемия, поражение почек, снижалось содержание в крови железа, кальция, фосфора.
Работающие в контакте с кадмием часто умирают от рака лёгкого и простаты. Исследования показывают, что у рабочих производства кадмиево - никелевых аккумуляторов (США) при стаже работы 5 лет и концентрациях кадмия в воздухе 1 мг/м.куб оказалась очень высокая онкозаболеваемость.
Действие солей тяжелых металлов на белки






В результате активного воздействия цивилизации на окружающую среду степень ее загрязнения возрастает с каждым годом. Главной причиной ухудшения экологической обстановки можно считать колоссальное потребление и переработку минеральных ресурсов, являющихся источником металлов, необходимых для производства.
Особенно опасным является все возрастающее загрязнение природных источников воды токсическими веществами, включающими ионы тяжелых металлов (ТМ). Поскольку человек за год выпивает примерно две тонны питьевой воды, то даже малые концентрации этих веществ, которые накапливаются в организме человека, могут привести к различным тяжелым заболеваниям, включающим онкологические и сердечно-сосудистые патологии.
В условиях активной антропогенной деятельности загрязнение окружающей среды тяжелыми металлами стало особенно опасным потому, что не существует надежных механизмов самоочищения среды (период полувыведения из почвы цинка — до 500 лет, свинца — до нескольких тысяч лет). Попадая в окружающую среду с газовыми выбросами, твердыми отходами и сточными водами предприятий, удобрениями и пестицидами, ТМ загрязняют почвенный покров, воды и воздух, причем из водной и воздушной среды прямыми или косвенными путями попадают в почву. Особенно опасны загрязнения изотопами металлов, которые, как показала Чернобыльская катастрофа, могут быть радиоактивными.
Главными источниками поступления в биосферу большинства металлов являются предприятия теплоэнергетики, поскольку в угле и нефти присутствуют все металлы. Количество ртути, кадмия, кобальта, мышьяка в атмосферных выбросах при сжигании угля, нефти, торфа и другого горючего может в 3-8 раз превышать количество добываемых металлов.
Для пригородных и сельских районов характерно поступление ТМ в окружающую среду в составе сточных вод и отходов. Существенным источником загрязнения почвы является применение удобрений из шламов, полученных из промышленных и канализационных очистных сооружений. Даже обычные моющие средства могут быть источником ионов цинка и селена.
Кроме того, к основным источникам токсических загрязнений необходимо отнести и автотранспорт. Автомобили кроме оксидов азота, углерода и серы выбрасывают в атмосферу соли свинца. Содержание свинца в организме жителей США, например, в настоящее время приближается к предельно допустимой концентрации (ПДК).
Физический механизм воздействия тяжелых металлов на живые организмы
До недавнего времени было непонятно, почему сравнительно малые концентрации тяжелых металлов вызывают тяжелые отравления.
Последние годы в работах, проводимых на физическом факультете, было обнаружено новое физическое явление — образование надмолекулярных структур — дипольных белковых кластеров в растворах различных белков и ферментов, содержащих ионы тяжелых металлов. Принято называть тяжелыми металлами те элементы, атомный вес которых превышает 40.
Образование белковых нано структур было изучено нами в растворах различных протеинов, содержащих ионы тяжелых щелочных металлов — цезий, рубидий, а также медь, кадмий, свинец, европий и др. различными оптическими методами (рассеяние света, фотонно-корреляционная спектроскопия и поляризация флуоресценции).
Как показали эти исследования, особую роль играет взаимодействие белков и ферментов с таким важным для жизнедеятельности организма элементом, как калий. Оказалось, что наличие в растворах белков ионов калия K + также приводит к возникновению дипольных нанокластеров.
Таблица. Металлы и их ионные радиусы
| МЕТАЛЛ | Na+ | K+ | Cs+ | Rb+ | Cd+ | Pb 2+ | Eu 3+ | Сe+ |
| ВЕЛИЧИНА ИОННОГО РАДИУСА | 0,87 A | 1,33 A | 1,67 A | 1,47 A | 1,14 A | 1,2 A | 0,95 A | 1,27 A |
Было выявлено, что на процесс кластерообразования влияет величина ионного радиуса металла. В случаях, когда в растворах белков имеются малые ионы типа Na+, образование дипольных кластеров не наблюдается, поскольку ион натрия находится у поверхности белка в окружении молекул воды и не может соединиться непосредственно с противоположным зарядом на белке.
Ионы с большим радиусом (смотри таблицу), такие как Cs+, Rb+, Cd+, Ce+, Pb 2+ , Eu 3+ а также К+, не могут удерживать на своей поверхности воду, т.к. энергия взаимодействия заряд иона — дипольная молекула воды обратно пропорциональна четвертой степени ионного радиуса и может быть сравнима с тепловой энергией. Поэтому такие ионы присоединяются к отрицательным зарядам на поверхности белка непосредственно без водной оболочки (рис.1).
Когда концентрация перечисленных выше ионов увеличивается, наступает момент электрической разрядки поверхности белка. При этом вместо кулоновского отталкивания между макромолекулами белка возникает диполь-дипольное притяжение. Этот процесс возможен только для белков и ферментов, поскольку только у них наблюдаются гигантские дипольные моменты, достигающие величины в тысячу D (дебай).
Смена характера межмолекулярного взаимодействия приводит к появлению в растворах белков надмолекулярных наноструктур — дипольных белковых кластеров, масса которых растет в области изоэлектрической точки белка с ростом концентрации тяжелых ионов.

Рис.1. Схема возможного процесса образования дипольной белковой наноструктуры
Роль калия и натрия в жизнедеятельности организма очень важна. Электрические свойства (потенциал покоя — потенциал действия) большинства клеток определяются этими двумя ионами, а также ионом кальция Ca+, поэтому они называются потенциало — образующими. Как известно, натрий содержится в крови, в плазматической жидкости межклеточного пространства, в то время как калий в организме человека, в основном, находится внутри клеток. Так внутри мышечных клеток калия почти в 50 раз больше, чем в межклеточном пространстве. Для поддержания такой концентрационной неравновесности затрачивается большая энергия. С помощью молекулярных «машин» — Атфаз — натрий из клеток выкачивается, и в клетки закачивается калий. При патологическом состоянии у человека может происходить разрушение клеточных мембран (лизис клеток). В этом случае выходящий из клеток калий нарушает процесс синтеза белков и ферментов и приводит к кластеризации макромолекул.
Безусловный интерес представляют собой исследования свойств водных растворов основных белков крови (альбумина и гамма-глобулина), а также белков являющихся основными структурными элементами тканей живых организмов, к которым относится фибриллярный белок — коллаген.
В наших работах с помощью методов статического и динамического рассеяния света (фотонно-корреляционной спектроскопии) было показано, что размер ионного радиуса металла влияет на межмолекулярные взаимодействия и подвижность молекул коллагена в растворе. Воздействие ионов калия, имеющих больший ионный радиус по сравнению с ионами натрия, аналогично воздействию ионов тяжелых металлов, т.к. приводит к агрегации молекул коллагена вблизи изоэлектрической точки (pH 6). Это проявляется в уменьшении примерно в два раза величины коэффициента трансляционной подвижности, при этом масса рассеивающих частиц увеличивается на порядок.
Рост массы частиц в растворах белков при воздействии ионов металлов с большими ионными радиусами было подтверждено также с помощью метода поляризации флуоресценции.
Следует отметить, что по данным наших экспериментов начало кластерообразования в растворах альбумина, содержащих ионы свинца, меди, кадмия и др., соответствуют значениям ПДК для этих металлов.
В 2009 году в дипломной работе Т.Н. Тихоновой с помощью атомно-силового микроскопа (АСМ) были впервые получены изображения молекул основных белков сыворотки крови — альбумина и гамма-глобулина, а также изображения белковых кластеров, которые образуются в растворах при добавлении ионов с большими ионными радиусами.
В качестве примера на фотографиях показаны снимки молекул альбумина и белковых агрегатов в растворах альбумина с ионами калия и европия.
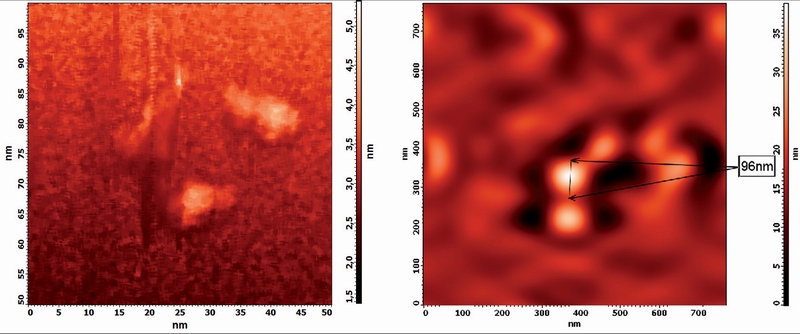
Рис.2. Строение молекулы альбумина, отснятой на АСМ
Рис.3. 2D-изображение частиц образующихся в растворе альбумина при добавлении KCl, полученного с помощью АСМ
Данная фотография, полученная с помощью АСМ, дает представление о размере молекулы альбумина (~10 нм).
Как можно видеть, размер частицы увеличился почти на порядок.
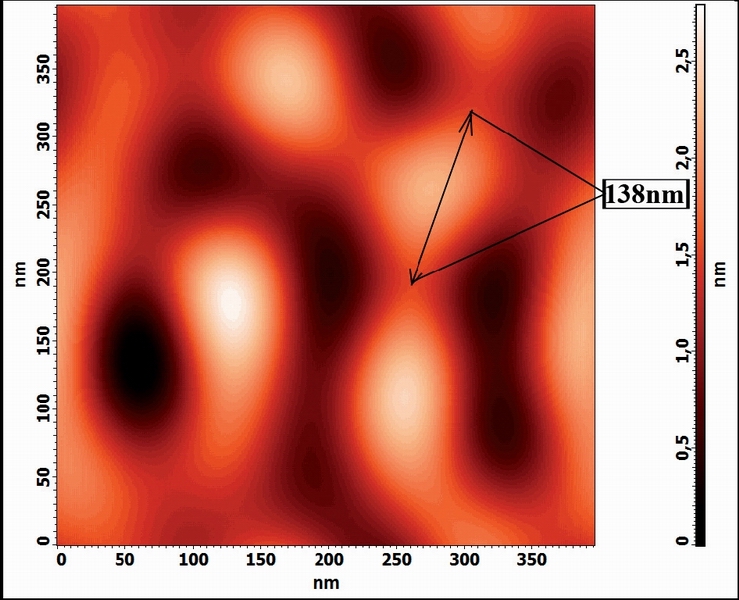
Рис. 4. 2D-изображение белковых кластеров в растворе альбумина, содержащем соль Eu(NO3)3
На фотографии (рис 4.), полученной с помощью АСМ, показано изображение частиц, образующихся в растворе альбумина при добавлении соли Eu(NO3)3 .
Таким образом, нами обнаружен и объяснен механизм образования наноразмерных дипольных кластеров в растворах белков, содержащих ионы тяжелых металлов и калия.
Можно предполагать, что образование белковых кластеров в крови человека под действием ТМ, приводит к нарушениям как транспортной, так и иммунной функций основных белков крови.
Возникает вопрос, каким способом можно обезопасить человека от отравления тяжелыми металлами.
Наиболее эффективным методом очистки от ТМ может служить сорбция металлических ионов на пористых средах, например на активированном угле. Подобные фильтры применяются во всех современных системах очистки водопроводной воды.
Г.П. Петрова, Ю.М. Петрусевич, И.А. Сергеева,
Т.Н. Тихонова, К.В. Федорова,
(кафедра молекулярной физики,
кафедра медицинской физики)
Литература
1. G.P. Petrova, Yu.M.Petrusevich, A.N.Evseevicheva.// Gen. Phys. and Biophys. 1998, V.17(2), C. 97
2. Петрова Г.П., Петрусевич Ю.М. // Биомед. радиоэлектроника. 2000, №3, С. 41.
3. Петрова Г.П., Петрусевич Ю.М., Тен Д.И. // Квант. Электроника. 2002, 32, №10, С. 897.
4. И.А. Сергеева, Н.В. Сокол, М.С. Иванова, Г.П. Петрова, Ю.М. Петрусевич// ВМУ. Серия 3 Физика. Астрономия. 2009, №4, С. 85
Читайте также:
