Дельта фаза в металле
Обновлено: 21.09.2024
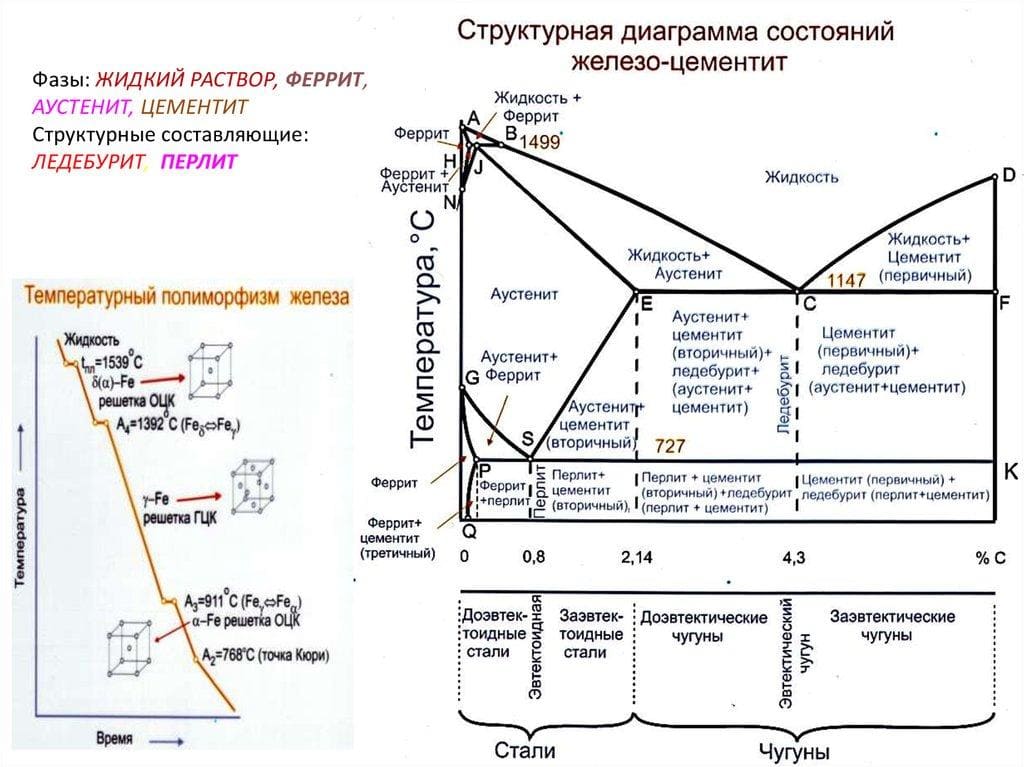
Феррит (твердый раствор внедрения C в α-железе с объемно-центрированной кубической решеткой)
Аустенит (твердый раствор внедрения C в γ-железе с гранецентрированной кубической решеткой)
Цементит (карбид железа; Fe3C метастабильная высокоуглеродистая фаза)
Графит стабильная высокоуглеродистая фаза
Ледебурит (эвтектическая смесь кристаллов цементита и аустенита, превращающегося при охлаждении в перлит)
Мартенсит (сильно пересыщенный твердый раствор углерода в α-железе с объемно-центрированной терагональной решеткой)
Перлит (эвтектоидная смесь, состоящая из тонких чередующихся пластинок феррита и цементита)
Сорбит (дисперсный перлит)
Троостит (высокодисперсный перлит)
Бейнит (устар: игольчатый троостит) — ультрадисперсная смесь кристаллов низкоуглеродистого мартенсита и карбидов железа
Белый чугун (хрупкий, содержит ледебурит и не содержит графит)
Серый чугун (графит в форме пластин)
Ковкий чугун (графит в хлопьях)
Высокопрочный чугун (графит в форме сфероидов)
Половинчатый чугун (содержит и графит, и ледебурит)
Феррит (лат. ferrum — железо), фазовая составляющая сплавов железа, представляющая собой твёрдый раствор углерода и легирующих элементов в α-железе (α-феррит). Имеет объемноцентированную кубическую кристаллическую решётку. Является фазовой составляющей других структур, например, перлита, состоящего из феррита и цементита.
При температурах выше 1401 °С в железоуглеродистых сплавах образуется твёрдый раствор углерода в δ-железе (δ-феррит), который можно рассматривать как высокотемпературный феррит.
Содержание
Свойства
Растворимость углерода в α-феррите 0,02–0,03 % (по массе) при 723 °C, а при комнатной температуре 10 −6 –10 −7 %; в δ-феррите — 0,1 %. Растворимость легирующих элементов может быть весьма значительной или неограниченной. Легирование феррита в большинстве случаев приводит к его упрочнению. Нелегированный феррит относительно мягок, пластичен, сильно ферромагнитен до 768–770 °С.
Строение
Микростроение, размеры зерна и субструктура феррита зависят от условий его образования при полиморфном γ—α превращении. При небольшом переохлаждении образуются приблизительно равноосные, полиэдрические зёрна; при больших переохлаждениях и наличии легирующих элементов (Cr, Mn, Ni) феррит возникает по мартенситному механизму и вследствие этого упрочняется. Укрупнение зёрен аустенита часто приводит к образованию при охлаждении видманштеттова феррита, особенно в литых и перегретых сталях. Выделение доэвтектоидного феррита происходит преимущественно на границах аустенитных зёрен.
Источники
- Бочвар А. А., Металловедение, 5 изд., М., 1956.
- Бунин К. П., Баранов А. А. Металлография — М .: Металлурия, 1970.
- Феррит (фаза) — статья из Большой советской энциклопедии
См. также
- Железо
- Материаловедение
- Фазы железоуглеродистых сплавов
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Феррит (фаза)" в других словарях:
Феррит (в железе) — Феррит (фаза) Фазы железоуглеродистых сплавов Феррит (твердый раствор внедрения C в α железе с объемно центрированной кубической решеткой) Аустенит (твердый раствор внедрения C в γ железе с гранецентрированной кубической решеткой) Цементит… … Википедия
Феррит (железо) — Феррит (фаза) Фазы железоуглеродистых сплавов Феррит (твердый раствор внедрения C в α железе с объемно центрированной кубической решеткой) Аустенит (твердый раствор внедрения C в γ железе с гранецентрированной кубической решеткой) Цементит… … Википедия
Феррит — Феррит: Ферриты (оксиферы) химические соединения оксида железа Fe2O3 с оксидами других металлов. Феррит (фаза) железо или сплав железа с объёмноцентрированной кубической кристаллической решёткой. См. также Ферритовый фильтр … … Википедия
Феррит (металлургия) — У этого термина существуют и другие значения, см. Феррит. Феррит (металлургия) Фазы железоуглеродистых сплавов Феррит (твердый раствор внедрения C в α железе с объемно центрированной кубической решеткой) Аустенит (твердый раствор внедрения C в γ… … Википедия
ФЕРРИТ — твердый раствор углерода (обычно низкой концентрации порядка сотых долей процента) и других элементов в α железе α Fe (C) (почти чистое железо α). Содержание углерода менее 0,04 %. Кристаллическая решетка феррита аналогична… … Металлургический словарь
Феррит — [ferrite] твёрдый раствор С (до 0,025 % при 723 °С) и легирующих элементов в α Fe с ОЦК решеткой. Феррит одна из основных фаз в сталях и чугунах. С и N растворяются в α Fe внедрения, а Р, Si и все металлы замещаются. В легированных сталях и… … Энциклопедический словарь по металлургии
ФЕРРИТ — (от лат. ferrum железо) фаза железоуглеродистых сплавов, твёрдый р р углерода (до 0,02%) в а железе. Ф. имеет кубическую объёмно центриров. решётку. В Ф. могут быть растворены кремний, марганец, фосфор и др. элементы. При темп ре 911 769 °С Ф.… … Большой энциклопедический политехнический словарь
ферритная фаза (дельта-феррит, феррит) — 3.1 ферритная фаза (дельта феррит, феррит): Мелкодисперсная фаза, возникающая при кристаллизации из жидкого состояния хромоникелевых сталей аустенитного и аустенитно ферритного класса, имеет объемно центрированную кубическую кристаллическую… … Словарь-справочник терминов нормативно-технической документации
Ферит (в железе) — Феррит (фаза) Фазы железоуглеродистых сплавов Феррит (твердый раствор внедрения C в α железе с объемно центрированной кубической решеткой) Аустенит (твердый раствор внедрения C в γ железе с гранецентрированной кубической решеткой) Цементит… … Википедия
Ферит — Феррит (фаза) Фазы железоуглеродистых сплавов Феррит (твердый раствор внедрения C в α железе с объемно центрированной кубической решеткой) Аустенит (твердый раствор внедрения C в γ железе с гранецентрированной кубической решеткой) Цементит… … Википедия
Дельта фаза в металле
О -железе мы уже упоминали в статье «Аллотропия». Как было обещано, скажем об этом железе несколько слов. -железо ( -феррит) – это один из твердых растворов в системе железо-углерод, высокотемпературная модификация феррита. -феррит является аллотропической модификацией железа, которая существует при температуре выше 1390 о С.
Структура -железа такая же, как и -железа – объемно-центрированная кубическая. Но название -феррит принято в металловедческой практике. -феррит оказывает определенное влияние на строение некоторых марок литых сталей и их последующую термическую обработку. Кроме того -феррит отрицательно влияет на механические свойства.
О -феррите действительно упоминают редко. Он исследован слабо, потому что его практически невозможно наблюдать при комнатной температуре.
В соответствии с диаграммой состояния железо-углерод при понижении температуры он превращается сначала в аустенит, потом в a -феррит. -феррит встречается в легированных сталях, особенно часто в высокохромистых. Добавки хрома, как и других элементов, которые способствуют образованию феррита, понижают минимальную температуру устойчивости -феррита. Такой феррит можно исследовать при комнатной температуре. На рис.1 показан аустенит и протяженные включения -феррита (белые участки, рис.1 а,б), темные участки, рис.1 в.
 |  |
| а | б |
 | |
| в |
Рисунок 1. Структура хромомолибденовой стали: 0,1% C, 12% Cr, 0,5% Mo. Термическая обработка: 1100 о С 1 час, закалка в воду (Материалы книги «Металлография железа» в 3 томах)
d -феррит, образовавшийся при высокой температуре, был зафиксирован закалкой, поскольку превращение феррит-аустенит не успело полностью произойти. Аустенит превратился в мартенсит, а d - феррит сохранился, и его стало возможным видеть при комнатной температуре. Снимки на современном оборудовании показаны на рис.2 при различных увеличениях.
 |  |
| а | б |
 | |
| в |
Рисунок 2. -феррит в высоколегированной стали; современная съемка
После длительной термической обработки при 1250 о С в стали сформировалась равноосная структура (рис.3). Это практически полигональные участки -феррита и мартенсита. -феррит, который образовался из расплава, находился в равновесии с аустенитом. Часть феррита превратилась в аустенит. При закалке аустенит превратился в мартенсит, -феррит сохранился. Вогнутая форма границ зерен -феррита указывает на то, что аустенит зародился внутри кристаллов -феррита и рос за их счет.
 |  |
| а | б |
Рисунок 3. Структура хромомолибденовой стали состава: 0,11% C, 12% Cr, 1.0% Mo. Термическая обработка: 1250 о С 1 час, закалка в воду (Материалы книги «Металлография железа» в 3 томах)
-феррит можно наблюдать не только в закаленной, но и в литой стали после быстрого охлаждения. При этом также не успевает пройти перитектическое превращение L+δ= , и -феррит сохраняется в структуре вплоть до комнатной температуры. На рис.4 -феррит – это темная округлая фаза.

Рисунок 4. Микроструктура литой быстрорежущей стали (А.П.Гуляев. Металловедение)
Ферритная фаза
В процессе остывания сталей они проходят этап (фазу) кристаллизации. Ферритная фаза определяет количество мелкодисперсионного дельта феррита. Например, в аустенитных марках типа Е308 или Е308L процент содержания этого элемента колеблется от трёх до десяти процентов.Это количество позволяет предотвратить появление трещин и не допустить так называемое «охрупчивание» металла при высоких температурах.

Строение и свойства
При повышении температуры аустенитные стали превращаются в жидкий раствор с определённым процентным отношением железа и углерода. Если температура раствора превышает линию так называемого ликвидуса (это около 1700 °C),образовавшийся расплав становится статически неустойчивым. Его состояние оценивают по двум составляющим:фазовой и структурной.
Для первой составляющей основным показателем является фаза состояния полученной смеси. Она определяет состояние металла по следующим показателям:
- раствора углерода в железе;
- количество различных образований (непосредственно феррит, в том числе высокотемпературный, аустенит, цементит).

Структурная составляющая часть образца определяется как гомогенная или квазигомогенная форма. Общая структура образовавшегося феррита составляет равноосные кристаллы. В трёхмерном пространстве решётка ферритной фазы представляет объёмно-центрированный куба. Эти кристаллы определяют твёрдость феррита и способность углерода в нём растворяться. Опыт показывает, что при температуре равной 727 градусов в феррите растворяется только 0,02% углерода.
Кроме этого к основным свойствам феррита относятся:
- обладает сильными ферромагнитными свойствами (до температуры 770 °С — точка Кюри);
- является теплопроводным элементом;
- хорошим проводником электрического тока;
- обладает повышенной пластичностью.
К основным недостаткам относятся невысокая прочность и недостаточная твёрдость. Последний показатель зависит от величины образованного зерна и находится в интервале от 65 до 130 НВ.
В зависимости от этапа проходящих превращений ферритная фаза находится в следующих состояниях:
- как основа кристаллической решётки образовавшегося сплава;
- второе или избыточное состояние (располагается по границам так называемых перлитных образований);
- элемент феррито-графитного эвтектоида.
Каждое состояние требует точного определения и выявления возникающих преобразований. От них во многом зависят характеристики конечного продукта.Полное отсутствие ферритного образования или незначительное его содержание проявляется с образованием горячих трещин. Завышенное содержание этого показателя снижает пластичность, ударную вязкость и антикоррозийную стойкость.
Контроль ферритной фазы
Особенность влияния ферритной фазы на образец проявляется при небольших изменениях содержания этого показателя (несколько процентов). Могут существенным образом измениться конечные свойства изготовленной стали. Поэтому практически все образцы подвергаются проверке.

Этот процесс регламентируется ГОСТ Р 53686-2009. В нём приведен порядок, как должен осуществляться контроль содержания ферритной фазы.На основании этого стандарта должна проходить проверка, которая должна определить следующие показатели:
- содержание ферритной фазы;
- процент этого показателя;
- ферритное число.
ГОСТ Р 53686-2009 Определение содержания ферритной фазы в металле сварного шва аустенитных и двухфазных феррито-аустенитных хромоникелевых коррозионностойких сталей
Определение содержания ферритной фазы указывает на её объёмную долю в сталях аустенитного или аустенитно-ферритного класса.
Особенно подробное испытание проводится для сталей в которых в дальнейшем будет применяться сварка. Полученный сварной шов проверяется на прочность и долговечность путём проверки ферритной фазы. Она не должна превышать шести процентов.Пониженный процент ферритной фазы ухудшает механические характеристики.
Для проведения контроля ферритной фазы используют специально отобранные образцы. Они проверяются на специальных приборах определяющих силу отрыва контрольного магнита от готового сварного соединения. На основе нескольких измерений с использованием калибровочной кривой рассчитывают ферритовое число.



Различные явления, характерные для однофазных ферритных и аустенитных сталей: «475°-ная хрупкость», образование σ-фазы, мартенситное превращение, дисперсионноe твердение (карбидное и интерметаллидное) могут происходить в структурных составляющих двухфазных сталей феррито-аустенитного класса. В процессе нагрева происходит перераспределение легирующих элементов между фазами, что не может иметь место в однофазных сталях и что накладывает особый отпечаток на кинетику фазовых превращений. В зависимости от различного соотношения феррито- и аустенитообразующих элементов и различного распределения их в структурных составляющих степень стабильности твердых растворов — феррита и аустенита — является различной, и это определяет развитие одних и подавление других процессов.
В феррито-аустенитных сталях, как правило, ферритообразующих элементов больше в феррите, чем среднее содержание их в стали. Наоборот, аустенитообразующих элементов больше в аустените.
«475°-ная хрупкость». Процессы, известные под названием «475°-ная хрупкость», являются характерными для ферритных высокохромистых сталей. Они вызывают повышение твердости, снижение ударной вязкости, электросопротивления и, в ряде случаев, коррозионной стойкости.
Явление «475°-ной хрупкости» может происходить и в ферритной фазе феррито-аустенитных сталей, что ограничивает применение этих сталей температурой 400°С.
Изучению кинетики и природы этого явления посвящено значительное количество исследований советских и зарубежных авторов, однако до последнего времени природа этого явления не совсем ясна.
Из соответствующих гипотез можно выделить две, связанные: первая — с распадом α-твердого раствора, вторая — с образованием упорядоченных структур.
До последнего времени наиболее распространенной была гипотеза о распаде α-твердого раствора при 475°С. Причем одни авторы считали, что распад происходит без выделения фаз: в результате перегруппировки атомов образуются комплексы, богатые хромом. Искажения кристаллической решетки приводят к возникновению напряжений, которые и обуславливают изменение свойств. Другие авторы придерживались иной точки зрения: распад α-твердого раствора происходит с образованием богатых хромом метастабильных фаз. Причем некоторые из них считали, что мри этом возникает σ-фаза (последнее является маловероятным, по скольку 475°-ная хрупкость не сопровождается изменением магнитного насыщения, так как σ-фаза немагнитна, и возникновением новых характерных линий по рентгенограмме). Другие авторы полагали, что это промежуточные фазы, предшествующие образованию σ-фазы. Взаимодействие фаз и матрицы создает большие напряжения, приводящие к хрупкости.
В работах последних лет с применением более тонких методов физического эксперимента было показано, что хрупкость при 475°С связана с образованием упорядоченных структур определенного химического состава. В работе Taкеда и Нагаи приводятся данные об образовании в высокохромистых сталях сверхструктур типа FeCr (3 метастабильные ферромагнитные сверх-структуры Fe3Cr, FeCr и FeCr3). Процесс упорядочения при 475°С они противопоставляют процессу образования σ-фазы из неупорядоченного твердого раствора при более высоких температурах (800°С).
Наиболее убедительные и полные данные о природе 475°-ной хрупкости приведены в работе Окенко А.П., изучавшей кинетику образования и причины «475°-ной хрупкости» высокохромистых сталей Х25Т и Х28. Уже двухминутная выдержка при температуре 475°С приводит к повышению порога хладноломкости, понижению ударной вязкости, удельного электросопротивления. Наличие парных дислокаций на электронных микрофотографиях и сверхструктур типа Fe3Cr на нейтронограмме свидетельствуют об упорядочении твердого раствора. Упорядочение сопровождается увеличением параметра решетки α-фазы с 2,874 до 2,876 А.
При длительных выдержках упорядочение исчезает в связи с расслоением твердого раствора феррита и образованием фаз, имеющих ОЦК-решетку и содержащих хрома в 2 раза больше, чем в твердом растворе.
Таким образом, охрупчивание высокохромистого феррита при 475°С вызывается на ранней стадии упорядочением твердого раствора с образованием сверхструктуры, на более поздней стадии — распадом (расслоением) твердого раствора с образованием богатых хромом комплексов. Такое объяснение позволяет объединить имеющиеся в литературе противоречивые данные по этому вопросу.
Поскольку «475°-ная хрупкость» является недостатком ферритных и феррито-аустенитных сталей, то возникла необходимость избежать ее в технологические процессах при производстве сталей В связи с этим на заводе «Красный Октябрь» была снижена температура травления с 490 до 330° С и тем самым устранены условия охрупчивания стали. Надо иметь в виду, что травление является последней операцией перед поставкой стали.
Процессы, вызывающие 475°-ную хрупкость, обратимы. кратковременный нагрев до температуры 600—800° С с последующим охлаждением в воде восстанавливает пластичность, утраченную в результате 475°-ной хрупкости.
Образование σ-фазы. Высокотемпературная хрупкость в интервале 600—800° С ферритных, феррито-аустенитных и аустенитных сталей связана с выделением хрупкой немагнитной интерметаллидной σ-фазы.
По диаграмме состояния железо-хром образование σ-фазы начинается при концентрации хрома около 25%. Впервые обнаруженная в железохромистых сплавах в 1927 году Бейном и Гриффитсом как «хрупкая составляющая» σ-фазы с тех пор довольно широко изучена в различных сплавах. Имея переменный состав, она лишь приблизительно отвечает составу соединения FeCr, так как может растворять до 35% марганца, до 15%) молибдена, до 10% никеля и до 0,016% углерода. σ-фаза имеет тетрагональную решетку с 30 атомами на ячейку и параметрами а = 18,800, с = 4,544 А.
Известно, что присутствие кремния, марганца, молибдена и титана приводит к расширению области существования σ-фазы как по концентрации хрома, так и по температуре образования.
Николсон и Шортслив показали, что в промышленных сплавах не только специальные добавки (например, молибден) влияют на границы образования σ-фазы, но также и необходимые постоянные примеси, как кремний, марганец. Николсоном были получены данные о влиянии никеля на границу образования σ-фазы. По мере увеличения содержания никеля образование σ-фазы наблюдается при более высоких содержаниях хрома. Так, при содержании 8% никеля достаточно 18% хрома, а при содержании 20% никеля необходимо уже 21% хрома.
В отличие от никеля марганец, наоборот, способствует образованию σ-фазы при более низких концентрациях хрома (рис. 8).

В ряде работ отмечалось, что образование σ-фазы в процессе старения сопровождается уменьшением магнитной проницаемости, объема, ударной вязкости и интенсивным повышением твердости. Однако практическое использование высокой твердости таких сталей затруднено ввиду охрупчивания металла. Несмотря на большой экспериментальный материал, приведенный в литературе по фазовым превращениям, связанным с образованием σ-фазы, нет единого мнения о кинетике ее образования и механизме распада твердого раствора.
В работе Банных О.А., посвященной электронномикроскопическому исследованию распада аустенита в двухфазной стали, содержащей 18% хрома и 14% марганца, ведущей фазой в процессе превращения α → σ + γ является σ-фаза. Выделение и рост ее частиц приводят к обеднению прилегающих областей феррита и перестройке кристаллической решетки.
Необходимо отметить, что σ-фаза может возникнуть и в аустенитных сталях, однако скорость ее образования в феррите примерно в 20 раз выше скорости образования в аустените. Авторы упомянутых работ исследовали образование σ-фазы после длительного старения. В зависимости от легирования стали скорости процессов выделения σ-фазы различные. Поэтому исследование кинетических особенностей образования и растворения σ-фазы имеет большое практическое значение. Однако таких данных по наиболее распространенным хромоникелевым феррито-аустенитным сталям нет.
Дисперсионное твердение. Как показали исследования двухфазной хромоникелевой стали типа Х21Н5Т, вблизи температур 400 и 550°С она проявляет склонность к охрупчиванию. Это выражается в понижении ударной вязкости с 20—25 до 4 кгм/см2 в результате повышения порога хладноломкости выше комнатной температуры и увеличения твердости.
Большинство исследователей связывают охрупчивание этой стали с выделением интерметаллидной фазы типа Ni3(Ti, Al), Ni3Ti, NiAl, подобно тому, как это имеет место в дисперсионно-твердеющих сталях переходного класса (Х17Н7Ю, Х15Н9Ю и др.) и в аустенитных сталях типа Х15Н25. Эти стали содержат значительное количество никеля для обеспечения дисперсионного твердения за счет выделения никельсодержащих интерметаллидных фаз.
Максимальное упрочнение подобных сплавов достигается на той стадии распада, когда дисперсные выделения новой метастабильной фазы когерентны с матричным твердым раствором.
Наличие в сталях избыточного титана (сверх количества, необходимого для связывания углерода) и алюминия усиливает склонность к охрупчиванию в результате процессов дисперсионного твердения при старении. В промышленных плавках нержавеющих сталей алюминий всегда содержится в небольших переменных количествах, но его присутствием, как правило, пренебрегают при оценке фазовых превращений.
Исследования Спиридонова В.Б. показали, что в присутствии избыточного титана и алюминия в стали Х21Н5Т наблюдаются выделения мелкодисперсных фаз размером 80—100 А. При нагреве до температуры 600— 650° С происходит коагуляция выделений, сопровождаемая повышением ударной вязкости. В стали без титана, содержащей 0,36% алюминия, выделяющаяся фаза имеет период решетки 2,88 А и представляет соединение типа (Fe, Ni) Al. В сталях, содержащих 0,46—0,70% титана и до 0,20% алюминия, выделяющаяся фаза имеет период решетки, равный удвоенному периоду матрицы — 5,75 А.
Электронномикроскопическое исследование стали Х21Н5Т позволило вскрыть неравномерный характер выделений вследствие неоднородности в распределении легирующих элементов в областях, прилегающих к границам, и в зерне. С целью уменьшения этой неоднородности можно дополнительно легировать сталь бором и тем самым снизить степень охрупчивания.
Содержание углерода до 0,12% и карбидообразующих элементов, составляющих основу нержавеющих сталей — хрома, железа, а также введение специальных легирующих элементов с карбидообразующей способностью (титана, ниобия, молибдена, ванадия, марганца), могут вызвать дисперсионное твердение за счет выделения карбидных фаз.
Хром образует несколько модификаций карбидов: кубический — Cr23C6, гексагональный — Сr7С3, ромбический Cr23C2. В нержавеющих железохромоникелевых и железохромомарганцевых сталях наиболее устойчива модификация Cr23C6 с гранецентрированной решеткой, имеющей 116 атомов в одной элементарной ячейке. Марганец и железо — слабые карбидообразующие элементы — не образуют в нержавеющих сталях самостоятельных карбидов и, как правило, входят в состав сложного карбида хрома, замещая часть его атомов. Поэтому правильнее говорить о карбиде переменного состава M23C6.
Титан и ниобий (стабилизирующие добавки) в этом карбиде не растворяются и образуют самостоятельные карбиды типа TiC, NbC. Эффект твердения в высоколегированных аустенитных сталях связан с преимущественным образованием сложных карбидов хрома типа M23C6 и фаз внедрения типа MC, способных к растворению при температуре закалки. Фазы внедрения типа MC. не растворяющиеся при нагреве под закалку, не вызывают дисперсионного твердения. Их роль проявляется в создании препятствий, затрудняющих рост зерна. Дополнительное упрочнение может иметь место за счет выделения в азотосодержащих сталях избыточных кар-бонитридных и нитридных фаз, затрудняющих движение дислокаций.
Сущность всех известных методов упрочнения за счет дисперсионного твердения заключается в усилении степени нарушения атомно-кристаллического строения металла.
В двухфазных сталях это достигается путем создания сложной многофазной системы, обеспечивающей повышенную прочность и твердость. Поэтому очевидно, что применение для двухфазных сталей метода дисперсионного твердения с целью упрочнения является менее эффективным, чем для аустенитных сталей, тем более, что выпадение упрочняющих фаз является лишь одним из дополнительных факторов, усугубляющих охрупчивание двухфазных сталей при длительном старении.
Мартенситное превращение. Склонность к мартенсит-ному превращению аустенита феррито-аустенитных сталей зависит, в основном, от химического состава аустенита.
Понижают мартенситную точку следующие элементы: марганец, никель, хром, углерод, азот. Обеднение аустенита хромом вследствие выделения карбидов Сr23С6 при отпуске стали типа 18—8 в интервале температур 550—750° С может привести при последующем охлаждении до комнатной температуры к его превращению. Очевидно, что процесс превращения аустенита в двухфазных феррито-аустенитных сталях при отпуске должен протекать менее интенсивно, поскольку преимущественное выпадение карбидов происходит в феррит-ной составляющей.
Закономерности мартенситного превращения в феррито-аустенитных сталях недостаточно изучены. Имеются предположения о возможном образовании мартенсита в стали типа Х21Н5Т при охлаждении с 550°С. После 10%-ной деформации в стали Х21Н5Т происходит значительное образование мартенсита, что подтверждается увеличением магнитного насыщения. Деформация выше точки Md предотвращает образование мартенсита. Выделение карбидов типа М23С6 при отпуске этой стали приводит к повышению точки Мн.
Мартенситное превращение, протекающее при температурах выше комнатной, следует рассматривать как отрицательное явление в двухфазных сталях, предназначенных для изготовления аппаратуры, имеющей строго постоянные размеры.
Диаграмма состояния сплавов железо-углерод с пояснением
Фазовые диаграммы представляют собой изображение зон существования фаз, которые имеются в сплаве при различных условиях (температура, давление, химсостав).
Диаграмма железо углерод описывает подходящие условия для существования двух или более фаз в равновесии. Популярная аналогия: фазовая диаграмма воды описывает точку (тройную точку), в которой вода может сосуществовать в трёх разных фазах одновременно. Это происходит при температуре чуть выше точки замерзания (0,01 ° C) и при давлении 0,006 атм.
Существует четыре основных применения фазовых диаграмм:
- Разработка новых сплавов на основе требований применения.
- Производство этих сплавов.
- Разработка и контроль соответствующих процедур термообработки, которые предназначены для улучшения химических, физических и механических свойств сплавов.
- Устранение проблем, возникающих при применении новых сплавов, что в конечном итоге улучшает предсказуемость свойств продукта.
При разработке сплава фазовые диаграммы помогают предотвращать проектирование чрезмерно большого количества вариантов, сокращая затраты и время обработки. Они также помогают разрабатывать альтернативные сплавы или такие же, но с альтернативными легирующими элементами.
Компонентный состав
Диаграмма железо-углерод была разработана, чтобы показать микроструктурное состояние металла как функцию температуры и содержания углерода. Она показывает, что, в зависимости от интенсивности охлаждения стали, в ней могут возникать очень разные микроструктуры.
Когда металл расплавлен, то есть находится в жидком состоянии, решётчатые структуры отсутствуют. Атомы могут свободно перемещаться во всех направлениях. Чтобы достичь желаемых кристаллических структур, необходимо, чтобы металл медленно и полностью остыл при комнатной температуре. Промежуточные термические обработки положительно влияют на формирование кристаллических структур.
По вертикальной оси диаграммы железо-углерод располагается шкала температур в °C. Металл показан здесь от твердого до жидкого состояния. Например, чистое железо начинает плавиться при 1147°C. Температура устойчивого состояния расплава - 1536 °C.
По горизонтальной оси указывается процентное содержание углерода в металле.
Линии, которые соединяют характерные точки диаграммы, отмечают трансформацию металла. Они разделяют участки, где металл находится в в состоянии преобразования из твёрдого состояния в жидкое. Но одновременно диаграмма состояния «железо-углерод» определяет и реорганизацию атомов в кристаллической решётке.
Диаграмма показывает участки, в которых металл находится только в состоянии. расплава, феррита или аустенита. Остальные зоны характеризуются определённым сочетанием свойств. Это, например, расплав и аустенит, аустенит и феррит, феррит и перлит.
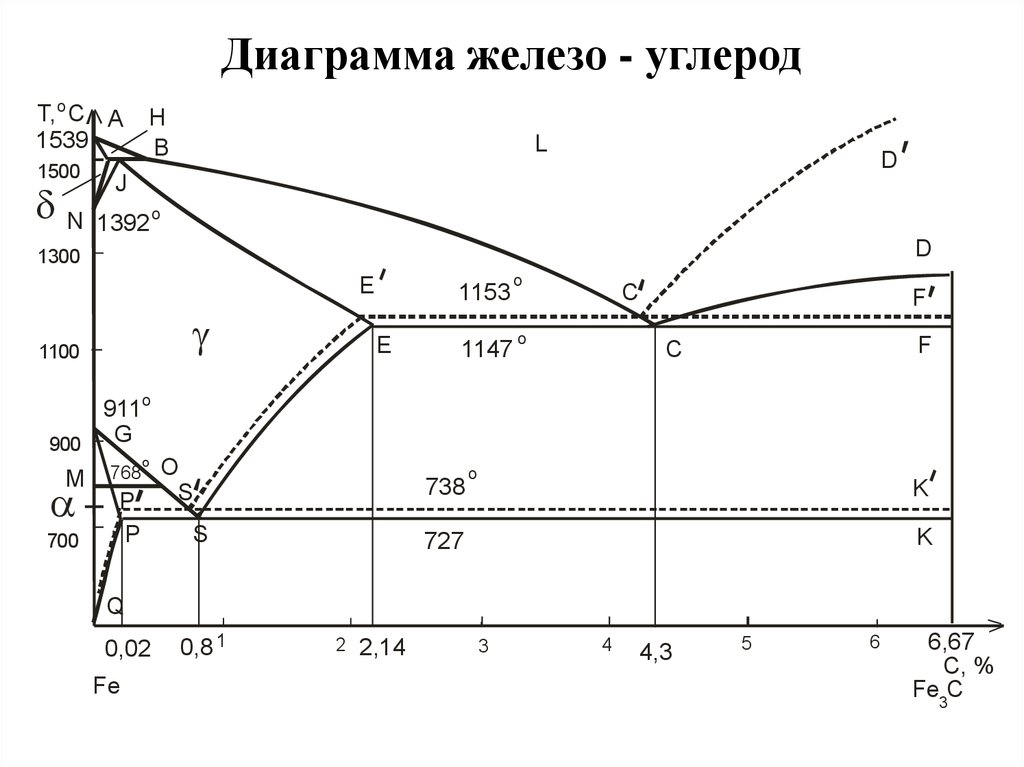
Обозначение точек пересечения заглавными буквами на линиях преобразования предназначено для лучшего понимания. Они указывают на переход в другое состояние или условие.
Диаграмма предполагает постоянное охлаждение металлов. Если металл медленно охлаждать, образуются крупные зёрна, если же металл остывает быстро, то размеры зёрен уменьшаются. Тип зерна металла определяет его прочностные свойства. Крупнозернистый материал имеет меньшую прочность, но его можно сделать более мелким и, следовательно, более прочным путём термической обработки или пластического деформирования (упрочнением). Самый высокий уровень прочности имеет именно мелкозернистый металл.
Выполним краткую характеристику основных химических компонентов диаграммы.
Железо
Железо образует кубическую пространственную решётку. Атомы железа расположены по углам этой решётки. Количество углерода, которое может быть растворено в железе, зависит от модификации железа, потому что разные формы кристаллической решетки железа (например, кубическая пространственно-центрированная и кубическая гранецентрированная) имеют межстраничные промежутки разного размера.
Второстепенную роль играет дельта-смешанный кристалл, который имеет объемно-центрированные атомы, но существует только в высоколегированных сталях. Эти кристаллы образуются в диапазоне температур от 1536 °C (точка плавления чистого железа) до 1392 °C.
Альфа-смешанный кристалл существует как объемно-центрированная кубическая решетка. Эти структуры образуются в чистом железе до температуры 911 °C.
В гамма смешанном кристалла атомы железа гранецентрированы, и это означает, что они расположены в середине каждой грани куба. Эти кристаллы образуются при температурах от 1392 °C до 911 °C в чистом железе.
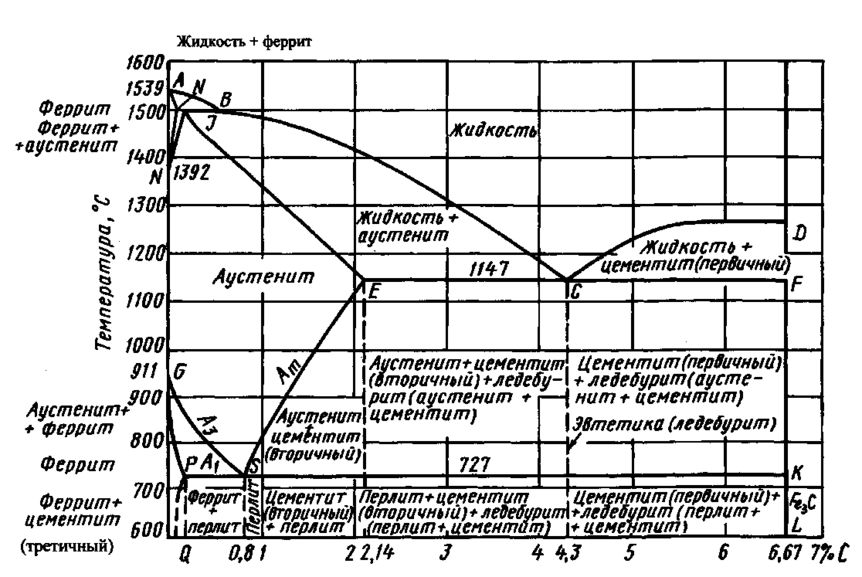
Углерод
В низких концентрациях, углерод не образует твёрдого химического соединения с железом, но откладывается в промежутках кристаллической решетки железа.
Углерод в железе является примесью внедренияи может существовать в форме гранецентрированную или объемно-центрированной кубической решётки. Диаграмма состояния сплавов железо-углерод устанавливает области стабильного существования твёрдого раствора с α, γ и δ фазами железа.
Описанные выше кристаллические решётки имеют различную растворимость углерода в зависимости от температуры. Углерод осаждается в междуузельных пространствах кристаллической решётки, при этом гранецентрированная кубическая решетка, также называемая аустенитом, имеет растворимость не более чем в сто раз выше, чем кристаллы феррита.
Цементит
Цементит - метастабильная фаза сплава с фиксированным составом, имеющий химическую формулу Fe3C. При комнатной температуре цементит очень медленно разлагается на железо и углерод (графит).
Некоторые другие факторы (например, высокие температуры и добавление определенных легирующих элементов) могут влиять на это разложение, поскольку они способствуют образованию графита.
Цементит твёрдый и хрупкий, что делает его пригодным для упрочнения сталей (существует специальная технология химико-термической обработки стали, которая называется цементацией). Механические свойства цементита зависят от его микроструктуры, а также от условий связи с ферритом.
Жидкий раствор Fe-C на диаграмме обозначается выше линии L (ликвидус). Поскольку δ-феррит плавится при 1538 °C, очевидно, что температура плавления железа снижается с увеличением содержания углерода.
Перлит
Зёрна перлита включают в себя структурные объединения, где все образовавшиеся пластины между собой параллельны. При возрастании числа перлитных конкреций рост размеров пластин приостанавливается, а сами они могут изменить направление своего движения. С уменьшением температуры колонии перлита превращаются в шаровидные мелкозернистые образования.
Ледебурит в сталях
Ледебурит - один из основных структурных компонентов железоуглеродистых сплавов и является эвтектическую смесью аустенита и цементита, которая образуется при 1145°C и ниже (для чистых железоуглеродистых сплавов). Аустенит превращается в ферритно-цементитную смесь при температурах ниже 723°C. В сталях ледебурит, состоящий из аустенита и карбидов, образуется только при очень высоком содержании компонентов сплава и углерода (0,7…1,0%); такие стали (называются ледебуритовыми сталями.
Метастабильная нелегированная эвтектика ледебурита Fe – Fe3C классифицируется как квазирегулярная. Доказано, что после зарождения Fe3C рост пластин цементита происходит быстро, в результате на стыках образуется аустенит, и возникает взаимосвязь ориентации. Fe3C и аустенит также растут совместно и образуют стержневую структуру, которая располагается перпендикулярно пластинам цементита. Эти два режима роста образуют квазирегулярную структуру, но рост по краю происходит быстрее, чем по бокам, и доминирует в структуре. Эксперименты по направленной кристаллизации показали, что рабочая точка на кривой роста квазирегулярной структуры близка к точке экстремума. Такую квазирегулярную структуру можно модифицировать закалкой, но модификация примесей пока не исследовалась.
Структурная подложка сталей ледебуритного класса имеет доэвтектические компоненты, включающие перлит, ледебурит и шаровидный графит. Легированный слой состоит из дендритов и междендритов. В чугуне с шаровидным графитом конкреции графита постепенно растворяются в ванне расплава, и в то же время под действием гидродинамических сил и сил текучести перемещаются к поверхности.

Фазы в системе “железо-углерод”
Фазы - это физически однородные состояния сплава. Фаза имеет точный химический состав - определенное расположение и связь между атомами. Такая структура атомов придает разные свойства различным фазам.
Некоторые специальные сплавы могут существовать в нескольких фазах, что достигается нагревом металла до определенных температур и использованием разных процедур термообработки.
Жидкая
Существует при температуре, которая превышает 1457 o C. Фазовое превращение при этой температуре означает полное плавление, поэтому на диаграмме жидкая фаза всегда обозначается линией L.
Феррит
На диаграмме присутствует в трёх разных фазах:
- Фаза дельта-феррита (δ-Fe) представляет собой твердый раствор C в δ-Fe (ОЦК) в высокотемпературной области диаграммы. Раствор стабилен при температуре выше 1400 °C и плавится при температуре выше 1539 °C. Структурно подобен α-ферриту;
- Фаза гамма-феррита (γ-Fe) является твёрдым раствором C в γ-Fe, который называют аустенитом. Нестабилен ниже температуры 910 °C, превращаясь в δ-феррит при 1395 ° C.. Максимальная растворимость углерода составляет около 2,1% при 1147 °C. Аустенит мягок и пластичен, не обладает магнитными свойствами;
- Фаза альфа-феррита (α-Fe) представляет собой твердый раствор C в α-Fe с ОЦК-решёткой. Считается самой стабильной формой железа при комнатной температуре. Максимальная растворимость углерода составляет около 0,02% при 727 °C. Мягче аустенита, магнитен.
Аустенит в сталях
Аустенит всегда присутствует в нержавеющих сталях, которые содержат от 16 до 26 процентов хрома и до 35 процентов никеля. Аустенитные стали, помимо высокой коррозионной стойкостью, не закаливаются при термической обработке и немагнитны.

Формы существования цементита важны для определения коррозионной стойкости сталей. Доказано, что цементит (Fe3C) увеличивает скорость коррозии, причём этот эффект более выражен, когда он образует когерентную сеть на поверхности. В нормализованных сталях цементит образует когерентную сетку, а в отпущенном мартенсите - нет. Поэтому цементит влияет на скорость коррозии нормализованной, но не закалённой стали.
В целом скорость коррозии углеродистой стали снижается с увеличением содержания хрома из-за образования защитного оксида хрома. Однако, когда хром соединяется с углеродом с образованием карбида хрома, положительный эффект хрома теряется.
Влияние микроструктуры различных низколегированных сталей, показанное на этой модели, распространяется только на условия, в которых не образуются защитные плёнки. Более того, образование карбидной сетки на поверхности нормализованной стали - процесс, зависящий от времени.
Узловые критические точки
Диаграмма «железо-углерод» с пояснениями позволяет облегчить изучение кинематики формирования различных микроструктур. Фазовые диаграммы помогают металлургам понять, какие фазы являются термодинамически стабильными, метастабильными или нестабильными. Пользуясь ими, можно выбрать соответствующие элементы для легирования стали. Фазовые диаграммы показывают нам также, как решать такие проблемы, как межкристаллитная коррозия, горячая коррозия, водородное повреждение и т.п.
Характерной точкой на диаграмме является точка эвтектики - место, где встречаются несколько фаз. На диаграмме «железо-углерод» эвтектическая точка находится там, где пересекаются линии A1, A3 и ACM. Образование этих точек случайно.

В этих точках происходят эвтектические реакции, при которых жидкая фаза затвердевает и превращается в смесь двух твердых фаз. Это происходит при охлаждении жидкого сплава эвтектического состава до его эвтектической температуры.
Сплавы, образующиеся на этом этапе, известны как эвтектические сплавы. Слева от этой точки сплавы называются заэвтектическими, а справа – заэвтектическими.
Значение линий диаграммы
Границы, пересекающиеся друг с другом, отмечают определенные области на диаграмме. Внутри каждой зоны может существовать отдельная фаза или две фазы. На границе происходит фазовый переход. Эти области являются фазовыми полями, они указывают фазы, присутствующие для определенного состава и температуры сплава.
На диаграмме имеется несколько характерных линий, обозначаемых как A1, A2, A3, A4 и ACM. При повышении или понижении температуры металла на этих границах происходит фазовый переход. Обычно при нагревании сплава его температура повышается, но вдоль этих линий нагрев приводит к перестройке структуры в другую фазу, и, таким образом, температура перестаёт расти до тех пор, пока фаза полностью не изменится. Этот процесс называется термической остановкой.
Элементы легированной стали - никель, марганец, хром, и молибден - влияют на положение этих границ на фазовой диаграмме. Границы могут сдвигаться в любом направлении в зависимости от используемого элемента. Например, на диаграмме состояния железа и углерода добавление никеля понижает границу A3, а добавление хрома увеличивает её.
Читайте также:
