Для получения металлов из их оксидов в промышленности
Обновлено: 25.04.2024
Большинство металлов содержится в природе в виде их оксидов или сульфидов, которые в результате обжига превращаются в оксиды. Металлургический процесс извлечения металлов из руд заключается в восстановлении их оксидов. В качестве восстановителей используют углерод, СО2, водород или металл.
В промышленности получение металлов из их оксидов восстановлением водородом находит применение в бездоменных процессах или для получения тугоплавких металлов. Применение водорода как в промышленности, так и в лаборатории сопряжено с большими трудностями, т.к. он образует с воздухом взрывоопасную смесь.
Цель работы: получить металл при восстановлении его оксида водородом и определить его практический выход.
Реактивы: цинк, соляная кислота (1:1), концентрированная серная кислота, порошки оксидов меди (II), железа (II), Pb, Sn.
Оборудование: аппарат Киппа, промывная склянка, осушительная колонка, кварцевая трубка, кварцевая лодочка, муфельная трубчатая печь.
Порядок выполнения работы: собирают установку по схеме на рисунке 3.
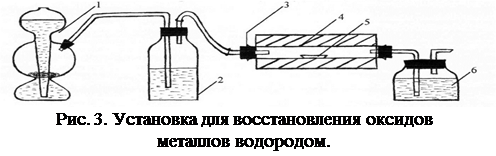
1 – аппарат Киппа; 2 – промывная склянка с концентрированной серной кислотой; 3 – кварцевая трубка;
4 – муфельная трубчатая печь; 5 – лодочка с оксидом металла; 6 – промывная склянка
Выполнение этой работы требует особых мер предосторожности:
1) установку продуть газом-восстановителем до полного вытеснения воздуха и проверить газ на чистоту. Категорически запрещается проводить эти операции при повышенной температуре;
2) после окончания работы, водород подавать до ее охлаждения.
Оксид металла восстанавливается в кварцевой лодочке, помещенной в кварцевую трубку диаметром 15 мм, которая расположена в трубчатой электропечи, температура в которой регулируется автоматическим терморегулятором.
Водород получают электролизом или в аппарате Киппа. Прибор подсоединяют к аппарату Киппа через промывную склянку с концентрированной серной кислотой. Навеску оксида металла массой 1,5-2 г, взвешенную с точностью до 0,01 г, насыпают в кварцевую лодочку и помещают ее посредине кварцевой трубки. Закрывают трубку и начинают пропускать в течение 10-15 минут водород для вытеснения воздуха из системы. Проверяют газ на чистоту и установку на герметичность, надевая на выход промывной склянки резиновую трубку с зажимом. При полной герметичности прибора ток кислорода вскоре должен прекратиться.
Если весь воздух вытеснен, то электропечь включают и нагревают трубку в токе водорода, пропуская его со скоростью 1-2 пузырька в секунду. Появление влаги в газоотводной трубке, а также уменьшение или полное прекращение прохождения пузырьков водорода через промывную склянку на выходе из установки показывает, что реакция началась. Об окончании реакции можно судить о приблизительно одинаковом количестве пузырьков водорода, проходящих через промывные склянки до реактора и после него.
После окончания реакции печь отключают и отодвигают, а водород продолжают пропускать через установку до ее полного охлаждения. Если водород отсоединить при нагретом реакторе, то воздух с оставшимся в реакторе водородом образует взрывоопасную смесь, а восстановленный металл с кислородом воздуха - оксид металла. После полного охлаждения установки отсоединяют газоподводящую трубку и вынимают лодочку с металлом.
Оформление результатов работы.
1. Напишите уравнение реакции восстановления оксида металла.
2. Приведите необходимые расчеты.
3. Результаты работы оформите в виде таблицы.
| Оксид металла | m, г | Восстановленный металл | m, г | Выход, % |
Вопросы семинара по теме: "Получение металлов"
1. Сырье металлургической промышленности: руды, кокс, флюсы.
2. Подготовка сырья к доменной плавке.
3. Методы получения металлов из руд.
4. Теоретические основы доменного процесса.
5. Устройство домны и каупера.
6. Методы преобразования чугуна в сталь: мартеновский и конверторные способы.
7. Кислородно-конверторный способ выплавки стали и получение стали в электропечах.
Водород: химия водорода и его соединений
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1sАтом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
вода H2O и др. летучие водородные соединения (HCl, HBr)
кислые соли (NaHCO3 и др.)
основания NaOH, Cu(OH)2
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Тестовое задание на тему" Как получают металлы?"
4. Наиболее важный минерал, содержащий около 7% лития,- это сподумен Li 2 O Al 2 O 3 4 SiO 2 . Последней стадией производства лития является электролиз его хлорида. Превращение сподумена в LiCl протекает через ряд стадий. Представьте в виде схемы реакций каждую из стадий.
Стадия процесса Схема реакций
(1) Обработка раздробленного минерала серной кислотой …
(2) Выщелачивание сульфата лития водой и осаждение карбоната …
(3) Превращение карбоната в хлорид .
(4) Электролитическое разложение расплава LiCl (в смеси с KCl ) .
5. Какой металл нельзя получить в чистом виде из его оксида восстановлением водородом:
(1) вольфрам; (3) кальций;
(2) железо; (4) молибден ?.
6. Для получения металлов из их оксидов в промышленности в качестве восстановителей используют ……
7. Для получения металлов калия нельзя использовать метод, который заключается:
(1) в вытеснении калия из расплавленного KCI ;
(2) в электролизе расплава KCI – NaCl с получением натрий – калиевого сплава и выделении калия перегонкой;
(3) в восстановлении KCI при нагревании в вакууме алюминием;
(4) в электролизе расплава хлорида калия.
8. При электролизе расплава хлорида натрия массой 234 г образуется металлический натрий массой (г):
9. Природными минералами являются: боксит, куприт, гипс, доломит, пирит. Магний можно получать из… .
10.Магний высокой степени чистоты в промышленности получают электролитическим разложением:
(1) расплава М g ( OH )2;
(2) морской воды, содержащий М g 2 + ;
(3) расплава М gCl 2 ;
(4) расплава доломита.
11.Магний – второй по содержанию металлический элемент в морской воде. Выделение его из морской воды включает несколько процессов, каждый из которых может быть представлен соответствующей схемой реакций.
Процесс Схема
(1) Осаждение М g 2+ в виде гидроксида негашеной известью …
(2) Обработка отделенного осадка смесью растворов HCl и H 2 SO 4 …
(3) Отделение полученного раствора хлорида магния от примеси Са 2+ , …
осажденной в виде сульфата
(4) Упаривание раствора хлорида магния и электролиз его расплава …
12. При электролизе расплава хлорида кальция выделяются: на катоде … , на аноде…
13.При электролизе раствора гидроксида калия с использованием угольных электродов на аноде получено 500 см 3 газа. Какое вещество и в каком количестве выделится на катоде:
(1) калий, 0,87 г; (3) водород, 500 см 3 ;
(2) калий, 1,75 г; (4) водород, 1000 см 3 ?
14.При производстве алюминия электролизу подвергают расплав:
(1) боксита ( Al 2 O 3 H 2 O ) ;
(2) глинозема ( Al 2 O 3 );
(3) криолита ( Na 3 AIF 6 );
(4) AI 2 O 3 в криолите.
15. Ниже приведены названия и состав алюминиевых руд. Каковы будут составы этих руд в виде химических формул?
Название руды Массовая доля, % Химическая формула
(1) Гидаргиллит 65 , 3 34, 7 …
(2) Диаспор 85, 0 15, 0 …
16. Подвергая электролизу 1т AI 2 O 3 , можно получить металлический алюминий массой ( кг):
(1) 265; (3) 795;
(2) 530; (4) 1000.
17. Для выплавки алюминия в электропечах используют криолит. Искусственный криолит можно получить, смесь, содержащую 1 моль AI ( OH )3 и 3 моль NaOH ,обработать плавиковой кислотой. Уравнение этой реакции…
18. Наиболее распространенными минералами, содержащими цинк, являются галмей ( химическая формула … ) и цинковая обманка ( формула … ).Получение цинка из этих минералов описывается уравнениями химических реакций ….
19. Медь получают из минерала малахита по реакциям … и …
20. Одним из способов получения меди из руды, содержащей медь в виде сульфида меди ( I ), является следующий. Руду первоначально обжигают в токе воздуха, при этом происходит реакция … Затем обожженную руду смешивают с вдвое меньшим количеством необожженной руды, и полученную смесь прокаливают без доступа воздуха. Уравнение реакции процесса….
21. Для получения меди используют руду, содержащую минерал халькопирит С uFeS 2 . Какую массу (г) металлической меди можно получить из 1 кг этого минерала, полагая, что пирометаллургический процесс протекает со 100% выходом:
(1) 173; (3) 519;
(2) 346; (4) 692?
Пирометаллургический процесс получения меди можно выразить суммарной реакцией …
22. С помощью электролиза можно проводить очистку металлов. Какой анод надо использовать при получении электрический чистой меди, подвергая электролизу хлорид меди ( II ):
(1) Pt ; (3) Ni ;
(2) C ; (4) Cu .
23. При полном восстановлении порошка оксида меди ( II ) массой 79. 5 г водородом образовалась металлическая медь массой (г):
(1) 32, 75; (3) 63, 5;
(2) 39, 75; (4) С u ?
24. Какова массовая доля металлов в смеси после термического восстановления смеси оксида меди ( II ) и оксида железа ( III ) массой 31, 9 г, если в результате образовалось 9 г воды:
(1) 22 % Cu и 78 % Fe ;
(2) 11 % Cu и 88 % Fe ;
(3) 50 % Cu и 50 % Fe ;
(4) 75% Cu и 25 % Fe ?
25. При электролиза раствора сульфата меди на инертных электродах выделяются:
(1) С u, SO2; (3) С u, H2;
1.Каков основной состав, выраженный в виде химических формул, представленных ниже железных руд?
Руда Формула
(1) Лимонит …
(2) Гематит …
(3) Магнетит …
(4) Сидерит …
2.Из какой руды выгоднее добывать железо:
(1) гематита; (3) лимонита;
(2) магнетита; (4) сидерита?
3.Какая масса (кг) красного железняка, содержащего оксид железа ( III ) (массовая доля 78%, остальное – посторонние примеси), потребуется для получения 1 т сплава с массовой долей железа 95%:
(1) 950; (3) 1600;
(2) 1357; (4) 1740?
4.Железо из руд получают восстановлением его оксидов коксом и оксидом углерода ( II ) доменных печах. При этом образуется чугун, который, помимо железа, содержит в качестве примесей .
5, Химизм восстановления железа в доменном процессе из оксида железа ( III ) можно представить в виде четырех основных стадий, которым соответствуют следующие уравнения реакций:
Стадия процесса Уравнения реакций
(1) Образование оксида железа ( II , III ) …
(2) Восстановление до оксида железа ( II ) …
(3) Восстановление до металлического …
железа оксидом углерода
(4) Восстановление до металлического …
железа коксом
6. При восстановлении железа из руды частично могут восстанавливаться примеси, содержащиеся в руде. Закончите уравнения реакции восстановления следующих веществ:
(1) SiO + C 2 . . .;
(2) MnO + C . . . ;
(3) Ca 3 ( PO 4 )2 + C . . . .
7. В качестве примеси обычно в исходной руде присутствует сера в виде соединений
CaSO 4 или FeS 2 . Сера в процессе восстановления железа превращается :
(1) в SO2; (3) в CS2;
(2) в H2S; (4) в FeS .
8. Выходящий из домны газ называется колошниковым или доменным. Колошниковый газ имеет следующий состав в объёмных долях (%) : CO -
32,2; CO 2 -14,0; N 2 -54,0. Сколько кубических метров воздуха потребуется для
сжигания 1 м 3 этого газа :
(1) 0 ,16; (3) 0,8;
(2) 0,32; (4) 1,6;
9. В бессемеровском способе получения стали окислителями являются . . . , восстановителями – . . . .
10. При получении стали в мартеновском производстве «выгорание» примесей из чугуна происходит за счет окисления кремния оксидом железа ( II ) по реакции . . . .
11. В томасовских конвертах при переработке высокофосворитых чугунов фосфор выводится в шлак. С этой целью в шихту конвертера добаляют жженую известь . . . Удаление фосфора отражается уравнением реакции . . . .
12. В мягкой стали (ковкое железо) массовая доля ( % ) углерода составляет:
(1) 4 – 4,5; (3) от 0,3 до 1,7;
(2) около 1,7; (4) до 0,3.
13. При производстве чугуна в доменной печи на каждую 1000 т руды расходуется около 180 т известняка. Поскольку при этом образуется примерно 350 т шлака, массовая доля (%) примеси в руде составит:
(1) 10; (3) 25;
(2) 18; (4) 35.
14. Одним из способов получения чистейших металлов является синтез карбонилов металлов с их последующим разложением. Эти процессы в случае очистки железа выражается в виде схемы:
Fe + … => … => Fe + … .
щенное) щенное)
15. В порошковой металлургии порошок железа получают разложением пентакарбонила железа. Для получения 2 кг порошкообразного железа требуется пентакарбонила железа массой (кг) :
(1) 7; (3) 5;
(2) 3; (4) 1;
16. Метод алюмотермии, заключающийся в восстановлении металлов из их оксидов при поджигании смеси этих оксидов п с порошком алюминия, открыл в конце прошлого столетия известный русский химик….
17. Алюмотермией получают металлический:
(1) Mg ; (3) Cr ;
18. Какие вещества необходимо взять для получения хрома алюмотермическим способом:
19. Для получения 39 г хрома алюмотермическим способом из его оксида необходимо взять навеску алюминия массой (г) :
(1) 10, 125; (3) 27;
(2) 20, 25; (4) 40,5.
20. Наиболее распространенной рудой для получения хрома служит … формула которого …
21. Массовая доля (%) хрома в феррохроме, полученном восстановлением хромого железняка, составляет:
(1) 96; (3) 48;
(2) 65; (4) 32.
22. Одним из промышленных способов производства металлического кальция является прокаливание оксида кальция с металлическим алюминием в глубоком вакууме. На получение 100 кг кальция таким способом теоретически должно расходоваться алюминия ( кг):
(1) 135; (3) 45;
(2) 67, 5; (4) 22, 5.
23. В природе встречается минерал эритрин CO 3 ( AsO 4 )2 8 H 2 O – продукт выветривания кобальтина ( кобальтового блеска CoAsS ) и арсенидов кобальта и никеля. Из этой руды получают кобальт. Для производства 1 кг кобальта надо переработать …. кг этой руды ( потерями в производстве можно пренебречь).
24. При восстановлении 1, 82 г оксида ванадия металлическим кальцием получено 1, 02 г чистого ванадия. Формула оксида ванадия … , а уравнение реакции восстановления …
25. Какой метод получения металлов ( или их очистки0 не может применяться для получения металлов очень высокой степени чистоты:
(1) Зонная плавка металлов;
(2) Переплавка металлов в вакууме;
(3) Разложение летучих соединений металлов;
(4) Электрическое восстановление металлов?
Ключи к тестовому заданию на тему: « Что ты знаешь о получении важнейших химических продуктов»
1. (1) –г; (2) – б; (3) – а; (4) – в.
6, AI , C , CO , H 2 .
7. (3). Согласно ряду напряжений алюминий находится значительно правее
калия , а следовательно не может восстанавливать его из расплава соли.
9. 2( MgO • CaO ) + Si = Ca2SiO4 + 2Mg.
10 . (3). MgCI2 ––––––––→ Mg + CI↑
11. (1) Mg 2+ + CaO + H2O ––→ Mg (OH)2 ↓ + Ca 2+
(4 ) MgCI 2 ––––––––→ Mg + CI 2
4. Применение металлов и их сплавов
О том, что свойства металлов меняются при их сплавлении, стало известно ещё в древности. \(5\) тысяч лет тому назад наши предки научились делать бронзу — сплав олова с медью. Бронза по твёрдости превосходит оба металла, входящие в её состав.
Свойства чистых металлов, как правило, не соответствуют необходимым требованиям, поэтому практически во всех сферах человеческой деятельности используют не чистые металлы, а их сплавы.
Сплав — это материал, который образуется в результате затвердения расплава двух или нескольких отдельных веществ.
В состав сплавов кроме металлов могут входить также неметаллы, например, такие как углерод или кремний.
Добавляя в определённом количестве примеси других металлов и неметаллов, можно получить многие тысячи материалов с самыми разнообразными свойствами, в том числе и такими, каких нет ни у одного из составляющих сплав элементов.
- механически прочнее и твёрже,
- со значительно более высокой или низкой температурой плавления,
- устойчивее к коррозии,
- устойчивее к высоким температурам,
- практически не менять своих размеров при нагревании или охлаждении и т. д.
Например, чистое железо — сравнительно мягкий металл. При добавлении в железо углерода твёрдость его существенно возрастает. По количеству углерода, а следовательно, и по твёрдости, различают сталь (содержание углерода менее \(2\) % по массе), чугун (\(С\) — более \(2\) % ). Но не только углерод изменяет свойства стали. Добавленный в сталь хром делает её нержавеющей, вольфрам делает сталь намного более твёрдой, добавка марганца делает сплав износостойким, а ванадия — прочным.
Сплавы, используемые для изготовления различных конструкций, должны быть прочными и легко обрабатываемыми.
Такие сплавы железа, как стали, отличаются высокой прочностью и твёрдостью. Их можно ковать, прессовать, сваривать.
Чугуны используют для изготовления массивных и очень прочных деталей. Например, раньше из чугуна отливали радиаторы центрального отопления, канализационные трубы, до сих пор изготавливают котлы, перила и опоры мостов. Изделия из чугуна изготавливаются с применением литья.
Сплавы алюминия, используемые в конструкциях, наряду с прочностью должны отличаться лёгкостью. Дюралюминий, силумин — сплавы алюминия, они незаменимы в самолёто-, вагоно- и кораблестроении.
Для улучшения ударопрочности, коррозионной стойкости, износоустойчивости сплавы легируют — вводят специальные добавки. Добавка марганца делает сталь ударопрочной. Чтобы получить нержавеющую сталь, в состав сплава вводят хром.
Инструментальные сплавы предназначены для изготовления режущих инструментов, штампов и деталей точных механизмов. Такие сплавы должны быть износостойкими и прочными, причём при разогревании их прочность не должна существенно уменьшаться. Таким требованиям отвечают, например, нержавеющие стали, которые прошли специальную обработку (закалку).
Для придания необходимых свойств инструментальные стали, как правило, легируют вольфрамом, ванадием или хромом.
Сплавы служат незаменимым материалом при изготовлении особо чувствительных и высокоточных приборов, различного рода датчиков и преобразователей энергии.
Например, на изготовление сердечников трансформаторов и деталей реле идёт сплав никеля. Отдельные детали электромоторов изготавливаются из сплавов кобальта.
Сплав никеля с хромом — нихром, отличающийся высоким сопротивлением — используется для изготовления нагревательных элементов печей и бытовых электроприборов.
Из сплавов меди в электротехнической промышленности и в приборостроении наиболее широкое применение находят латуни и бронзы.
Латуни незаменимы при изготовлении приборов, деталью которых являются запорные краны. Такие приборы используются в сетях подачи газа и воды.
Главным востребованным свойством легкоплавких сплавов является заданная низкая температура плавления. Это свойство, в частности, используется для пайки микросхем. Кроме того, эти сплавы должны иметь определённую плотность, прочность на разрыв, химическую инертность, теплопроводность.
Легкоплавкие сплавы производят из висмута, свинца, кадмия, олова и других металлов. Такие сплавы используют в термодатчиках, термометрах, пожарной сигнализации, например, сплав Вуда. А также в литейном деле для производства выплавляемых моделей, для фиксации костей и протезирования в медицине.
Сплав натрия с калием (температура плавления \(–\)\(12,5\) °С) используется как теплоноситель для охлаждения ядерных реакторов.
 |  |
| Рис. \(7\). Припой (сплав для паяния) имеет невысокую температуру плавления | Рис. \(8\). Легкоплавкие сплавы незаменимы в датчиках пожарной сигнализации |
Применение в чистом виде драгоценных металлов в ювелирном деле не всегда оправдано и целесообразно из-за их дороговизны, физических и химических особенностей.
Для придания ювелирным изделиям из золота большей твёрдости и износостойкости используются сплавы с другими металлами.
Самая лучшая добавка — это серебро (понижает температуру плавления) и медь (повышает твёрдость). Чистое золото используют очень редко, так как оно слишком мягкое, легко деформируется и царапается.
Из сплавов золота с \(10–30\) % других благородных металлов (платины или палладия) изготавливают форсунки лабораторных приборов, а из сплава с \(25–30\) % серебра — ювелирные изделия и электрические контакты.

Оловянная бронза (сплав меди с оловом) — один из первых освоенных человеком сплавов металлов. Она обладает большей, по сравнению с чистой медью, твёрдостью, прочностью и более легкоплавка. Бронзы успешно применяют для получения сложных по конфигурации отливок, включая художественное литьё. Классической маркой бронзы является колокольная бронза.
Одно из новых направлений в искусстве — производство художественных литых изделий из чугуна. Литые изделия из чугуна существенно превосходят по качеству кованые изделия.
Чугун — металл гораздо более хрупкий и не такой ковкий, как сталь. Но даже из такого, казалось бы, грубого материала можно получать настоящие произведения литейного искусства способом литья, например, такие как литые лестницы или решётки на окна. Такие изделия подвержены лишь поверхностной коррозии и не требуют тщательного ухода.
Читайте также:
