Электрохимические процессы коррозия металлов
Обновлено: 17.05.2024
Важнейшими конструкционными материалами являются металлы и их сплавы. В процессе хранения и эксплуатации металлических конструкций происходит их взаимодействие с окружающей и рабочей средами, в результате чего они подвергаются коррозии.
Коррозией металлов называют самопроизвольное разрушение металлических конструкций вследствие их химического или электрохимического взаимодействия с коррозионной средой. Коррозионной может быть как окружающая среда, так и рабочая, в которой находится металл.
Коррозионный процесс протекает на границе двух фаз: металл – коррозионная среда, т.е. является гетерогенным процессом. Коррозия металлов наносит огромный ущерб практически любой отрасли промышленности.
Потери от коррозии можно разделить на две группы: прямые и косвенные.
Прямые потери складываются в основном из потерь непосредственно самого металла вследствие коррозии. Косвенные потери огромны и обусловлены расходами, связанными с отказом в работе оборудования, его простоем, стоимостью ремонта и замены деталей оборудования и т.п.
В разделе «коррозия металлов» изучаются две связанные между собой проблемы:
1) механизмы взаимодействия металлов с окружающей средой и общих закономерностей процессов коррозии;
2) методы защиты металлов от коррозионного разрушения.
1. Общая характеристика и классификация
коррозионных процессов
Металлы, являясь восстановителями, легко отдают валентные электроны, образуя положительно заряженные ионы. Восстановительные свойства металлов различны и определяются их стандартными электродными потенциалами. В табл. 1 приведены стандартные электродные потенциалы металлов и их классификация по активности.
Ряд стандартных электродных потенциалов металлов (В)
и классификация металлов по активности
| Активные | Средней активности | Неактивные | |||
| Li + /Li | -3,04 | Mn 2+ /Mn | -1,18 | Cu 2+ /Cu | +0,34 |
| K + /K | -2,92 | Zn 2+ /Zn | -0,76 | Ag+/Ag | +0,80 |
| Ca 2+ /Ca | -2,87 | Cr 3+ /Cr | -0,74 | Pt 2+ /Pt | +1,20 |
| Na + / Na | -2,71 | Fe 2+ /Fe | -0,44 | Au 3+ /Au | +1,50 |
| Mg 2+ /Mg | -2,38 | Ni 2+ /Ni | -0,25 | ||
| Al 3+ /Al | -1,66 | Sn 2+ /Sn | -0,14 | ||
| Pb 2+ /Pb | -0,13 | ||||
| H + / 1/2H2 | 0,00 |
По своей химической активности и положению в ряду стандартных потенциалов металлы делятся на три группы:
1) активные – от Li до Al включительно – вытесняют водород из воды и растворов кислот;
2) средней активности – от Mn до Pb включительно – вытесняют водород из растворов кислот;
3) неактивные – стоящие в ряду после водорода – не вытесняют водород из растворов кислот.
Основной причиной, вызывающей коррозионное разрушение металлов и сплавов, является протекание на их поверхности электрохимических или химических реакций.
В зависимости от механизма протекания все коррозионные процессы делят на два вида – химические и электрохимические.
Химической коррозией называют процессы, протекающие при непосредственном химическом взаимодействии между металлом и коррозионной средой и не сопровождающиеся возникновением электрического тока.
Электрохимической коррозией называют процессы взаимодействия металлов с водными растворами электролитов, сопровождаю-
щиеся возникновением в системе электрического тока в результате пространственного разделения процессов окисления и восстанов-
ления.
При химической коррозии ее продукты образуются непосредственно на участках поверхности, где происходит разрушение металла. Однако следует учитывать, что такое деление коррозионных процессов несколько условно, так как механизм коррозии может изменяться. Например, электрохимическая коррозия железа в парах воды при повышении температуры переходит в химическую, а в жидкости, являющейся неэлектролитом, химическая коррозия в присутствии влаги переходит в электрохимическую.
По условиям протекания коррозии различают несколько видов коррозии [1]:
1) газовую – коррозию в газах при высоких температурах;
2) атмосферную – коррозию в атмосфере воздуха или влажного газа;
3) жидкостную – коррозию в жидкой среде (в растворах неэлектролитов и электролитов);
4) подземную – коррозию в почвах и грунтах;
5) биокоррозию – коррозию под влиянием жизнедеятельности микроорганизмов;
6) структурную – коррозию, связанную со структурной неоднородностью металла;
7) коррозию блуждающими токами;
8) контактную – электрохимическую коррозию, вызванную контактом металлов, имеющих разные электродные потенциалы в данном электролите;
9) щелевую – коррозию в щелях и зазорах между металлами;
10) коррозию под напряжением – коррозию при одновременном воздействии коррозионной среды и механических напряжений;
11) коррозионную кавитацию – разрушение металла, вызванное одновременным коррозионным и ударным воздействием внешней среды.
По характеру коррозионных разрушений различают следующие виды коррозии:
1) сплошную,или общую, коррозию, охватывающую всю поверхность металла, находящуюся под воздействием коррозионной среды. Она бывает равномерной, неравномерной, избирательной;
2) местную, охватывающую отдельные участки металла. Она бывает точечной (питтинг), сквозной, язвенной и др.
Химическая коррозия
Как отмечалось выше, химической коррозией называется процесс разрушения металлов и сплавов вследствие взаимодействия их с внешней средой, который не сопровождается возникновением электрических токов. По условиям протекания процесса различаются следующие виды химической коррозии:
1) газовая коррозия – коррозия металлов, вызываемая действием паров и газов при высоких температурах при условии, что на поверхности металла не конденсируется пленка жидкости, проводящая электрический ток;
2) жидкостная коррозия – коррозия металлов в жидкостях, не проводящих электрический ток.
Газовая коррозия
Газовая коррозия наиболее часто встречается в процессе эксплуатации металлов. Газовой коррозии подвергаются металлические изделия, детали и аппараты, работающие при повышенных температурах в условиях воздействия агрессивных газов. Это процессы окисления арматуры печей, деталей двигателей внутреннего сгорания, металлов при горячей прокатке, отжиге, закалке и др. Наиболее агрессивными по отношению к большинству металлов являются газы, содержащие серу (H2S, SO2), а также галогены и их соединения (Cl2, F2, I2, Br2, HCl, HF). Кислород также считают агрессивным газом, поскольку известно, что многие металлы при соприкосновении с воздухом образуют на поверхности оксидные соединения, являющиеся продуктами коррозии. Поскольку именно оксиды металлов чаще всего и являются продуктами газовой коррозии, рассмотрим этот вид коррозии на их примере.
Виды оксидных пленок и законы их роста. Даже при комнатной температуре на поверхности многих металлов на воздухе образуется тончайший слой оксидов. Образовавшаяся оксидная пленка может защищать металл от дальнейшего окисления. Чтобы пленка имела защитные свойства, она должна быть сплошной, хорошо сцепленной с основным металлом и иметь близкий к нему коэффициент теплового расширения, а также не должна разрушаться в агрессивной среде.
Толщина пленок, образующихся при взаимодействии металлов с сухим воздухом или другими окислителями, зависит от природы металла, характера среды, температуры и других факторов. По толщине пленки можно разделить на следующие три группы:
1) тонкие, невидимые (толщина менее 40 нм);
2) средней толщины, дающие цвета побежалости (толщина 40…500 нм);
3) толстые, видимые (толщина более 500 нм).
Основным условием предотвращения дальнейшего окисления металла, покрытого оксидной пленкой, является ее беспористость и сплошность. Возможность образования сплошной пленки определяется соотношением объемов образованного оксида и окисленного металла. Условие сплошности пленок было сформулировано Пиллингом и Бэдвордсом и заключается в следующем: если объем химического соединения (например, оксида Vок) меньше, чем объем металла (VМе), образующего это соединение, можно ожидать получения несплошной, пористой пленки, обладающей слабыми защитными свойствами.
При обратном соотношении Vок и VМе можно ожидать образования сплошных пленок, способных защищать металл от коррозии. То есть, если Vок / VМе < 1, пленка не будет сплошной, а если
Vок / VМе > 1, она может быть сплошной.
Величину Vок / VМе > 1 имеют многие металлы: Al, Sn,Ti, Zn, Ni, Cr, Fe и др. Их оксидные пленки тормозят дальнейшее окисление металла. Однако в ряде случаев могут быть отклонения от этой закономерности. Например, в реальных условиях в пленке в процессе ее роста могут возникать разрушающие ее напряжения. Могут также иметь место недостаточная пластичность пленки, летучесть оксидов и т.д.
В зависимости от природы металла рост пленок подчиняется различным закономерностям (рис. 1).
y = Kt,
где y – толщина пленок; t – время окисления; К – постоянная.
Рис. 1. Графики, иллюстрирующие законы окисления металлов
Если пленка обладает защитными свойствами, то по мере ее роста скорость окисления уменьшается. Чем более высокими защитными свойствами обладает пленка, тем меньше скорость диффузии окислителя через нее и меньше скорость ее роста. Возможна параболическая зависимость:
y 2 = Kt.
В некоторых случаях рост пленок идет с сильным затуханием по логарифмической зависимости:
y = ln(Kt).
Пленки, растущие по этому закону, обладают лучшими защитными свойствами, например для меди, никеля и железа в соответствующем интервале температур.
Влияние различных факторов на скорость газовой коррозии. Скорость и характер процесса химической коррозии зависят от многих факторов. Внешними называют факторы, связанные с составом коррозионной среды и условиями коррозии (температура, давление, скорость движения среды и др.), внутренними – факторы, связанные с составом и структурой металла, внутренними напряжениями в металле, характером обработки поверхности и др.
Температура значительно влияет на скорость коррозии: с ее повышением процессы окисления металлов протекают значительно быстрее. С изменением температуры может изменяться даже состав оксидных пленок. Колебания температур, особенно переменные нагрев и охлаждение, увеличивают скорость окисления металлов, так как в оксидной пленке образуются трещины и она может отслаиваться от металла (например, для железа и сталей).
Состав газовой среды очень сильно влияет на скорость окисления наиболее важных конструкционных материалов – железа и стали. Особенно сильно влияние кислорода, соединений серы и водяных паров. Насыщение воздуха парами воды увеличивает скорость коррозии стали в два-три раза. При увеличении скорости движения газовой среды скорость окисления металлов сначала быстро возрастает и в дальнейшем практически не изменяется.
Защитные свойства образующейся пленки продуктов коррозии и, следовательно, коррозионная стойкость металлов находятся в зависимости от ее состава. Что касается сплавов на основе железа, то можно отметить следующие закономерности.
Сера, фосфор, никель и марганец не влияют на окисление железа. Титан, медь, кобальт и бериллий заметно замедляют окисление железа, что связано с повышением защитных свойств образующейся окалины. Хром, алюминий и кремний сильно замедляют окисление железа из-за образования высокозащитных оксидных пленок. Поэтому эти элементы широко применяют для легирования стали. Характер обработки поверхности металла также влияет на скорость газовой коррозии. Чем тщательнее обработана поверхность стали, тем меньше скорость ее окисления. Это обусловлено в основном худшей сохранностью защитных пленок на неровных поверхностях.
Существуют также и особые случаи газовой коррозии металлов, когда агрессивными газами являются не кислород, а оксиды азота, сернистые соединения, хлор, хлористый водород, а также водород и гелий [2].
Для многих металлов характерна карбонильная коррозия за счет их взаимодействия в особых условиях с оксидом углерода (II) с образованием легко возгоняющихся веществ – карбонилов:
Me + nCO = Me(CO)n.
Жидкостная коррозия
Химическая коррозия наблюдается не только в сухих газах, но и в некоторых жидких средах, например в неэлектролитах и жидких металлах. К неэлектролитам, т.е. к жидкостям, не проводящим электрический ток, относятся, например, жидкий бром, расплавленная сера, а также многие органические вещества, в частности органические растворители (бензол, четыреххлористый углерод, хлороформ и др.), жидкое топливо (нефть, керосин, бензин и др.), смазочные масла.
Суммарный процесс химической коррозии в неэлектролитах можно разделить на ряд стадий, каждая из которых определяет скорость процесса:
1) диффузия реагента (окислителя) к поверхности металла;
2) адсорбция реагирующих частиц на металле;
3) химическая реакция реагента с металлом;
4) десорбция продуктов реакции с поверхности металла;
5) диффузия продуктов реакции от металла в объем неэлектролитов.
Электрохимическая коррозия
Как уже отмечалось, электрохимическая коррозия металлов представляет собой самопроизвольное разрушение металлов вследствие их электрохимического взаимодействия с коррозионной средой, проводящей электрический ток, т.е. с электролитом.
Этот тип коррозии более широко распространен, чем химическая коррозия. Он имеет место при взаимодействии металлов с жидкими электролитами (водой, водными растворами солей, кислот и щелочей и т.д.). Примерами такого вида коррозии являются ржавление различных металлических изделий и конструкций в атмосфере (оборудование заводов, стальных мостов, каркасов зданий, транспортных средств и др.), ржавление стальных трубопроводов в земле, коррозия обшивки судов в речной и морской воде, разрушение баков и аппаратов растворами солей, кислот и щелочей на химических и других заводах и т.п.
Электрохимическая коррозия
Электрохимическая коррозия - самый распространенный вид коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии.
К электрохимической коррозии относятся такие виды местных разрушений, как питтинги, межкристаллитная коррозия, щелевая. Кроме того процессы электрохимической коррозии происходят в грунте, атмосфере, море.
Механизм электрохимической коррозии может протекать по двум вариантам:
1) Гомогенный механизм электрохимической коррозии:
- поверхностный слой мет. рассматривается как гомогенный и однородный;
- причиной растворения металла является термодинамическая возможность протекания катодного или же анодного актов;
- К и А участки мигрируют по поверхности во времени;
- скорость протекания электрохимической коррозии зависит от кинетического фактора (времени);
- однородную поверхность можно рассматривать как предельный случай, который может быть реализован и в жидких металлах.
2) Гетерогенный механизм электрохимической коррозии:
- у твердых металлов поверхность негомогенная, т.к. разные атомы занимают в сплаве различные положения в кристаллической решетке;
- гетерогенность наблюдается при наличии в сплаве инородных включений.
Электрохимическая коррозия имеет некоторые особенности: делится на два одновременно протекающих процесса (катодный и анодный), которые кинетически зависимы друг от друга; на некоторых участках поверхности электрохимическая коррозия может принять локальный характер; растворение основного мет. происходит именно на анодах.
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют электрохимическому его разрушению.
Причины возникновения местных гальванических элементов могут быть самые разные:
1) неоднородность сплава
- неоднородность мет. фазы, обусловленная неоднородностью сплава и наличием микро- и макровключений;
- неравномерность окисных пленок на поверхности за счет наличия макро- и микропор, а также неравномерного образования вторичных продуктов коррозии;
- наличие на поверхности границ зерен кристаллов, выхода дислокации на поверхность, анизотропность кристаллов.
2) неоднородность среды
- область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию.
3) неоднородность физических условий
- облучение (облученный участок - анод);
- воздействие внешних токов (место входа блуждающего тока - катод, место выхода - анод);
- температура (по отношению к холодным участкам, нагретые являются анодами) и т. д.
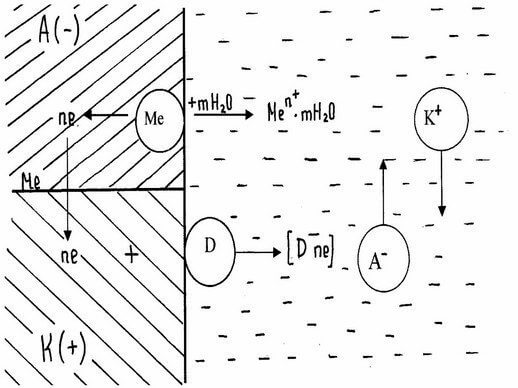
При работе гальванического элемента одновременно протекает два электродных процесса:
Анодный - ионы металла переходят в раствор
Происходит реакция окисления.
Катодный - избыточные электроны ассимилируются молекулами или атомами электролита, которые при этом восстанавливаются. На катоде проходит реакция восстановления.
O2 + 2H2O + 4e → 4OH - (кислородная деполяризация в нейтральных, щелочных средах)
O2 + 4H + + 4e → 2H2O (кислородная деполяризация в кислых средах)
2 H + + 2e → H2 (при водородной деполяризации).
Торможение анодного процесса приводит к торможению и катодного.
При соприкосновении двух электропроводящих фаз (например, мет. - среда), когда одна из них заряжена положительно, а другая отрицательно, между ними возникает разность потенциала. Это явление связано с возникновением двойного электрического слоя (ДЭС). Заряженные частицы располагаются несимметрично на границе раздела фаз.
Скачек потенциалов в процессе электрохимической коррозии может происходить из-за двух причин:
При достаточно большой энергии гидратации ионы металла могут отрываться и переходить в раствор, оставляя на поверхности эквивалентное число электронов, которые определяют ее отрицательный заряд. Отрицательно заряженная поверхность притягивает к себе катионы мет. из раствора. Так на границе раздела фаз возникает двойной электрический слой.
На поверхности металла разряжаются катионы электролита. Это приводит к тому, что поверхность мет. приобретает положительный заряд, который с анионами раствора образует двойной электрический слой.
Иногда возникает ситуация, когда поверхность не заряжена и, соответственно, отсутствует ДЭС. Потенциал, при котором это явление наблюдается называется потенциалом нулевого заряда (φN). У каждого металла потенциал нулевого заряда свой.
Величина электродных потенциалов оказывает очень большое влияние на характер коррозионного процесса.
Скачок потенциала между двух фаз не может быть измерен, но при помощи компенсационного метода можно измерить электродвижущую силу элемента (ЭДС), который состоит из электрода сравнения (его потенциал условно принят за ноль) и исследуемого электрода. В качестве электрода сравнения берется стандартный водородный электрод. ЭДС гальванического элемента (стандартный водородный электрод и исследуемый элемент) называют электродным потенциалом. Электродами сравнения могут также выступать хлорсеребряный, каломельный, насыщенный медно-сульфатный.
Международной конвенцией в Стокгольме 1953г. решено при записях электрод сравнения всегда ставить слева. При этом ЭДС рассчитывать, как разность потенциалов правого и левого электродов.
Если положительный заряд внутри системы движется слева направо - ЭДС элемента считается положительной, при этом
где F - число Фарадея. Если положительные заряды будут двигаться в противоположном направлении, то уравнение будет иметь вид:
При коррозии в электролитах самыми распространенными и значимыми являются адсорбционные (адсорбция катионов или анионов на границе раздела фаз) и электродные потенциалы (переход катионов из металла в электролит или наоборот).
Электродный потенциал, при котором металл находится в состоянии равновесия с собственными ионами называется равновесный (обратимый). Он зависит от природы металлической фазы, растворителя, температуры электролита, активности ионов мет.
Равновесный потенциал подчиняется уравнению Нернста:
где, E ο - стандартный потенциал мет.; R - молярная газовая постоянная; n - степень окисления иона мет.; Т - температура; F - число Фарадея;αMe n+ - активность ионов мет.
При установленном равновесном потенциале электрохимическая коррозия не наблюдается.
Если по электроду проходит электрический ток - равновесное состояние его нарушается. Потенциал электрода изменяется в зависимости от направления и силы тока. Изменение разности потенц., приводящее к уменьшению силы тока, принято называть поляризацией. Уменьшение поляризуемости электродов называют деполяризацией.
Скорость электрохимической коррозии тем меньше, чем больше поляризация. Поляризация характеризуется величиной перенапряжения.
Поляризация бывает трех типов:
- электрохимическая (при замедлении анодного или катодного процессов);
- концентрационная (наблюдается, когда скорость подхода деполяризатора к поверхности и отвода продуктов коррозии мала);
- фазовая (связана с образованием на поверхности новой фазы).
Электрохимическая коррозия наблюдается также при контакте двух разнородных металлов. В электролите они образуют гальванопару. Более электроотрицательный из них будет анодом. Анод в процессе будет постепенно растворяться. При этом идет замедление или даже полное прекращение электрохимической коррозии на катоде (более электроположительном). Например, при контакте в морской воде дюралюминия с никелем интенсивно растворятся будет именно дюралюминий.
Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла.
Как мы знаем, наше окружение наполнено электричеством.
В зависимости от среды, меняются показатели проводимости. Не отличается то, что при контакте с такой средой сталь начинает постепенно портиться.
У процесса есть несколько важных отличий.
В первую очередь – неодновременное протекание восстановления окислительного процесса и ионизации атомов металла.
На интенсивность распространения при этом влияет такой параметр, как электродный потенциал металла.
Главная причина электрохимической коррозии в том, что большинство металлов проявляют термодинамическую неустойчивость.
Примеры распространения коррозии такого типа встречаются в воде, почве, на открытом воздухе.
Она часто становится причиной потери прочности и постепенного разрушения металла на днище судов, трубопроводов, опор ЛЭП и других объектов.
Если говорить о типах электрохимической коррозии, то называют 3 разновидности:
- щелевые поражения;
- питтинги;
- межкристаллическое повреждение.
Повреждаться могут разные типы металлов в зависимости от их расположения. Ржавчина появляется при контакте со стоячей и текущей водой, в местах соединения разных металлов, а также на сварных швах.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
- Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного. На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
- Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться. Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.

Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии.
Среди них три распространенные:
- Сплав имеет неоднородную структуру. В большинстве сплавов поверхность негомогенная, потому что в кристаллической решетке присутствуют посторонние включения. Ухудшает ситуацию и присутствие пор макро и микротипа. Это приводит к тому, что продукты коррозии также начинают образовываться неравномерно.
- Неоднородная среда, в которой находится металл. Чтобы коррозия протекла быстрее, важен фактор доступа окислителя. Электрохимическая реакция может быть ускорена.
- Отличие физических условий. Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл.
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Чтобы понять, есть ли у металла склонность к коррозии под действием термодинамических факторов, измеряют потенциал анодного и катодного процесса, а также изобарно-изотермического.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением.
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Негативно влияют на качество металла также воздействие истирания, периодические контакты с другими металлическими изделиями.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
- Температура. Температура сильно влияет на то, как себя ведет металл в разных условиях. От нее сильно зависит то, насколько быстро будут растворяться вторичные продукты коррозии. Среди других особенностей – запуск и стимуляция диффузионных процессов в металле, создание перенапряжения на электродах и другие проявления. Когда металлическое изделие помещается в растворы с кислородной деполяризацией, по мере прогрева электролита диффузия окислителя ускоряется. На фоне этого наблюдается сильное снижение перенапряжения ионизации кислорода.
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Повышение температуры уменьшает скорость распространения повреждений, потому что сильно снижается перенапряжение водорода.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
- Уровень рН раствора, в который помещен металл. Такой показатель как рН указывает, насколько в растворе будут активными ионы водорода, и как быстро коррозия будет распространяться по материалу. Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → H2.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора.
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения.
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.

Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
- Большая накопленная энергия гидратации. В таком случае наблюдается отрыв ионов металла и постепенное перетекание их в раствор. На поверхности в результате остается аналогичное число электронов, заряд становится отрицательным. Далее, в соответствии с законами физики, наблюдается перетекание катионов из раствора, формируется ДЭС на границе, как мы уже описывали выше.
- Разряжение катионов электролита. В результате металл начинает стремительно принимать положительный заряд. ДЭС появляется из-за активности анионов раствора в контакте с катионами электролита.
Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
В современной науке нет средств, которые могли бы точно измерить величину скачка потенциала, значит и процесс формирования электродвижущей силы оказывается на таким интенсивным.
Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Поляризация и ее влияние на скорость протекания коррозии
Процесс поляризации связан с интенсивностью распространения электрохимической коррозии.
Этот показатель отражает, насколько сильное перенапряжение наблюдается на определенном участке.
Принято выделять три вида поляризации:
- Электрохимическая. Чаще всего наблюдается в ситуации, когда катодный и анодный процессы начинают замедляться.
- Фазовая. Возникает в том случае, если на поверхности материала формируется новая фаза.
- Концентрационная. Этот процесс появляется в том случае, если есть очень малые показатели скорости отвода продуктов коррозии, а также подхода деполяризатора.
Особенности поляризации также стоит учитывать в том случае, если вы заинтересованы в дополнительной защите металлов от постепенного разрушения.
Обеспечиваем эффективную защиту от коррозии
Наша компания предлагает заказчикам защиту металлоконструкций разных типов от коррозии.
В пользу работы с нами говорит сразу несколько факторов:
- Опыт работы с 2007 года, есть постоянные заказчики.
- Большие производственные площади. Три цеха для горячего цинкования, мощность 120 тысяч тонн в год.
- Универсальность. Работаем со множеством видов изделий благодаря установленной на предприятии самой глубокой ванны в ЦФО – 3,43 метра.
Мы используем в процессе проверенное европейское оборудование. Даем гарантию соответствия качества товаров требованиям ГОСТ 9.307-89.
Чтобы получить дополнительные консультации и ответы на интересующие вас вопросы, звоните нам или оставляйте заявку на сайте.
Электрохимическая коррозия металлов
Коррозия - это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
Электрохимическая коррозия - наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением внутри системы электрического тока. Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д.
Причиной электрохимической коррозии является образование на поверхности металла большого количества микрогальванических пар, которые возникают по следующим причинам:
1. Наличие примесей металлов или других веществ, отличающихся по активности от основного металла.
2. Структурная неоднородность поверхности металла, что определяет наличие участков с разной активностью.
3. Неравномерность распределения деформаций в металле после термической и механической обработки и др.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
- анодный - окисление металла: Ме - n? = Me n+
- катодный - восстановление ионов водорода в кислой среде:
2H + + 2e = H2 или молекул кислорода, растворенного в воде, в случае атмосферной коррозии:
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии - коррозии во влажном воздухе при комнатной температуре - деполяризатором является кислород.
Пример 20. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. При таком контакте возникает коррозионный гальванический микроэлемент. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403) (табл. 12.1), поэтому он является анодом, а кадмий - катодом.
Анодный процесс: Zn - 2? = Zn 2+ .
Катодный процесс: в кислой среде: 2H + + 2? = H2 ;
в нейтральной среде: 2H2O + O2 + 4? = 4OH - .
Так как ионы Zn 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии в нейтральной среде будет Zn(OH)2.
Скорость коррозии тем больше, чем сильнее различаются электродные потенциалы металлов, т.е. чем дальше они расположены друг от друга в ряду напряжений. Кроме того, скорость коррозии повышается при увеличении концентрации электролита и повышении температуры.
Защита от коррозии.
Все методы защиты условно делятся на следующие группы:
1. Легирование металлов. Это эффективный, хотя и дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла вследствие образования на их поверхностях прочных оксидных пленок. В качестве таких компонентов применяют хром, никель, вольфрам и др.);
2. Защитные покрытия (металлические, неметаллические). Металлические покрытия подразделяются на анодные и катодные. При анодном покрытии металл покрывается более активным металлом, расположенным в ряду напряжения левее, например железо – цинком, и вэтом случае при коррозии идет окисление цинка. При катодном покрытии металл покрывается менее активным металлом, например железо - оловом, и в этом случае при коррозии тдет окисление железа;
3. Электрохимическая защита (этот метод основан на торможении анодных или катодных реакций коррозионного процесса. Защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала - протектора, а также катодной или анодной поляризацией за счет тока от внешнего источника);
4. Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении, например снижают концентрацию Н + - ионов – подщелачивание, удаляют кислород и др.
Пример 21. Какие процессы протекают при коррозии оцинкованного и луженого железа?
а) в кислой среде;
Решение. 1. Оцинкованное железо получают, покрывая железо тонким слоем цинка. При таком контакте возникает гальванический элемент. Цинк имеет более отрицательный потенциал (-0,763 В), чем железо (-0,44 В) (табл. 7.1), поэтому он является анодом, а железо - катодом. а) Схема ГЭ записывается в кислой среде:
Анодный процесс: Zn - 2? = Zn 2+ ;
катодный процесс: 2H + + 2? = H2 .
Следовательно, цинк в этом случае корродирует вместо железа. Подобная защита металла, при которой он играет роль катода в процессе электрохимической коррозии, называется катодной защитой, а цинк в этом случае является анодным покрытием.
б) Для коррозии на воздухе схема ГЭ: (-) Zn ½ H2O, O2 ½ Fe (+).
катодный процесс: 2H2O + O2 + 4? = 4OH - .
Цинк защищает железо от коррозии даже после нарушения целостности покрытия.
2. Так называемую «белую жесть» получают, покрывая тонким слоем олова листовое железо. Сравнение электродных потенциалов железа (-0,44 В) и олова (-0,13 В) показывает, что железо окисляется легче олова, поэтому железо в этой паре играет анода.
a) В кислой среде: (-) Fe ½ HCl ½ Sn (+).
Анодный процесс: Fe - 2?= Fe 2+ ;
б) Во влажной атмосфере: (-) Fe ½ H2O, O2 ½ Sn (+).
Суммарный процесс: 2Fe + 2H2O + O2 = 2Fe 2+ + 4OH - .
Олово защищает железо лишь до тех пор, пока защитный слой остается неповрежденным. Стоит только его повредить, как на железо начинают воздействовать воздух и влага. Олово даже ускоряет коррозию железа, потому что служит катодом в электрохимическом процессе коррозии. Подобная защита металла, при которой он играет роль анода в процессе электрохимической коррозии, называется анодной защитой, а олово в этом случае является катодным покрытием.
Пример 22. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
Решение. Сравнение электродных потенциалов железа (-0,44 В) и алюминия (-1,7 В) показывает, что алюминий этой паре является анодом, а железо - катодом. Схема ГЭ:
Таким образом, вблизи алюминиевого гвоздя труба будет защищена от коррозии. Однако алюминиевый гвоздь должен в этих условиях быстро корродировать, и в конце концов труба упадет. Продуктом коррозии будет белый порошок гидроксида алюминия.
Анодный процесс: Al - 3? = Al 3+ , х4
катодный процесс: 2H2O + O2 + 4? = 4OH - . х3
Суммарный процесс: 4Al + 6H2O + 3O2 = 4Fe 2+ + 12OH - .
Электрохимическая коррозия — самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов под влиянием внешних факторов, в котором, в отличие от химической коррозии, наблюдается направленное движение электронов от окисляемого металла к окислителю.
Электрохимическая коррозия возникает, когда соприкасаются два металла различной активности . Различие в энергиях ионизации и в величине сродства к электрону заставляет электроны переходить от более активного металла к менее активному, что и запускает процесс электрохимической коррозии.
Механизм электрохимической коррозии.
Процессы электрохимической коррозии протекают по законам электрохимической кинетики, когда общая реакция взаимодействия может быть разделена на следующие процессы:
1) анодный процесс — переход ионов окисленного металла в раствор, сопровождающийся гидратацией (сольватацией):
2) омический процесс — перетекание освободившихся электронов от анодных участков к катодным и движение ионов в растворе;
3) катодный процесс — ассимиляция электронов каким-либо окислителем, при этом происходит катодное восстановление окислителя Ох:
Окислителями при коррозии служат молекулы кислорода О2, хлора Cl2, ионы Н + , Fe 3+ , NO3 – и др. Наиболее часто при коррозии в нейтральной и щелочной среде наблюдается восстановление кислорода:
а в кислой среде — выделение водорода:
Коррозия с участием молекулярного кислорода называется коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Кроме электрохимических реакций при коррозии обычно протекают вторичные химические процессы, например взаимодействие образующихся ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций:
 |
| Рис. 5. Атмосферная коррозия в результате контакта меди и железа |
Например, если железо находится в контакте с медью в атмосфере влажного воздуха (рис. 5), то менее активный металл медь выступает в роли катода, на котором происходит восстановление окислителя, а материал анода окисляется.
Возникает гальванопара, при работе которой происходят процессы:
анод Fe 0 – 2 → Fe 2+ ;
Далее происходят вторичные процессы:
Образующийся гидроксид железа (II) легко окисляется кислородом воздуха, что в конечном итоге приводит к образованию ржавчины mFe2O3 · nFeO · pH2O.
Образование гальванического элемента (гальванопары) из двух различных по активности металлов приводит к коррозии более сильной, чем для исходного активного металла. Например, цинк в растворе соляной кислоты (Е 0 Zn2+/Zn 0 = – 0,762 B) реагирует с выделением водорода:
или в ионном виде:
Zn + 2H + = Zn 2+ + H2↑;
но постепенно изолируется от раствора мелкими пузырьками образовавшегося газа, в результате чего его дальнейшее растворение прекращается.
Медь с разбавленной соляной кислотой не реагирует, так как находится в ряду напряжений после водорода, её стандартный электродный потенциал Е 0 Cu2+/Cu 0 = +0,34 B. Но цинк в контакте с медью образует в разбавленной соляной кислоте коррозионную гальванопару:
В кислой среде наблюдается электрохимическая коррозия Zn с водородной деполяризацией, в которой роль анода играет более электроотрицательный (более активный) металл — цинк, так как
В процессе коррозии цинк растворяется:
анод: Zn – 2 → Zn 2+ (окисление);
омический процесс — переход электронов с анода на катод:
катод: 2H + + 2 → H2 (на поверхности меди).
Продукт коррозии в кислой среде — хлорид цинка:
Zn 2+ + 2Cl – = ZnCl2.
Очень часто электрохимическая коррозия возникает, когда металл содержит вкрапления металла меньшей активности или неметаллические, но, вместе с тем, токопроводящие включения (как, например, происходит в стали, где есть многочисленные включения карбида железа FeC3), становящиеся катодными участками электрохимической коррозии.
В качестве примера рассмотрим железо, которое в качестве примеси содержит включения меди (рис. 6). Вся конструкция погружена в разбавленный раствор соляной кислоты HCl. На поверхности меди происходит восстановление окислителя, а материал анода окисляется и растворяется:
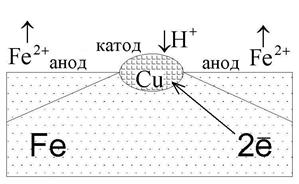 | HCl ←→ H + + Cl – . Анод Fe 0 – 2? → Fe 2+ ; Fe 2+ +2Cl – ←→ FeCl2. Катод H + + ? → Н 0 ; 2H 0 ←→ H2↑. |
| Рис. 6. Коррозия железа с включениями меди |
Электрохимическая коррозия и ЭДС гальванопары.
Возможность протекания коррозии может быть установлена по знаку ЭДС образующегося гальванического элемента. Если ЭДС > 0, то коррозия возможна. ЭДС равна разности потенциалов окислителя и восстановителя (катода и анода), поэтому коррозия возможна при условии, что потенциал катода (окислителя) положительнее потенциала анода (восстановителя). Если на аноде идет растворение металла, то должно быть ЕОх > ЕMen + /Me 0 .
Потенциал кислородного электрода при 298 К описывается уравнением:
Потенциал водородного электрода описывается уравнением:
Графики зависимостей приведены на рис. 7, по ним можно определить возможность протекания коррозии различных металлов в водных средах.
Если потенциал металла положительнее потенциала кислородного электрода (который равен +1,2 В в кислой среде при pH = 1 и составляет около +0,8 В в нейтральной среде при pH = 7), то коррозия металла невозможна (область III).
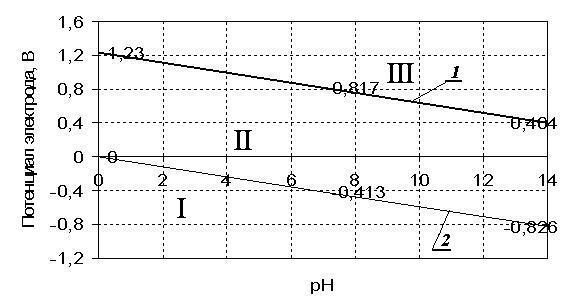 |
| Рис. 7. Зависимость потенциала кислородного (линия 1) и водородного (линия 2) электродов от значения pH среды при PO2 и PH2 = 1 атм |
Если потенциал металла положительнее потенциала водородного электрода (последний равен нулю в кислых средах при pH = 1 и составляет около – 0,41 В в нейтральной среде при pH = 7) и отрицательнее потенциала кислородного электрода (область II), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода.
Если потенциал металла отрицательнее потенциала водородного электрода (область I), то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные, щелочноземельные, алюминий, цинк, и др.
Скорость электрохимической коррозии.
Действие гальванических элементов в значительной мере зависит от поляризации и деполяризации. При этом может происходить как поляризация анода, которая выражается в том, что его потенциал становится более положительным, так и поляризация катода, вызываемая смещением его потенциала в отрицательную сторону.
Поляризация снижает скорость коррозии во много раз. Без поляризации многие металлы, в том числе и железо, корродировали бы с такой высокой скоростью, что потеряли бы свое техническое значение.
Скорость электрохимической коррозии можно определить по формуле:
где I — сила тока, величина которого указывает на скорость коррозии; R — омическое сопротивление раствора электролита; Па — поляризация анода, Пк — поляризация катода; Е — электродвижущая сила.
В зависимости от того, какая из величин (R, Па, Пк) оказывает ограничительное действие на скорость процесса, различают коррозию с различным контролем:
Контролирующая стадия является лимитирующей для всего процесса, т.е. ограничивает скорость коррозии в целом, так как протекает медленнее других. Возможен и смешанный контроль, когда слагаемые в знаменателе приблизительно равны по величине.
Читайте также:
