Электрохимическую коррозию металла вызывает
Обновлено: 04.10.2024
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микр о- , а макрогальванопара , и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов *, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере Имеется в виду атмосфера с примесью газообразного HCl. . В этом случае железо будет анодом (E ° = –0,44В), а медь – катодом (E ° =+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризац ии ио нами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода . Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Коррозия металла — причины возникновения и методы защиты
Словосочетания «коррозия металла» заключает в себе намного больше, чем название популярной рок-группы. Коррозия безвозвратно разрушает металл, превращая его в труху: из всего, произведенного в мире железа, 10% полностью разрушится в этот же год. Ситуация с российским металлом выглядит примерно так — весь металл, выплавленный за год в каждой шестой доменной печи нашей страны, становится ржавой трухой еще до конца года.
Выражение «обходится в копеечку» в отношении коррозии металла более чем верно — ежегодный ущерб, приносимый коррозией, составляет не менее 4% годового дохода любой развитой страны, а в России сумма ущерба исчисляется десятизначной цифрой. Так что же вызывает коррозийные процессы металлов и как с ними бороться?
Что такое коррозия металлов
Разрушение металлов в результате электрохимического (растворение во влагосодержащей воздушной или водной среде — электролите) или химического (образование соединений металлов с химическими агентами высокой агрессии) взаимодействия с внешней средой. Коррозийный процесс в металлах может развиться лишь в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия).
Металл под воздействием кислорода и воды становится рыхлым светло-коричневым порошком, больше известным как ржавчина (Fе2O3·H2О).
Химическая коррозия
Этот процесс происходит в средах, не являющихся проводниками электрического тока (сухие газы, органические жидкости — нефтепродукты, спирты и др.), причем интенсивность коррозии возрастает с повышением температуры — в результате на поверхности металлов образуется оксидная пленка.
Химической коррозии подвержены абсолютно все металлы — и черные, и цветные. Активные цветные металлы (например — алюминий) под воздействием коррозии покрываются оксидной пленкой, препятствующей глубокому окислению и защищающей металл. А такой мало активный металл, как медь, под воздействием влаги воздуха приобретает зеленоватый налет — патину. Причем оксидная пленка защищает металл от коррозии не во всех случаях — только если кристаллохимическая структура образовавшейся пленки сообразна строению металла, в противном случае — пленка ничем не поможет.
Сплавы подвержены другому типу коррозии: некоторые элементы сплавов не окисляются, а восстанавливаются (например, в сочетании высокой температуры и давления в сталях происходит восстановление водородом карбидов), при этом сплавы полностью утрачивают необходимые характеристики.
Электрохимическая коррозия
Процесс электрохимической коррозии не нуждается в обязательном погружении металла в электролит — достаточно тонкой электролитической пленки на его поверхности (часто электролитические растворы пропитывают среду, окружающую металл (бетон, почву и т.д.)). Наиболее распространенной причиной электрохимической коррозии является повсеместное применение бытовой и технической солей (хлориды натрия и калия) для устранения льда и снега на дорогах в зимний период — особенно страдают автомашины и подземные коммуникации (по статистике, ежегодные потери в США от использования солей в зимний период составляют 2,5 млрд. долларов).
Происходит следующее: металлы (сплавы) утрачивают часть атомов (они переходят в электролитический раствор в виде ионов), электроны, замещающие утраченные атомы, заряжают металл отрицательным зарядом, в то время как электролит имеет положительный заряд. Образуется гальваническая пара: металл разрушается, постепенно все его частицы становятся частью раствора. Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Другие причины коррозии металла
Развитию коррозийных процессов способствуют радиация, продукты жизнедеятельности микроорганизмов и бактерий. Коррозия, вызываемая морскими микроорганизмами, наносит ущерб днищам морских судов, а коррозийные процессы, вызванные бактериями, даже имеют собственное название — биокоррозия.
Совокупность воздействия механических напряжений и внешней среды многократно ускоряет коррозию металлов — снижается их термоустойчивость, повреждаются поверхностные оксидные пленки, а в тех местах, где появляются неоднородности и трещины, активируется электрохимическая коррозия.
Меры защиты металлов от коррозии
Неизбежными последствиями технического прогресса является загрязнение нашей среды обитания — процесс, ускоряющий коррозию металлов, поскольку внешняя окружающая среда проявляет к ним все большую агрессию. Каких-либо способов полностью исключить коррозийное разрушение металлов не существует, все, что можно сделать, это максимально замедлить этот процесс.
Для минимизации разрушения металлов можно сделать следующее: снизить агрессию среды, окружающей металлическое изделие; повысить устойчивость металла к коррозии; исключить взаимодействие между металлом и веществами из внешней среды, проявляющими агрессию.
Человечеством за тысячи лет испробованы многие способы защиты металлических изделий от химической коррозии, некоторые из них применяются по сей день: покрытие жиром или маслом, другими металлами, коррозирующими в меньшей степени (самый древний метод, которому уже более 2 тыс. лет — лужение (покрытие оловом)).
Антикоррозийная защита неметаллическими покрытиями
Неметаллические покрытия — краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
Применение красок и лаков выгодно тем, что наносить эти защитные покрытия можно непосредственно на монтажной и строительной площадке. Методы нанесения лакокрасочных материалов просты и поддаются механизации, восстановить поврежденные покрытия можно «на месте» — во время эксплуатации, эти материалы имеют сравнительно низкую стоимость и их расход на единицу площади невелик. Однако их эффективность зависит от соблюдения нескольких условий: соответствие климатическим условиям, в которых будет эксплуатироваться металлическая конструкция; необходимость применения исключительно качественных лакокрасочных материалов; неукоснительное следование технологии нанесения на металлические поверхности. Лакокрасочные материалы лучше всего наносить несколькими слоями — их количество обеспечит лучшую защиту от атмосферного воздействия на металлическую поверхность.
В роли защитных покрытий от коррозии могут выступать полимеры — эпоксидные смолы и полистирол, поливинилхлорид и полиэтилен. В строительных работах закладные детали из железобетона покрываются обмазками из смеси цемента и перхлорвинила, цемента и полистирола.
Защита железа от коррозии покрытиями из других металлов
Существует два типа металлических покрытий-ингибиторов — протекторные (покрытия цинком, алюминием и кадмием) и коррозионностойкие (покрытия серебром, медью, никелем, хромом и свинцом). Ингибиторы наносятся химическим способом: первая группа металлов имеет большую электроотрицательность по отношению к железу, вторая — большую электроположительность. Наибольшее распространение в нашем обиходе получили металлические покрытия железа оловом (белая жесть, из нее производят консервные банки) и цинком (оцинкованное железо — кровельное покрытие), получаемые путем протягивания листового железа через расплав одного из этих металлов.
Часто цинкованию подвергаются чугунная и стальная арматура, а также водопроводные трубы — эта операция существенно повышает их стойкость к коррозии, но только в холодной воде (при проводе горячей воды оцинкованные трубы изнашиваются быстрее неоцинкованных). Несмотря на эффективность цинкования, оно не дает идеальной защиты — цинковое покрытие часто содержит трещины, для устранения которых требуется предварительное никелерование металлических поверхностей (покрытие никелем). Цинковые покрытия не позволяют наносить на них лакокрасочные материалы — нет устойчивого покрытия.
Лучшее решение для антикоррозийной защиты — алюминиевое покрытие. Этот металл имеет меньший удельный вес, а значит — меньше расходуется, алюминированные поверхности можно окрашивать и слой лакокрасочного покрытия будет устойчив. Кроме того, алюминиевое покрытие по сравнению с оцинкованным покрытием обладает большей стойкостью в агрессивных средах. Алюминирование слабо распространено из-за сложности нанесения этого покрытия на металлический лист — алюминий в расплавленном состоянии проявляет высокую агрессию к другим металлам (по этой причине расплав алюминия нельзя содержать в стальной ванне). Возможно, эта проблема будет полностью решена в самое ближайшее время — оригинальный способ выполнения алюминирования найден российскими учеными. Суть разработки заключается в том, чтобы не погружать стальной лист в расплав алюминия, а поднять жидкий алюминий к стальному листу.
Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности. Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза. Легирующие добавки вводятся в состав стали с соблюдением правила Таммана: высокая коррозийная устойчивость достигается, когда на восемь атомов железа приходится один атом легирующего металла.
Меры противодействия электрохимической коррозии
Для ее снижения необходимо понизить коррозийную активность среды посредством введения неметаллических ингибиторов и уменьшить количество компонентов, способных начать электрохимическую реакцию. Таким способом будет понижение кислотности почв и водных растворов, контактирующих с металлами. Для снижения коррозии железа (его сплавов), а также латуни, меди, свинца и цинка из водных растворов необходимо удалить диоксид углерода и кислород. В электроэнергетической отрасли проводится удаление из воды хлоридов, способных повлиять на локальную коррозию. С помощью известкования почвы можно снизить ее кислотность.
Защита от блуждающих токов
Снизить электрокоррозию подземных коммуникаций и заглубленных металлоконструкций возможно при соблюдении нескольких правил:
- участок конструкции, служащий источником блуждающего тока, необходимо соединить металлическим проводником с рельсом трамвайной дороги;
- трассы теплосетей должны размещаться на максимальном удалении от рельсовых дорог, по которым передвигается электротранспорт, свести к минимуму число их пересечений;
- применение электроизоляционных трубных опор для повышения переходного сопротивления между грунтом и трубопроводами;
- на вводах к объектам (потенциальным источникам блуждающих токов) необходима установка изолирующих фланцев;
- на фланцевой арматуре и сальниковых компенсаторах устанавливать токопроводящие продольные перемычки — для наращивания продольной электропроводимости на защищаемом отрезке трубопроводов;
- чтобы выровнять потенциалы трубопроводов, расположенных параллельно, необходимо установить поперечные электроперемычки на смежных участках.
Защита металлических объектов, снабженных изоляцией, а также стальных конструкций небольшого размера выполняется с помощью протектора, выполняющего функцию анода. Материалом для протектора служит один из активных металлов (цинк, магний, алюминий и их сплавы) — он принимает на себя большую часть электрохимической коррозии, разрушаясь и сохраняя главную конструкцию. Один анод из магния, к примеру, обеспечивает защиту 8 км трубопровода.
Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла.
Как мы знаем, наше окружение наполнено электричеством.
В зависимости от среды, меняются показатели проводимости. Не отличается то, что при контакте с такой средой сталь начинает постепенно портиться.
У процесса есть несколько важных отличий.
В первую очередь – неодновременное протекание восстановления окислительного процесса и ионизации атомов металла.
На интенсивность распространения при этом влияет такой параметр, как электродный потенциал металла.
Главная причина электрохимической коррозии в том, что большинство металлов проявляют термодинамическую неустойчивость.
Примеры распространения коррозии такого типа встречаются в воде, почве, на открытом воздухе.
Она часто становится причиной потери прочности и постепенного разрушения металла на днище судов, трубопроводов, опор ЛЭП и других объектов.
Если говорить о типах электрохимической коррозии, то называют 3 разновидности:
- щелевые поражения;
- питтинги;
- межкристаллическое повреждение.
Повреждаться могут разные типы металлов в зависимости от их расположения. Ржавчина появляется при контакте со стоячей и текущей водой, в местах соединения разных металлов, а также на сварных швах.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
- Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного. На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
- Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться. Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.

Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии.
Среди них три распространенные:
- Сплав имеет неоднородную структуру. В большинстве сплавов поверхность негомогенная, потому что в кристаллической решетке присутствуют посторонние включения. Ухудшает ситуацию и присутствие пор макро и микротипа. Это приводит к тому, что продукты коррозии также начинают образовываться неравномерно.
- Неоднородная среда, в которой находится металл. Чтобы коррозия протекла быстрее, важен фактор доступа окислителя. Электрохимическая реакция может быть ускорена.
- Отличие физических условий. Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл.
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Чтобы понять, есть ли у металла склонность к коррозии под действием термодинамических факторов, измеряют потенциал анодного и катодного процесса, а также изобарно-изотермического.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением.
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Негативно влияют на качество металла также воздействие истирания, периодические контакты с другими металлическими изделиями.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
- Температура. Температура сильно влияет на то, как себя ведет металл в разных условиях. От нее сильно зависит то, насколько быстро будут растворяться вторичные продукты коррозии. Среди других особенностей – запуск и стимуляция диффузионных процессов в металле, создание перенапряжения на электродах и другие проявления. Когда металлическое изделие помещается в растворы с кислородной деполяризацией, по мере прогрева электролита диффузия окислителя ускоряется. На фоне этого наблюдается сильное снижение перенапряжения ионизации кислорода.
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Повышение температуры уменьшает скорость распространения повреждений, потому что сильно снижается перенапряжение водорода.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
- Уровень рН раствора, в который помещен металл. Такой показатель как рН указывает, насколько в растворе будут активными ионы водорода, и как быстро коррозия будет распространяться по материалу. Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → H2.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора.
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения.
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.

Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
- Большая накопленная энергия гидратации. В таком случае наблюдается отрыв ионов металла и постепенное перетекание их в раствор. На поверхности в результате остается аналогичное число электронов, заряд становится отрицательным. Далее, в соответствии с законами физики, наблюдается перетекание катионов из раствора, формируется ДЭС на границе, как мы уже описывали выше.
- Разряжение катионов электролита. В результате металл начинает стремительно принимать положительный заряд. ДЭС появляется из-за активности анионов раствора в контакте с катионами электролита.
Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
В современной науке нет средств, которые могли бы точно измерить величину скачка потенциала, значит и процесс формирования электродвижущей силы оказывается на таким интенсивным.
Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Поляризация и ее влияние на скорость протекания коррозии
Процесс поляризации связан с интенсивностью распространения электрохимической коррозии.
Этот показатель отражает, насколько сильное перенапряжение наблюдается на определенном участке.
Принято выделять три вида поляризации:
- Электрохимическая. Чаще всего наблюдается в ситуации, когда катодный и анодный процессы начинают замедляться.
- Фазовая. Возникает в том случае, если на поверхности материала формируется новая фаза.
- Концентрационная. Этот процесс появляется в том случае, если есть очень малые показатели скорости отвода продуктов коррозии, а также подхода деполяризатора.
Особенности поляризации также стоит учитывать в том случае, если вы заинтересованы в дополнительной защите металлов от постепенного разрушения.
Обеспечиваем эффективную защиту от коррозии
Наша компания предлагает заказчикам защиту металлоконструкций разных типов от коррозии.
В пользу работы с нами говорит сразу несколько факторов:
- Опыт работы с 2007 года, есть постоянные заказчики.
- Большие производственные площади. Три цеха для горячего цинкования, мощность 120 тысяч тонн в год.
- Универсальность. Работаем со множеством видов изделий благодаря установленной на предприятии самой глубокой ванны в ЦФО – 3,43 метра.
Мы используем в процессе проверенное европейское оборудование. Даем гарантию соответствия качества товаров требованиям ГОСТ 9.307-89.
Чтобы получить дополнительные консультации и ответы на интересующие вас вопросы, звоните нам или оставляйте заявку на сайте.
Электрохимическая коррозия - самый распространенный вид коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии.
К электрохимической коррозии относятся такие виды местных разрушений, как питтинги, межкристаллитная коррозия, щелевая. Кроме того процессы электрохимической коррозии происходят в грунте, атмосфере, море.
Механизм электрохимической коррозии может протекать по двум вариантам:
1) Гомогенный механизм электрохимической коррозии:
- поверхностный слой мет. рассматривается как гомогенный и однородный;
- причиной растворения металла является термодинамическая возможность протекания катодного или же анодного актов;
- К и А участки мигрируют по поверхности во времени;
- скорость протекания электрохимической коррозии зависит от кинетического фактора (времени);
- однородную поверхность можно рассматривать как предельный случай, который может быть реализован и в жидких металлах.
2) Гетерогенный механизм электрохимической коррозии:
- у твердых металлов поверхность негомогенная, т.к. разные атомы занимают в сплаве различные положения в кристаллической решетке;
- гетерогенность наблюдается при наличии в сплаве инородных включений.
Электрохимическая коррозия имеет некоторые особенности: делится на два одновременно протекающих процесса (катодный и анодный), которые кинетически зависимы друг от друга; на некоторых участках поверхности электрохимическая коррозия может принять локальный характер; растворение основного мет. происходит именно на анодах.
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют электрохимическому его разрушению.
Причины возникновения местных гальванических элементов могут быть самые разные:
1) неоднородность сплава
- неоднородность мет. фазы, обусловленная неоднородностью сплава и наличием микро- и макровключений;
- неравномерность окисных пленок на поверхности за счет наличия макро- и микропор, а также неравномерного образования вторичных продуктов коррозии;
- наличие на поверхности границ зерен кристаллов, выхода дислокации на поверхность, анизотропность кристаллов.
2) неоднородность среды
- область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию.
3) неоднородность физических условий
- облучение (облученный участок - анод);
- воздействие внешних токов (место входа блуждающего тока - катод, место выхода - анод);
- температура (по отношению к холодным участкам, нагретые являются анодами) и т. д.
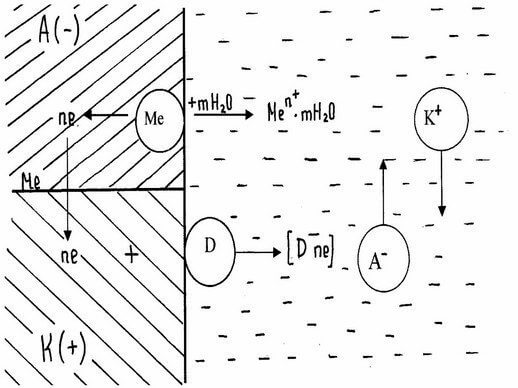
При работе гальванического элемента одновременно протекает два электродных процесса:
Анодный - ионы металла переходят в раствор
Происходит реакция окисления.
Катодный - избыточные электроны ассимилируются молекулами или атомами электролита, которые при этом восстанавливаются. На катоде проходит реакция восстановления.
O2 + 2H2O + 4e → 4OH - (кислородная деполяризация в нейтральных, щелочных средах)
O2 + 4H + + 4e → 2H2O (кислородная деполяризация в кислых средах)
2 H + + 2e → H2 (при водородной деполяризации).
Торможение анодного процесса приводит к торможению и катодного.
При соприкосновении двух электропроводящих фаз (например, мет. - среда), когда одна из них заряжена положительно, а другая отрицательно, между ними возникает разность потенциала. Это явление связано с возникновением двойного электрического слоя (ДЭС). Заряженные частицы располагаются несимметрично на границе раздела фаз.
Скачек потенциалов в процессе электрохимической коррозии может происходить из-за двух причин:
При достаточно большой энергии гидратации ионы металла могут отрываться и переходить в раствор, оставляя на поверхности эквивалентное число электронов, которые определяют ее отрицательный заряд. Отрицательно заряженная поверхность притягивает к себе катионы мет. из раствора. Так на границе раздела фаз возникает двойной электрический слой.
На поверхности металла разряжаются катионы электролита. Это приводит к тому, что поверхность мет. приобретает положительный заряд, который с анионами раствора образует двойной электрический слой.
Иногда возникает ситуация, когда поверхность не заряжена и, соответственно, отсутствует ДЭС. Потенциал, при котором это явление наблюдается называется потенциалом нулевого заряда (φN). У каждого металла потенциал нулевого заряда свой.
Величина электродных потенциалов оказывает очень большое влияние на характер коррозионного процесса.
Скачок потенциала между двух фаз не может быть измерен, но при помощи компенсационного метода можно измерить электродвижущую силу элемента (ЭДС), который состоит из электрода сравнения (его потенциал условно принят за ноль) и исследуемого электрода. В качестве электрода сравнения берется стандартный водородный электрод. ЭДС гальванического элемента (стандартный водородный электрод и исследуемый элемент) называют электродным потенциалом. Электродами сравнения могут также выступать хлорсеребряный, каломельный, насыщенный медно-сульфатный.
Международной конвенцией в Стокгольме 1953г. решено при записях электрод сравнения всегда ставить слева. При этом ЭДС рассчитывать, как разность потенциалов правого и левого электродов.
Если положительный заряд внутри системы движется слева направо - ЭДС элемента считается положительной, при этом
где F - число Фарадея. Если положительные заряды будут двигаться в противоположном направлении, то уравнение будет иметь вид:
При коррозии в электролитах самыми распространенными и значимыми являются адсорбционные (адсорбция катионов или анионов на границе раздела фаз) и электродные потенциалы (переход катионов из металла в электролит или наоборот).
Электродный потенциал, при котором металл находится в состоянии равновесия с собственными ионами называется равновесный (обратимый). Он зависит от природы металлической фазы, растворителя, температуры электролита, активности ионов мет.
Равновесный потенциал подчиняется уравнению Нернста:
где, E ο - стандартный потенциал мет.; R - молярная газовая постоянная; n - степень окисления иона мет.; Т - температура; F - число Фарадея;αMe n+ - активность ионов мет.
При установленном равновесном потенциале электрохимическая коррозия не наблюдается.
Если по электроду проходит электрический ток - равновесное состояние его нарушается. Потенциал электрода изменяется в зависимости от направления и силы тока. Изменение разности потенц., приводящее к уменьшению силы тока, принято называть поляризацией. Уменьшение поляризуемости электродов называют деполяризацией.
Скорость электрохимической коррозии тем меньше, чем больше поляризация. Поляризация характеризуется величиной перенапряжения.
Поляризация бывает трех типов:
- электрохимическая (при замедлении анодного или катодного процессов);
- концентрационная (наблюдается, когда скорость подхода деполяризатора к поверхности и отвода продуктов коррозии мала);
- фазовая (связана с образованием на поверхности новой фазы).
Электрохимическая коррозия наблюдается также при контакте двух разнородных металлов. В электролите они образуют гальванопару. Более электроотрицательный из них будет анодом. Анод в процессе будет постепенно растворяться. При этом идет замедление или даже полное прекращение электрохимической коррозии на катоде (более электроположительном). Например, при контакте в морской воде дюралюминия с никелем интенсивно растворятся будет именно дюралюминий.
Причины электрохимической коррозии и способы защиты металла
Электрохимическая коррозия металлов – одна из насущных проблем человечества с того момента, как в производстве различных, необходимых человеку предметов, стали использоваться изделия из металла. Проблема защиты металлов от коррозии всегда стояла остро, потому что под действием разрушительных процессов окисления предметы теряли функциональность, деформировались и приходили в негодность, и нужно было искать способы их защиты.
Когда химия выделилась в отдельную науку, а использование металлов стало приобретать широкое промышленное значение, человечество начало исследовать эти процессы и искать способы борьбы с разрушениями от внешних воздействий.
Что такое коррозия
Процесс разрушения верхнего слоя металлического материала под влиянием внешних воздействий называется коррозией в широком смысле.

Термин коррозия в данном случае – только характеристика того, что металлическая поверхность вступает в химическую реакцию и теряет под её влиянием свои изначальные свойства.
4 основных признака, по которым можно определить, что этот процесс существует:
- процесс, развивающийся на поверхности, и со временем проникающий внутрь металлического изделия;
- реакция возникает самопроизвольно от того, что нарушается устойчивость термодинамического баланса между окружающей средой и системой атомов в сплаве или монолите;
- химия воспринимает этот процесс не просто, как реакцию разрушения, но как реакцию восстановления и окисления: при вступлении в реакцию одни атомы замещают другие;
- свойства и особенности метала при такой реакции претерпевают значительные изменения, или утрачиваются там, где она происходит.
Виды коррозии
В зависимости от типа металла и окислительно-восстановительной реакции, происходящей с ним, коррозия может быть:
- равномерной или неравномерной;
- местной и точечной (отдельные участки почему-либо вступили в реакцию, а другие – нет);
- язвенной, известной еще как питтинг;
- подповерхностной;
- растрескивающейся;
- межкристаллической, возникающая вдоль границ кристалла металла.
Также в зависимости от того, какие именно внешние факторы воздействуют на поверхность, коррозия бывает химической и электрохимической. Химическая коррозия происходит в результате некоторых реакций под влиянием химических взаимодействий, но без участия электрического тока, и может быть присуща даже нефти и газу. Электрохимическая отличается определенными процессами, она более сложная, чем химическая.

На видео: коррозия металлов.
Причины и признаки электрохимической коррозии
Электрохимическая коррозия отличается от химической тем, что процесс разрушения проходит в системе электролитов, отчего внутри этой системы возникает электрический ток. Два сопряжённых процесса, анодный и катодный, приводят к удалению из кристаллической решетки металла неустойчивых атомов. Ионы при анодном переходят в раствор, а электроны от анодного процесса попадают в ловушку к веществу-окислителю и связываются деполяризатором.
Таким образом, деполяризация – это отвод с катодных участков свободных электронов, а деполяризатор – вещество, которое отвечает за этот процесс. Основные реакции происходят с участием водорода и кислорода в роли деполяризаторов.

Существует множество примеров электрохимической коррозии разного типа, которая оказывает воздействие на металлические поверхности в природе и проходит под влиянием различных условий. Водород при этом работает в кислой среде, а кислород – в нейтральной.
Практически все металлы подвергаются электрохимической коррозии, и по этому признаку их разбивают на 4 группы, определяют величину их электродного потенциала:
- активные коррозируют даже в той среде, где нет окислителей;
- среднеактивные вступают в реакцию окисления в кислотной среде;
- малоактивные не вступают в реакцию при отсутствии окислителей и в нейтральных, и в кислых средах;
- не вступают в реакцию — высокой стабильности (благородные металлы, палладий, золото, платина, иридий).
Самый распространенный вид электрохимической коррозии – атмосферная.

Но эта же реакция может протекать и в воде, в растворах оснований, солей и кислот. В узкоспециальном различии атмосферной коррозии различают почвенную и аэрационную, морскую и биологическую (протекающую под воздействием бактерий).
Есть даже электрическая коррозия, которая протекает под воздействием электрического тока, и является результатом работы блуждающих токов, возникающих там, где электрический ток используется человеком для осуществления определенной деятельности.
Гомогенная металлическая поверхность при этом разрушается из-за термодинамической неустойчивости к окружающей среде. А гетерогенная – из-за состава кристаллической решётки, в которой атомы одного металла держатся плотнее, чем атомы инородных вкраплений. Эти реакции отличаются скоростью протекания ионизации ионов, и восстановления окислительных компонентов окружающей среды.
Разрушение металлических поверхностей при электрохимической коррозии состоит в одновременном протекании двух процессов: анодного и катодного, и отличия процессов состоят в том, что растворение происходит на анодах, которые и контактируют с окружающей средой через множество микроэлектродов, которые входят в состав поверхности любого металла и замкнуты на себя.
Характерными примерами электрохимической коррозии можно считать протекание коррозионных процессов на днищах морских судов или в атмосфере на металлических конструкциях.

Необходимость антикоррозионной защиты
Защита металла от воздействий, которые разрушающе действуют на его поверхность – одна из основных задач, возникающих перед теми людьми, которые работают с механизмами, агрегатами и машинами, морскими судами и строительными процессами.
Любой металл, кроме благородных, в той или иной степени, подвергается воздействию разрушительных процессов.

Чем активнее эксплуатируется устройство или деталь, тем больше шансов у нее подвергнуться разрушительному воздействию и атмосферных условий, жидкостей, с которыми приходится сталкиваться в процессе работы. Над защитой металла от коррозии работают многие отрасли науки и промышленного производства, но основные способы остаются при этом неизменными, и состоят в создании защитных покрытий:
- металлических;
- неметаллических;
- химических.
Неметаллические покрытия создаются с помощью органических и неорганических соединений, их принцип действия достаточно эффективен и отличается от остальных типов защиты. Для создания неметаллической защиты в промышленном и строительном производстве используются лакокрасочные составы, бетон и битум и высокомолекулярные соединения, особенно активно взятые на вооружение в последние годы, когда больших высот достигла химия полимеров.

Химия внесла свой вклад в создание защитных покрытий методами:
- оксидирования (создания защитной пленки на металле с помощью оксидных пленок);
- фосфатирования (фосфатных пленок);
- азотирования (насыщения поверхности стали азотом);
- цементации (соединения с углеродом);
- воронения (соединения с органическими веществами);
- изменения состава металла путем введения в него антикоррозийных добавок);
- модификации окружающей коррозийной среды путем введения ингибиторов, влияющих на нее.
Электрохимическая защита от коррозии – это процесс, обратный электрохимической коррозии. В зависимости от смещения потенциала металла в положительную или отрицательную стороны, различают анодную и катодную защиту. Путем подсоединения к металлическому изделию протектора или источника постоянного тока на металлической поверхности создается катодная поляризация, которая и препятствует разрушению металла через анод.
Электрохимические методы защиты состоят в двух вариантах:
- металлическое покрытие защищено другим металлом, у которого более отрицательный потенциал (то есть, защищающий металл менее устойчив, чем защищаемый), и это называется анодное покрытие;
- покрытие нанесено из менее активного металла, и тогда он является и называется катодным.

Анодная защита от коррозии – это, например, оцинкованное железо. Пока не израсходуется весь цинк с защитного слоя, железо будет в относительной безопасности.
Защита катодным способом – это никелирование или нанесение меди. В этом случае разрушение защитного слоя приводит и к разрушению того слоя, который он защищает. Присоединение протектора для предохранения металлического изделия ничем не отличается от протекания реакции в других случаях. Протектор выступает в роли анода, а то, что находится под его протекторатом, остается в сохранности, используя созданные ему условия.
Способы защиты металла
Электрохимическая коррозия – одно из основных препятствий, которые встречаются на пути человеческой деятельности. Защита от воздействия разрушительных процессов и их протекания на поверхности конструкций и сооружений – одна из перманентных и насущных задач любого промышленного производства, и любой бытовой деятельности человека.

Разработано несколько способов такой защиты, и все они активно применяются в повседневном цикле жизнедеятельности:
- Электрохимическая защита – электролитическое по принципу работы использование химических закономерностей, защищает металл с помощью анодного, катодного и протекторного принципа.
- Э лектроискровая обработка с использованием различных установок – бесконтактных, контактных, анодно-механических.
- Электродуговое напыление – основное преимущество в толщине наносимого слоя и относительной дешевизне производимого процесса.
- Эффективная антикоррозийная обработка – удаление загрязнений и очистка обрабатываемой поверхности, с последующим нанесением на поверхность сначала противокоррозионного, а затем и дополнительного защитного слоя.
Все эти способы наработаны в процессе деятельности человека с целью защиты инструментария, средств передвижения и транспортировки на стыке нескольких промышленных отраслей, и с использованием научных достижений.
Электрохимическая коррозия, которая является естественным процессом разрушения поверхности металла под воздействием нейтральных или агрессивных факторов окружающей среды, представляет собой сложную проблему. Убытки от нее терпят и машиностроительные, и транспортные, и промышленные предприятия, средства передвижения. И это проблема, которая требует ежедневного разрешения.
Читайте также:
