Электронное строение внешней оболочки металла формула
Обновлено: 09.05.2024
Металлы, или вещества, находящиеся в металлическом состоянии, обладают электронным строением, характеризующимся наличием незаполненных подуровней в валентной зоне. Валентные электроны не связаны с определенными атомами, а принадлежат всему металлическому телу, образуя электронный газ, окружающий каркас из положительно заряженных ионов.
Металлическая связь между атомами ненаправленная. Каждый атом стремится окружить себя как можно большим числом соседних атомов, следствием чегоявляется высокая компактность металлов.
Электроны, образующие электронный газ, называют электронами проводимости, поскольку они легко перемещаются во внешнем электрическом поле, создаваяэлектрический ток.
Незаполненность валентных энергетических зон металлов определяет их высокую электропроводность,теплопроводность, металлический блеск и др. Все металлыимеют положительный температурный коэффициент электрического сопротивления, т. е. при Т→0 К R → 0 (у полупроводников и неметаллов при Т→0 К R→∞).
По ряду характерных признаков металлы делят на две группы: черные и цветные. К черным относят железо и его сплавы (стали, чугуны). Остальные металлы и сплавы на их основе – цветные.
Нередко к металлам железной группы относят Ni, Co и Мn.
Металлы с температурой плавления выше 1800 0 С называют тугоплавкими. К ним принадлежи Тi, Zг. Сг, V, Nb, Mo, Wи др.
Металлы с низкой температурой плавления (Hg, Sn, Bi, Cd, Pb, Zn, Sb и др.) относят к легкоплавким.
К легким относят металлы с низкой плотностью. К ним принадлежат нашедшие широкое техническое применение Mg, Be, Al, Ti.
Металлы (Ag, Au, Os, Ir, Pt, Rh, Pd и др.) составляют группу благородных. Они химически инертны.К благородным металлам часто относят медь, обладающую химической стойкостью в сухой атмосфере.
К редкоземельным металлам (РЗМ) относят металлы группы лантана – лантаноиды(Се, Рг, Nd и др.) и сходные с ними Y и Sc.
Металлы актиноидной (урановой) группы составляют используемые в атомной технике актиноиды (Th, Pa, U и др.).
Li, Na, К и др. (их используют в качестве теплоносителей в быстрых ядерных реакторах с высоко энергетической активной зоной) составляют группу щелочноземельных металлов.
Ряд металлов (Fe, Ni, Co, Gd), в связи с особенностями их электронного строения, обладает ферромагнетизмом –способностью сильно намагничиваться во внешнем магнитном поле. Основные свойства ферромагнетиков определяются доменной структурой их кристаллов. Домен –это область кристалла размером 10 -4 . 10 -6 м, которая при отсутствии внешнего магнитного поля спонтанно (самопроизвольно) намагничена до насыщения. Магнитные моменты отдельных доменов направлены различно, поэтому полный магнитный момент ферромагнетика равен нулю.
Занятие 2. Кристаллическое строение металлови дефекты кристаллических структур
Большинство металлов имеют кристаллическую решетку. Положительно заряженные ионы, образующие каркас металлического тела, совершают непрерывные тепловые колебания около точек, закономерно расположенных в определенных местах пространства. Эти точки являются узлами воображаемой пространственной кристаллической решетки.
Наименьший объем кристалла, при трансляции которого по координатным осями воспроизводится вся кристаллическая решетка, называется элементарной кристаллической ячейкой.Ячейка характеризуется параметрами а, Ь и с – периодами кристаллической решетки (расстояниями между атомами, расположенными на ребрах ячейки, направленных по осям х, у и z соответственно) и углами между координатными осями – a (между осями х и z), β (между у и z), γ (между x и у).
Различают простые и сложные кристаллические решетки. В элементарной ячейке простой решетки атомы (ионы) расположены только в вершинах образующего ячейку многогранника. В сложных – они могут находиться также внутри многогранника или на его гранях.
Металлы имеют сложные кристаллические решетки. В большинстве случаев – это кубическая объемно-центрированная (ОЦК), кубическая гранецентрированная (ГЦК) и гексагональная плотноупакованная (ГПУ).
В элементарной ячейке ОЦК атомы находятся в вершинах куба и внутри него, в точке пересечения пространственных диагоналей. В ячейке ГЦК атомы расположены в вершинах куба и в центре каждой грани. В ячейке ГПУ атомы находятся в вершинах правильной шестигранной призмы, в центре каждого ее основания и, кроме того, три атома заключены внутри призмы.
Размеры элементарной ячейки определяются размерами образующих ее атомов. При этом полагают, что атомы, представляемые в виде жестких шаров, касаются друг друга в направлениях ячейки с наиболее плотным их расположением.
Во многих случаях в разных температурных интервалах один и тот же металл обладает различными кристаллическими решетками. Такое явление носит название полиморфизм или аллотропия.
Важными характеристиками кристаллической решетки являются коэффициент компактности, координационное число, базис.
Коэффициент компактности – это отношение объема принадлежащих кристаллической ячейке атомов к объему всей ячейки. Следует иметь в виду, что в кристаллической решетке часть атомов, составляющих ячейку, относится не только к данной ячейке, но и к ячейкам, находящимся по соседству. Например, атом, расположенный в вершине кубической ячейки (простая кубическая, ОЦК, ГЦК) принадлежит еще семи соседним ячейкам, т.е. данной ячейке принадлежит лишь 1/8 атома.
Коэффициент компактности простой кубической решетки равен 52 %, ОЦК – 68 %, ГЦК – 74 % (столь же компактна решетка ГПУ). Остальное пространство занято порами. В ячейке ГЦК в центре расположена крупная октаэдрическая пора с радиусом, равным 0,41 радиуса атома. В ячейке ОЦК больших пор нет. Поры, расположенные на ребрах ячейки, имеют радиус, равный 0,16 радиуса атома.
Координационное число – это число атомов, находящихся в кристаллической решетке на равном наименьшем расстоянии от данного атома. Каждый атом простой кубической решетки имеет 6 ближайших соседей, расположенных на расстоянии длины ребра куба (на расстоянии периода решетки). Координационное число такой решетки обозначают К6. В ОЦК решетке у каждого атома 8 ближайших соседей и координационное число равно 8 (К8). В ГЦК и ГПУ решетках каждый атом имеет 12 ближайших соседей. Соответственно координационные числа К12 и Г12.
Чем выше координационное число, тем плотнее пространственная кристаллическая решетка материала.
Базис кристаллической решетки – это таблица координат атомов, принадлежащих элементарной ячейке, рассматриваемой в пространственных координатных осях. Базис простой кубической решетки (0,0,0), ОЦК – (0,0,0; 1/2,1/2,1/2), ГЦК – (0,0,0; 1/2,0,1/2; 0,1/2,1/2; 1/2,1/2,0).
Пространственное положение кристаллографических плоскостей (плоскостей, проходящих через определенные группы атомов кристаллической решетки), а также кристаллографических направлений характеризуется кристаллографическими индексами.
Индексы плоскости – это три целых числа, заключенных в круглые скобки и представляющих собой приведенные к целым числам значения обратных величин отрезков, отсекаемых плоскостью на осях х, у, z.За единицы длины принимают параметры решетки а, b, с. Например, плоскость, включающая пространственные диагонали куба, имеет индексы (101). Если плоскость отсекает отрицательные отрезки, то знак минус ставится над соответствующим индексом. Кристаллографические индексы отражают положение не только данной плоскости, но целого семейства плоскостей, ей параллельных.
Индексы направлений – это три числа, заключенных в квадратные скобки и представляющих собой приведенные к целым значениям координаты любой точки направления после его параллельного переноса в начало координат. За единицы принимают параметры кристаллической решетки. Например, направление совпадающее с пространственной диагональю куба, имеет индексы [111]. Если направление имеет отрицательные координаты, то над соответствующим индексом ставится знак минус.
В различных направлениях кристаллической решетки плотность расположения атомов различна, что влечет за собой различие в свойствах кристалла в зависимости от направления, в котором это свойство измерено – анизотропию. В поликристаллических телах в пределах отдельных зерен наблюдается явление анизотропии. Однако, поскольку ориентация кристаллической решетки в различных зернах различна, в целом по куску материала свойства усредняются. Поэтому реальные металлы являются изотропными,т.е. телами с примерно одинаковыми свойствами по всем направлениям. Поскольку их изотропность является не истиной, а усредненной, то их принято называть квазиизотропами. Если каким-либо способом, например давлением, сориентировать кристаллические решетки в зернах одинаково (создать текстуру деформации), то такое поликристаллическое тело станет анизотропным.
Реальные кристаллы всегда содержат дефекты – искажения правильного расположения атомов в пространстве. Различают точечные, линейные, поверхностные и объемные дефекты.
Точечные дефекты по размерам сравнимы с межатомными расстояниями. К ним относятся вакансии (отсутствие атома в узле кристаллической решетки), межузельные или дислоцированные атомы (атом находится в межузельном пространстве кристаллической решетки) и примесные атомы. Среди последних различают атомы замещения (чужеродный атом занимает место в узле кристаллической решетки) и атомы внедрения (чужеродный атом находится в межузельном пространстве решетки).
Линейные дефекты по размерам в двух направлениях сравнимы с межатомными расстояниями, а в третьем простираются на многие тысячи периодов кристаллической решетки. Важнейшими видами линейных несовершенств являются краевые (линейные) и винтовые дислокации.
Образование краевых дислокаций вызвано присутствием в кристаллической решетке неполных кристаллографических плоскостей. Такие полуплоскости, не имеющие продолжения в нижней или верхней частях кристаллической решетки, называются экстраплоскостями. Краевая дислокация представляет собой область упругих искажений, проходящих вдоль края экстраплоскости. Различают положительные и отрицательные дислокации. Положительная дислокация (ее отмечают знаком ┴.) возникает, если экстраплоскость находится в верхней части кристалла, если в нижней – отрицательная (ее отмечают знаком ┬).
Винтовая дислокация – это область упругих искажений кристаллической решетки, проходящая вдоль линии, вокруг которой атомные плоскости изогнуты по винтовой поверхности. В зависимости от направления изгиба различают правые и левые винтовые дислокации.
Дислокации (краевые и винтовые) не могут обрываться внутри кристалла. Они выходят на границы кристалла, прерываются другими дислокациями или образуют дислокационные петли.
Поверхностные дефекты малы только в одном направлении. Они представляют собой упругие искажения кристаллической решетки по границам зерен или их фрагментов (блоков мозаичной структуры). Различают большеугловые (высокоугловые) и малоугловые (низкоугловые) границы.
Большеугловые границы представляют собой области в несколько периодов кристаллической решетки, на протяжении которых решетка одной кристаллографической ориентации переходит в решетку другой ориентации. Такое строение имеют межзеренные границы.
Малоугловые границы представляют собой цепочки дислокаций (дислокационные стенки), отделяющие одну часть кристаллической решетки от другой (один блок мозаичной структуры от другого). Плотность расположения дислокаций зависит от угла между кристаллографическими плоскостями в соседних блоках. Чем угол больше (в пределах до нескольких угловых градусов), тем чаще расположены дислокации.
Объемные дефекты представляют собой искажения решетки, вызванные наличием пор, трещин, раковин и других макронарушений непрерывности кристаллической решетки.
Строение атомов металлов и их особенности
Если провести в Периодической таблице Д.И. Менделеева символическую линию из верхнего левого угла в нижний правый угол, то все элементы, находящиеся ниже этой линии, будут металлами.
Металлы можно охарактеризовать при помощи нескольких свойств, которые будут общими для всех элементов. К таким характеристикам следует отнести высокую электрическую проводимость и теплопроводность, пластичность, благодаря которой металлы можно подвергать ковке, прокатке, штамповке или вытягиванию в проволоку, металлический блеск и непрозрачность.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип> 1000 o С) и легкоплавкие (Tкип< 1000 o С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Электронное строение металлов и их особенности
Атомы металлов, также как, и неметаллов состоят из положительно заряженного ядра внутри которого находятся протоны и нейтроны, а по орбитам вокруг него движутся электроны. Однако, по сравнению с неметаллами, атомные радиусы металлов намного больше. Это связано с тем, что валентные электроны атомов металлов (электроны внешнего энергетического уровня) расположены на значительном удалении от ядра и, как следствие, связаны с ним слабее. По этой причине металлы характеризуются низкими потенциалами ионизации и легко отдают электроны (являются восстановителями в ОВР) при образовании химической связи.
Все металлы за исключением ртути представляют собой твердые вещества с атомной кристаллической решеткой. Рассмотрим строение металлов в кристаллическом состоянии. В атомах металлов имеются «свободные» электроны (электронный газ), которые могут перемещаться по кристаллу даже под действием слабых электрических полей, что обусловливает высокую электропроводимость металлов.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Запишем уравнение реакции растворения металла в воде. Поскольку металл двухвалентен, его реакция с водой будет описываться уравнением следующего вида: |
Согласно уравнению реакции:
N (Ме) =n (Н2) = 3,36/22,4 = 0,15 моль.
Найдем относительную атомную массу металла:
Ar(Ме) = m / n= 6,0/0,15 = 40 г/моль
Следовательно, этот металл — кальций.
| Задание | При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси. |
| Решение | Известно, что медь не растворяется в соляной кислоте, поскольку стоит в ряду активности металлов после водорода, т.е. выделение водорода происходит только в результате взаимодействия хлороводородной кислоты с железом. |
Запишем уравнение реакции:
Найдем количество вещества водорода:
Согласно уравнению реакции n(H2) : n(Fe) = 1:1, т.е.n(H2) = n(Fe) = 0,25 моль. Тогда масса железа будет равна (молярная масса – 56 г/моль):
Электронное строение атома
Понятие «атом» знакомо человечеству ещё со времен Древней Греции. Согласно высказыванию древних философов, атом представляет собой мельчайшую частицу, входящую в состав вещества.
Атом состоит из положительно заряженного ядра внутри которого находятся протоны и нейтроны. Вокруг ядра по орбитам движутся электроны, каждый из которых можно охарактеризовать набором из четырех квантовых чисел: главного (n), орбитального (l), магнитного (ml) и спинового (ms или s).
Главное квантовое число определяет энергию электрона и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия. Другими словами, главное квантовое число определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Главное квантовое число имеет значения ряда целых чисел от 1 до бесконечности.
Орбитальное квантовое число характеризует форму электронного облака. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т.е. расщепление её на энергетические подуровне. Орбитальное квантовое число может имеет значения от нуля до (n-1), всего n значений. Энергетические подуровни обозначают буквами:
более сложная форма
Магнитное квантовое число показывает ориентацию орбитали в пространстве. Оно принимает любое целое числовое значение от (+l) до (-l), включая нуль. Число возможных значений магнитного квантового числа равна (2l+1).
Электрон, двигаясь в поле ядра атома, кроме орбитального момента импульса обладает также собственным моментам импульса, характеризующим его веретенообразное вращение вокруг собственной оси. Это свойства электрона получило название спина. Величину и ориентацию спина характеризует спиновое квантовое число, которое может принимать значения (+1/2) и (-1/2). Положительное и отрицательное значения спина связаны с его направлением.
До того, как все вышеописанное стало известно и подтверждено экспериментально существовало несколько моделей строения атома. Одна из первых моделей строения атома была предложена Э. Резерфордом, который в опытах по рассеянию α-частиц показал, что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре. Согласно его модели, вокруг ядра на достаточно большом расстоянии движутся электроны, причем их число таково, что в целом атом электронейтрален.
Развивать модель строения атома Резерфорда стал Н. Бор, который в своем исследовании также объединил учения Эйнштейна о световых квантах и квантовую теорию излучения Планка. Завершили начатое и представили миру современную модель строения атома химического элемента Луи де Бройль и Шредингер.
| Задание | Укажите количество протонов и нейтронов, которые содержатся в ядрах азота (атомный номер 14), кремния (атомный номер 28) и бария (атомный номер 137). |
| Решение | Количество протонов в ядре атома химического элемента определяется по его порядковому номеру в Периодической таблице, а количество нейтронов – это разница между массовым числом (М) и зарядом ядра (Z). |
n (Ba)= M –Z = 137-56 = 81.
б) Орбиталям 4d, 5s, 5р, 6s будут соответствовать числа 7, 5, 6 и 6. Следовательно заполнение электронами будет происходить в следующей последовательности: 5s, 5p, 6s, 4d.
в) Орбиталям 4f, 5s, 6р; 4d, 6s будут соответствовать числа 7, 5, 76 и 6. Следовательно заполнение электронами будет происходить в следующей последовательности: 5s, 4d,6s, 4f, 6р.
г) Орбиталям 5d, 6s, 6р, 7s, 4f будут соответствовать числа 7, 6, 7, 7 и 7. Следовательно заполнение электронами будет происходить в следующей последовательности: 6s, 4f, 5d, 6р, 7s.
Строение атома
Многообразие химических соединений обусловлено различным сочетанием атомов химических элементов в молекулы и немолекулярные вещества. Способность же атома вступать в химические соединения, его химические и физические свойства определяются структурой атома. В связи с этим для химии первостепенное значение имеет внутреннее строение атома и в первую очередь структура его электронной оболочки.
Модели строения атома
В начале XIX века Д. Дальтон возродил атомистическую теорию, опираясь на известные к тому времени основополагающие законы химии (постоянства состава, кратных отношений и эквивалентов). Были проведены первые эксперименты по изучению строения вещества. Однако, несмотря на сделанные открытия (атомы одного и того же элементы обладают одними и теми же свойствами, а атомы других элементов – иными свойствами, введено понятие атомной массы), атом считали неделимым.
После получения экспериментальных доказательств (конец XIX начало XX века) сложности строения атома (фотоэффект, катодные и рентгеновские лучи, радиоактивность) было установлено, что атом состоит из отрицательно и положительно заряженных частиц, которые взаимодействуют между собой.
Эти открытия дали толчок к созданию первых моделей строения атома. Одна из перых моделей была предложена Дж. Томсоном (1904) (рис. 1): атом представлялся как «море положительного электричества» с колеблющимися в нем электронами.
После опытов с α-частицами, в 1911г. Резерфорд предложил так называемую планетарную модель строения атома (рис. 1), похожую на строение солнечной системы. Согласно планеетарной модели, в центре атома находится очень маленькое ядро с зарядом Zе, размеры которого приблизительно в 1000000 раз меньше размеров самого атома. Ядро заключает в себе практически всю массу атома и имеет положительный заряд. Вокруг ядра по орбитам движутся электроны, число которых определяется зарядом ядра. Внешняя траектория движения электронов определяет внешние размеры атома. Диаметр атома составляет 10 -8 см, в то время, как диаметр ядра много меньше -10 -12 см.
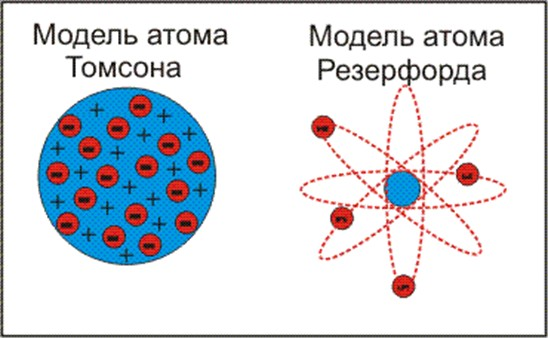
Рис. 1 Модели строения атома по Томсону и Резерфорду
Опыты по изучению атомных спектров показали несовершенство планетарной модели строения атома, поскольку эта модель противоречит линейчатой структуре атомных спектров. На основании модели Резерфорда, учении Энштейна о световых квантах и квантовой теории излучения планка Нильс Бор (1913) сформулировал постулаты, в которых заключается теория строения атома (рис. 2): электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным орбитам (стационарным), двигаясь по такой орбите он не излучает электромагнитной энергии, излучение (поглощение или испускание кванта электромагнитной энергии) происходит при переходе (скачкообразном) электрона с одной орбиты на другую.
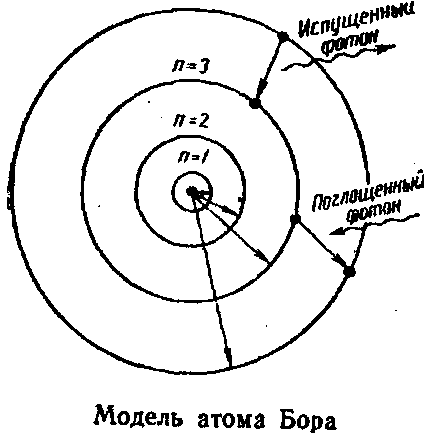
Рис. 2. Модель строения атома по Н. Бору
Накопленный экспериментальный материал, характеризующий строение атома, показал, что свойства электронов, а также других микрообъектов не могут быть описаны на основе представлений классической механики. Микрочастицы подчиняются законам квантовой механики, которая стала основой для создания современной модели строения атома.
Главные тезисы квантовой механики:
— энергия испускается и поглощается телами отдельными порциями – квантами, следовательно, энергия частиц изменяется скачкообразно;
— электроны и другие микрочастицы имеют двойственную природу – проявляет свойства и частицы, и волны (корпускулярно-волновой дуализм);
— квантовая механика отрицает наличие определенных орбит у микрочастиц (для движущихся электронов невозможно определить точное положение, т.к. они движутся в пространстве вблизи ядра, можно лишь определить вероятность нахождения электрона в различных частях пространства).
Пространство вблизи ядра, в котором достаточно велика вероятность нахождения электрона (90%), называется орбиталью.
Квантовые числа. Принцип Паули. Правила Клечковского
Состояние электрона в атоме можно описать с помощью четырех квантовых чисел.
n – главное квантовое число. Характеризует общий запас энергии электрона в атоме и номер энергетического уровня. n приобретает целочисленные значения от 1 до ∞. Наименьшей энергией электрон обладает при n=1; с увеличением n – энергия возрастает. Состояние атома, когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия минимальна, называется основным. Состояния с более высокими значениями называются возбужденными. Энергетические уровни обозначаются арабскими цифрами в соответствии со значением n. Электроны можно расположить по семи уровням, поэтому, реально n существует от 1 до 7. Главное квантовое число определяет размеры электронного облака и определяет средний радиус нахождения электрона в атоме.
l – орбитальное квантовое число. Характеризует запас энергии электронов в подуровне и форму орбитали (табл. 1). Принимает целочисленные значения от 0 до n-1. l зависит от n. Если n=1,то l=0, что говорит о том, что на 1-м уровне 1-н подуровень.
Таблица 1. Формы орбиталей
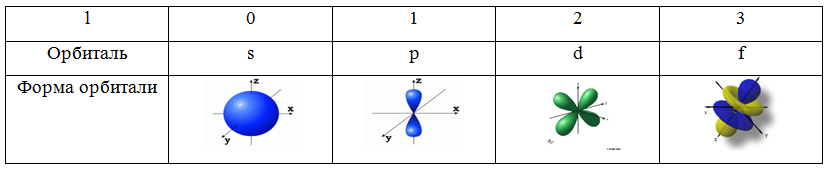
me – магнитное квантовое число. Характеризует ориентацию орбитали в пространстве. Принимает целочисленные значения от –l через 0 до +l. Так, при l=1 (p-орбиталь), me принимает значения -1, 0, 1 и ориентация орбитали может быть различной (рис. 3).
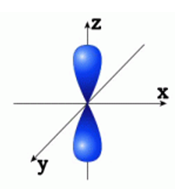
Рис. 3. Одна из возможных ориентаций в пространстве p-орбитали
s – спиновое квантовое число. Характеризует собственное вращение электрона вокруг оси. Принимает значения -1/2(↓) и +1/2 (↑). Два электрона на одной орбитали обладают антипараллельными спинами.
Состояние электронов в атомах определяется принципом Паули: в атоме не может быть двух электронов с одинаковым набором всех квантовых чисел. Последовательность заполнения орбиталей электронами определяется правилами Клечковского: орбитали заполняются электронами в порядке возрастания суммы (n+l) для этих орбиталей, если сумма (n+l) одинакова, то первой заполняется орбиталь с меньшим значением n.
Однако, в атоме обычно присутствуют не один, а несколько электронов и, чтобы учесть их взаимодействие друг с другом используют понятие эффективного заряда ядра – на электрон внешнего уровня действует заряд, меньший заряда ядра, вследствие чего внутренние электроны экранируют внешние.
Основные характеристики атома: атомный радиус (ковалентный, металлический, ван-дер-ваальсов, ионный), сродство к электрону, потенциал ионизации, магнитный момент.
Электронные формулы атомов
Все электроны атома образуют его электронную оболочку. Строение электронной оболочки изображается электронной формулой, которая показывает распределение электронов по энергетическим уровням и подуровням. Число электронов на подуровне обозначается цифрой, которая записывается справа вверху от буквы, показывающей подуровень. Например, атом водорода имеет один электрон, который расположен на s-подуровне 1-го энергетического уровня: 1s 1 . Электронная формула гелия, содержащего два электрона записывается так: 1s 2 .
5B 1s 2 2s 2 2p 1
У атомов некоторых элементов, наблюдается явление «проскока» электрона с внешнего энергетического уровня на предпоследний. Проскок электрона происходит у атомов меди, хрома, палладия и некоторых других элементов. Например:
24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
Связь электронного строения атома с положением элемента в Периодической системе
Номер группы для элементов главных подгрупп равен числу электронов на внешнем энергетическом уровне, такие электроны называют валентными (они участвуют в образовании химической связи). Валентными электронами у элементов побочных подгрупп могут быть электроны внешнего энергетического уровня и d-подуровня предпоследнего уровня. Номер группы элементов побочных подгрупп III-VII групп, а также у Fe, Ru, Os соответствует общему числу электронов на s-подуровне внешнего энергетического уровня и d-подуровне предпоследнего уровня
Задания:
Изобразите электронные формулы атомов фосфора, рубидия и циркония. Укажите валентные электроны.
Ответ:
15P 1s 2 2s 2 2p 6 3s 2 3p 3 Валентные электроны 3s 2 3p 3
37Rb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1 Валентные электроны 5s 1
40Zr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 2 5s 2 Валентные электроны 4d 2 5s 2
Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns 1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами. С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О. Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns 2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns 2 nр 1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы. Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам. Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
Читайте также:
