Элемент образует оксид состава э2о3 и простое вещество металл
Обновлено: 01.06.2024
Элемент образует оксид состава Э2О3 и простое вещество-металл. Символ этого элемента:
а) P; б) Mg; в) Al; г) K
Для этого элемента составьте электронную схему атома и подчеркните валентные электроны, укажите атомный номер, номера периода и группы, вид подгруппы
Металл-Al
заряд ядра +13 ,3 энергетических уровня, на 1-ом 2, 2-ом 8, 3-ем 3
валентность не помню, атомный номер-это что, думаю, что 13. период 3, 3 группа, главная подгруппа.
2Na + O2 = Na2O2 ( пероксид натрия)
1) CaF2 - ионная связь
2) K2O - ионная связь
3) PbS - ионная связь
4) Ca - металлическая связь
Прошу вас.
Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. Элементарную природу серы установил Лавуазье в опытах по сжиганию
3 малый период, VI группа, главная подгруппа.
(Электронно-графическая формула в фото 1)
Степень окисления: -2, 0, +4,+6
Валентность: IV, VI
Высший оксид: SO3, летучее водородное соединение: H2S
Нахождение в природе:
- в самородном виде:
Cера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже в глубокой древности.
- в виде соединений:
PbS – свинцовый блеск,
ZnS – цинковый блеск (цинковая обманка)
FeS2 – пирит (серный колчедан)
Для серы характерно явление аллотропии.\
Ромбическая сера – это наиболее устойчива модификация, состоит из молекул S8. Кристаллы имеют лимонно-желтый цвет и полупрозрачны, Tпл.= 112,8 °С.
Моноклинная сера имеет вид желтых игольчатых кристаллов, Tпл.= 119,3 °С.
Пластическая сера – Вязкая тёмно-коричневая масса, которая через несколько дней снова превращается в ромбическую.
Сера в химических реакциях проявляет окислительные и восстановительные свойства.
1. Сера взаимодействует с металлами. При этом образуются соли - сульфиды:
2Al + 3S → Al2S3 (сульфид алюминия)
Cu + S → CuS (сульфид меди (II))
Hg + S → HgS (сульфид ртути (II))
2. При повышенной температуре реагирует с водородом:
S + H2→ H2S (сероводород)
3. Сера горит в кислороде голубоватым пламенем.
4. Сера реагирует с галогенами:
Основные отрасли применения:
- для производства серной кислоты
- для производства бенгальских огней
- для производства бумаги
- Изготовление веществ для удобрения растений.
- Получения цветных металлов.- Для придачи стали дополнительных свойств.- Для изготовления спичек, материалов для взрывов и пиротехники.- Для производства краски, волокон - Для отбеливания ткани.получение:самородную серу добывают непосредственно из пластов в недрах земли. Ее потом очищают разными методами.
Определение формулы оксида с использованием последовательно-разветвленного, так и встречного алгоритмов
Задача 158
Массовая доля кислорода в оксиде некоторого элемента составляет 56,34% . Определите формулу этого оксида.
Дано: массовая доля кислорода: (О)(в оксиде) = 56,34% .
Найти: формулу оксида.
Решение:
В данной задаче также возможен как последовательно-разветвленный, так и встречный алгоритм. Рассмотрим оба способа решения.
I способ (последовательно-разветвленный алгоритм).
В аналогичном примере решения такой задачи (№ 1.115) мы применили следующий алгоритм:
Для определения количества вещества искомого элемента по количеству вещества кислорода (переход n(О) — > n(Э)) мы пользовались индексами в общей формуле искомого вещества. В данном случае в условии нет данных, позволяющих определить эти индексы. Следовательно, решение данной задачи возможно только путем подбора индексов в формуле. Для этого необходимо перебрать все возможные степени окисления (с.о.) неизвестного элемента и по ним составить общую формулу. По определению класса оксидов искомый элемент может проявлять степени окисления, выражающиеся положительными целыми числами. Максимальная степень окисления определяется химическими свойствами и ограничивается значением (+8). Наш алгоритм на этом этапе (n(О) ⇔ n(Э)) будет иметь альтернативный характер:
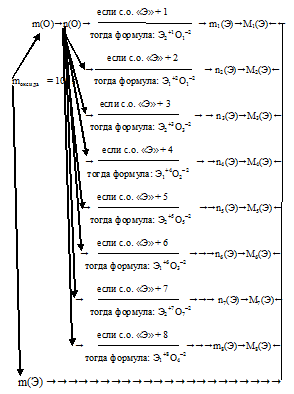
При каждом значении степени окисления (с.о.) мы определяем молярную массу искомого элемента и сопоставляем ее с массовыми числами в Периодической системе. Решением будет являться тот вариант, при котором вычисленное значение молярной массы совпадет со значением молярной массы какого-либо элемента. Причем найденный элемент должен реально проявлять использованную при его расчете степень окисления.
Выбираем образец массой 100 г. В нем содержится 56,34 г кислорода (по значению массовой доли кислорода).
Определяем массу искомого элемента в выбранном образце:
m(Э) = 100 – m(О) = 100 – 56,34 = 43,66 г.
Находим количество вещества атомарного кислорода:
Приступим к перебору степеней окисления:
а) Пусть степень окисления искомого элемента (+1), тогда формула оксида будет иметь вид Э2О.
n(Э+1) > п(О –2 ) в 2 раза (по индексам в предполагаемой формуле)
По Периодической системе находим элемент с молярной массой атомов 6,2 г/моль. Наиболее близка молярная масса лития: М(Li) = 6,9 г/моль. Он проявляет степень окисления (+1) при образовании оксида Li2О, но согласование между расчетной молярной массой и табличной не очень удовлетворительно. Поэтому в данном случае разумно продолжить перебор. Переходим к следующему значению степени окисления.
б) Пусть степень окисления искомого элемента (+2), тогда формула оксида будет иметь вид ЭО.
n(Э+2) = п(О –2 ) (по индексам в предполагаемой формуле)
n(Э+2) = 3,521 моль.
По Периодической системе находим элемент с молярной массой атомов 12,4 г/моль. Наиболее близка молярная масса атомов углерода: М(С) — 12 г/моль. Он проявляет степень окисления (+2) при образовании оксида СО. В данном случае согласование между расчетной молярной массой и табличной лучше, чем для лития, но не идеально. Поэтому разумно продолжить перебор. Переходим к следующему значению степени окисления.
в) Пусть степень окисления искомого элемента (+3), тогда формула оксида будет иметь вид Э2О3.
на 2 моль Э+3 приходится 3 моль (О2–) по записи формулы)
на х моль Э+3 приходится 3,521 моль (О2– ) (по условию) < /p>
По Периодической системе находим элемент с молярной массой атомов 18,6 г/моль. Наиболее близка молярная масса атомов фтора: М(F) = 19 г/моль.
Но фтор с кислородом образует не оксид, а фторид кислорода (ОГ2 ) и проявляет в нем степень окисления (–1), следовательно, этот вариант не подходит вовсе. Переходим к следующему значению степени окисления.
г) Пусть степень окисления искомого элемента (+4), тогда формула оксида будет иметь вид ЭО2.
По Периодической системе находим элемент с молярной массой атомов 24,8 г/моль. Наиболее близка молярная масса атомов магния: M(Мg) = 24,3 г/моль. Но магний не проявляет степень окисления (+4), следовательно, этот вариант не подходит. Переходим к следующему значению степени окисления.
д) Пусть степень окисления искомого элемента (+5), тогда формула оксида будет иметь вид Э2О5.
По Периодической системе находим элемент с молярной массой атомов 31 г/моль. Идеально подходит молярная масса атомов фосфора: М(P) = 31 г/моль. Он проявляет степень окисления (+5) при образовании оксида Р2O5. В данном случае согласование между расчетной молярной массой и табличной идеальное, что позволяет однозначно определить правильный ответ: Р2О5.
е) Пусть степень окисления искомого элемента (+6), тогда формула оксида будет иметь вид ЭО3.
По Периодической системе находим элемент с молярной массой атомов 37,2 г/моль. Ни одно из значений массовых чисел не согласуется с рассчитанной молярной массой. Следует отметить, что один из распространенных природных изотопов хлора имеет молярную массу 37 г/моль. Но хлор не удовлетворяет условию согласования степени окисления. Он проявляет нечетные степени окисления, следовательно, этот вариант не подходит.
Переходим к следующему значению степени окисления.
По Периодической системе находим элемент с молярной массой атомов 43,4 г/моль. Ни одно из значений массовых чисел не согласуется с рассчитанной молярной массой, следовательно, этот вариант не подходит. Переходим к следующему значению степени окисления.
з) Пусть степень окисления искомого элемента (+8), тогда формула оксида будет иметь вид ЭО4.
По Периодической системе находим элемент с молярной массой атомов 49,6 г/моль. Ни одно из значений массовых чисел не согласуется с рассчитанной молярной массой, следовательно, этот вариант не подходит.
Ответ: идеально согласуется с условием задачи Р2О5.
II способ (встречный алгоритм).
Встречный алгоритм решения выглядbn следующим образом:
Этот алгоритм можно использовать без изменения и для решения данной задачи, но для его применения необходимо составить общую формулу искомого оксида. Обозначим неизвестную степень окисления искомого элемента буквенной переменной «k». В этом случае формула оксида будет иметь вид: Э2 +k Оk –2. Применим предложенный алгоритм.
Запишем выражение для молярной массы Э 2 +k О k –2 :
М( Э 2 +k О k –2 ) = 2 . М(Э) + k . М(О) = (2 . М(Э) + k . 16) г/моль.
Масса 1 моль Э 2 +k О k –2 составляет (2 . М(Э) + k . 16) г. Масса кислорода в ней (k . 16) г.
Составим выражение для массовой доли кислорода, используя данные, полученные по молярной массе.
Приравниваем полученное выражение к значению массовой доли кислорода из условия
Получили одно уравнение с двумя неизвестными: М(Э) и «kс». Оно имеет множество решений, но нам необходимо выбрать лишь то, которое удовлетворяет физическому смыслу. Переменная «k» обозначает степень окисления неизвестного элемента и индекс в формуле, поэтому физическому смыслу могут удовлетворять значения целых положительных чисел от 1 до 8. Для нахождения верного ответа будем последовательно подставлять в полученное уравнение значения «k» и вычислять значения молярной массы искомого элемента М(Э). Далее будем сопоставлять ее с массовыми числами в Периодической системе. Решением будет являться тот вариант, при котором вычисленное значение молярной массы совпадет со значением молярной массы какого-либо элемента. Причем найденный элемент должен реально проявлять использованную при его расчете степень окисления.
Значения М(Э), полученные при решении уравнения отразим в таблице:
Степень
окисления
«k»
Ответ: идеально согласуется с условием задачи Р2О5. Решение данной задачи позволяет сделать следующий вывод.При согласовании расчетных значений молярной массы и степени окисления должны обязательно выполняться два условия:
1.Элемент, с полученной в результате расчета молярной массой атомов, должен существовать в Периодической системе Д.И. Менделеева.
2. Удовлетворяющий условию элемент в действительности должен быть способен проявлять степень окисления, использованную при его вычислении в этом шаге подбора.
И только при выполнении обоих условий можно использовать найденный элемент для формирования ответа задачи. Если хотя бы одно из условий не выполняется, следует продолжить перебор степеней окисления неизвестного элемента. Здесь следует заметить, что вариантов перебора для каждого элемента не очень много. Причиной этому служит ряд ограничений, накладываемых химией. 1. Числовое значение степени окисления, как правило, является целочисленным. 2. Знак степени окисления: (+) или (-), неизвестного элемента часто можно определить по другим, известным элементам. 3. Положительные степени окисления могут принимать значения целых чисел от «+1» до «+8 ». 4. Отрицательные степени окисления, в большинстве случаев, укладываются в интервал целых значений от (-1) до (-4).
Комментарии:
На самом деле существуют соединения, в которых у некоторых элементов степень окисления не целочисленная. Например, К +1 О –1/3 — озонид калия (степень окисления кислорода в нем –1/3); Nа +1 О2 –1/2 — а супероксид натрия (степень окисления кислорода в нем –1/2). Такие значения степеней окисления не противоречат определению этого понятия: степень окисления — условный заряд атома, вычисленный в предположении полностью ионной связи.
Но такие соединения встречаются относительно редко, и подобные задачи с их использованием не составляются.
Элемент образует оксид состава Э2О3 и простое вещество - металл?
Элемент образует оксид состава Э2О3 и простое вещество - металл.
Символ этого элемента : а) P ; б) Mg ; в) Al ; г) K Для этого элемента составьте электронную схему атома и подчеркните валентные электроны, укажите атомный номер, номера периода и группы, вид подгруппы.

Металл - Al$Al _ O _$
заряд ядра + 13 , 3 энергетических уровня, на 1 - ом 2, 2 - ом 8, 3 - ем 3
валентность не помню, атомный номер - это что, думаю, что 13.
Период 3, 3 группа, главная подгруппа.

Сложное вещество образованное химическим элементом с номер 26 и элементом с электронной схемой атом 2e, 6e( атомы химического элемента с атомным номером 26 проявляют валентность равную трём) нагревают?
Сложное вещество образованное химическим элементом с номер 26 и элементом с электронной схемой атом 2e, 6e( атомы химического элемента с атомным номером 26 проявляют валентность равную трём) нагревают в токе простого вещества образованного атомами химического элемента с атомным номером 1, найдите объем вступающего в реакцию простого вещества если масса исходного сложного вещества равно 10г.

Напишите формулы высших оксидов элементов с атомными номерами 4, 12, 20 и расположите их в порядке усиления основных свойств?
Напишите формулы высших оксидов элементов с атомными номерами 4, 12, 20 и расположите их в порядке усиления основных свойств.
Для элемента, образующего наиболее основной оксид, составьте электронную формулу атома, изобразите расположение валентных электронов по орбиталям атома, находящегося в основном и возбужденном состояниях, и определите возможные валентности атома.
Составьте электронную и графическую формулы высшего гидроксида этого элемента и укажите тип химической связи между атомами.

Охарактеризуйте элемент с атомным номером 16 (изотоп с массовым числом 32), исходя из его положения в Периодической системе химических элементов и строения атома, по следующему плану : а) химический с?
Охарактеризуйте элемент с атомным номером 16 (изотоп с массовым числом 32), исходя из его положения в Периодической системе химических элементов и строения атома, по следующему плану : а) химический символ и название элемента ; б) номер периода, группы и вид подгруппы ; в) заряд и состав ядра атома ; г) общее число электронов в атоме и число электронов на внешнем энергетическом уровне ; д) схема строения электронной оболочки атома ; е) свойства простого вещества, образуемого атомами этого элемента (металлические или неметаллические).
Охарактеризуйте элемент с порядковым номером 12, исходя из его положения в Периодической системе химических элементов и строения атома по плану : - Химический символ и название элемента - Атомный номе?
Охарактеризуйте элемент с порядковым номером 12, исходя из его положения в Периодической системе химических элементов и строения атома по плану : - Химический символ и название элемента - Атомный номер, номера периода и группы, подгруппа - Заряд и состав ядра атома - Электронная формула атома, электронное семейство - Формула и свойство простого вещества (металлические или неметаллические) - Формулы высшего оксида и гидроксида, газообразного водородного соединения и их свойства (основные, кислотные или амфотерные).

Составить полную характеристику элемента по плану?
Составить полную характеристику элемента по плану.
План Основные характеристики элемента
Количество протонов, электронов, нейтронов
Период, ряд, группа, подгруппа
Атомная масса 2.
Высшая валентность 3.
Металл, неметалл, переходный элемент
Формула гидроксида 4.
Cравнение свойств простого вещества со свойствами соседних элементов (металлические, неметаллические ; окислительные, восстановительные)

Выберите правильное утверждение : а) Число энергетических уровней в атомах элементов равно номеру периода б) общее число электронов в атоме химического элемента равно номеру группы в) число электронов?
Выберите правильное утверждение : а) Число энергетических уровней в атомах элементов равно номеру периода б) общее число электронов в атоме химического элемента равно номеру группы в) число электронов на внешнем уровне атомов элементов одной группы главной подгруппы одинаково.
Охарактеризуйте элемент с порядковым номером 17, исходя из его положения в Периодической системе химических элементов и строения атома по плану : - Химический символ и название элемента - Атомный номе?
Охарактеризуйте элемент с порядковым номером 17, исходя из его положения в Периодической системе химических элементов и строения атома по плану : - Химический символ и название элемента - Атомный номер, номера периода и группы, подгруппа - Заряд и состав ядра атома (массовое число 37) - Электронная формула атома, электронное семейство - Формула и свойство простого вещества (металлические или неметаллические) - Формулы высшего оксида и гидроксида, газообразного водородного соединения и их свойства (основные, кислотные или амфотерные)
Укажите химический элемент третьего периода , атомы которого имеют 5 валентных электронов ?
Укажите химический элемент третьего периода , атомы которого имеют 5 валентных электронов .
Для этого элемента изобразите схему строения атома ; составьте формулы водородного соединения , высшего оксида .
По номеру группы, в которой расположен химич?
По номеру группы, в которой расположен химич.
Элемент, можно определить : а) число электронов в атоме б) число электронов на в.
В атоме элемента главной подгруппы в) число элементов на в.
Охарактеризуйте элемент с атомным номером 12?
Охарактеризуйте элемент с атомным номером 12.
Исходя из его положения в Периодической системе химических элементов и строения атома, по следующему плану : а)хим.
Символ и название элемента ; б)номер периода, группы и вид подгруппы ; в)заряд и состав ядра атома ; г) общее число электронов в атоме и число электронов на внешнем энергетическом уровне ; д) схема строения электронной оболочки атома ; е)свойства простого вещества, обращуемоно атомами этого элемента.
Вы находитесь на странице вопроса Элемент образует оксид состава Э2О3 и простое вещество - металл? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 1 - 4 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.

1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..

Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.

Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.

В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.
Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Символ этого элемента : а)P.
Г)K Для этого элемента составте электронную схему атома подчеркните валентные электроны укажите атомный номер, номера периода и группы, вид подгруппы.
Этот элемент - Al (алюминий).
Атомный номер 13 ; № периода - III ; №группы - 3 ; главная подгруппа ; 2e, 8e, 3e.
Решение во вложении, если будут вопросы - объясню : ).

Охарактеризуйте элементы с порядковым номером 17, исходя из его положения в Периодической системе химических элементов и строения атомов по плану : - химические символы и названия элемента ; - атомный?
Охарактеризуйте элементы с порядковым номером 17, исходя из его положения в Периодической системе химических элементов и строения атомов по плану : - химические символы и названия элемента ; - атомный номер, номера периода и группы, подгруппа ; - заряд и состав ядра атома(массовое число 37) ; - электронная формула атома, электронное семейство ; - формула и свойства простого вещества(металлические или неметаллические) - формулы высшего отсюда и гидроксида, разнообразного водородного соединения и их свойства ( основные, кислотные или амфотерные).
Помогите пожалуйста, очень необходимо?
Помогите пожалуйста, очень необходимо!
Символ этого элемента : а) Р б)Mg в)Аl г) К Для этого элемента составьте электронную схему его атома и подчеркните валентные электроны, укажите атомный номер, номера периода и группы, вид подгруппы и тип химической связи между атомами в его оксиде.
Составьте электронную схему для алюминия, подчеркните валентные электроны, укажите атомный номер, номера периода и группы, вид подгруппы?
Составьте электронную схему для алюминия, подчеркните валентные электроны, укажите атомный номер, номера периода и группы, вид подгруппы.
Число валентных электронов у атома элемента с атомным номером 15?
Число валентных электронов у атома элемента с атомным номером 15.
Опишите строение атома элемента с порядковым номером 30 по следующему алгоритму : период, группа, заряд ядра, подгруппа, количество протонов, нейтронов, электронов, энергетических уровней, электронная?
Опишите строение атома элемента с порядковым номером 30 по следующему алгоритму : период, группа, заряд ядра, подгруппа, количество протонов, нейтронов, электронов, энергетических уровней, электронная формула, валентные электроны.
Напишите его высший оксид, гидроксид.
Изобразите символы элементов, укажите заряд ядер их атомов, составьте схему расположения электронов по энергетическим уровням, определите положение (период, группа, подгруппа) и характер элементов (ме?
Изобразите символы элементов, укажите заряд ядер их атомов, составьте схему расположения электронов по энергетическим уровням, определите положение (период, группа, подгруппа) и характер элементов (металл, неметалл, газ) с порядковыми номерами 11 и 15.
Охарактеризуйте элемент с атомным номером 15, изотоп с массовым числом 31, исходя из его положения в периодической системе химических элементов и строения атома, последующему плану : а)химический сисв?
Охарактеризуйте элемент с атомным номером 15, изотоп с массовым числом 31, исходя из его положения в периодической системе химических элементов и строения атома, последующему плану : а)химический сисвол и название элемента б)номера периода, группы и вид подгруппы в)заряд и состав ядра атома г)общее число электронов в атоме и число электронов на внешнем энергетическом уровне д)схема строения электронной оболочки атома е)свойства простого вещества, образованного атомами этого элемента(металлические и неметаллические) Составьте схему образования химической связи между атомами этого элемента и атомами элемента водорода, укажите вид химической связи между атомами и в сторону атомов какого элемента смещаются общие электронные пары.
Охарактеризуйте элемент с атомным номером 7?
Охарактеризуйте элемент с атомным номером 7.
Исходя из его положения в Периодической системе химических элементов и строения атома, по следующему плану :
а) химический символ и название элемента ; б) номер периода, группы и вид подгруппы ; в) заряд и состав ядра атома ; г) общее число электронов в атоме и число электронов на внешнем энергетическом уровне ; д) схема строения электронной оболочки атома ; е) свойства простого вещества, образуемого атомами этого элемента.
Напишите электронную формулу элемента, атомный номер который 20?
Напишите электронную формулу элемента, атомный номер который 20.
Определив валентность этого элемента, составьте формулы его оксида и гидроксида.
Охарактеризуйте элемент с атомным номером 7 ?
Охарактеризуйте элемент с атомным номером 7 .
Исходя из его положения в периодической системе химических элементов и строения атома , по следующему Плану : а) химический символ и название элемента ; б) номер периода , группы и вид подгруппы ; в) заряд и состав ядра атома ; г) общее число элемента в атоме и число электронов в атоме и число электронов на внешнем энергетическом уровне ; д) схема строения электронной оболочки атома ; е) свойства простого вещества , образуемого атома этого элемента.
Вы открыли страницу вопроса Элемент образует оксид состава Э2О3 и простое вещество - металл?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 5 - 9 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Металл образует амфотерный оксид состава Э2О3?
Электроная схема этого атома : а) 2е 2е, б) 2е 4е, в)2е 1е, г)2е 8е 3е.
Г)2е 8е 3е - 13 электронов, это Al
Верны ли следующие суждения об ионах?
Верны ли следующие суждения об ионах?
А. Отрицательный ион образуется при присоединении электронов атомом элемента - неметалла.
Б. Положительный ион образуется при отдаче электронов атомом элемента - металла.
Щелочноземельные металлы образуют оксиды :1?
Щелочноземельные металлы образуют оксиды :
Не образуют оксиды.
Выберите правильный ответ?
Выберите правильный ответ.
1. Ковалентная неполярная связь в молекуле простых веществ, например, в молекуле хлора образуется :
а) между атомами металла и неметалла ;
б) между разными атомами неметаллов ;
в) между атомом серы и атомом хлора ;
г) между одинаковыми атомами неметаллов ;
д) за счет перехода электронов от одного атома к другому
Металлическая связь в металлах, железе образуется :
б) между одинаковыми атомами неметаллов ;
в) между атомом хлора и атомом металла ;
г) между металлами ;
д) за счет перехода электронов, общих для всех ионов металла.
Электронная схема атома серы?
Электронная схема атома серы?
Пожалуйста помогите составить характеристику кальция по плану 1?
Пожалуйста помогите составить характеристику кальция по плану 1.
Положение элемента в периодической системе.
Период, группа, подгруппа.
2, Порядковый номер, заряд ядра, количество протонов, количество электронов, количество нейтронов.
3. Электронное строение атома.
4. Возможные валентные состояния атома.
5. Металл, неметалл, амфотерный металл.
6. Высший оксид элемента, его характер.
7. Гидроксид элемента, его характер.
8. Пример формул солей.
9. Водородные соединения.
Схема электронного строения атома 2е 8е 4е его высший оксид h2sio3 h2co3 co2 sio?
Схема электронного строения атома 2е 8е 4е его высший оксид h2sio3 h2co3 co2 sio.
Элемент, имеющий электронную конфигурацию 1s2, 2s2, 2p6, 3s2, 3p6, 4s2 образует оксид и гидроксид , имеющий свойства 1) оксид - амфотерные , гидроксид - основные 2)оба амфотерные 3)оксид - основные , ?
Элемент, имеющий электронную конфигурацию 1s2, 2s2, 2p6, 3s2, 3p6, 4s2 образует оксид и гидроксид , имеющий свойства 1) оксид - амфотерные , гидроксид - основные 2)оба амфотерные 3)оксид - основные , гидроксид - амфотерные 4) оба основные.
Электронная схема атома азота?
Электронная схема атома азота.
Электронная схема 2e, 6e соответствует атомам элемента металла : а) да б) нет?
Электронная схема 2e, 6e соответствует атомам элемента металла : а) да б) нет.
Реагирует ли амфотерный оксид с металлами или водой?
Реагирует ли амфотерный оксид с металлами или водой?
ZN0 реагирует ли с Ag или водой?
На этой странице сайта вы найдете ответы на вопрос Металл образует амфотерный оксид состава Э2О3?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 - 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
Читайте также:
