Фазовые превращения в металлах
Обновлено: 05.07.2024
В работе предложены аналитические выражения для расчета критических температур, тепловых эффектов фазовых превращений и структурных параметров сосуществующих фаз.
где: I1 – первый ионизационный потенциал;
К – координационное число атомов.
m = 0.041666
n
- целое положительное число
Энергия одной связи для решетки с координационным числом К кратна кванту энергии mI1:
При фазовых превращениях энергия связи электрона изменяется дискретно. При этом скачкообразно изменяется координационное число и объем металла, выделяется или поглощается тепловая энергия.
Тепловые эффекты фазовых превращений:
– Полиморфного превращения
При n=1,2,3….24 координационное число
принимает значения К =24,12,8,6,4,3,2,1.
МЕТОД РАСЧЕТА ФАЗОВЫХ ПРЕВРАЩЕНИЙ В МЕТАЛЛАХ И СПЛАВАХ
МЕТОДЫ РАСЧЕТА ФАЗОВЫХ ПРЕВРАЩЕНИЙ В МЕТАЛЛАХ И СПЛАВАХ
Д У. Смагулов, А.Р, Толеуова
Республика Казахстан
Казахский национальный технический университет
им. К.И. Сатпаева
Энергия образования кристаллического вещества равна :
Уравнения (3,4) позволяют рассчитать также координационные числа атомов
в жидких и твердых фазах, образующиеся при нагреве или охлаждении металла,
а также их изменения при фазовых переходах.
При температурах фазовых переходов, когда устанавливается критическое расстояние между соседними ионами, должно выполнятся следующее условие :
:
Расчет температур фазовых переходов в чистых металлах :
где:
где: - температуры испарения, плавления и полиморфного превращения.
• Выражения (1-6) применимы и для расчета фазовых превращений в сплавах. В этом случае энергии связи атомов и тепловые эффекты превращений будут зависимыми, кроме температуры, также и от состава фаз.
• Если известны температурные и концентрационные зависимости тепловых эффектов фазовых переходов в сплавах, тогда можно определить коэффициенты распределения компонентов между равновесными фазами. В этом случае появляется возможность по ранее предложенной авторами методике [4] с помощью ЭВМ рассчитать любые фазовые превращения в многокомпонентных сплавах и расчетным путем построить их фазовые диаграммы.
• В работе расчетным путем определены параметры , nж, nт, тепловые эффекты Нисп, qпл, qпп и энергии образования ряда элементов периодической системы, для которых в литературе имеются надежные экспериментальные данные о теплотах образования и фазовых переходов. Кроме того, расчетным путем определялись температуры Тисп и Тпл, а также структурные характеристики жидких и твердых фаз, образующихся при охлаждении или нагреве ряда металлов (Таблица 1).
• Примеры политермических разрезов диаграмм состояния многокомпонентных систем, построенные расчетным путем и экспериментально, приведены в работах [5, 6].
2. Расчет фазовых равновесий в трехкомпонентных
металлических системах
Существующие методы термодинамического расчета фазовых равновесий и построения диаграмм состояния не позволяют количественно описать процесс формирования фазового состава и структуры конкретных сплавов заданного состава.
В работе получены аналитические зависимости между составами исходных сплавов, составами и относительными количествами равновесных фаз и коэффициентами распределения компонентов, позволяющие рассчитать составы и относительные количества фаз в зависимости от температуры и состава исходного сплава (число компонентов сплава n= 2,3, …N) .
• Состав жидкой фазы Хn (n=А,В,С индексы компонентов) рассчитывается:
• Состав твердой фазы, находящейся в равновесии с жидкой при заданной температуре, определяется, как:
- грамм-атомные доли компонентов А, В и С в твердой () и жидкой (Ж) фазах,
- грамм-атомные доли компонентов А, В и С в исходном сплаве.
• Относительные количества твердой
и жидкой (1-
)
фаз
можно определить из уравнении:
• Например, при кристаллизации тройных твердых растворов
температуры ликвидуса и солидуса определяются из условий:
где:
Расчет процесса кристаллизации многокомпонентных твердых растворов,
где число компонентов n3
Для многокомпонентных систем в случае двухфазных равновесий +ж
зависимости между составами исходного сплава
, жидкой
и твердой
фазами, а также коэффициентами распределения компонентов также имеют вид:
где: i – индекс компонента сплава (i=1n):
T - относительное количество твердой фазы при заданной температуре Т0К.
Для определения относительной доли твердой фазы Т:
Определяя концентрационные и температурные зависимости коэффициентов распределенияв многокомпонентных сплавах независимыми способами, из уравнений () можно найти долю равновесных твердой (Т) и жидкой (1-Т) фаз при любой температуре, рассчитать их составы и определить положения конод.
Температуры ликвидуса и солидуса многокомпонентных сплавов также могут быть определены из условий:
4 Расчет неравновесной кристаллизации твердых растворов
При разработке метода расчета весь процесс неравновесной кристаллизации сплава рассматривается как сумма начальных моментов кристаллизации набора сплавов, составы которых соответствуют составу жидкой фазы, остающейся после каждой стадии кристаллизации. Согласно теории Бартона, Прим и Слихтора на границе кристалл - жидкий раствор имеет место равновесие между жидкой и твердой фазами. Тогда первые кристаллы твердой фазы на любой стадии процесса кристаллизации будут иметь составы, соответствующие равновесной диаграмме состояния. В этом случае для любой стадии процесса неравновесной кристаллизации можно использовать уравнения, полученные для случая равновесной кристаллизации сплавов. При этом необходимо только знание зависимостей равновесных коэффициентов распределения компонентов сплава от температуры.
Тогда, из условий
Находим температуру ликвидуса Тл.
Состав первых кристаллов твердого раствора: Хi = Кi (Тл).Хi.
За время 1 температура сплава понижается до Тi =Тл-1, где - скорость охлаждения сплава. При этом коэффициенты
распределения компонентов изменяются от Кi(Тл) до Кi(Т1), и закристаллизуется определенная доля твердой фазы
.
Состав кристаллов твердого раствора Хi(Т1) и оставшейся жидкой фазы
при температуре Т10К:
при температуре Т10К:
При изменении температуры на Т=2, Т2= Т1- Т= Т1-2.
Составы равновесных фаз к концу второй стадии процесса кристаллизации:
Приведенные здесь вычисления повторяются до тех пор, пока не закончится кристаллизация сплава.
В момент окончания процесса кристаллизации количество твердой фазы М должно равняться
исходному количеству сплава М0, , а ее доля; =
.
Выводы:
Для расчета общего количества твердой фазы m-n и ее относительной доли Sn после n-й стадий процесса кристаллизации:
m-n= m-1+ m-2+…+ m-n ,
Sn= 1+(1- 1)2+(1- 1) (1- 2) 3+…+(1- 1) (1- 2)… (1- n-1) n .
Температуру при которой Sn становится равной единице, примем за температуру неравновесного солидуса. Общее время кристаллизации сплава (0) при заданной скорости охлаждения равно: 0=(Тлик-Тсолид) .
1.Предложен метод расчета фазовых равновесий в многокомпонентных металлических системах и построения их диаграмм состояния, основанный на впервые сформулированных условиях определения критических точек фазовых превращений с использованием температурных и концентрационных зависимостей коэффициентов распределения компонентов. Установлены аналитические зависимости между коэффициентами распределения компонентов, средним химическим составом сплавов, составом и относительными количествами равновесных фаз. Предложенный метод позволяет количественно описать процесс формирования фазового состава и структуры сплавов при равновесных и неравновесных условиях охлаждения.
2. Предложены математические модели изменения избыточных химических потенциалов компонентов при фазовых переходах и произведения растворимостей компонентов при выделении кристаллов химических соединений в сплавах систем на основе алюминия и меди. Разработаны программы расчета фазовых превращений в равновесных и неравновесных условиях охлаждения.
3. Расчетным методом, а также методами микроскопического, дифференциально-термического и микрорентгеноспектрального анализов исследованы фазовые равновесия в сплавах систем Al-Cu-Si, Al-Ni-Si, Al-Si-Cu-Ni. Показано хорошее соответствие между расчетными и опытными данными.Впервые установлено, что в сплавах изученных систем имеет место ряд безвариантных эвтектических и перитектических превращений. Уточнены положения критических точек.
Превращения в металлах и сплавах в твердом состоянии
Превращения в металлах и сплавах в твердом состоянии по своей физической сущности во многом напоминают кристаллизацию жидких металлов. Эти превращения называют фазовой перекристаллизацией, а при их исследованиях используют те же подходы в отношении механизмов и кинетики формирования новой фазы, включая образование зародышей и последующий их рост.
В чистых металлах основными превращениями в твердом состоянии являются аллотропические (полиморфные), а также магнитные превращения. В сплавах превращения в твердом состоянии дополняются целым рядом превращений, таких как эвтектоидное, перитектоидное, растворение и выделение избыточных фаз и др. Их изучение потребует знания диаграмм фазового равновесия и будет кратко рассмотрено позже.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела. В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы a - Fe с объемно-центрированной кубической решеткой в высокотемпературную форму g - Fe с гранецентрированной кубической решеткой, при температуре 911 °С и последующее превращение при температуре 1392 °С g - Fe в d - Fe с объемно-центрированной кубической решеткой, аналогичной a - Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются a - Ti, a - Zr с гексагональной плотноупакованной решеткой. При температуре выше 882° С для титана и 862° С для циркония образуются b - Ti и b - Zr, обладающие объемно-центрированной решеткой.
Аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении при переходе через критическую точку. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава претерпевающая аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла (рисунок 2. 11). Температура перехода называется критической точкой превращения. При температуре (Т0) наблюдается фазовое равновесие двух аллотропических разновидностей.
| Рисунок 2.11. Термическая кривая для случая аллотропического при охлаждении | Рисунок 2.12. Изменение свободной энергии системы при аллотропическом превращении |
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева при нагреве.
Аллотропическое превращение происходит так же как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии, и поскольку линии, характеризующие изменения свободной энергии в зависимости от температуры, пересекаются при температуре Т0 (рисунок 2.12). При температурах выше Т0 стабильной является b - фаза, при более низкой температуре стабильной оказывается a - фаза, имеющая меньший запас свободной энергии.
В процессах кристаллизации основным препятствием образования твердых кристаллов являются затраты энергии на образование границы раздела фаз. Это вызывает необходимость переохлаждения для начала процесса кристаллизации.
При аллотропическом превращении кроме энергии, затрачиваемой на образование границы раздела фаз, необходимы дополнительные затраты энергии на преодоление упругого сопротивления твердой фазы, связанные с тем, что полиморфные превращения всегда приводят к изменением объема. Поскольку затраты энергии для образования зародышей при аллотропическом превращении больше, чем при кристаллизации из жидкого состояния, то переохлаждение при превращениях в твердом состоянии должны быть гораздо больше, чем при кристаллизации.
Аллотропические превращения могут протекать по двум механизмам:
1. диффузионным (нормальным) путем,
2. бездиффузионным (мартенситным) путем.
В отдельных металлах эти превращения могут протекать как по одному, так и по другому механизму, что будет зависеть от скорости охлаждения.
Диффузионный механизм аллотропического превращения заключается в том, что атомы, располагающиеся в решетке высокотемпературной модификации путем диффузионного перемещения, занимают новые места, характерные для новой аллотропической формы: низкотемпературной модификации.
Следовательно, развитие диффузионного механизма аллотропического превращения наиболее благоприятно при высоких температурах, обеспечивающих большую скорость диффузионного перемещения атомов. Кроме того, если температура превращения настолько высока, что обеспечивает высокую пластичность, то затраты энергии на преодоление упругого сопротивления тела образованию и росту новой фазы, отличающейся от новой фазы удельным объемом становятся меньше, в связи с чем аллотропическое превращение протекает при минимальном переохлаждении. Зародыши новой фазы появляются на границах зерен старой фазы и на других дефектах кристаллов. В дальнейшем происходит рост этих зародышей за счет перехода атомов из старой фазы в новую. Наряду с этим наблюдается продолжение зарождения новых зародышей образующейся фазы.
При переходе металла из одного кристаллографического состояния в другое происходит не только изменение кристаллической структуры, но и имеет место полный процесс фазовой перекристаллизации, при которой на месте старых зерен образуются совершенно новые зерна с новым расположением границ. Причем на месте старого одного зерна могут возникнуть несколько новых или на месте нескольких старых - одно новое зерно.
Этот процесс зависит, главным образом, от скорости охлаждения и степени переохлаждения, которые в основном определяют количество образующихся в единицу времени центров кристаллизации и скорость роста новой фазы. Чем выше скорость охлаждения и выше степени переохлаждения, тем больше количество центов кристаллизации, тем более дисперсными являются зерна новой фазы.
Поскольку аллотропические превращения происходят в твердой среде, наиболее интенсивно процесс фазовой перекристаллизации будет происходить в том случае, если длина диффузных путей будет минимальной. А это означает, что при образовании зародышей должен соблюдаться принцип структурного и размерного соответствия. Он сформулирован С.Т. Конобеевским и заключается в том, что: "форма и ориентировка зародышей новой фазы при кристаллизации должны соответствовать минимуму поверхностной энергии при данном объеме, а минимум поверхностной энергии обеспечивается при максимальном сходстве в расположении атомов на соприкасающихся гранях старой и новой фаз".
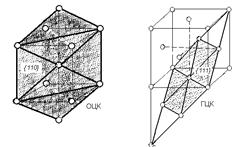 | Рисунок 2.13. Близкие по строению плоскости в решетке ОЦК и в ГЦК решетке |
Поэтому зарождение новой фазы начинается на плоскостях, которые являются наиболее сходными у обеих кристаллических решеток. Например, при переходе g - Fe в a - Fe наибольшее сходство имеют плоскости в g - Fe и в a - Fe (рисунок 2.13).
Преобразованием плоскостей g в a и направлений [110] g в [111] a во всем объеме металла протекает рассматриваемое аллотропическое превращение. При этом происходит лишь небольшой поворот кристаллографических направлений, при котором обеспечиваются углы 70°30¢ и 54°45¢ соответствующие расположению атомов в объемно-центрированном кубе.
Форма выделений новой фазы в основном определяется упругой энергией, возникающей при выделении. Если при аллотропическом превращении наблюдается большая степень размерного и структурного соответствия кристаллов старой и новой фаз, упругая энергия системы минимальна, а кристаллы новой фазы имеют форму дисков (пластин). Кроме того, на форму выделяющихся кристаллов оказывает влияние степень анизотропии упругих свойств обеих фаз. Если модули упругости возникающей фазы для всех направлений меньше, чем модули переходной фазы, в этом случае форма выделений - диски или пластины. Если модуль новой фазы только для одного из направлений меньше, чем модуль исходной фазы, то может появиться игольчатая форма выделений.
Появление новой фазы с новым удельным объемом может способствовать развитию сопутствующих процессов, таких как наклеп (фазовый) и рекристаллизации. Кроме того, на развитие аллотропии может оказывать влияние наличие примесей, которые могут играть роль дополнительных зародышевых центров. Все эти дополнительные параметры могут оказать влияние на окончательную структуру и свойства металла, претерпевшего аллотропическое превращение. В результате собирательной рекристаллизации, сопутствующей аллотропическому превращению, происходит укрупнение зерна, причем тем больше, чем выше температура нагрева. В случае же нагрева до температур, лежащих выше критической точки, когда происходит образование зерен новой фазы, но не успевает начаться укрупнение зерна, обычно получается очень маленькое зерно.
Бездиффузионный или мартенситный механизм аллотропического превращения осуществляется при низких температурах, при которых диффузия или самодиффузия почти не осуществляется. Это превращение происходит или в металлах с низкой температурой аллотропического перехода или при сильном переохлаждении высокотемпературной аллотропической формы в металлах с высокой температурой превращения. Так у кобальта, у которого Т0 = 420 °С, аллотропическое превращение идет только бездиффузионным путем. В железе, титане, цирконии и других металлах с высокой температурой Т0 при большом переохлаждении превращение идет бездиффузионным путем, а при малом переохлаждении - диффузионным путем. При мартенситном аллотропическом превращении новая фаза образуется путем кооперативного и закономерного перемещения атомов таким образом, что они сохраняют своих соседей и смещаются по отношению один к другому на расстояния, не превышающие междуатомные. Основное предположение мартенситного превращения заключается в том, что в процессе перехода старой фазы в новую сохраняется сопряженность (когерентность) их пространственных решеток. При наличии когерентности двух фаз поверхностная энергия границы очень мала, что способствует интенсивному росту образовавшихся кристаллов.
Упругая энергия сравнительно велика, она все время возрастает в процессе роста кристалла. Это происходит до тех пор, пока не будет превзойден предел упругости в переходной зоне. При этом в ней происходит пластический сдвиг, нарушающий когерентность кристаллических решеток старой и новой фаз. Возникновение некогерентной границы приостанавливает рост данного кристалла мартенситной фазы. Дальнейшее увеличение количества образующейся фазы происходит путем образования новых зародышей и мгновенного их роста. Скорость роста кристаллов при мартенситном превращении очень велика и достигает скорости звука. Скорость образования центров кристаллизации подчиняется общим закономерностям фазовых превращений. При развитии мартенситного механизма аллотропического превращения участки новой фазы располагаются вдоль определенных кристаллографических плоскостей старой фазы и выглядят под микроскопом в виде иголок или пластин. Это является результатом структурного и размерного соответствия, устанавливающегося между решетками старой и новой фаз.
Важной особенностью мартенситного превращения является то, что в изотермических условиях превращения только часть старой фазы переходит в новую. Дальнейшее превращение может протекать только при понижении температуры. Мартенситное превращение происходит в интервале температур. Различают точки Мн и Мк - начало и конец мартенситного превращения. Во многих случаях превращение не доходит до конца даже при очень низких температурах. Установлено, что мартенситное превращение, как и нормальное - диффузионное обратимо. Образование высокотемпературной формы из низкотемпературной при достаточной степени перенагрева может происходить бездиффузионным путем.
Магнитное превращение, наблюдаемое в ферромагнитных материалах, не является обычным фазовым превращением. Оно не связано с перемещением диффузией атомов, а вызывается только изменением взаимодействия магнитно нескомпенсированных d или f - электронов, обусловливающих возникновение ферромагнетизма. Характер изменения магнитных свойств зависит от физической природы металла. Температура потери магнитных свойств, называемая точкой Кюри, не зависит от скорости нагрева или охлаждения. Эта температура постоянна для каждого металла. Для железа она равна 768° С, никеля - 365- 370° С, кобальта - 1050° С.
Процесс кристаллизации и фазовые превращения в сплавах. Основные типы диаграмм состояния
В сплавах в зависимости от взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы, твердые растворы, химические или интерметаллические соединения.
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого или других компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры (периоды).
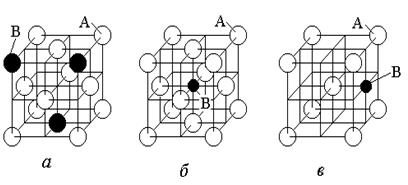
Различают твердые растворы замещения и твердые растворы внедрения (рисунок 1.30, б). При образовании твердого раствора замещения (рисунок1.30, а) атомы растворенного компонента замещают часть атомов растворителя в узлах его кристаллической решетки. Атомы растворенного компонента могут замещать любые атомы растворителя, но взаимное расположение всех атомов, как правило, является статистически неупорядоченным.
Рисунок 1.30. Схема твердых растворов: а – замещения;
б, в – внедрения в ГЦК и ОЦК решетках
При образовании твердого раствора внедрения (рисунок 1.30, б) атомы растворенного компонента располагаются в междоузлиях (пустотах) кристаллической решетки растворителя. При этом атомы располагаются не в любом междоузлии, а в таких пустотах, где для них имеется больше свободного пространства.
Например, в плотноупакованной ГЦК решетке наиболее подходящими будут октаэдрические поры в центре элементарной ячейки (рисунок 1.30, б). В ОЦК решетке наибольший объем поры будет в центре грани (рисунок 1.30, в).
Микроструктура твердого раствора в условиях равновесия представляет собой кристаллические зерна, в которых, как правило, микроскопическим способом не наблюдается выделений.
В металловедении принято обозначать чистые компоненты большими буквами латинского алфавита А, В, С, а твердые растворы – малыми буквами греческого алфавита a, b, g и т. д.
Упорядоченные твердые растворы теми же буквами со штрихом a / , b / , g / и т. д.
Все металлы могут в той или иной степени растворяться один в другом в твердом состоянии. В тех случаях, когда компоненты могут замещать один другого в кристаллической решетке в любых количественных соотношениях, образуется непрерывный ряд твердых растворов.
Твердые растворы замещения с неограниченной растворимостью могут образовываться при соблюдении следующих условий:
1) компоненты должны обладать одинаковыми по типу кристаллическими решетками;
2) различие в атомных размерах не должно превышать 9…15 %;
3) компоненты должны принадлежать к одной группе периодической системы элементов или к смежным родственным группам и в связи с этим обладать близким строением валентной оболочки электронов в атомах.
Например, неограниченно растворяются в твердом состоянии Ag и Au, Ni и Cu, Mo и W.
Твердые растворы внедрения могут возникнуть только в тех случаях, когда диаметр растворенного элемента невелик. Поэтому твердые растворы этого типа получаются лишь при растворении в металле углерода, азота, водорода. Твердые растворы внедрения могут быть только ограниченной концентрации.
Химические соединения и родственные им по природе фазы в металлических сплавах многообразны. Характерные особенности химических соединений следующие:
1) кристаллическая решетка отличается от решеток компонентов, образующих соединение;
2) всегда сохраняется простое кратное соотношение элементов AnBm, где n и m – целые числа;
3) свойства соединения резко отличаются от свойств образующих его компонентов;
4) температура плавления или диссоциации постоянна;
5) образование химического соединения сопровождается значительным тепловым эффектом.
В отличие от твердых растворов химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов.
Типичными примерами химических соединений являются соединения магния с элементами IV-VI групп периодической системы: Mg2Sn, Mg3Sb2, MgS и др.
Соединения одних металлов с другими носят общее название интерметаллидов или интерметаллических соединений. Например, интерметаллидами являются соединения NiAl и Cu3Al. Химическая связь между атомами в интерметаллидах чаще всего сохраняется металлической. Соединения металлов с неметаллом, которые могут обладать металлической связью, называют металлическими соединениями(нитриды, карбиды и гидриды).
1.3.2. Экспериментальные методы построения диаграмм состояния
Процесс кристаллизации металлических сплавов и связанные с ним многие закономерности строения сплавов описывают с помощью диаграмм состояния или диаграмм фазового равновесия. Эти диаграммы в удобной графической форме показывают фазовый состав и структуру в зависимости от температуры и концентрации.
Экспериментальное построение диаграмм состояния возможно благодаря тому, что любое фазовое превращение сплава сопровождается изменением физико-механических свойств (электрического сопротивления, удельных объемов и др.) или тепловым эффектом. Переход сплава из жидкого состояния в твердое сопровождается значительным выделением теплоты, поэтому, измеряя зависимость температуры от времени при нагреве или охлаждении, можно по перегибам или остановкам на кривых охлаждения определить критические температуры, при которых происходят фазовые превращения.
Для того чтобы зафиксировать превращения в твердом состоянии, сопровождаемые малыми тепловыми эффектами, обычно измеряют зависимость от температуры какой-либо физической величины, значительно изменяющейся при фазовых превращениях. Например, можно использовать зависимость длины образца от температуры (рисунок 1.31).
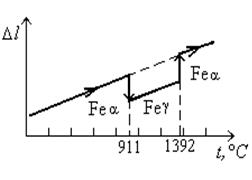
Рисунок 1.31. Схема изменения длины железного образца в зависимости от температуры нагрева
Для экспериментального построения диаграммы состояния сплавов, образованных компонентами А и В необходимо изготовить серию сплавов с различным содержанием компонентов А и В.
Для каждого сплава экспериментально определяют критические точки, т. е. температуры фазовых превращений. Полученные значения температуры откладывают на вертикальных линиях в соответствии с химическим составом сплавов. Соединяя критические точки, получают линии диаграммы состояния.
Пример построения одной из простейших диаграмм состояния приведен на рисунке 1.32, где линия ликвидус – геометрическое место всех точек, которые определяют температуру начала кристаллизации сплавов, а линия солидус соответствует концу кристаллизации. Эти линии разделяют диаграммы состояния на области с различным фазовым составом.
Положение линий на диаграмме зависит от скорости охлаждения сплавов, поэтому температуры критических точек при построении диаграммы состояния определяют при медленных охлаждениях или нагревах. Такие диаграммы называют равновесными.
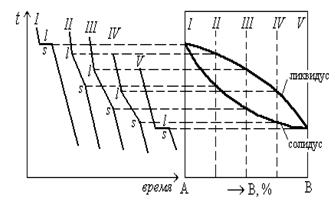
Рисунок 1.32. Схема построения диаграммы состояния
Общие закономерности существования устойчивых фаз, отвечающих условиям равновесия, могут быть выражены в математической форме, называемой правилом фаз (Гиббса).
Правило фаз при постоянном давлении выражается уравнением:
где К – число компонентов в системе;
С – число степеней свободы.
Число степеней свободы – это число независимых переменных внутренних (состав фаз) и внешних (температура), которые можно изменять без изменения числа фаз, находящихся в равновесии.
Из правила фаз следует, что в двойной системе при постоянном давлении не может одновременно существовать более трех фаз. Три фазы существуют при С = 0, т. е. при определенных составе фаз и температуре. Для однофазного состояния правило фаз не применяют.
1.3.3. Основные равновесные диаграммы состояния двойных сплавов
Диаграмма состояния сплавов, компоненты которых полностью растворимы в жидком и твердом состояниях представлена на рисунке 1.33.
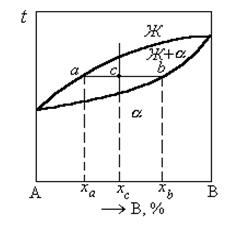
Рисунок 1.33. Диаграмма состояния сплавов, компоненты которых полностью растворимы в жидком и твердом состояниях
Такая диаграмма (см. рисунок 1.33) имеет простой вид и состоит из двух линий – ликвидус и солидус, пересекающихся между собой в точках кристаллизации чистых компонентов А и В. Все сплавы затвердевают в некотором интервале температур (С = 1). Диаграммы такого типа имеют системы Ni-Cu, Ag-Au, Mo-V, Mo-W и др.
Имея диаграмму состояния, можно проследить за фазовыми превращениями любого сплава и указать состав и количественное соотношение фаз при любой температуре. Это осуществляется при помощи двух простых правил.
Правило определения состава фаз (правило концентраций).
Для определения концентрации компонентов в двух фазах через данную точку (см. рисунок 1.33, точка с), характеризующую состояние сплава, проводят горизонтальную линию (коноду) до пересечения с линиями, ограничивающими данную область; проекции точек пересечения (a и b) на горизонтальную ось диаграммы покажут составы фаз (xa и xb).
Правило определения количественного соотношения фаз (правило отрезков).
Через данную точку c проводят горизонтальную линию. Отрезки этой линии (коноды) между точкой с и точками a и b, определяющими составы фаз, обратно пропорциональны количествам (объемам, массам) этих фаз:
Эти правила справедливы для любой двухфазной области диаграммы состояния и не имеют смысла в однофазной области.
Используя эти два правила и привлекая еще дополнительно правило фаз, можно «прочитать» любую сложную диаграмму.
Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют эвтектику (рисунок 1.34).
В сплавах , составы которых расположены в областях a и b, образуются однородные твердые растворы: a, на базе компонента А, с кристаллической решеткой, характерной для этого компонента, и b с кристаллической решеткой компонента В.
Предельная растворимость компонента A в компоненте B определяется линией FQ, и эта растворимость не изменяется или изменяется незначительно.
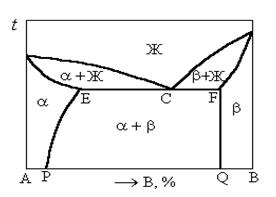
Рисунок 1.34. Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют эвтектику
Твердый раствор компонента B в компоненте A является раствором не только ограниченной, но и переменной растворимости. Линия EP является линией растворимости, которая определяет равновесное содержание растворенного компонента при изменении температуры.
Максимальное содержание компонента B в a-фазе определяется точкой E и при охлаждении снижается до точки P.
Для сплавов с составами от точки E до точки F при постоянной температуре, соответствующей линии EF происходит эвтектическая реакция, при которой жидкая фаза кристаллизуется с одновременным выделением двух твердых фаз определенной концентрации
В результате образуется смесь двух фаз, которую называют эвтектикой.
Для эвтектики характерно определенное количественное соотношение фаз, которое определяется правилом отрезков:
Сплав с содержанием компонента B, соответствующим точке C, называется эвтектическим.
Диаграмма состояния сплавов, компоненты которой ограниченно растворимы в твердом состоянии и образуют перитектику (рисунок 1.35).
В сплавах с содержанием компонента B меньше xC или больше xF кристаллизация приводит к образованию однофазных сплавов a и b соответственно.
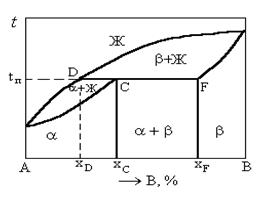
Рисунок 1.35. Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют перитектику
В сплавах с содержанием компонента B от xD до xF при постоянной температуре tп происходит перитектическое превращение, в результате которого жидкая фаза ЖD и твердая фаза bF, взаимодействуя между собой, образуют новую твердую фазу aC:
Количество фаз ЖD и bF, необходимое для образования фазы aC определяется соотношением отрезков
Сплав состава xC называется перитектическим.
Перитектической реакции предшествует выделение кристаллов b-фазы из расплава. В сплавах до- и заперитектических после перитектической реакции остается избыточная жидкая фаза или b-фаза соответственно.
Диаграмма состояния сплавов с полиморфным превращением одного из компонентов (рисунок 1.36).
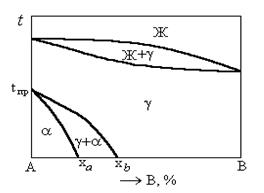
Рисунок 1.36. Диаграмма состояния сплавов с полиморфным превращением одного из компонентов
Сплавы с содержанием компонента B менее xa изменяет кристаллическую структуру в результате охлаждения в интервале температур. Это вызвано полиморфизмом компонента A. который до температуры tпр имеет тип кристаллической решетки a, а при более высокой температуре - g. Причем кристаллическая решетка g такая же, как у компонента B, в результате чего между ними образуется непрерывный ряд твердых растворов.
В сплавах, составы которых лежат между xa и xb, превращение g ® a при охлаждении не заканчивается и сплав остается двухфазным. Сплавы с содержанием компонента B более xb превращений в твердом состоянии не имеют.
Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением показана на рисунке 1.37.
Из анализа диаграммы следует, что после кристаллизации всех сплавов данной системы в определенном интервале температур образуется твердый раствор g, который в результате охлаждения при постоянной температуре tэ испытывает эвтектоидное превращение gC ® aE + bF. Образовавшуюся смесь двух фаз принято называть эвтектоидом.
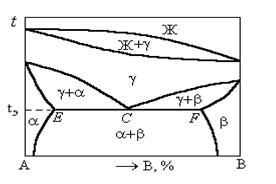
Рисунок 1.37. Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением
В связи с переменной растворимостью компонентов в твердых растворах a и b при дальнейшем охлаждении следуют вторичные выделения твердых растворов.
Правило Курнакова Н. С. определяет связь между свойствами сплавов и типом диаграмм состояния. Между составом и структурой сплава имеется определенная зависимость (рисунок 1.38).
Рисунок 1.38. Диаграмма состав-свойства для сплавов типа: а механическая смесь; б – твердый раствор; в – химическое соединение; А и В – компоненты сплава, АmВn – химическое соединение, Н – твердость, Е – электропроводность
В механических смесях свойства (твердость, электропроводность и др.) изменяются линейно (рисунок 1.38, а). В твердых растворах свойства изменяются по криволинейной зависимости (рисунок 1.38, б). В химических соединениях свойства выражаются ломанными линиями (рисунок 1.38, в).
При концентрации, соответствующей химическому соединению, отмечается характерный перелом на кривой свойств.
Это объясняется тем, что химические соединения обладают индивидуальными свойствами, наиболее часто резко отличающимися от свойств образующих их компонентов.
По диаграммам состояния можно определять и технологические свойства сплавов, что облегчает выбор материала для изготовления изделий.
Так, твердые растворы имеют низкие литейные свойства (низкая жидкотекучесть, склонны к образованию трещин и пористости), а эвтектические сплавы, напротив, имеют хорошую жидкотекучесть.
Контрольные вопросы:
1. Что такое фаза, химическое соединение, твердый раствор, механическая смесь?
2. Как влияют фосфор, сера, кремний и марганец на графитизацию?
3. Какие твердые растворы соответствуют диаграммам первого, второго, третьего и четвертого родов?
Процесс кристаллизации и фазовые превращения в сплавах. Основные типы диаграмм

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
2
При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура.

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
3
Кривые охлаждения при кристаллизации металла
Разность между температурами tn и tк , при которых может протекать процесс кристаллизации, носит название степени переохлаждения: Δt= tn — tк

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
4
Модель процесса кристаллизации

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
5
Сплавы – это вещества, состоящие из двух или более элементов периодической системы. Получают их с помощью спекания или сплавлением.
Компоненты – вещества, образующие сплав.
Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Гомогенные вещества имеют одну фазу, а гетерогенные – несколько фаз.
Структура – строение металла, в котором можно различать отдельные фазы, их форму, размеры и взаимное расположение. Структура влияет на свойства. Равновесное состояние – когда в сплаве все фазы, присущие этой системе оформлены. Это состояние обеспечивается при медленном охлаждении, можно различать размеры и формы фаз. Неравновесное состояние – процесс образования и обособления фаз не закончился, образуется при быстром охлаждении.

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
6
Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе.
Существует математическая связь между числом компонентов (К), числом фаз (Ф) ,числом внешних переменных факторов (В – температура, давление) и вариантностью системы (С). Это правило фаз или закон Гиббса
С=К+В-Ф
Если принять, что все превращения в железоуглеродистом сплаве (сталь) происходят при постоянном давлении Р=const, температура Т≠ const, то
С= 2+1 –Ф=3-Ф

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
7
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов.
В зависимости от характера взаимодействия компонентов различают сплавы:
механические смеси;
химические соединения;
твердые растворы.

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
8
Сплавы механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения.
Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Сплав состоит из кристаллов входящих в него компонентов А и В (рис.). В сплавах сохраняются кристаллические решетки компонентов.
Рис. Схема микроструктуры механической смеси

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
9
Сплавы химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными.
Особенности этих сплавов:
Сплав образуется при определенном соотношении компонентов, химическое соединение обозначается Аn Вm
Образуется кристаллическая решетка с правильным упорядоченным расположением атомов , отличающаяся от решеток элементов, составляющих химическое соединение, (рис. )
Ярко выраженные индивидуальные свойства
Постоянство температуры кристаллизации, как у чистых компонентов
Рис. Кристаллическая решетка химического соединения

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
10
Сплавы твердые растворы – это твердые фазы, в которых соотношения между компонентов могут изменяться. Являются кристаллическими веществами.
Характерной особенностью твердых растворов является: наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя.
Твердый раствор состоит из однородных зерен (рис.).
Рис.Схема микроструктуры твердого раствора

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
11
По степеням растворимости компонентов различают твердые растворы:
с неограниченной растворимостью компонентов;
с ограниченной растворимостью компонентов.
По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы:
замещения;
внедрения.
Кристаллическая решетка твердых растворов замещения (а), внедрения (б)

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
12
Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. )
Диаграммы состояния показывают устойчивые состояния, ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы.
Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа.
Температуры, соответствующие фазовым превращениям, называют критическими точками. Точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус.
По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура.

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
13
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью)

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
14
Сначала получают термические кривые. Полученные точки переносят на диаграмму, соединив точки начала кристаллизации сплавов и точки конца кристаллизации, получают диаграмму состояния.
Проведем анализ полученной диаграммы.
1. Количество компонентов: К = 2 (компоненты А и В).
2. Число фаз: f = 2 (жидкая фаза L, кристаллы твердого раствора )
3. Основные линии диаграммы:
acb – линия ликвидус, выше этой линии сплавы находятся в жидком состоянии;
adb – линия солидус, ниже этой линии сплавы находятся в твердом состоянии.
4. Характерные сплавы системы:
Чистые компоненты А и В кристаллизуются при постоянной температуре, кривая охлаждения компонента В представлена на рис. б.

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
15
Диаграмма состояния сплавов с отсутствием растворимости компонентов в компонентов в твердом состоянии (механические смеси)
Рис. Диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (а) и кривые охлаждения сплавов (б)

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
16
Эвтектический сплав – сплав, соответствующий концентрации компонентов в точке с (сплав I). Кривая охлаждения этого сплава, аналогична кривым охлаждения чистых металлов (рис. б)
Эвтектика – мелкодисперсная механическая смесь разнородных кристаллов, кристаллизующихся одновременно при постоянной, самой низкой для рассматриваемой системы, температуре.
При образовании сплавов механических смесей эвтектика состоит из кристаллов компонентов А и В: Эвт. (кр. А + кр. В)

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
17
Схема микроструктур сплавов: а – доэвтектического, б – эвтектического, в – заэвтектического

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
18
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (а) и кривые охлаждения типичных сплавов (б)

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
19
Диаграмма состояния сплавов, компоненты которых образуют химические соединения

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
20
Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (а) и кривая охлаждения сплава (б)

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
21
Связь между свойствами сплавов и типом диаграммы состояния
При образовании твердых растворов с ограниченной растворимостью свойства в интервале концентраций, отвечающих однофазным твердым растворам, изменяются по криволинейному закону, а в двухфазной области – по линейному закону. Причем крайние точки на прямой являются свойствами чистых фаз, предельно насыщенных твердых растворов, образующих данную смесь.

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
22
При образовании механических смесей свойства изменяются по линейному закону. Значения характеристик свойств сплава находятся в интервале между характеристиками чистых компонентов.

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
23
При образовании твердых растворов с неограниченной растворимостью свойства сплавов изменяются по криволинейной зависимости, причем некоторые свойства, например, электросопротивление, могут значительно отличаться от свойств компонентов.

ТюмГНГУ,МиТКМ,ЗолотареваЕВ
24
При образовании химических соединений концентрация химического соединения отвечает максимуму на кривой. Эта точка перелома, соответствующая химическому соединению, называется сингулярной точкой.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Читайте также:
