Химические свойства металлов 11 класс
Обновлено: 21.09.2024
Металлы, как и все химические элементы, имеют три формы существования: атомы, простые и сложные вещества. Из 118 элементов периодической системы к металлам относят 96.
Общие физические свойства металлов.
Физические свойства металлов обусловлены металлической кристаллической решёткой и металлической химической связью. Напомним, что для металлов характерны металлический блеск, пластичность, высокая электро- и теплопроводность, рост электрического сопротивления при повышении температуры, а кроме того, такие практически значимые свойства, как ковкость, твёрдость, магнитные свойства.
Металлы — твёрдые при обычных условиях вещества (кроме ртути, которая становится твёрдой и ковкой при низких температурах).
Металлы пластичны и тягучи, кроме хрупких висмута и марганца. Из меди, алюминия, олова, а также золота изготавливают тончайшие листы — фольгу. Золотая фольга может иметь толщину около 100 нм! Такую фольгу используют для золочения предметов интерьера, стен и потолков, изделий из гипса, дерева, металла, стекла и пластика.
Все металлы имеют металлический блеск, большинство из них серебристо-белого или серого цвета. Из-за того, что стронций, золото и медь поглощают в большей степени близкие к фиолетовому цвету короткие волны и отражают длинные волны светового спектра, эти металлы окрашены в светло-жёлтый и медный цвет. Очень тонкие листки серебра и золота имеют совершенно необычный вид — они представляют собой голубовато-зелёную фольгу, а мелкие порошки металлов кажутся тёмно–серыми и даже чёрными. И только порошки магния и алюминия сохраняют серебристо-белый цвет.
В технике металлы принято классифицировать по различным физическим свойствам:
Металлы принято делить на чёрные (железо и его сплавы) и цветные (остальные металлы и сплавы). Соответственно называются и отрасли металлургической промышленности: чёрная и цветная металлургия.
Важнейшими продуктами цветной металлургии являются титан, вольфрам, молибден и другие металлы, которые могут использоваться в качестве специальных легирующих добавок для производства сверхтвёрдых, тугоплавких, устойчивых к коррозии сплавов, широко применяемых в машино– и станкостроении, в оборонно–космической отрасли.
Современные композиционные материалы, выполненные на основе керамики или полимеров, становятся сверхпрочными, если укреплены металлическими нитями из молибдена, вольфрама, титана, специальных сталей и т. д.
Химические свойства металлов.
Во всех реакциях простые вещества — металлы проявляют только восстановительные свойства.

- Металлы взаимодействуют с неметаллами, образуя бинарные соединения. По правилам ИЮПАК названия этих соединений образуются в соответствии со схемой:
Так, с очень активными неметаллами (галогенами, серой) металлы образуют соединения, которые молено рассматривать, как соли бескислородных кислот: 2Na + Сl2 = 2NaCl
Если металл проявляет переменные степени окисления, подобная соль имеет состав, который зависит от окислительных свойств неметалла. Например, железо энергично взаимодействует с хлором, образуя хлорид железа(III): 2Fe + 3Сl2 = 2FeCl3
При взаимодействии железа с серой, окислительная способность которой ниже, чем у галогенов, продуктом реакции является сульфид железа(II): Fe + S = FeS
- При взаимодействии металлов с кислородом образуются оксиды или пероксиды:
Оксиды в этом случае имеют основный или амфотерный характер:
2Mg + O2 = 2MgO
4Аl + 3O2 = 2Аl2O3
Эти реакции сопровождаются выделением большого количества теплоты и очень ярким пламенем, поэтому применяются для изготовления сигнальных ракет, фейерверков, салютов и других пиротехнических средств. Поэтому обращение с ними требует строгого соблюдения правил техники безопасности.
Продуктом горения железа в кислороде является смешанный оксид 3Fe + 2O2 = Fe3O4
- Металлы — простые вещества, образованные элементами IA– и IIА–групп, в полном соответствии с названием этих групп взаимодействуют с водой с образованием щёлочи и водорода. В общем виде эти реакции можно записать так:
2М + 2Н2O = 2МОН + Н2↑, где М — щелочной металл
М + 2Н2O = М(ОН)2 + H2↑, где М — Mg или щёлочноземельный металл.
Для характеристики химических свойств металлов важное значение имеет их положение в электрохимическом ряду напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Sn, Pb, (H2) , Cu, Hg, Ag, Au
Вспомните известные вам из курса основной школы два вывода:
- взаимодействие металлов с растворами кислот происходит, если металл находится в ряду напряжений левее водорода;
- взаимодействие металлов с растворами солей происходит, если металл находится в ряду напряжений левее металла соли.
Лабораторный способом получения водорода:
Zn + 2НСl = ZnCl2 + H2↑
Zn 0 + 2H + = Zn 2+ + H2 0
Аналогично протекает реакция металлов и с органическими кислотами:
2СН3СООН + Zn —> (CH3COO)2Zn + Н2↑
2СН3СООН + Zn –> 2СН3СОO – + Zn 2+ + Н2 0
Реакция между цинком и раствором сульфата меди(II) протекает согласно уравнению:
Zn + CuSO4 = ZnSO4 + Сu
Zn 0 + Сu 2+ = Zn 2+ + Сu 0
Подчеркнём, что в этом случае металл может находиться в ряду напряжений и после водорода, но не после металла соли. Например, реакция замещения серебра медью:
Cu + 2AgNO3 = Сu(NО3)2 + 2Ag
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
В завершение рассмотрим ещё одно характерное не для всех металлов свойство, которое называется металлотермия. Такие активные металлы, как алюминий, кальций, магний, литий, способны взаимодействовать с оксидами других металлов. Для того чтобы началась такая реакция, смесь активного металла и оксида металла (её называют термитной) необходимо поджечь. После этого процесс сопровождается выделением большого количества теплоты и света (отсюда и название процесса). Металлотермию применяют для получения и более ценных металлов: 2Аl + Сr2О3 = Al2O3 + 2Сг
Химия металлов (таблица)

Конспект урока по химии в 11 классе «Металлы». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Презентация по химии "Химические свойства металлов"

Данная презентация может быть использовани при изучении химических свойств металлов на уроке химии в 11 классе.
Просмотр содержимого документа
«Презентация по химии "Химические свойства металлов"»

Химические свойства металлов
Автор: Кунова Г.В. – учитель химии ГОАОУ ЦОРиО, г. Липецк

Общая характеристика металлов
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь из простых веществ в катионы:
Реакции металлов относятся к окислительно-восстановительным реакциям. Окислителями металлов являются неметаллы, ионы водорода, азотная кислота разной концентрации и концентрированная серная кислота.
Для металлов как восстановителей в соединениях характерны положительные степени окисления ( +1, +2, +3 – металлы главных подгрупп I – III групп).
Многим из них присущи переменные степени окисления – металлы побочных подгрупп (Fe, Cu и др.).
Химические свойства металлов различаются в зависимости от химической активности металла.

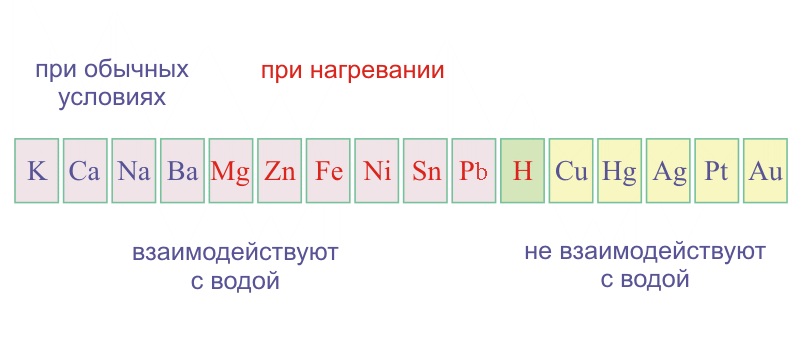
Электрохимический ряд напряжений металлов
По активности в водных растворах металлы расположены в « Электрохимический ряд напряжений металлов»:
В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород.
Активность металлов убывает слева направо.
Металлы, расположенные в ряду напряжений до алюминия называют активными металлами.
Металлы, стоящие в ряду напряжений после водорода , называют неактивными металлами .

Химические свойства металлов
Взаимодействие с кислородом
- При взаимодействии с кислородом металлы образуют различные по составу продукты: оксиды, а также пероксиды. Полученные в результате таких реакций оксиды проявляют или осно́вные, или амфотерные свойства. Серебро, золото и платина с кислородом не реагируют.
- Литий и щелочноземельные металлы взаимодействуют с кислородом воздуха, образуя основные оксиды :
- Алюминий сгорает ярким ослепительным пламенем:
- Щелочные металлы Nа, К активно реагируют с кислородом воздуха, образуя пероксиды:
Оксид натрия может быть получен при прокаливании пероксида натрия с натрием:
- Железо сгорает в кислороде с образованием железной окалины – Fe 3 O 4 (FeO ● Fe 2 O 3 ):

Взаимодействие с неметаллами
- Так как металлы являются восстановителями , то они отдают свои электроны неметаллам, которые, проявляют при этом окислительные свойства.
В результате образуются бинарные соединения, названия которых формируются по единому принципу:
- В случае переменной степени окисления у металла продукт его взаимодействия с неметаллом зависит от окислительных свойств последнего.
1) Металлы взаимодействуют с галогенами с образованием солей:

2) С водородом самые активные металлы образуют гидриды, в которых водород имеет степень окисления -1, например:
Са 0 + Н 2 0 = Са +2 Н -1 2
3) Взаимодействие с серой при нагревании:
М + S → М n S m сульфид металла
Смесь железа с серой

4) Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
При обычной температуре взаимодействует с азотом только литий:
6Li + N 2 = 2Li 3 N,
при этом образуется нитрид лития.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca + 2P = Ca 3 P 2

Взаимодействие с водой
- Щелочные и щелочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые основания — щёлочи:
Алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку.
- Mg – Pb реагируют с водой при нагревании с образованием оксидов металлов и водорода: М + Н 2 О = М х О у + Н 2 .
- Неактивные металлы (Cu - Au) - не реагируют с водой.

Взаимодействие с растворами кислот
- Металлы взаимодействуют с растворами кислот при соблюдении ряда условий:
- металл должен находиться в ряду напряжений левее водорода ;
- в результате реакции должна образоваться растворимая соль , так как в противном случае она покроет металл осадком и доступ кислоты к металлу прекратится;
- для этих реакций не рекомендуется использовать щелочные металлы , т.к. они активно взаимодействуют с водой;
- особым образом взаимодействуют с металлами концентрированная серная кислота и азотная кислота любой концентрации .

Взаимодействие с растворами солей
- Металлы взаимодействуют с растворами солей при соблюдении ряда условий:
- металл должен находиться в ряду напряжений левее металла, образующего соль ;
- в результате реакции должна образоваться растворимая соль , так как в противном случае она покроет металл осадком и доступ соли к металлу прекратится;
- для этих реакций не рекомендуется использовать щелочные металлы.
Если опустить кусочек свинца в раствор сульфата меди, то поверхность металла покроется тонким слоем сульфата, и реакция прекратится:
CuSO 4 + Pb ≠ PbSO 4 ↓ + Cu

Металлотермия – восстановление металлов из их оксидов
- Некоторые активные металлы способны вытеснять другие металлы из их оксидов.
- В методах металлотермии в качестве восстановителей используют Al, Na, Ca, Mg и др.
- Методы металлотермии в настоящее время широко используются в металлургии для получения таких металлов как Ti, Cr, Mn, V, Mg, Ba, Ca, Rb, Cs и др.

- Новый цинковый бак, в котором приготовили раствор медного купороса для опрыскивания растений, вскоре стал протекать.
Объясните причину разрушения стенок бака. Запишите уравнение химической реакции.
Урок химии 11 класс " Химические свойства металлов"
Повторение и обобщение по химическим свойствам металлов, знания учащихся полученные в 9 классе.
Просмотр содержимого документа
«Урок химии 11 класс " Химические свойства металлов"»
2.Химические свойства металлов.
Зная строение металлов, можно предвидеть их общие химические свойства.
В атомах металлов на внешней электронной оболочке находятся электроны, которые легко отрываются от атомов.
Наиболее общим химическим свойством металлов является способность их атомов при химических реакциях отдавать валентные электроны и превращаться в положительно заряженные ионы, т.е. металлы в реакциях являются сильными восстановителями.
2.1.Взаимодействие с простыми веществами: кислородом, галогенами, серой, азотом, водородом.
Реакции с кислородом.
4 Nа + O2 → 2 Nа2O; (побочный продукт)
Взаимодействие с галогенами.
2К + Cl2 →2 КCl;
Взаимодействие с серой.
2K + S → K2 S;
Взаимодействие с азотом.
Взаимодействие с водородом (щелочные металлы).
2К + Н2 → 2КН
Обратите внимание, что в этих реакциях атомы металлов отдают электроны, т.е. являются восстановителями, а неметаллы принимают электроны, т.е. являются окислителями.
Вывод: Запомните, металлы реагируют с галогенами, кислородом, серой, азотом, водородом, образуя соединения ……иды. В реакциях с неметаллами металлы являются восстановителями.
Давайте теперь рассмотрим с вами взаимодействие металлов со сложными веществами.
2.2. Взаимодействие со сложными веществами.
2.2.1.Взаимодействие металлов с водой.
При каких условиях металлы вступают в реакцию с водой? (При обычной температуре и при нагревании).
Что образуется при взаимодействии воды с активными металлами при обычной температуре? (Образуется гидроксид и выделяется водород).
Обсуждаем, какой металл реагирует более активно с водой? Почему? С чем это связано? (Положение в ПСХЭ, чем больше радиус, тем активнее металл).
2Na + H2O → 2NaOH + H2 ↑.
Ca + 2H2O → Ca(OH)2 + H2 ↑.
Как вы думаете, почему натрий более активно взаимодействует с водой, чем кальций? (Натрий более активный металл, чем кальций. Он легко отдает свои валентные электроны, является самым сильным восстановителем).
При взаимодействии воды с менее активными металлами образуются оксиды металлов и выделяется водород. Это металлы, стоящие в ряду напряжений после алюминия. Составляем уравнение реакции взаимодействия цинка с водой.
Zn + H2O → ZnO + H2 ↑;
Скажите пожалуйста, все ли металлы взаимодействуют с водой? (Нет).
Совершенно верно. А почему? (см. электрохимический ряд напряжения).
Скажите, а будет ли золото взаимодействовать с водой? (Нет).
Почему? (В ЭХ ряду после водорода) .Медь, ртуть, серебро, платина, золото с водой не реагируют!
Au + H2O → реакция не идет
Запомните! Металлы, стоящие в электрохимическом ряду напряжений до алюминия (включительно) образуют с водой гидроксиды, от алюминия до свинца – оксиды. Остальные с водой не реагируют.
2.2.2. Взаимодействие металлов с растворами кислот.
Мg + 2HCl → Мg Cl2 + H2 ↑;
Запомните! Металлы стоящие в электрохимическом ряду напряжений до водорода могут вытеснять водород из растворов кислот. Металлы стоящие в электрохимическом ряду напряжений после водорода не могут вытеснять водород из растворов кислот.
Cu + H2SO4 → не реагирует.
Какой же вывод можно сделать из этого? С помощью преподавателя находят правильные ответы на поставленные вопросы, делают выводы.
Итак, ряд поправок:
1. правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
2. концентрированная серная кислота и азотная кислота любой концентрации реагируют с металлами по особому, при этом водород не образуется;
3. на щелочные металлы правило не распространяется, т.к. они легко взаимодействуют с водой.
Вывод: из уравнений реакций видно, что в них окислителями являются ионы водорода и ионы неметаллов, а атомы металлов – восстановители.
2.2.3. Взаимодействие металлов с растворами солей.
Показываем, какие металлы вытесняют из солей по ряду напряжений металлов.
Fe + CuSO4 → Cu + FeSO4
Запомните! В электрохимическом ряду напряжений металл, стоящий левее, может вытеснять из растворов солей металл, стоящий правее (записываем в тетрадь).
Исключение: металлы до магния не могут вытеснять другие металлы из растворов солей, так как в первую очередь реагируют с водой, образуя щелочи.
3.Свойства алюминия: Главное, ребята, вес удельный мой,
Потому в дюралях я главный составной,
Назван я «крылатым», так как самолёты
Надежно, легко отправляю в полёты.
« Я металл, серебристый и лёгкий,
И зовусь самолётный металл,
И покрыт я оксидною плёнкой,
Чтоб меня кислород не достал».
Взаимодействие с кислородом.
4Al + 3O2 → 2Al2O3; (при нагревании)
Взаимодействие с галогенами.
2Al + 3Br2 → 2AlBr3; (при нагревании)
Взаимодействие с серой.
2 Al + 3S = Al 2S3 (при нагревании)
Взаимодействие с азотом
2 Al + N2 = 2Al N (при нагревании)
С водородом непосредственно не реагирует.
Поскольку алюминий проявляет амфотерные свойства, то он реагирует и с кислотами и с щелочами, образуя соли. Является активным металлом, поэтому также реагирует и с водой. Почему в быту алюминий не проявляет свойства активного металла?» (поверхность алюминия покрыта оксидной пленкой).
Урок химии в 11 классе: « Металлы».

Просмотр содержимого документа
«Урок химии в 11 классе: « Металлы».»
Урок химии в 11 классе: « Металлы».
Изучение и первичное закрепление новых знаний и способов деятельности.
Образовательная: учащиеся должны повторить известные сведения
о строении атомов металлов, коррекция знаний учащихся характеризовать общие химические свойства, записывать уравнения химических реакций.
Развивающая: создать условия для формирования умения анализировать
информацию, выделять главное, существенное, продолжить развитие навыков самостоятельного умственного труда, умение сравнивать, наблюдать, делать выводы.
Воспитательная: продолжить работу по воспитанию аккуратности, коммуникативности, взаимопомощи.
Средства обучения:
1) ПСХЭ Д.И.Менделеева,
2)раздаточный материал: таблица « Физические свойства металлов», опорный сигнал по теме «Металлы»;
3) демонстрационные таблицы: кристаллическая решетка металлов, изменения радиуса атомов в периодической системе;
4) коллекция «Металлы и сплавы»;
5) модели кристаллических решеток металлов;
6) мультимедийный проектор.
Форма организации работы в классе: индивидуальная, фронтальная, парная.
Ход урока
Организационный момент. (1 минута).
( Настроить учащихся на активную, плодотворную работу.)
Постановка цели . (2 минуты).
Учитель: Мы приступаем к изучению большой темы «Вещества и их свойства». Изучение веществ начинаем с самой многочисленной и разнообразной группы - металлов. Цель урока: обобщить систематизировать знания о Ме, которые вы получили при изучении химии в 8,9,10 классах и повседневной жизни. Записываем тему урока «Металлы». (Беседа с учащимися о значении металлов).
Учитель сообщает план урока (учащиеся записывают в тетрадях):
1.Хим. элементы металлы (Ме):
а) положение в ПСХЭ Д.И.Менделеева
б) особенности электронного строения атомов.
2.Простые вещества Ме:
а) структура простых веществ, общие физические свойства.
б) общие химические свойства.
3. Актуализация опорных знаний. (10 минут).
Предварительный контроль: (фронтальный опрос)
Вопрос: Охарактеризуйте положение Ме в ПСХЭ Д.И.Менделеева;
Вопрос: Каковы особенности строения атомов химических элементов металлов?
Вопрос: К каким семействам относят элементы Ме?
Учитель: Рассмотрим строение атомов s,p,d-элементов Ме.
(Учитель организует самостоятельную работу по группам.
Карточка с заданием у каждого ученика на столе)
Задание: Запишите схемы строения атомов:
натрия (1 группа),
алюминия (2 группа),
По одному человеку от каждой группы работают у доски, а остальные ученики - в рабочих тетрадях. Учащиеся записывают схемы строения атомов, электронные и электронно-графические формулы.
(Индивидуальный опрос: учитель проверяет работу учащихся у доски).
Самопроверка знаний: оценили свою работу, обратили внимание на особенности d-элементов.
Вопрос: Какие значения степеней окисления могут проявлять эти элементы?
Задание: Сравните число значений степеней окисления у элементов побочных подгрупп с элементами главных подгрупп. Почему?
Ученики отвечают на вопросы, указывая на большее значение степеней окисления у элементов побочных подгрупп, связывая это с большими валентными возможностями атомов.
Введение новых знаний. (10 минут).
Вопрос: Какими свойствами обладают атомы Ме?
Задание: Дайте определение химическим элементам Ме исходя из особенностей строения их атомов.(Ученики отвечают на вопрос, дают определение химическим элементам Ме).)
Учитель: Переходим к рассмотрению простых веществ Ме.
На основании особого строения атомов у Ме существует особый вид связи.
Вопрос: Какой тип связи характерен для простых веществ Ме? (ученики отвечают на вопрос).
МЕ связь – это связь в металлах и сплавах между катионами метал-
лов, нейтральными атомами за счёт свободных электронов. ( Ученики записывают в тетради определение металлической связи).
Учитель: Раз у всех металлов одинаковый вид связи, то и тип кристаллической решётки, тоже одинаковый. Какой?
Что находится в узлах кристаллической решётки металлов?
Чем они связаны? (ученики отвечают на вопросы).
Учитель: (демонстрирует таблицу «Кристаллическая решетка металлов»).
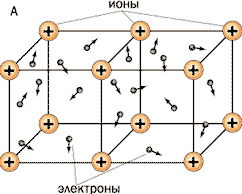
Изображение условно, так как атом, теряя электрон, превращается в ион, а ион, присоединяя электрон, превращается в атом. То есть система динамическая. Поскольку у металлов тип кристаллической решетки один, то и физические свойства металлов общие.
Учитель: (Демонстрирует образцы металлов).
Вопрос: Пользуясь таблицей« Физические свойства металлов», перечислите общие физические свойства металлов. (Ученики называют общие физические свойства Ме , сравнивают физические свойства металлов, отмечают особые свойства металлов).
Учитель: Общие физические свойства металлов объясняются наличием свободных электронов. Однако у металлов, наряду с общими, есть и специфические физические свойства.
Вопрос: Используя таблицу « Физические свойства металлов», назовите металлы, которые обладают специфическими физическими свойствами.
Учитель: Специфические физические свойства обусловлены, различными типами металлических кристаллических решеток. (Демонстрирует различные типы металлических кристаллических решёток).
5 . Первичное обобщение и ведение новых знаний в систему знаний учащихся. (15 минут).
Учитель: Особое строение атомов, особый вид химических свойств, приводит к особым химическим свойствам металлов.
В химических реакциях атомы металлов отдают электроны, превращаясь в положительно заряженные ионы:
Ме 0 – ne ® Me + n (процесс окисления)
восстановитель
( ученики записывают схему в тетради)
Ученики делают вывод о восстановительных свойствах простых веществ металлов.
Учитель: Познакомимся с химическими свойствами Ме:
Взаимодействие Ме с простыми веществами:
(Демонстрирует опыты с помощью мультимедийного проектора:
«Горение железа кислороде»; «Взаимодействие железа с серой»;
«Взаимодействие сурьмы, меди и железа с хлором»)
Текущий контроль:
Ученики записывают уравнение химической реакции « Горение железа хлоре», рассматривают реакцию как окислительно-восстановительную, указывают окислитель и восстановитель. Один ученик выполняет это задание на доске. Обращаем внимание на значение степени окисления железа в этой реакции. Прогнозируют состав продуктов реакций, степени окисления Ме в соединениях с серой.
Учитель: Рассмотрим взаимодействие Ме со сложными веществами. По степени активности металлы располагают в ряд напряжений, в котором металлы расположены в порядке убывания их восстановительных свойств и усиления окислительных свойств их ионов. Он характеризует активность металлов в ОВР, протекающих в водных растворах.
(Демонстрирует опыты с помощью мультимедийного проектора:
«Взаимодействие натрия и кальция с водой», «Взаимодействие железа с серной кислотой», «Взаимодействие меди с раствором нитрата ртути (II)», «Взаимодействие натрия с этанолом»).
Ученики записывают уравнение одной из химических реакций, а остальные уравнения будут делать при выполнении домашнего задания. Один ученик выполняет это задание на доске, рассматривает реакцию как окислительно-восстановительную, указывает окислитель и восстановитель. Ученики прогнозируют состав продуктов реакций, степени окисления Ме в образовавшихся соединениях.
6. Закрепление и применение полученных знаний. (2 минуты).
Вопрос: Какие свойства проявляют в химических реакциях простые вещества металлы? (Ученики делают вывод о восстановительных свойствах простых веществ металлов).
7. Подведение итогов урока. (2минуты).
Учитель: Сегодня мы рассмотрели химические элементы и простые вещества металлы. Выяснили общие и специфические физические свойства простых веществ металлов. Рассмотрели общие химические свойства простых веществ металлов. Ещё раз убедились в том, что свойства веществ зависят от строения. Что нового вы узнали о простых веществах Ме?
Учащиеся перечисляют, что нового узнали о простых веществах металлах, оценивают свою работу на уроке. Учитель комментирует оценки и выставляет их в журнал.
8. Информация о домашнем задании. (3 минуты).
§ №18.Написать уравнение наблюдаемых реакций и рассмотреть их, как ОВР:
на оценку «5»составить уравнение электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления для всех реакций; на оценку «4»составить уравнение электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления для четырех реакций;
на оценку «3»составить уравнение электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления для двух реакций.
Читайте также:
