Химические свойства щелочных и щелочноземельных металлов
Обновлено: 07.07.2024
Химические свойства щелочных металлов: взаимодействие, получение
Щелочные металлы находятся в первой группе периодической таблицы. Атомы этих элементов содержат один электрон на внешнем энергетическом уровне. Он расположен на большом расстоянии от ядра. Как и все металлы являются восстановителями и легко отдают электрон. Характерна степень окисления равная +1. В группе сверху вниз наблюдается увеличение металлических свойств. За счет растущей энергии ионизации способность отдавать электроны, а следовательно, электроотрицательность возрастают снизу вверх.
Франций является самым активным металлом, так как у него электрон находится на самом далеком расстоянии от ядра. Соответственно, его способность к восстановлению самая высокая.
- В нормальных условиях щелочные металлы взаимодействуют с кислородом. Они очень активны в таких реакциях, поэтому их хранят под слоем вазелинового масла. Продукты реакции могут быть оксидами или пероксидами.
2K + Cl2 → 2KCl
2Na + Cl2 → 2NaCl
Многие щелочные металлы способны взаимодействовать с разбавленными кислотами до образования водорода. Однако, реакция протекает стадийно, т.е. сначала металл реагирует с водой до образования щелочи, а затем происходит нейтрализация щелочи кислотой. Взаимодействие с кислотами сопровождается взрывом и поэтому такие реакции на практике не проводятся.
Получение
- Основным методом получения щелочных металлов является электролиз галогенидных расплавов. При этом чаще всего используются хлориды, входящие в состав природных минералов.
Например, натрий можно получить путем кальцинирования соды с углем.
Литий получают из его оксида при повышении температуры до 300°С.
Химические свойства щелочноземельных металлов: взаимодействие, получение
Главную подгруппу второй группы периодической системы химических элементов образуют металлы, которые получили название щелочноземельных. Так названы они потому, что гидраты их окислов («земель»), подобно гидратам окислов щелочных металлов, являются щелочами.
Внешний электронный слой их атомов состоит из двух электронов. Отдавая их, атомы этих металлов превращаются в ионы, несущие две единицы положительного заряда. Во всех своих соединениях металлы подгруппы бериллия положительно двухвалентны. В периодической таблице они соседствуют с щелочными металлами. Поэтому эти элементы проявляют высокую химическую активность, уступая в ней только щелочным металлам. Свойства металла повышаются с увеличением порядкового номера.
- Вступают в реакции с кислородом, продуктом реакции становятся оксиды, исключение барий, он образует пероксид BaO2. Бериллий и магний взаимодействуют с кислородом только при очень высоких t, так как покрыты тонкой защитной оксидной пленкой.
В приведенной выше реакции кусочек кальция сгорает с образованием белого дыма при нагревании. Он образован тончайшими твердыми частицами оксида кальция.
Фенолфталеин окрашивается в полученном растворе в малиновый цвет. Этот пример оправдывает ожидаемое сходство в химических свойствах щелочноземельных и щелочных металлов: оба взаимодействуют с водой с выделением водорода. Гидраты оксидов щелочноземельных металлов, как и щелочи, являются щелочами, то есть они растворимы в воде.
Взаимодействуют с азотом при нагревании, за исключением магния. Он реагирует с азотом в нормальных условиях. Продуктом реакции являются нитриды.
Основными способами получения металлов второй группы главной подгруппы являются электролиз расплавов, алюминотермия и вытеснение из их солей другими более активными металлами.
Химические свойства алюминия
Алюминий находится в третьей группе периодической системы элементов. Заряд ядра атома алюминия +13, на внешнем электронном слое три электрона.
По строению атомов и положению в периодической системе можно предположить, что у элементов третьей группы металлические свойства должны быть выражены слабее, чем у элементов второй группы. Это действительно так.
При химических реакциях атом алюминия отдает три электрона внешнего слоя, обращаясь в трех зарядный положительный ион Al 3+ . Поэтому во всех его устойчивых соединениях алюминий положительно трехвалентен. Его соединения проявляют амфотерные свойства.
Алюминий – химически активный металл и проявляет себя как восстановитель. Однако его активность снижает оксидная пленка, которая образуется на его поверхности. Поэтому во многих реакциях пленка сначала удаляется, а затем осуществляется взаимодействие с веществами. Рассмотрим на конкретных примерах химические свойства алюминия.
- Алюминий соединяется с кислородом воздуха и при нагревании и при обыкновенной температуре. На его поверхности быстро образуется тончайшая плотная пленка окиси алюминия. Она трудно проницаема для газов и защищает металл от дальнейшего окисления.
В раздробленном состоянии и при повышенной температуре алюминий бурно реагирует с кислородом с выделением большого количества тепла. В результате образуется окись алюминия.
С концентрированной азотной и серной кислотой не реагирует. Поэтому концентрированная азотная кислота хранится в алюминиевых емкостях и транспортируется в алюминиевых резервуарах.
С разбавленной азотной кислотой вступает в реакцию с образованием
Химические свойства переходных металлов (меди, цинка, хрома, железа)
Переходные элементы – металлы, расположены в побочных подгруппах периодической системы химических элементов. Так как у них происходит заполнение d-уровней в последнюю очередь, то их относят к d-элементам. Если последним заполняется f-уровень, то это f-элементы. Соответственно, химические свойства обусловлены таким строением атома. Рассмотрим химические свойства некоторых переходных элементов. У всех переходных элементов наблюдается так называемый «проскок электрона», т.е. электрон может переходить на соседнюю орбиталь в пределах одного электронного слоя.
- Взаимодействие с кислородом
- В кислороде железо сгорает, разбрасывая искры – раскаленные капли железной окалины, а при накаливании на воздухе окисляется с поверхности, образуя окалину в виде корки. Во всех случаях образуется железная окалина. 3Fe + 2O2 → Fe3O4
- Медь, цинк и хром вступают в реакцию с кислородом только при нагревании
2Zn + O2 → 2ZnO
4Cr + 3O2 → 2Cr2O3
При обычных условиях железо реагирует с парами воды и кислородом. Происходит процесс ржавления и образуется желто-бурая ржавчина – гидрат окиси железа.
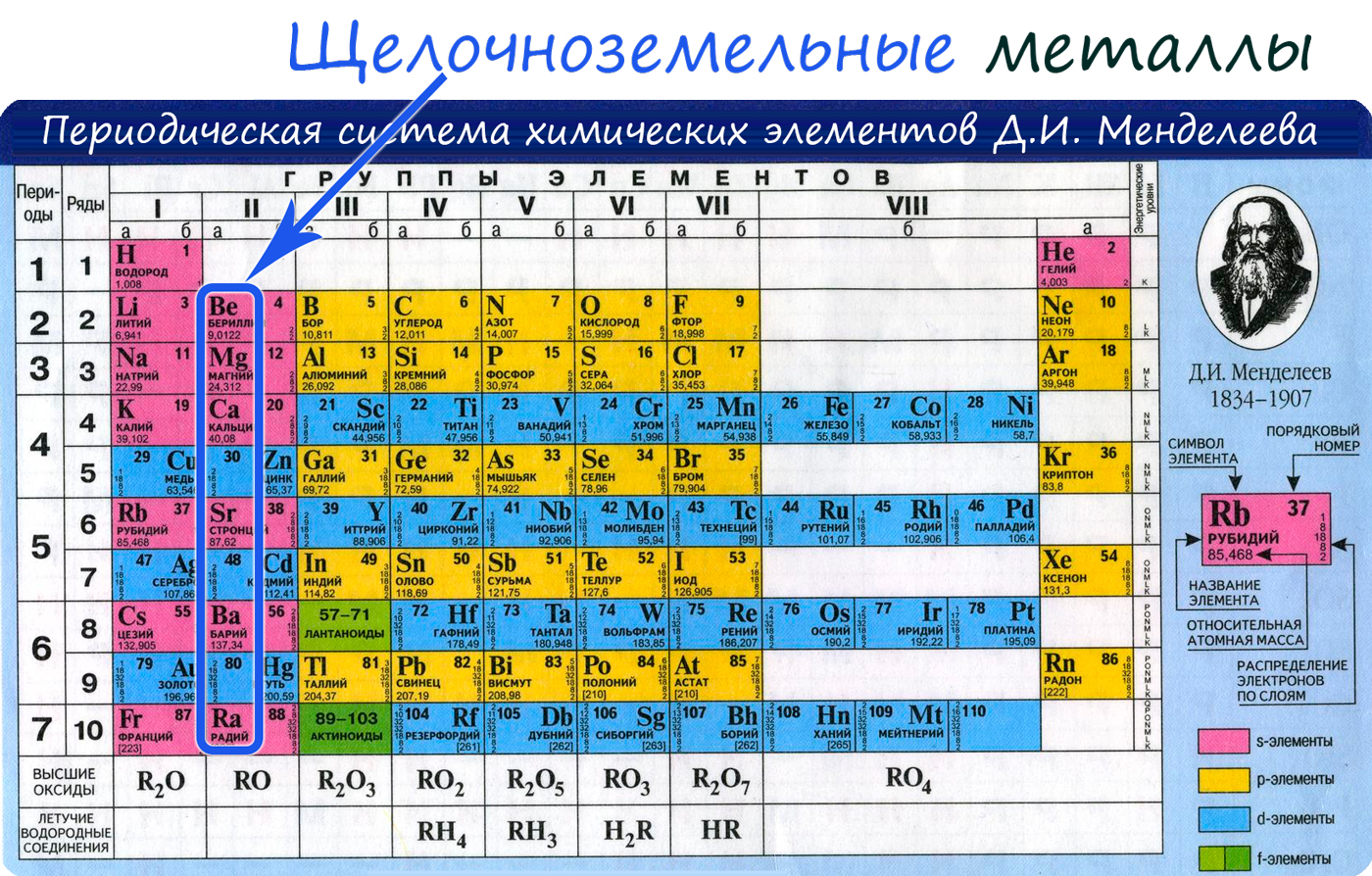
Щелочные и щелочноземельные металлы

Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Общее описание
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
Электронная конфигурация щелочных металлов – ns 1 , щелочноземельных металлов – ns 2 .
Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II. За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях. Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Физические свойства
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.

Рис. 2. Разрезание натрия ножом.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см 3 ).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Химические свойства
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
Взаимодействие
Щелочные металлы
Щелочноземельные металлы
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
Реагируют при нагревании с серой, водородом, фосфором:
С азотом реагирует только литий, с углеродом – литий и натрий:
Реагируют при нагревании:
Бурно реагируют с образованием галогенидов:
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
Менее активно, чем щелочные металлы, реагируют при комнатной температуре:
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
Из всех металлов реагирует только бериллий:
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы:
2Mg + ZrO2 → Zr + 2MgO

Рис. 3. Реакция калия с водой.
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Что мы узнали?
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются. Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы. Со щелочами реагирует только бериллий .
Урок 9. Щелочные и щёлочноземельные металлы

Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны. А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает
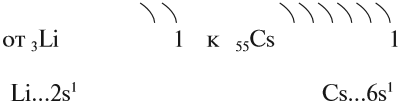
Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:
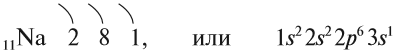
Имея один валентный электрон (…3s 1 ), натрий является активным металлом с постоянной валентностью I:
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:

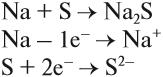
Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:
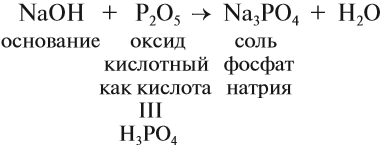
Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др. Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы. Эти вещества применяются и в технических целях.

Щелочноземельные металлы
Металлы главной подгруппы II группы в отличие от щелочных металлов имеют довольно разные свойства.
- Сколько электронов на внешнем уровне атомов этих металлов?
- Какой металл более активен: натрий или магний? Почему?
Эти металлы имеют на внешнем уровне по 2 электрона, следовательно, они менее активны, чем их «соседи» — щелочные металлы, так как на отрыв двух электронов нужно затратить больше энергии, чем на отрыв одного электрона.
Вопрос. Как изменяется активность металлов в подгруппе сверху вниз? Почему?
В этой подгруппе, как и у щелочных металлов, сверху вниз увеличивается сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Кроме того, увеличивается заряд иона, а значит, усиливается притяжение группы ОН в гидроксиде металла: ионы Na + и OH – притягиваются слабее, чем Са 2+ и ОН – .
Поэтому первые два элемента этой подгруппы не образуют щелочей:
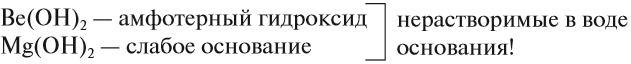
Кальций уже образует сильное основание — щёлочь, а стронцию и барию соответствуют ещё более сильные основания.
Запомните: Ca, Sr, Ba — щелочноземельные* металлы, так как их оксиды проявляют щелочные свойства.
* «Земли» — устаревшее название оксидов металлов, так как эти оксиды входят в состав земли (почвы).
Несмотря на эти различия, перечисленные элементы имеют много сходного в свойствах.
Вопрос. Какую валентность проявляют эти химические элементы в соединениях?
Главное сходство химических элементов главной подгруппы II группы заключается в том, что они проявляют в соединениях постоянную валентность II, так как на внешнем уровне имеют по два электрона, а на предвнешнем уровне нет незавершённых подуровней.
Рассмотрим свойства химических элементов главной подгруппы II группы на примере кальция. Строение атома кальция изображается схемой:
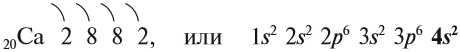
Имея два валентных электрона: …4s 2 , кальций является активным металлом, поскольку оба электрона расположены на внешнем уровне. Его постоянная валентность равна двум:
Простое вещество «кальций» — довольно прочный, серебристо-белый умеренно твёрдый металл. Активно реагирует с кислородом, водородом, неметаллами, водой, растворами кислот:
Рассмотрим как происходит взаимодействие кальция с азотом:
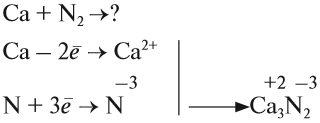
Вопрос. Почему атом азота присоединяет три электрона?
Задание 9.6. Составьте уравнения реакций кальция с кислородом, хлором (Cl2), серой, водой, соляной кислотой.
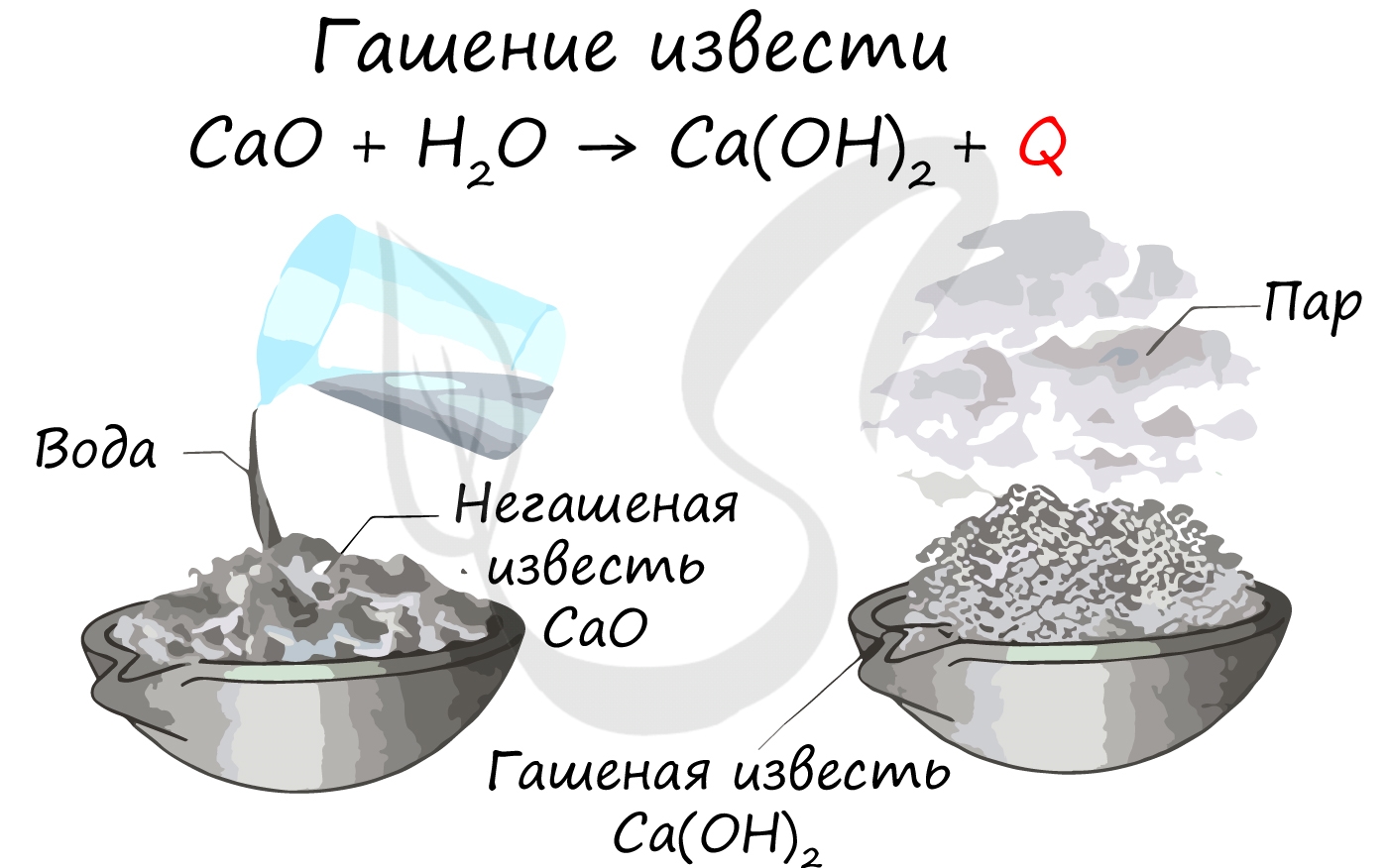
Оксид кальция CaO (негашёная известь) очень активно реагирует с водой с выделением такого большого количества теплоты, что вода закипает:
Этот процесс называется «гашением извести», а систему называют «кипелкой».
Вопрос. С какими ещё веществами может реагировать оксид кальция?
Как основный оксид CaO реагирует с кислотными оксидами и с кислотами:
- CaO + SO2 → СаSO3
- CaO + НNO3 → … (закончить уравнение этой реакции).
Гидроксид кальция Са(ОН)2 (гашёная известь) проявляет все свойства щелочей.
Вопрос. С какими веществами могут реагировать щелочи? (При затруднении см. урок 2.3.)
Задание 9.7. Составить уравнения реакций:
Прозрачный раствор гидроксида кальция в воде называется известковой водой. Она мутнеет при пропускании через неё углекислого газа:
Этот эффект реакции считают качественным признаком того, что в данном растворе присутствуют ионы кальция. Убедиться в этом поможет также реакция с пламенем: все соединения кальция окрашивают пламя в кирпично-красный цвет.
Задание 9.8. Опишите по предложенной схеме свойства магния и его соединений.
Многие соединения кальция играют заметную роль в нашей жизни. Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
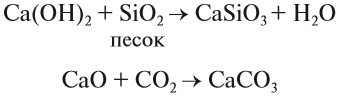
Образование в результате этих реакций прочных нерастворимых карбонатов и силикатов кальция надёжно скрепляет стены. Аналогичные реакции происходят при схватывании цемента.
Оксид кальция в больших количествах получают обжигом известняка:
Карбонат кальция СаСО3 составляет основу мела, мрамора, известняка. Из него состоят целые горы и пласты земной коры. Под действием воды и углекислого газа из воздуха карбонат кальция переходит в водорастворимое состояние — гидрокарбонат кальция:
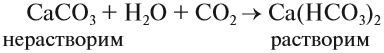
Аналогичные процессы происходят и с карбонатами магния. В результате этих и других процессов в природной воде появляются ионы кальция и магния.
Вода, содержащая ионы кальция и магния, называется ЖЁСТКОЙ.
Этот термин возник из-за того, что некоторые овощи и плоды под действием такой воды становятся жёсткими: ионы кальция и магния вступают в реакцию с органическими компонентами плодов и овощей.
Чаще всего жёсткая вода приносит неприятности: долго развариваются продукты, плохо моет мыло (см. урок 24.4), на стенках котлов и труб появляется слой накипи, что может привести к авариям:
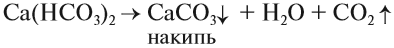
Накипь, конечно, можно растворить при помощи соляной кислоты:
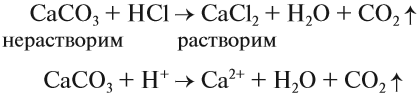
Задание 9.10. Можно ли растворить накипь при помощи серной, азотной, фосфорной кислот? Ответ подтвердите ионно-молекулярными уравнениями реакций.
Но лучше всего в случаях, когда жёсткость воды повышена, а это нежелательно, умягчать воду. Для этого ионы кальция и магния нужно перевести в нерастворимое состояние.
Вопрос. Умягчается ли вода при кипячении?
Частично вода умягчается при кипячении, так как при этом растворимые гидрокарбонаты переходят в нерастворимые карбонаты. Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Задание 9.11. Какие из солей: кальцинированная сода, фосфат натрия, поваренная соль — устраняют жёсткость воды? Ответ подтвердить ионными уравнениями реакций, считая, что в состав воды входит сульфат кальция.
Чаще всего для умягчения воды используют кальцинированную соду Na2CO3:
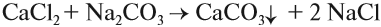
Кальцинированная сода входит в состав стиральных порошков, которые также содержат и фосфаты. Эти вещества «автоматически» смягчают воду при стирке.

Выводы
Щелочные металлы — это простые вещества, которые образованы элементами главной подгруппы первой группы. Это очень активные металлы, которые образуют с водой сильные растворимые основания — щёлочи.
Щелочноземельные металлы — это простые вещества, которые образованы некоторыми элементами главной подгруппы второй группы Ca, Sr, Ba. Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
Природные соединения
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Химические свойства
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
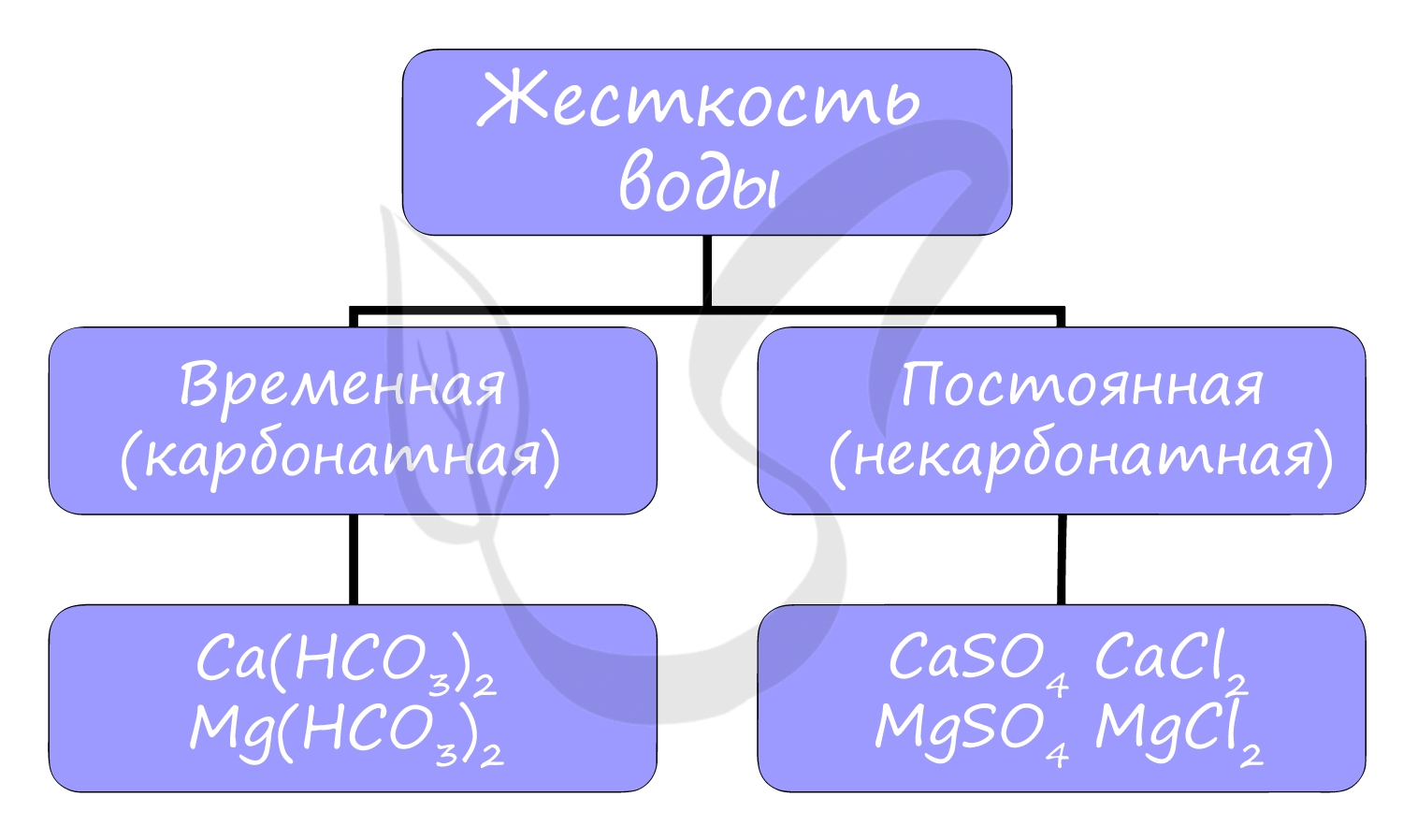
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
