Химическое соединение водорода с металлом
Обновлено: 17.05.2024
Системы водород — металл часто являются прототипами при изучении ряда фундаментальных физических свойств. Предельная простота электронных свойств и малая массы атомов водорода позволяют анализировать явления на микроскопическом уровне. Рассматриваются следующие задачи:
- Перестройка электронной плотности вблизи протона в сплаве с малыми концентрациями водорода вкючая сильное электрон-ионное взаимодействие
- Определение косвенного взаимодействия в металлической матрице через возмущение «электронной жидкости» и деформацию кристаллической решётки.
- При больших концентрациях водорода возникает проблема формирования металлического состояния в сплавах с нестехиометрическим составом.
Сплавы водород — металл
Водород, локализованный в междоузлиях металлической матрицы слабо искажает кристаллическую решётку. С точки зрения статистической физики реализуется модель взаимодействующего «решёточного газа». Особый интерес представляет исследование термодинамических и кинетических свойств вблизи точек фазового перехода. При низкихтемпературах образуется квантовая подсистема с большой энергией нулевых колебаний и с большой амплитудой смещения. Это позволяет изучать квантовые эффекты при фазовых превращениях. Большая подвижность атомов водорода в металле делает возможным изучение процессов диффузии. Другим направлением исследований являются физика и физхимия поверхностных явлений взаимодействия водорода с металлами: распад молекулы водорода и адсорбция на поверхности атомарного водорода. Особый интерес представляет случай, когда начальное состояние водорода является атомарным, а конечное — молекулярным. Это важно при создании метастабильных металл-водородных систем.
Применение систем водород — металл
- Очистка водорода и водородные фильтры
- Использование металлогидридов в ядерных реакторах в качестве замедлителей, отражателей и т. д.
- Разделение изотопов
- Термоядерные реакторы — извлечение трития из лития
- Устройства для диссоциации воды для топливных элементов и батарей
- Аккумуляция водорода для автомобильных двигателей на базе металлогидридов
- Тепловые насосы на базе металлогидридов, включая кондиционеры для автотранспорта и жилища
- Преобразователи энергии для тепловых электростанций
Интерметаллические металлогидриды
Гидриды интерметаллических соединений нашли широкое применение в промышленности. Основная часть перезаряжаемых батарей и аккумуляторов, например, для сотовых телефонов, переносных компьютеров (ноутбуков), фото- и видеокамер содержит электрод из металлогидрида. Такие аккумуляторы являются экологически чистыми, так как не содержат кадмия.

Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Металлические гидриды" в других словарях:
Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом[1],[2]. Классификация В зависимости от характера связи водорода различают… … Википедия
ГИДРИДЫ — соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Иногда к Г. относят соед. всех хим. элементов с водородом. Различают простые, или бинарные, Г., комплексные (см., напр., Алюмогидриды, Борогидриды металлов … Химическая энциклопедия
Гидриды — соединения водорода с другими элементами. В зависимости от характера связи водорода различают три типа Г.: ионные, металлические и ковалентные. К ионным (солеобразным) Г. относятся Г. щелочных и щёлочноземельных металлов. Это… … Большая советская энциклопедия
МЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ — (металлиды), обладают металлич. св вами, в частности электрич. проводимостью, что обусловлено металлич. характером хим. связи. К М. с. относятся соед. металлов друг с другом интер металлиды и мн. соед. металлов (в осн. переходных) с неметаллами.… … Химическая энциклопедия
Бороводороды — гидриды бора, бораны, соединения бора с водородом. Известны Б., содержащие от 2 до 20 атомов бора в молекуле. Простейший Б., BH3, в свободном состоянии не существует, он известен лишь в виде комплексов с аминами, эфирами и т.п. Характер… … Большая советская энциклопедия
Металлы — простые вещества, обладающие в обычных условиях характерными свойствами: высокой электропроводностью и теплопроводностью, отрицательным температурным коэффициентом электропроводности, способностью хорошо отражать электромагнитные волны… … Большая советская энциклопедия
АЗОТА ФОСФОРА СЕМЕЙСТВО — ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у… … Энциклопедия Кольера
ИНТЕРМЕТАЛЛИДЫ — (от лат. inter между и металл) (интерметаллич. соединения), хим. соед. двух или неск. металлов между собой. Относятся к металлическим соединениям, или металлидам. И. образуются в результате взаимод. компонентов при сплавлении, конденсации из пара … Химическая энциклопедия
МЕТАЛЛЫ — (от греч. metallon первоначально, шахта, копи), в ва, обладающие в обычных условиях характерными, металлическими, свойствами высокими электрич. проводимостью и теплопроводностью, отрицат. температурным коэф. электрич. проводимости, способностью… … Химическая энциклопедия
Металл — (Metal) Определение металла, физические и химические свойства металлов Определение металла, физические и химические свойства металлов, применение металлов Содержание Содержание Определение Нахождение в природе Свойства Характерные свойства… … Энциклопедия инвестора
Водород: химия водорода и его соединений
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1sАтом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
вода H2O и др. летучие водородные соединения (HCl, HBr)
кислые соли (NaHCO3 и др.)
основания NaOH, Cu(OH)2
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Гидриды
соединения водорода с другими элементами. В зависимости от характера связи водорода различают три типа Г.: ионные, металлические и ковалентные.
К ионным (солеобразным) Г. относятся Г. щелочных и щёлочноземельных металлов. Это белые кристаллические вещества, устойчивые в обычных условиях и лишь при нагревании разлагающиеся без плавления на металл и водород (кроме LiH, плавящегося при 680°С). Водой энергично разлагаются с выделением водорода. Получаются при взаимодействии металлов с водородом при 200—600°С. LiH и NaH применяются в органическом синтезе как восстановители и конденсирующие агенты. CaH2 — для высушивания и определения воды в органических растворителях, при получении порошков металлов из окислов, а также водорода. Раствором NaH в расплавленной щёлочи снимают окалину с металлических изделий. Ионное строение имеют и двойные Г. — Борогидриды МеВН4 и алюмогидриды MeA1H4 (см. Алюминия гидрид), широко используемые в органическом синтезе в качестве эффективных восстановителей.
Г. переходных металлов принадлежат к типу металлических, т.к. по характеру химических связи они сходны с металлами. Эти Г. в большинстве случаев являются соединениями переменного состава, и приводимые ниже формулы дают лишь предельное содержание в них водорода. Многие металлы способны поглощать значительное количество водорода с образованием твёрдых растворов, сохраняющих кристаллическую структуру данного металла. Напротив, истинные Г. имеют структуру иную, чем исходный металл. Для металлов III группы периодической системы (подгруппа Sc и лантаноиды) характерно образование двух типов Г. — MeH2 и MeH3. Металлы IV группы (подгруппа Ti) образуют Г. MeH2, а металлы V группы (подгруппа ванадия) — MeH. Г. металлов этих групп — хрупкие твёрдые вещества серого или чёрного цвета, получаются при действии водорода на мелкораздробленные металлы при повышенных температурах. Металлы VI, VII и VIII групп (кроме палладия) при поглощении водорода не дают определённых химических соединений.
Г. переходных металлов служат катализаторами различных химических реакций. Способность металлов образовывать Г. используется в высоковакуумной технике для связывания водорода. В результате образования Г., например при действии паров воды на раскалённый металл и при электролитическом выделении металлов, ухудшается качество металлов (появляется т. н. водородная хрупкость).
Г. переходных металлов I и II групп периодической системы, а также Г. III группы (подгруппа A1) не образуются при взаимодействии металла с водородом. Они получаются, например, при восстановлении соединений этих металлов алюмогидридом лития LiAlH в эфирном растворе. Все они при нагревании легко разлагаются на металл и водород.
Ковалентные Г. образуются неметаллами IV, V, VI и VII групп периодической системы, а также бором. Кроме простейших соединений этого типа (метана CH4, силана SiH4 и т.п.), являющихся газами, известны Г. с большим числом атомов элемента, соединённых друг с другом в виде цепей, например силаны SinH2n+2. Простейший Г. бора ВН3 не существует, Бороводороды имеют сложное строение. Г. элементов первых периодов очень стабильны, Г. тяжёлых элементов крайне неустойчивы. Многие Г. (B2H6, SiH4, PH3) легко воспламеняются на воздухе. B2H6 и SiH4 разлагаются водой с выделением водорода. Г. элементов V, VI и VII групп водой не разлагаются. Известны многочисленные производные ковалентных Г., в которых часть атомов водорода замещена на атомы галогена или металла, а также на алкильные и др. группы. Ковалентные Г. получают непосредственным взаимодействием элементов, разложением металлических соединений водой или кислотами, восстановлением галогенидов и др. соединений гидридами, борогидридами и алюмогидридами щелочных металлов. Термическое разложение Г. служит одним из методов получения особо чистых элементов (например, кремния, германия).
Лит.: Херд Д., Введение в химию гидридов, пер. с англ., М., 1955; Жигач А. Ф., Стасиневич Д. С., Химия гидридов, Л., 1969; Михеева В. И., Гидриды переходных металлов, М., 1960; Маккей К., Водородные соединения металлов, пер. с англ., М., 1968; Галактионова Н. А., Водород в металлах, 2 изд., М., 1967.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом [1] , [2] .
Классификация
В зависимости от характера связи водорода различают три типа гидридов:
- ионные гидриды (солеобразные гидриды); ;
- ковалентные гидриды.
Примеры
Примечания
Смотреть что такое "Гидриды" в других словарях:
гидриды — Соединения водорода с металлами и менее электроотрицательными элементами (неметаллами). Различают простые (бинарные) г.; комплексные, напр. алюминогидриды У(АlН4), Са(АlH4)2 и т.п., борогидриды Аl(ВН4), Zr(BH4), Са(ВН4) и др. и г. интерметаллидов … Справочник технического переводчика
ГИДРИДЫ — химические соединения водорода с другими элементами. Восстановители. Некоторые гидриды промежуточные продукты при получении особо чистых элементов (кремния, германия). См., напр., Алюмогидриды, Борогидриды металлов … Большой Энциклопедический словарь
Гидриды — [hydrides] соединения водорода с металлами и менее электроотрицательными элементами (неметаллами). Различают простые (бинарные) гидриды; комплексные, например, алюминогидриды Li(АlH4), Са(АlH4)2 и т. п., борогидриды Al(ВH4), Zr(ВH4), Са(ВH4) и др … Энциклопедический словарь по металлургии
гидриды — химические соединения водорода с другими элементами. Восстановители. Некоторые гидриды промежуточные продукты при получении особо чистых элементов (кремния, германия). См., например, Алюмогидриды, Борогидриды металлов. * * * ГИДРИДЫ ГИДРИДЫ,… … Энциклопедический словарь
гидриды — (гидр(огениум) гр. eidos вид) хим. соединения водорода с другими элементами; примен. во многих областях техники. Новый словарь иностранных слов. by EdwART, , 2009. гидриды [гр. вода + вид] – хим. водородистые металлы; соединения водорода с… … Словарь иностранных слов русского языка
гидриды — мн. Химические соединения водорода с каким либо другим элементом. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
ГИДРИДЫ — соединение водорода с металлами и нек рыми неметаллами. Г. применяют для получения особо чистых элементов (напр., кремния, германия), как восстановители и катализаторы в органич. синтезе (Г. лития и натрия), для хранения и транспортирования… … Большой энциклопедический политехнический словарь
ГИДРИДЫ — хим. соединения водорода с др. элементами. Восстановители. Нек рые Г. промежуточные продукты при получении особо чистых элементов (кремния, германия). См., напр., Алюмогидриды, Борогидриды металлов … Естествознание. Энциклопедический словарь
Гидриды - свойства, формулы и применение водородных соединений
Соединения водорода с другими элементами, в которых он выступает как более электроотрицательный элемент, называют гидридами. Но часто так именуют любые химические вещества, образованные водородом с другими элементами. Водород — элемент не из редких, вещества, образованные его взаимодействием с другими элементами, в природе встречаются часто. Человек имеет с ними дело постоянно. Самый знакомый — Н2О, вода, или гидрид кислорода.
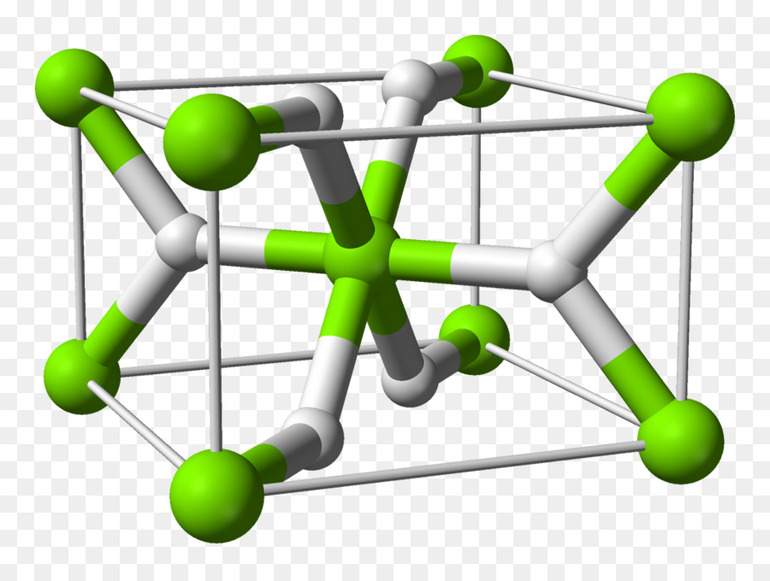
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
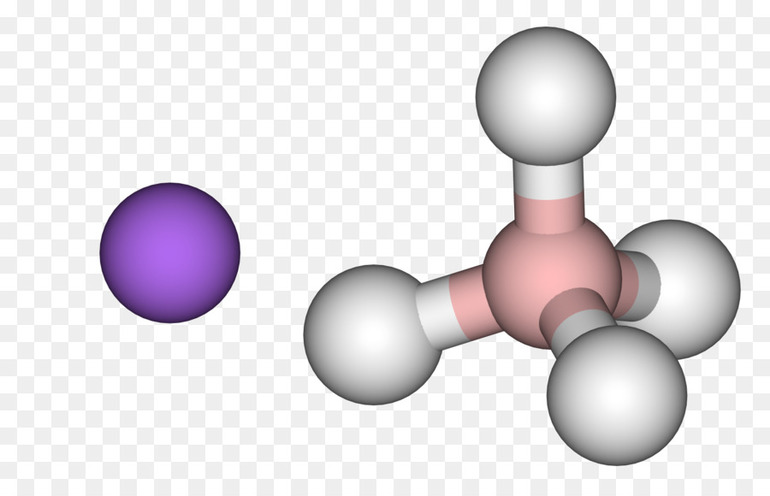
- Простые гидриды — бинарные, в них только 2 элемента, они встречаются чаще всего.
- Со многими переходными металлами (элементы р-подгруппы) водород образует ко́мплексные соединения. Ко́мплексные гидриды металлов (к примеру, боро- или алюмогидриды) вместо атома водорода, имеют алюмогруппу (AlH4) или борогруппу (BH4). Из них натрийборогидрид Na (BH4) и литийалюмогидрид Li (AlH4), будучи сильными восстановителями, нашли применение в лабораторной практике. Кроме этого, Na (BH4) используют для отбеливания бумаги.
- И также есть гидриды интерметаллидов (пример: TiAl или Ti3Al, алюминид титана), в кристаллических решётках которых водород просто растворяется, аккумулируется.
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
- металлоподобные;
- ионные (солеобразные);
- ковалентные.
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
Металлические гидриды
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:

- В основном такие гидриды являются бертоллидами, состав их зависит от способа получения, непостоянен, законам постоянных и кратных отношений не подчиняется.
- В формулах для них указывают предельное содержание водорода.
- В отличие от прочих, они сохраняют исходную металлическую решётку.
- Их вид и физические свойства соответствуют металлам, с которыми они образованы.
- Имеют характе́рный металлический блеск, взаимодействуют с H2O (в жидком или газообразном состоянии), кислородом, при нормальных условиях, но медленно.
- Как и металлы, обладают значительной теплопроводностью и проводимостью.
- При нагревании распадаются на водород и исходный металл.
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
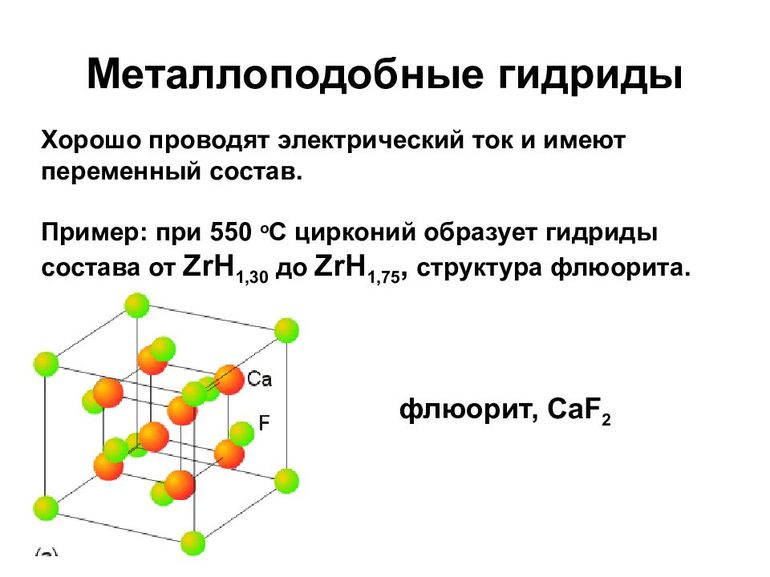
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
Соединения с ионным типом связи
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
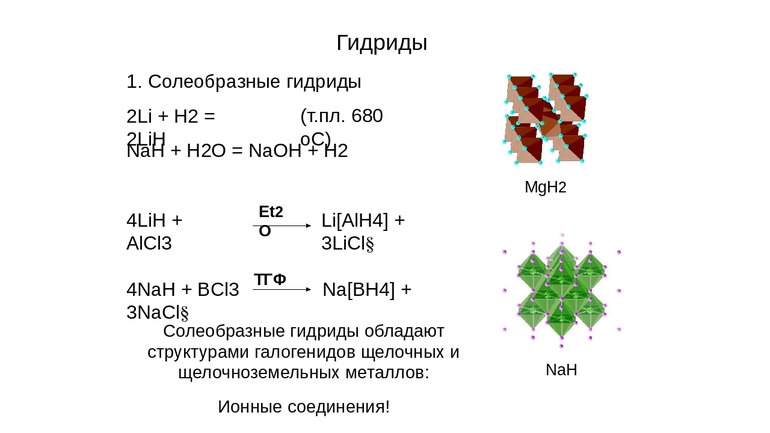
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
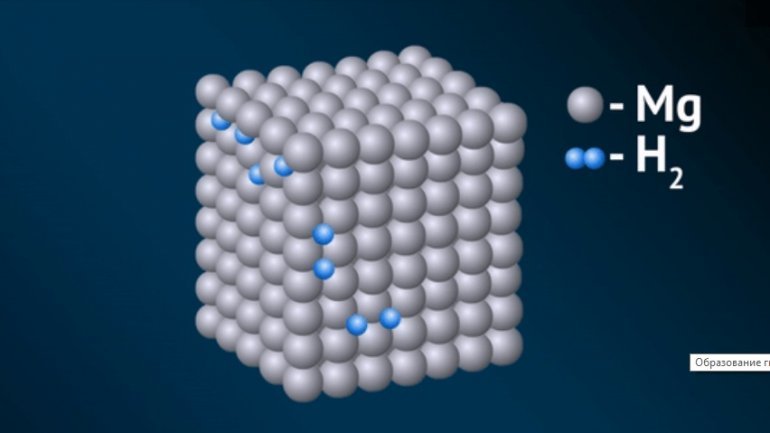
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
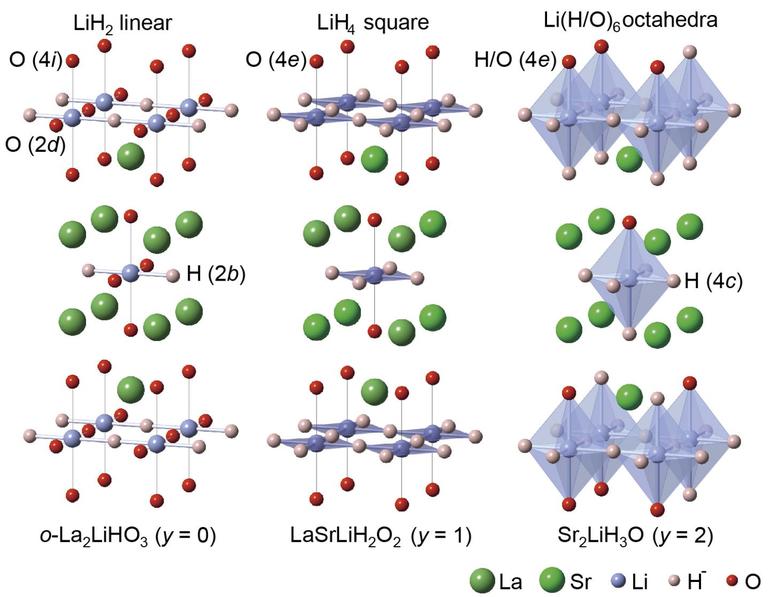
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:

- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Интерметаллические соединения
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.

У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
Читайте также:
