Химия 9 класс габриелян химические свойства металлов
Обновлено: 04.10.2024
Данная презентация служит сопровождением к уроку "Химические свойства металлов". Ресурс предназначен для учащихся 9 класса. УМК О.С.Габриеляна.
| Вложение | Размер |
|---|---|
| himicheskie_svoystva_metallov.ppt | 537.5 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
Тема урока: Химические свойства металлов Учитель химии МБОУ СОШ 70 г.Барнаул Шпенглер Мария Михайловна
Актуализация знаний - Назовите особенности строения атомов металлов. - Охарактеризуйте положение металлов в Периодической системе химических элементов. - Какие электроны называются «свободными»? - Что такое металлическая связь? - Перечислите особенности металлической кристаллической решетки. - Перечислите основные физические свойства металлов. Чем они обусловлены?
Химические свойства металлов У металлов на внешнем энергетическом слое мало электронов (от одного до трех) и относительно большой атомный радиус, поэтому в химических реакциях металлы легко отдают электроны и проявляют только восстановительные свойства. Ме 0 – ne → Ме n+ , где Ме 0 – металл – простое вещество, Ме n+ - металл – химический элемент в соединении. Для того чтобы прошла эта реакция необходимо наличие окислителя.
Химические свойства металлов Вещества, реагирующие с металлами: Простые вещества: неметаллы (кислород, галогены, водород, сера, азот). Сложные вещества: Вода. Кислоты. Соли.
Взаимодействие металлов с кислородом Щелочные и щелочноземельные металлы реагируют с кислородом легко: 4 Li 0 + O 2 0 = 2 Li 2 + O 2- Li 0 – 1e = Li + 4 восстановитель O 2 0 + 4e = 2O 2 2- 1 окислитель 4 Li 0 + O 2 0 = 4Li 0 + 2O 2 2-
Взаимодействие металлов с кислородом Металлы, находящиеся в ряду активности между Mg и Pb медленно окисляются кислородом воздуха при обыкновенной температуре с образованием защитной оксидной пленки, поэтому для осуществления реакции необходимо повышение температуры. Неактивные металлы, расположенные после водорода ( Cu , Hg ), не образуют защитной оксидной пленки, но окисляются кислородом при нагревании. Следующие за ними металлы ( Au , Ag , Pt ) не окисляются кислородом не при каких условиях.
Взаимодействие металлов с галогенами С галогенами многие металлы реагируют без нагревания. Например, порошок алюминия при смешивании с бромом загорается. 2 Al + 3 Br 2 = 2 AlBr 3 Обратите внимание, темно-красная жидкость – это бром. Трубка вверху реакционной пробирки наполнена древесным углем , для поглощения паров брома. Бром тяжелее воды, поэтому под реакционный прибор помещают кристаллизатор с водой.
Взаимодействие металлов с галогенами Медь, взятая в виде пучка тонкой проволоки и предварительно нагретая, при опускании в хлор раскаляется и сгорает, наполняя колбу бурым дымом, образованным частичками хлорида меди ( II ). Cu + Cl 2 = CuCl 2 В отличие от предыдущей реакции алюминия с бромом, эта реакция эндотермична и поэтому идет при повышенной температуре.
Взаимодействие металлов с водой При взаимодействии металлов с водой наблюдается некоторая аналогия, как в случае взаимодействия металлов с кислородом. Щелочные и щелочноземельные металлы легко взаимодействуют с водой, восстанавливая катионы водорода до свободного, и образуют при этом растворимые гидроксиды – щелочи . 2 K + 2 H 2 O = 2 KOH + H 2 ↑ Ca + 2 H 2 O = Ca ( OH ) 2 + H 2 ↑
Взаимодействие металлов с водой Малоактивные металлы (от Mg до Pb в ряду активности металлов)взаимодействуют с водой при нагревании с образованием оксида: 2Fe + 3H 2 O = Fe 2 O 3 + 3H 2 ↑ Металлы, стоящие в ряду правее водорода не реагируют с водой.
Закрепление Дописать уравнения химических реакций и составить схемы процессов окисления и восстановления: Al + O 2 → Ca + Cl 2 → Fe + S → Zn + H 2 O → Указать восстановитель и окислитель.
По теме: методические разработки, презентации и конспекты
Урок по теме "Общие химические свойства металлов"
Разработка урока содержит подробный конспект урока, слайды к проведению урока, рабочую тетрадь по изучаемой теме, инструктивные карты для проведения эксперимента и другой дидактический материал.
Уравнения по теме "Химические свойства металлов"
Большое количество уравнений, требующих детальной проработки теоретического материала.
Урок по теме "Химические свойства металлов"
Урок химии в 9 классе по теме "Химические свойства металлов".
Общие химические свойства металлов
МЕТОДИЧЕСКАЯ РАЗРАБОТКАурока химии в 9 классев условиях реализации переходана ФГОС нового поколения.
План-конспект урока химии 9 класс по теме "Общие химические свойства металлов"
Разработка урока с применением ЭОР.
Конспект урока «Общие химические свойства металлов»- 9 класс
Считаю, что урок с применением ЭОР во многом отличается от стандартного урока. Получение новой информации происходит в основном в процессе самостоятельной деятельности, которая заключается в освоении .
§ 11. Химические свойства металлов
В химических реакциях металлы проявляют только восстановительные свойства, т. е. их атомы отдают электроны, образуя в результате положительные ионы. Окислителями при этом могут выступать неметаллы (кислород, галогены, сера и др.), катионы водорода Н + и катионы других металлов.
С кислородом воздуха легко взаимодействуют щелочные и щёлочноземельные металлы (поэтому их хранят под керосином):
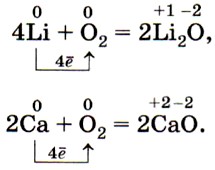
Железо, цинк, медь и другие менее активные металлы энергично окисляются кислородом только при нагревании:
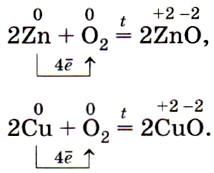
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
Как вы уже знаете, металлы образуют с неметаллами бинарные соединения — оксиды, хлориды, сульфиды, фосфиды ит. д., например:
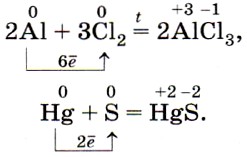
Щелочные и щёлочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые основания — щёлочи:
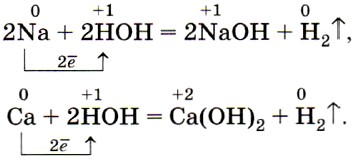
Менее активные металлы, например железо, взаимодействуют с водой только в раскалённом виде:
При этом, как и при горении железа, получается оксид состава Fe3O4 (железная окалина), который представляет собой смесь двух оксидов FeO • Fe2O3.
По восстановительной способности, как вы уже знаете, металлы располагают в ряд, который называют электрохимическим рядом напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au.
В этот ряд помещён и водород, который, как и металлы, способен отдавать электроны, образуя при этом положительно заряженные ионы Н + .
Как вы, очевидно, помните из курса химии 9 класса, из положения металлов в ряду напряжений вытекают два правила, характеризующие химические свойства металлов. Повторим их.
1. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот (рис. 35), а стоящие правее, как правило, не вытесняют водород из растворов кислот:
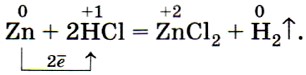
- правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
- концентрированная серная кислота и азотная кислота любой концентрации реагирует с металлами по-особому, при этом водород не образуется;
- на щелочные металлы правило не распространяется, так как они легко взаимодействуют с водой (а указанное правило относится к реакциям водных растворов кислот с металлами).
2. Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее, например (рис. 36):
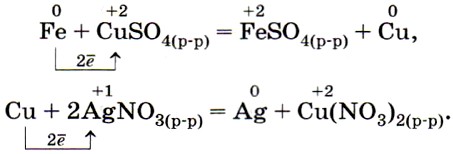

Это правило также имеет поправки, аналогичные таковым к первому правилу, а именно — правило соблюдается при условии образования растворимой соли; правило не распространяется на щелочные металлы.


1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.

1. Определите число электронов, которое отдают три атома железа молекуле воды в реакции образования железной окалины.
2. Вычислите объём воздуха (н. у.), который потребуется для сжигания 36 г магния. (Напоминаем, что объёмная доля кислорода в воздухе равна 0,21.)
3. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 120 мг кальция, если выход газа составляет 80% от теоретически возможного.
4. Почему щелочные и щёлочноземельные металлы хранят под керосином? Почему литий, в отличие от натрия и калия, хранят в вазелине?
5. Методом электронного баланса определите коэффициенты в уравнении реакции, схема которого:
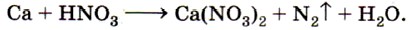
Какой ион проявляет в этой реакции окислительные свойства?
6. Можно ли получить водород при взаимодействии свинца с раствором серной кислоты?
7. Методом электронного баланса определите коэффициенты в уравнении реакции, схема которой:
Технологическая карта урока химии в 9 классе по теме: "Химические свойства металлов"
· Рассмотреть общие химические свойства металлов, а также формировать навыки проведения химического эксперимента с соблюдением правил техники безопасности.
Задачи урока
Развивающие
Воспитательные
закрепить и обобщить знания учащихся об общих химических свойствах металлов, закрепить умения работать с электрохимическим рядом напряжения металлов и периодической системой; продолжать развивать навыки составления уравнений химических реакций;
умения анализировать, делать выводы, мыслительные операции, эмоциональную сферу, познавательную деятельность через исследовательскую работу; развивать речь с использованием химической терминологии;
формирование научного мировоззрения, воспитание коллективизма, культуры химического эксперимента; умение создавать на уроке творческую и демократическую обстановку.
Урок открытия новых знаний с использованием исследовательской деятельности и информационных технологий
Планируемые результаты
Предметные знания и умения
Метапредметные результаты
Личностные результаты
научиться использовать при характеристике металлов и их соединений понятия «металлы», «ряд активности металлов», «щелочные металлы», «щелочноземельные металлы», называть соединения металлов и составлять их формулы по названию; характеризовать химические свойства простых веществ-металлов; объяснять зависимость свойств химических элементов-металлов от положения в Периодической системе химических элементов Д. И. Менделеева; составлять молекулярные уравнения реакций, характеризующих химические свойства металлов и их соединений, а также электронные уравнения процессов окисления-восстановления;
-коммуникативные: научится участвовать в коллективном обсуждении проблем, проявлять активность во взаимодействии для решения коммуникативных и познавательных задач, выслушивать мнение одноклассников, принимать коллективное решение.
-регулятивные: научится ставить учебные задачи на основе соотнесения того, что известно и усвоено , и того, что еще неизвестно, составлять план работы с учебником, выстраивать последовательность необходимых операций (алгоритм действий).
-познавательные: научится выдвигать гипотезы и их обосновывать, выделять существенную информацию из текстов разных видов.
будут сформированы умения использовать знания в быту. формирование навыков индивидуальной и коллективной исследовательской деятельности.
Учебно- методическое и материально-техническое обеспечение
Вид используемых на уроке средств ИКТ
Необходимое аппаратное и программное обеспечение
Коллекция металлов, оборудование и реактивы: цинк, медь, соляная и серная кислоты, железо, сульфат меди, хлорид железа 2, спиртовка, спички, пробиркодержатель, 6 пробирок.
Организационная структура урока
Название этапа урока
Задачи этапа
Деятельность учителя
Деятельность обучающихся
Подготовка обучающихся к учебной деятельности
Приветствует учащихся, настраивает на работу, проверяет готовность учащихся
2.Актуализация знаний и фиксация затруднений в деятельности
Выявление степени освоения знаний и умений, необходимых для решения учебной задачи.
- Учащиеся получают коллекции металлов и из коллекции получают один металл ,который необходимо охарактеризовать по физическим свойствам и примерным областям применения
-Перечислите основные физические свойства металлов. Чем они обусловлены?
- Какая особенность строения атомов металлов обуславливает общность их свойств?
Как эти свойства называются?
Рассматривают образцы металлов и характеризуют его физические свойства
Перечисляют физические свойства металлов. Отмечают ,что все металлы в химических реакциях легко отдают электроны, превращаясь при этом в положительно заряженные ионы-катионы. В реакциях служат восстановителями.
Постановка учебной задачи
Обозначение проблемной ситуации. Фиксация новой учебной задачи
Прозвучало словосочетание в химических реакциях
Значит, о чем же сегодня мы будем говорить?
Выслушав учащихся, учитель еще раз уточняет названную тему урока
«Химические свойства металлов» и говорит о том, что одновременно необходимо вспомнить ранее изученный материал, касающейся химических реакций (типы химических реакций, виды химических связей, основы номенклатура химических соединений)
Записывают тему урока, ставят цели урока:учащиеся делают заключение, что речь пойдет о реакциях, в которые будут вступать металлы, или о химических свойствах металлов
Освоение нового учебного материала
Формирование новых знаний и умений
Все металлы являются восстановителями
Для того чтобы прошла реакция записанная на доске ,необходимо наличие окислителя.
По реэультатам обсуждения составляется список веществ,которые могут вступать в реакции с металлами
1. Неметаллы: кислород,галогены,сера,водород и др.
Учитель предлагает учащимся выполнить лабораторный опыт,используя инструктивную карточку которая находится у вас на столах.
На столах у вас наборы реактивов: цинк в гранулах, медная проволока, железная скрепка, раствор соляной кислоты, магний, раствор сульфата меди (II), раствор хлорида железа (II), спиртовка, спички, пустые пробирки.
Используя эти реактивы проделайте опыты, запишите уравнения химических реакций, составьте схемы электронного баланса.
После выполнения работы учащиеся делают вывод относительно химических свойств металлов.
Учащиеся рассуждают и вспоминают вещества, которые могут служить в качестве окислителей при взаимодействии с
Учащиеся вместе с учителем составляют уравнения химических реакций, уравнивая их с помощью электронного баланса.
Учащиеся выполняют лабораторную работу, используя инструктивную карту .
Проделайте следующие опыты:
· между цинком и соляной кислотой (опустите гранулу цинка в пробирку, прилейте 1 мл соляной кислоты, понаблюдайте за признаками реакции);
· между медью и соляной кислотой (к медной проволоке прилейте 1 мл соляной кислоты, понаблюдайте за признаками реакции);
· между железом и сульфатом меди (II) (в пробирку прилейте 2 мл сульфата меди (II) и опустите в раствор железную скрепку, понаблюдайте за признаками реакции0;
· между медью и хлоридом железа (II) (в пробирку прилейте 2 мл хлорида железа; (II) и опустите медную проволоку, понаблюдайте за признаками реакции;
· между медью и кислородом (нагрейте медь в пламени спиртовки, понаблюдайте за признаками реакции).
· Между магнием и водой
Запишите уравнения возможных реакций, составьте схемы электронного баланса.
Учащиеся проделывают опыты и записывают следующие уравнения реакций:
1. Zn + 2HCl → ZnCL2 + H2 ↑
1 Zn 0 - 2e → Zn +2 - восстановитель, окисление
1 2H + + 2e → H2 - окислитель, восстановление
2. Сu + HCl? реакция не протекает, так как медь стоит в ряду напряжений металлов после водорода, следовательно не вытесняет водород из растворов кислот (по особому реагирует с азотной кислотой).
3. Fe + CuSO4 → FeSO4 + Cu
1 Fe 0 - 2e → Fe +2 - восстановитель, окисление
1 Cu +2 + 2e → Cu 0 - окислитель, восстановление
4. Cu + FeCl2 ? реакция не протекает, так как медь стоит в ряду напряжений металлов правее железа, следовательно, не может вытеснить его из раствора соли.
5. 2Cu + O2 → 2CuO
2 Cu 0 - 2e → Cu +2 - восстановитель, окисление
1 O2 0 + 4e → 2O -2 - окислитель, восстановление.
Сделайте вывод (все ли реакции протекали, если не все, то почему, свойства окислителя или восстановителя проявляют металлы в химических реакциях).
Предполагаемый вывод учащихся: металлы взаимодействуют с неметаллами, с растворами солей и растворами кислот согласно их расположению в ряду напряжений металлов, взаимодействие с водой зависит от активности металлов. Металлы проявляют свойства восстановителей.
На основе ранее изученного определяют тип реакции дают названия веществам ,определяют вид связи.-
Физ. минутка
Снятие усталости и напряжения; внесение
совершенствование общей моторики.
Учащиеся выполняют упражнения, соблюдая правила техники безопасности.
Закрепление учебного материала
Закрепление нового знания и умения при решении типовых задач.
Применение полученных знаний и умений в новой ситуации
В четырех колонках приведены формулы попарно взятых веществ. Сопоставьте вещества и определите, между какими парами веществ возможны химические реакции (слайд 2)
Цинк и кислород
2 натрий и вода
3 цинк и соляная кислота
железо и соляная кислота
серебро и соляная кислота
4 медь и сульфат цинка
цинк и сульфат меди
железо и хлорид меди
Учащиеся самостоятельно записывают уравнения осуществимых реакций.
Дают названия продуктам реакции
При затруднении выполнения задания обращаются к учителю
Рефлексия учебной деятельности
Формирование умения анализировать результаты учебной деятельности.
Рефлексия учителя и учащихся о достижении целей урока (Слайд 3):
- Можете ли вы назвать тему урока?
- Вам было легко или были трудности?
- Какое задание было самым интересным и почему?
- Как вы можете использовать полученные знания на уроке при изучении других предметов и в жизни?
- Как бы вы оценили свою работу?
Отвечают на вопросы. Называют основные позиции нового материала и как они их усвоили.
Анализируют работу на уроке через самооценку.
Анализируют свою деятельность, оценивают степень освоения материала.
Работа с дневниками
Информация о домашнем задании
Определение заданий для самоподготовки
П.11, №5 выполняют письменно все, №2 кто сдает огэ, на «5» придумать сказку о химических свойствах металла.
Урок химии в 9 классе « Химические свойства металлов»
методическая разработка по химии (9 класс) на тему
Урок химии в 9 классе « Химические свойства металлов»
Тема урока : «Химические свойства металлов» Тип урока: изучение нового материала
Цели урока: Образовательные: сформировать понятия об общих химических свойствах металлов; Развивающие: совершенствовать умения записывать уравнения химических реакций; применять знания и практические умения, работая по инструкции, с соблюдением правил техники безопасности; развивать познавательную активность учащихся, вырабатывать умение анализировать, делать выводы; Воспитательные: воспитывать коммуникативные компетенции, умение высказывать собственное мнение.
Средства обучения учебник «Химия – 9», авторы: Г.Е.Рудзитис, Ф.Г.Фельдман. таблицы: «Периодическая система химических элементов Д.И.Менделеева», «Растворимость кислот, оснований и солей в воде», «Электрохимический ряд напряжений металлов» мультимедийный проектор; компьютер; презентация в программе Power Point ; лабораторное оборудование, реактивы; дидактический раздаточный материал.
Формы работы Фронтальная Индивидуальная Парная
Методы Репродуктивный Частично- поисковый Творческий Словесный Наглядный Практический
Структура урока I. Организационный момент( 2 мин.) II. Актуализация ( 7 мин.) Игра «Самый, самый…» (2 мин.) Тестовые задания (5 мин.) III. Изучение нового материала (25 мин.) Первичное осознание (10 мин.) Осознание и осмысление (15 мин.) IV. Применение в новой ситуации ( 7 мин.) V. Подведение итогов урока: рефлексия, домашнее задание (3 мин.)
I. Организационный момент. (2 мин) Цель: вовлечение обучающихся в учебный процесс, подготовка к умственному труду. Учебно-воспитательный момент (побудительная мотивация) - Добрый день, мои друзья! Перед вами снова я. Очень рада видеть всех. Ждет сегодня вас успех. А еще скажу я вам: Улыбнитесь всем гостям. Соберитесь, подтянитесь И тихонечко садитесь. Чтоб другом химии стать, Тайны все её узнать, Все загадки разгадать, Научитесь наблюдать, Будем вместе развивать у себя внимательность, А поможет всё узнать наша любознательность.
II. Актуализация ( 7 мин) Цель: актуализация ранее полученных умений и навыков, необходимых для приобретения новых знаний, создать условия для перехода к изучению нового материала. Игра «Самый, самый…» (Форма работы - фронтальная) Какой металл самый – самый…? 1. Самый легкий металл – … 2. Самый тяжелый металл – … 3. Самый легкоплавкий металл – … 4. Самый тугоплавкий металл – … 5. Самый мягкий металл – … 6. Самый твердый металл – … 7. Самый электропроводный металл - … 8. Самый пластичный металл - …
Тест Тест «Металлы». (Форма работы - индивидуальная) Инструкция: выберите 1 правильный ответ, время выполнения 5 минут. Вариант 1. 1. Выберите группу элементов, в которой находятся только металлы а) Al, As, P; б ) Mg, Ca, Si; в ) K, Ca, Pb. 2. Атом магния имеет электронную конфигурацию а) 1s 2 2s 2 2p 6 3s 2 ; б) 1s 2 2s 2 2p 5 3s 2 ; в) 1s 2 2s 2 2p 6 3s 1 . 3. Укажите общее в строении атомов Mg и Al: а) два электрона на последнем электронном слое; б) три электрона на последнем электронном слое; в) одинаковое число электронных слоев. 4. Для всех металлов характерны: а) металлический блеск, ковкость, пластичность б) легкоплавкость, сверхпроводимость, твердость в) электропроводность, хрупкость, тугоплавкость г)теплопроводность, высокая электропроводимость, твердость Тип связи в простом веществе калия: а) ионная; б) металлическая; в) ковалентная полярная. Ответы: 1 2 3 4 5 В А В А Б Проводится самопроверка. Критерии оценки: все правильно – « 5 », 1 ошибка – « 4 », 2 ошибки « 3 », 3 ошибки и более « 2»
ТЕСТ Тест «Металлы». (Форма работы - индивидуальная) Инструкция: выберите 1 правильный ответ, время выполнения 5 минут. Вариант 2. 1. Выберите группу элементов, в которой находятся только металлы а) H , As, P; б ) Mg, Ca, Pb ; в ) K, Ca, N. 2. Атом натрия имеет электронную конфигурацию а) 1s 2 2s 2 2p 6 3s 2 ; б) 1s 2 2s 2 2p 5 3s 2 ; в) 1s 2 2s 2 2p 6 3s 1 . 3. Укажите общее в строении атомов K и Na : а) один электрон на последнем электронном слое; б) три электрона на последнем электронном слое; в) одинаковое число электронных слоев. 4. К физическим свойствам металлов не относят а) пластичность б) электропроводность в) металлический блеск г) растворимость в воде 4. Тип связи в простом веществе магния: а) ионная; б) металлическая; в) ковалентная полярная. Ответы: 1 2 3 4 5 б в а г б Проводится самопроверка. Критерии оценки: все правильно – « 5 », 1 ошибка – « 4 », 2 ошибки « 3 », 3 ошибки и более « 2»
III. Изучение нового материала (25 мин.) Первичное усвоение материала (10 мин) Цель: подготовка обучающихся к активному, осознанному изучению нового материала, отработать умения формулировать цели урока и составлять план работы. Учебно-воспитательный момент : побудительная мотивация Девиз :«Для описания свойств вещества достаточно знать его электронную структуру». Ребята! Прослушайте внимательно стихотворение и скажите о каких свойствах металлов здесь говорится? Они расходятся, как в море корабли, И целые союзы заключают . Металл бывает очень многолик- Во многие реакции вступает: С кислородом, водой, щелочами. И, конечно же, с кислотой и солями. Не признают металлы водород: При встрече вытесняют из кислот. Металл всегда восстановитель, Так называемый "строитель". - Назовите тему нашего урока.(Химические свойства металлов) -Запишите число и тему урока в тетрадь. Выход на цели урока . (Обучающиеся формулируют тему и цели урока). Обучающимся задаю вопрос :«А зачем необходимо знать химические свойства металлов?» Возможный ответ: Чтобы, зная свойства металлов, уметь применять металлические предметы. Составление плана работы. Фронтальная работа с классом. Ребята, составьте план нашего урока.
План. 1. Электрохимический ряд напряжений металлов. 2. Взаимодействие металлов с неметаллами. 3. Взаимодействие металлов с водой. 4. Взаимодействие металлов с кислотами. 5. Взаимодействие металлов с солями. Первичное усвоение материала
Первичное усвоение материала. Цель: Изучить ряд активности металлов. Вспомним основное химическое свойство металлов на основании строения их атомов.(Отвечают: металлы-восстановители) Отличаются ли металлы по активности? Чтобы ответить на вопрос, изучим ряд активности металлов ( обучающиеся работают с рядом активности металлов форзаца учебника). Сделайте вывод. Вывод : Активность металлов усиливается справа налево
Увеличение восстановительных свойств
Первичное усвоение материала. Предположите химические свойства металлов. С какими веществами могут они взаимодействовать?( Проблемный вопрос) (С неметаллами: кислород, сера, хлор. Со сложными веществами: вода, кислоты, соли ) Обучающиеся заполняют схему «Химические свойства металлов» Металл Простые вещества Сложные вещества Неметаллы Вода Кислоты Растворы солей
Первичное усвоение материала. Цель : изучить взаимодействие металлов с неметаллами: с кислородом, серой, галогенами Взаимодействие с неметаллами: с кислородом ( Обучающиеся формулируют выводы) Вывод: 1. Металлы при взаимодействии с кислородом образуют соответствующие оксиды, активные металлы реагируют с кислородом при обычных условиях, менее активные при нагревании, Pt , Au с кислородом не реагируют. 2. При взаимодействии Ме с серой образуются сульфиды, с галогенами – галогениды. 3. Ме в реакциях с неметаллами проявляют восстановительную способность. Li K Ca Na Mg Al Zn Cr Fe Ni Pb Cu Hg Ag Pt Au При обычных условиях M е 0 + О2 → оксид Ме + n Медленно или при нагревании M е 0 + O 2 → оксид Ме + n M е 0 – ne → Ме + n M е + O 2 ≠
Взаимодействие со сложными веществами: с водой Li K Ca Na Mg Al Zn Cr Fe Ni Pb (H 2 ) Cu Hg Ag Pt Au При обычных условиях M е 0 +H 2 O → H 2 + гидроксид Ме + n При нагревании M е 0 +H 2 O →H 2 + оксид Ме + n M е 0 - ne → Ме + n M е + H 2 O ≠ Первичное усвоение материала. Цель : изучить взаимодействие металлов с водой ( Обучающиеся формулируют выводы) Вывод: 1. Щелочные металлы и щелочноземельные Ca и Ba c водой образуют гидроксиды соответствующих металлов и водород! Ме Mg - Pb с водой реагируют при нагревании с образованием оксидов металлов и водорода. Cu , Ag , Au с водой не реагируют. 4. Ме в реакциях с водой проявляют восстановительную способность.
Взаимодействие с растворами кислот Li K Ca Na Mg Al |Zn Cr Fe Ni Pb ( H 2 ) Cu Hg Ag Pt Au Вытесняют H 2 ↑ из растворов кислот Не вытесняют H 2 ↑ из растворов кислот Первичное усвоение материала. Цель : изучить взаимодействие металлов с растворами кислот ( Обучающиеся формулируют выводы) Вывод : 1 . Металлы (до Н в ряду активности) реагируют с кислотами с выделением газа водорода. 2. H 2 SO 4 (конц.) и HNO 3 (любой концентрации) реагируют с металлами по-особому, при этом Н 2 не образуется
Взаимодействие с растворами солей Ряд напряжений дает возможность определить, как металлы будут вытеснять друг друга из растворов солей. Fe 0 + CuSO 4 Fe +2 SO 4 + Cu Fe 0 - 2е Fe +2 Вывод : 1. Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее. 2. Ме в реакциях с солями проявляют восстановительную способность. Первичное усвоение материала. Цель : изучить взаимодействие металлов с растворами солей.
Первичное усвоение материала. Цель : обобщить полученные знания, сделать вывод. ( Обучающиеся формулируют выводы) Вывод : 1. Металлы взаимодействуют с неметаллами, с водой, с кислотами, с солями. 2. Металлы обладают различной восстановительной способностью.
Осознание и осмысление учебного материала (Лабораторная работа - парная) Цель: развивать умения составлять уравнения химических реакций, наблюдать, приобретать знания самостоятельно, практическим путем, повторить правила техники безопасности, проверить первичное усвоение материала; уметь работать с лабораторным оборудованием, реактивами, делать выводы Я предлагаю провести исследование по изучению химических свойств металлов. Для этого проведем лабораторные опыты, а результаты запишете в таблицу.
Осознание и осмысление учебного материала Демонстрационный опыт : взаимодействие металлов с водой Цель : доказать, что при взаимодействии Ме разной активности с водой образуются различные соединения. Кружит металл, как шаловливый пес, Как будто за хвостом своим гоняясь, Потерю электронов перенес, С гидроксогруппой в щелочь превращаясь: 2Na + 2HOH = 2NaOH + H2 Обнаружить щелочь помогает индикатор- фенолфталеин: рН >7 (щелочная среда). Теперь не столь активный цинк возьмем И сильно мы нагреем смесь, То пузырьками на себя укажет Газ водород и о реакции нам скажет: Zn + H 2 O = ZnO + H 2 А действует ли на металл вода, Коль он стоит в ряду за водородом? Не реагирует с водой он никогда, Увы! Уж такова его природа. Cu + H 2 O = Вывод: 1. Щелочные металлы и щелочноземельные Ca и Ba c водой образуют гидроксиды соответствующих металлов и водород! 2 . Mg - Pb с водой реагируют при нагревании с образованием оксидов металлов и водорода. 3. Cu , Ag , Au с водой не реагируют. Наблюдения, уравнения реакций и выводы обучающиеся записывают в таблицу рабочего листа.
Осознание и осмысление учебного материала Демонстрационный опыт : взаимодействие металлов с солями. (Опыт заготовлен заранее, т.к. на него нужно время) Зачитываю стихотворение: С чего «турнир» начать нам? Друг другу электроны Бросают, как перчатки, Металлы церемонно… Выводы :1 . Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее. 2. Ме в реакциях с водой проявляют восстановительную способность. Наблюдения, уравнения реакций и выводы обучающиеся записывают в таблицу рабочего листа.
Осознание и осмысление учебного материала Лабораторный опыт : взаимодействие меди с кислородом (форма работы - парная) Цель : доказать, что при взаимодействии Ме с кислородом образуется соответствующий оксид - инструктаж по ТБ; - выполнить опыт: медную проволоку прокалить в пламени спиртовки, обратить внимание на произошедшие изменения, объяснить их, записать соответствующие уравнения реакций, наблюдения и выводы в таблицу рабочего листа. 2Cu + O 2 = 2 CuO Вывод : медная проволока почернела, образовался оксид меди (II) черного цвета.
Осознание и осмысление учебного материала Лабораторный опыт : взаимодействие металлов с кислотами (форма работы - парная) Цель : доказать, что при взаимодействии Ме с кислотами выделяется водород. Химический вопрос: Как ты думаешь, что произошло в реакции из этого стихотворения? В кислоту я брошу цинк. Звякнет он с обидой: "Дзыньк!", Вытеснять начнет тотчас Из раствора лёгкий газ. Рвётся газ из кислоты. Что за газ? Ответишь ты ! Вывод: 1 . Металлы (до Н в ряду активности) реагируют с кислотами с выделением газа водорода. 2. H 2 SO 4 (конц.) и HNO 3 (любой концентрации) реагируют с металлами по-особому, при этом Н 2 не образуется Наблюдения, уравнения реакций и выводы обучающиеся записывают в таблицу рабочего листа.
Осознание и осмысление учебного материала (Лабораторная работа - парная) опыт Уравнение реакции наблюдения вывод Взаимодействие Ме с кислородом 2Cu + O 2 = 2CuO Медная проволока при нагревании почернела Ме взаимодействуют с кислородом с образованием оксидов Взаимодействие Ме с водой 2 Na+ 2 H 2 O = 2 NaOH+H 2 Zn + H 2 O =ZnO + H 2 Cu + H 2 O = не идет Фенолфталеин окрасил раствор в малиновый цвет, выделился газ водород. При нагревании на поверхности Zn появились пузырьки газа-водорода. Cu с водой не реагирует Активные металлы c водой реагируют при обычной t с образованием щелочи и выделяется газ водород. Менее активные Ме с водой реагируют при нагревании с образованием оксида Ме и водорода. Пассивные Ме с водой не реагируют. Взаимодействие Ме с растворами кислот Zn + 2 HCl =ZnCl 2 + H 2 Выделился газ водород. При взаимодействии металлов ( до Н) выделяется газ водород. Взаимодействие Ме с солями Fe +CuSO 4 =FeSO 4 + Cu Образовался налет красного цвета-это медь Металлы реагируют с растворами солей
Обучающиеся проговаривают выводы по каждому пункту лабораторной работы и формулируют общий вывод : данные факты позволяют сделать вывод, что металлы обладают различной восстановительной способностью. Выводы : 1. Металлы реагируют с неметаллами. Наиболее энергично с кислородом, хлором, серой. 2. -Щелочные металлы и щелочноземельные Ca и Ba c водой образуют гидроксиды соответствующих металлов и водород! - Mg , Al , Mn , Zn , Cr , Fe , Ni , Pb с водой реагируют при нагревании с образованием оксидов металлов и водорода. - Cu , Ag , Au с водой не реагируют. 3. Металлы реагируют с кислотами с выделением газа водорода (металлы до Н в ряду активности). 4. Металлы реагируют с растворами солей.
Какие реакции практически осуществимы? Реагирующие вещества K Fe Cu О 2 Н 2 О HCl ( раствор) Pb(NO 3 ) 2 раствор Цель : выявить уровень усвоения учебного материала и его применение на практике. На заключительном этапе урока я предлагаю вам для проверки усвоения материала сегодняшнего урока выполнить работу в парах, обсуждая результаты и помогая друг другу. На выполнение этого задания – 3 минуты. IV. Применение знаний в новой ситуации ( 5 мин)
Какие реакции практически осуществимы? Реагирующие вещества Na Fe Cu О 2 + + + Н 2 О + + - HCl ( раствор) + + - Pb(NO 3 ) 2 раствор + + - Обучающиеся осуществляют самопроверку Поднимите руки : 1. У кого все выполнено правильно. 2. Допущено 2-3 ошибки. 3. Более 3-х ошибок.
Zn + H 2 SO 4 2Li + 2H 2 O 4Li + O 2 PbS Pb + S → 2Li 2 O ZnCI 2 + Cu CuCI 2 + Zn ZnSO 4 + H 2 2LiOH + H 2 Игра – соревнование «Снежинки» Правила игры : двое обучающихся по желанию выходят к учительскому столу, подбирают соответствующие «снежинки» левой и правой частей уравнения и на магниты прикрепляют на доску. Кто больше составит уравнения реакций? ( 2 мин.) Цель : зная химические свойства металлов, правильно подобрать левую и правую части уравнения.
Рефлексия ( 3 мин.) Для чего необходимо знать химические свойства металлов? (На этом этапе урока обучающиеся в рабочем листе фиксируют достигнутый результат и оценивают свою работу) На уроке я работал активно/пассивно Своей работой на уроке я доволен/недоволен Урок для меня показался коротким/длинным За урок не устал/ устал Мое настроение стало лучше/хуже Материал урока мне был понятен/не понятен Домашнее задание мне кажется легким/трудным
§ 37, упр. 1, 5 стр. 113 в Рабочей тетради По выбору: Задача 1 – 2 в учебнике на стр. 112 Творческое индивидуальное задание: «Роль и место металлов в природе, жизни, быту.» Найдите дополнительную интересную и полезную информацию по теме (пословицы, поговорки, загадки, стихи, патологическое действие металлов на организм человека, биологические свойства металлов…) «Мы рождены пролить все то, что льется, рассыпать то, чего нельзя пролить. Наш кабинет химическим зовется, идем домой мы химию учить».
Результат урока Урок цели достиг. Тип, структура, формы и методы работы соответствовали поставленным целям.
Открытый урок химии 9 класс на тему: "Общие химические свойства металлов"

Цель урока: систематизировать сведения о химических свойствах металлов, рассмотренных при изучении материала курса химии 8,9 классов, выявить особенности протекания реакций металлов со сложными веществами, подчеркнуть химическую функцию металлов как восстановителей.
Оборудование и реактивы:
на столах учащихся: раствор соляной кислоты (НCl), CuSO4 (раствор), металлы: цинк, медь, железо ( железные гвозди на ниточках), пробирки, штатив для пробирок, емкость для слива, спиртовка, щипцы, спички.
На столе учителя: предметный столик, спички, спиртовка, вата, шпатель, асбестовая прокладка, порошок магния, натрий, эксикатор с водой, фенол-фталеин.
Оснащение урока.
Компьютер, мультимедиапроектор, экран, таблицы « Растворимость кислот, солей и оснований в воде», « Периодическая система химических элементов Д.И.Менделеева», «Электрохимический ряд напряжений металлов», рабочие листы учащихся.
I. Орг. момент (готовность учащихся к уроку) (1 мин.)
II. Проверка опорных знаний (10 мин.).
Контроль ЗУН
а) Решение задач по карточке.
б) Блиц опрос – небольшой мозговой штурм. (3 мин.)
На какие группы мы разделили элементы Периодической системы?
Ответ: Металлы и неметаллы.
Определите расположение металлов в ПСХЭ
Ответ: Нижний угол относительно диагонали Вор-Астат, и все элементы побочных подгрупп.
Какая кристаллическая решетка свойственна для металлов?
Ответ: Металлическая кристаллическая решетка
Чем она отличается от всех других?
Ответ: в узлах металлической кристаллической решетки располагаются атомы и положительные ионы металлов, между которыми находится свободные электроны.
Какие общие физические свойства металлов объясняются наличием металлическая кристаллической решети.
Ответ: электропроводность, теплопроводность, металл блеск, пластичность, легкость тугоплавкость, легкоплавкость, твердость, мягкие
Как называется способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия? (пластичность);
Какой металл самый легкий?
Ответ: литий (Li)
Назовите самый тяжелый металл?
Ответ: Осмий (Os)
Лучшие проводники электричества среди металлов?
Ответ: серебро и медь;
Назовите самый тугоплавкий металл?
Ответ: Вольфрам (W)
Какой металл самый легкоплавкий?
Ответ: Ртуть (Hg)
Назовите самый пластичный металл?
Ответ: Золото (Au)
Какие металлы легко режутся ножом?
Ответ: щелочные металлы.
Название известного сплава на основе алюминия (дюралюминий);
Важнейшие сплавы на основе железа? (чугун и сталь);
Какой неметалл входит в состав сплавов железа (углерод);
Укажите не менее трех металлов, которые могут выступать в качестве легирующих добавок? (хром, никель, молибден)
В детстве мы читали о нем в сказке Андерсена. Его звон слышали заблудившиеся путники и находили дорогу. Он может болеть «чумой» Какой это металл? (2.8.18.18.4)
При раскопках этрусских гробниц (1000 лет до н.э) были обнаружены зубные протезы. Вопрос: из какого металла они были сделаны? Ответ: золото.
Тестовые задания по теме «Химические свойства металлов»
Задание: выберите один правильный ответ.
1.При взаимодействии кальция с водой образуются:
а) оксид кальция и водород;
б) гидроксид кальция и водород;
в) гидроксид кальция
2. Ртуть из раствора нитрата ртути (II) можно получить с помощью:
а) серебра; б) натрия; в) меди
3. Какой металл взаимодействует с водой с образованием оксида:
а) барий; б) хром; в) медь
4. С раствором серной кислоты с образованием соли и водорода реагирует:
а) ртуть; б) алюминий; в) золото
5. При взаимодействии с кислородом образует пероксид:
а) медь б) железо в) натрий
1.При взаимодействии цинка с водой образуются:
а) оксид цинка и водород;
б) гидроксид цинка и водород;
в) гидроксид цинка
2. Медь из раствора нитрата меди (II) можно получить с помощью:
а) серебра; б) натрия; в) железа
3. Какой металл взаимодействует с водой с образованием щелочи:
а) ртуть; б) свинец; в) золото
5. При обычных условиях с азотом взаимодействует:
а) литий б) железо в) хром
Проверка теста.
Самопроверка :
III. Изучение нового материала. ( 27 мин.- 30 мин.)
Постановка цели урока. Актуальность изучения данной темы.
Актуализация знаний (1-2 мин.)
Учитель: «Роберт Вуд, знаменитый американский физик и великий любитель всяческих проделок, направлялся из лаборатории домой на обед. Дорога шла через негритянский квартал. Была зимняя оттепель, и огромная лужа распростерлась по мостовой между тротуарами, на которых толпились негры, вышедшие погреться на солнышке. Проходя мимо них, Вуд громко закашлял и на виду у всех плюнул в лужу, незаметно бросив в том же направлении кусок натрия величиной с грецкий орех. Прогремел взрыв, полетели искры, и большое желтое пламя поднялось над поверхностью воды. Затем раздались вопли, молитвы и один голос громче, чем все остальные вместе взятые, пробасил: «спасайся, кто может, негры! Этот человек плюнул огнем! На вид он молодой, но только сам старый дьявол, сам старый сатана умеет это делать!» О каких свойствах натрия идет речь в этом отрывке?
Ученик: О химических
Учитель: Следовательно, тема нашего урока «Характерные химические свойства металлов»
Организация познавательной деятельности (20-25 мин.)
Учитель: Мир вокруг нас – это совокупность физических и химических превращений веществ. Как ведут себя металлы в этом мире, с какими веществами они взаимодействуют и каким должно быть их практическое применение.
От чего зависят химические свойства металлов? ( Химические свойства металлов зависят от их активности)
Как делятся металлы по активности? Приведите примеры (По активности металлы делятся на активные (натрий, кальций) и неактивные (медь, ртуть))
Где и как можно узнать о активности металла? (В электрохимическом ряду активности металлов. Если металл стоит в ряду активности до водорода, то это активный металл. Если после водорода, то это неактивный металл
Li K Ca Na Mg Al | Zn Cr Fe Ni Pb (H2) Cu Hg Ag Pt Au
Активные малоактивные неактивные
Химические свойства металлов делятся на две группы – с простыми веществами и сложными
Чем обусловлены химические свойства металлов?
(2) 1 Большим радиусом
2 Небольшим числом электронов на внешнем уровне
Чем, с точки зрения окислительно-восстановительных процессов, являются металлы в реакциях?
(3) Ответ: Металлы являются только восстановителями, т.к их атомы легко отдают электроны, превращаясь при этом в положительно заряженные ионы – катионы.
М 0 – nе - →М n + . Чем обусловлены
Для того, чтобы прошла данная реакция необходимо наличие окислителя.
Вопрос к классу: Вспомните вещества, которые могут выступать в качестве окислителя при взаимодействии с металлами.
Составить список этих веществ: Кислород, галогены, сера, водород и др., вода, кислоты
(2) Как называются продукты взаимодействия металлов с кислородом, галогенами, серой, азотом ? (учащиеся дают ответы, сверяют их с записью на слайдах).
Эпиграф — высказывание М.В. Ломоносова: “Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции”. А сейчас на некоторое время вы станете химиками-аналитиками!
Правила техники безопасности.
Лабораторный опыт №1.
Прокаливание медной пластинки в пламени спиртовки.
(признак реакции при прокаливании медной проволоки – изменение цвета, наблюдаем почернение – образование оксида меди (II), уравнение реакции 2Cu + O2 = 2CuO)
Наблюдения, уравнения реакций записывают в рабочем листе.
Следующие два опыта мы посмотрим на видеофрагменте:
Демонстрационный опыт 1 (видеоклип): горение магния в кислороде.
Вопрос: Как вы можете объяснить этот опыт? Где подобный процесс мог применяться?
( В прошлом веке использовался фотографами для улучшения освещения)
Ученик у доски: Составляет уравнение реакции горения магния в кислороде, определяет окислитель и восстановитель.
Демонстрационный опыт 2 (видеоклип): Взаимодействие сурьмы с хлором.
Ученик у доски: Составляет уравнение реакции взаимодействия сурьмы с хлором, определяет окислитель и восстановитель.
Закрепление. Допишите уравнения реакций взаимодействия металлов с другими неметаллами.
Физкультпауза Выполняются упражнения для глаз
2) Взаимодействие металлов с водой.
Как металлы реагируют с водой?
Активные металлы(Li – Na) + вода → гидроксид металла(щелочь) + Н2↑
Металлы средней активности(Mg – Pb) + вода → оксид металла + Н2↑
Неактивные металлы (Bi – Au) + вода → не реагируют
Посмотрите маленький фрагмент.
«Как вы думаете ?»… имеет ли смысл фраза, которую мы слышали в сказке: «К морю синему пошли и море синее зажгли?».
Демонстрационный опыт 2 (видеоклип): Взаимодействие калия с водой.
Лабораторный опыт №2: взаимодействие натрия с водой:
Ученик у доски: Составляет уравнения реакции взаимодействия натрия с водой. Фиксирует признаки химической реакции, определяет окислитель и восстановитель. Уравнение реакции:
Почему металлы первой группы (А) называют щелочными? (образуется щелочь). Докажите! (капают в раствор фенолфталеин. Раствор окрасился в малиновый цвет, значит среда – щелочная,)
Закрепление. Допишите уравнения возможных реакций взаимодействия металлов водой.
Проблема: почему алюминий при обычных условиях не реагирует с водой? (алюминий прокрыт оксидной пленкой, которая его и защищает)
Это свойство имеет практическое значение, т.к. для изготовления посуды не берут калий, натрий, а именно алюминий, цинк, железо.
3) Взаимодействие металлов с кислотами.
Лабораторный опыт №3. Взаимодействие цинка, железа, меди с соляной кислотой. ТБ
1 вариант - Zn + HCl
2 вариант - Cu + HCl
3 вариант – Fe + HCl
Учитель: контролирует правила ТБ при выполнении опытов, навыки и умения экспериментальной работы.
Запись в тетрадях уравнений реакций,
Cu + HCl → не идёт
Это свойство используется для получения водорода в лаборатории.
Объясните результаты опыта.
Вывод. Металлы , стоящие в ряду активности до водорода вытесняют его из растворов кислот, а после водорода - не вытесняют. .
Но для этой реакции есть несколько поправок.
Если образуется растворимая соль;
Кроме щелочных и щелочно-земельных металлов;
Азотной кислота и . концентрированная серная кислота реагируют особенно, при этом никогда не выделяется водород.
Взаимодействие металлов с солями.
Лабораторный опыт № 4. Взаимодействие железа с сульфатом меди и меди с хлоридом железа (III).
Запись в тетрадях уравнений реакций, наблюдения
FeCl2 + Cu → не идет
Для этой реакции тоже есть поправки, которые совпадают с первой и второй поправкой для кислот
Вывод. Более активные металлы вытесняют менее активные из растворов их солей.
Закрепление. Допишите уравнения возможных реакций.
Задания на определение катионов металлов
Для распознавания веществ используют качественные реакции на катионы и анионы. Мы сейчас говорим о металлах, значит на какие ионы нам нужно обратить внимание? (на катионы)
Лабораторный опыт № 5 :
I. Задание: Определить катионы металлов в трех пробирках при поморщи одного реагента.
Какой ход ваших мыслей для выполнения данного задания?
(Так как нужно определить катионы металлов, мы должны найти что то общее в свойствах катиона Mg 2+ , Аl 3+ и Cu 2+ . Это можно посмотреть в таблице растворимости. Все эти катионы образуют нерастворимые или малорастворимые основания. Значит, возможно, образование осадка. Следовательно, общим реагентом для них будет щелочь. Следовательно, для проведения исследования, используем имеющийся у нас на столах гидроксид натрия)
2AlCl3 +3NaOH= 2Al(OH)3 +3NaCl2
2Al 3+ +3OH - = 2Al(OH)3 ↓ (белый осадок)
Al(OH)3 + NaOH = Na [Al (OH)4] (осадок растворяется)
Al(OH)3 + OH - = Na + + [Al (OH)4] -
(образование голубого осадка говорит о наличии в растворе катионов меди, значит в пробирке № 3 хлорид меди; в двух других пробирках образовался белый осадок. Для распознавания добавим в эти пробирки еще щелочь. В пробирке №2 осадок растворился, значит в этой пробирке хлорид алюминия – он амфотерный и растворяется в избытке щелочи. А тогда в пробирке № 1 хлорид магния.
IV. Закрепление нового материала.
Предлагается ребятам выполнить интерактивное упражнение:
С какими из веществ будут реагировать предложенные металлы при нормальных условиях? Выбрать правильные ответы.
Ответить на вопросы.
С какими веществами реагируют металлы?
Чем являются металлы в реакциях – окислителями или восстановителями?
Какие поправки вводятся для реакций металлов с водой, кислотами, солями?
Для чего нужно изучать химические свойства металлов? Где их можно использовать?
Где применить полученные знания?
Ответ: Металлы широко используются человеком в технике, медицине, различных отраслях промышленности, но при использовании надо учитывать их свойства: взаимодействие с кислородом, водой, различными солями.
V.Итоги урока. «Самооценка». Учащиеся оценивают свою работу на уроке по результатам теста и своим ответам. Учитель корректирует оценки и выставляет их в журнал.
Читайте также:
