Имеет ли сера металлический блеск
Обновлено: 01.05.2024
Халькогены — группа элементов, к которой относится сера. Ее химический знак — S — первая буква латинского названия Sulfur. Состав простого вещества записывают с помощью этого символа без индекса. Рассмотрим основные моменты, касающиеся строения, свойств, получения и применения данного элемента. Характеристика серы будет представлена максимально подробно.
Общие признаки и различия халькогенов
Сера относится к подгруппе кислорода. Это 16-я группа в современной длиннопериодной форме изображения периодической системы (ПС). Устаревший вариант номера и индекса — VIA. Названия химических элементов группы, химические знаки:
- кислород (О);
- сера ( S);
- селен (Se);
- теллур (Te);
- полоний (Po).
Внешняя электронная оболочка вышеперечисленных элементов устроена одинаково. Всего она содержит 6 валентных электронов, которые могут участвовать в образовании химической связи с другими атомами. Водородные соединения отвечают составу H2R, например, H2S — сероводород. Названия химических элементов, образующих с кислородом соединения двух типов: сера, селен и теллур. Общие формулы оксидов этих элементов — RO2, RO3.
Халькогенам соответствуют простые вещества, которые значительно отличаются по физическим своствам. Наиболее распространенные в земной коре из всех халькогенов — кислород и сера. Первый элемент образует два газа, второй — твердые вещества. Полоний — радиоактивный элемент — редко встречается в земной коре. В группе от кислорода до полония неметаллические свойства убывают и возрастают металлические. Например, сера — типичный неметалл, а теллур обладает металлическим блеском и электропроводностью.

Элемент № 16 периодической системы Д.И. Менделеева
Относительная атомная масса серы — 32,064. Из природных изотопов наиболее распространен 32 S (более 95% по массе). Встречаются в меньших количествах нуклиды с атомной массой 33, 34 и 36. Характеристика серы по положению в ПС и строению атома:

- порядковый номер — 16;
- заряд ядра атома равен +16;
- радиус атома — 0,104 нм;
- энергия ионизации —10,36 эВ;
- относительная электроотрицательность — 2,6;
- степень окисления в соединениях — +6, +4, +2, -2;
- валентности — II(-),II(+), IV(+), VI (+).
Сера находится в третьем периоде; электроны в атоме располагаются на трех энергетических уровнях: на первом — 2, на втором — 8, на третьем — 6. Валентными являются все внешние электроны. При взаимодействии с более электроотрицательными элементами сера отдает 4 или 6 электронов, приобретая типичные степени окисления +6, +4. В реакциях с водородом и металлами атом притягивает недостающие 2 электрона до заполнения октета и достижения устойчивого состояния. Степень окисления в этом случае понижается до -2.
Физические свойства ромбической и моноклинной аллотропных форм

При обычных условиях атомы серы соединяются между собой под углом в устойчивые цепи. Они могут быть замкнуты в кольца, что позволяет говорить о существовании циклических молекул серы. Состав их отражают формулы S6 и S8.
Характеристика серы должна быть дополнена описанием различий между аллотропными модификациями, обладающими разными физическими свойствами.
Ромбическая, или α-сера — наиболее стабильная кристаллическая форма. Это ярко-желтые кристаллы, состоящие из молекул S8. Плотность ромбической серы составляет 2,07 г/см3. Светло-желтые кристаллы моноклинной формы образованы β-серой с плотностью 1,96 г/см3. Температура кипения достигает 444,5°С.
Получение аморфной серы
Какого цвета сера в пластическом состоянии? Это темно-коричневая масса, совершенно не похожая на желтый порошок или кристаллы. Для ее получения нужно расплавить ромбическую или моноклинную серу. При температуре выше 110°С образуется жидкость, при дальнейшем нагревании она темнеет, при 200°С становится густой и вязкой. Если быстро вылить расплавленную серу в холодную воду, то она застынет с образованием зигзагообразных цепей, состав которых отражает формула Sn.

Растворимость серы
Некоторые модификации вещества растворяются в сероуглероде, бензоле, толуоле и жидком аммиаке. Если медленно охладить органические растворы, то образуются игольчатые кристаллы моноклинной серы. При испарении жидкостей выделяются прозрачные лимонно-желтые кристаллы ромбической серы. Они хрупкие, их легко можно смолоть в порошок. Сера не растворяется в воде. Кристаллы опускаются на дно сосуда, а порошок может плавать на поверхности (не смачивается).

Химические свойства
В реакциях проявляются типичные неметаллические свойства элемента № 16:
- сера окисляет металлы и водород, восстанавливается до иона S 2- ;
- при сгорании на воздухе и кислороде образуются ди- и триоксид серы, которые являются ангидридами кислот;
- в реакции с другим более электроотрицательным элементом — фтором — сера тоже теряет свои электроны (окисляется).
Свободная сера в природе
По распространенности в земной коре сера находится на 15 месте среди химических элементов. Среднее содержание атомов S в горных породах и минералах составляет 0,05% от массы земной коры.
Какого цвета сера в природе (самородная)? Это светло-желтый порошок с характерным запахом или желтые кристаллы, обладающие стеклянным блеском. Залежи в виде россыпи, кристаллические пласты серы встречаются в районах древнего и современного вулканизма: в Италии, Польше, Средней Азии, Японии, Мексике, США. Нередко при добыче находят красивые друзы и гигантские одиночные кристаллы.
Сероводород и оксиды в природе
В районах вулканизма на поверхность выходят газообразные соединения серы. Черное море на глубине свыше 200 м является безжизненным из-за выделения сероводорода H2S. Формула оксида серы двухвалентной — SO2, трехвалентной — SO3. Перечисленные газообразные соединения присутствуют в составе некоторых месторождений нефти, газа, природных вод. Сера входит в состав каменного угля. Она необходима для построения многих органических соединений. При гниении белков куриного яйца выделяется сероводород, поэтому часто говорят, что у этого газа запах тухлых яиц. Сера относится к биогенным элементам, она необходима для роста и развития человека, животных и растений.

Значение природных сульфидов и сульфатов
Характеристика серы будет неполной, если не сказать, что элемент встречается не только в виде простого вещества и оксидов. Наиболее распространенные природные соединения — это соли сероводородной и серной кислот. Сульфиды меди, железа, цинка, ртути, свинца встречаются в составе минералов халькопирита, пирита, сфалерита, киновари и галенита. Из сульфатов можно назвать натриевую, кальциевую, бариевую и магниевую соли, которые образуют в природе минералы и горные породы (мирабилит, гипс, селенит, барит, кизерит, эпсомит). Все эти соединения находят применение в разных отраслях хозяйства, используются как сырье для промышленной переработки, удобрения, стройматериалы. Велико медицинское значение некоторых кристаллогидратов.
Получение
Вещество желтого цвета в свободном состоянии встречается в природе на разной глубине. При необходимости серу выплавляют из горных пород, не поднимая их на поверхность, а нагнетая на глубину перегретый водяной пар и сжатый воздух. Еще один метод связан с возгонкой из раздробленных горных пород в специальных печах. Другие способы предусматривают растворение сероуглеродом или флотацию.
Потребности промышленности в сере велики, поэтому для получения элементарного вещества используются его соединения. В сероводороде и сульфидах сера находится в восстановленной форме. Степень окисления элемента равна -2. Проводят окисление серы, повышая это значение до 0. Например, по методу Леблана сульфат натрия восстанавливают углем до сульфида. Затем из него получают сульфид кальция, обрабатывают его углекислым газом и парами воды. Образующийся сероводород окисляют кислородом воздуха в присутствии катализатора: 2H2S + O2 = 2H2O +2S. Определение серы, полученной разными способами, порой дает низкие показатели чистоты. Рафинирование или очистку проводят дистилляцией, ректификацией, обработкой смесями кислот.

Применение серы в современной промышленности
Сера гранулированная идет на различные производственные нужды:
- Получение серной кислоты в химической промышленности.
- Производство сульфитов и сульфатов.
- Выпуск препаратов для подкормок растений, борьбы с болезнями и вредителями сельскохозяйственных культур.
- Серосодержащие руды на горно-химических комбинатах перерабатывают для получения цветных металлов. Сопутствующим производством является сернокислотное.
- Введение в состав некоторых сортов сталей для придания особых свойств.
- Благодаря вулканизации каучука получают резину.
- Производство спичек, пиротехники, взрывчатых веществ.
- Использование для приготовления красок, пигментов, искусственных волокон.
- Отбеливание тканей.

Токсичность серы и ее соединений
Пылевидные частицы, обладающие неприятным запахом, раздражают слизистые оболочки носовой полости и дыхательных путей, глаза, кожу. Но токсичность элементарной серы считается не особенно высокой. Вдыхание сероводорода и диоксида может вызвать тяжелое отравление.
Если при обжиге серосодержащих руд на металлургических комбинатах отходящие газы не улавливают, то они поступают в атмосферу. Соединяясь с каплями и парами воды, оксиды серы и азота дают начало так называемым кислотным дождям.
Сера и ее соединения в сельском хозяйстве
Растения поглощают сульфат-ионы вместе с почвенным раствором. Снижение содержания серы ведет к замедлению метаболизма аминокислот и белков в зеленых клетках. Поэтому сульфаты применяют для подкормок сельскохозяйственных культур.

Для дезинфекции птичников, подвалов, овощехранилищ простое вещество сжигают или обрабатывают помещения современными серосодержащими препаратами. Оксид серы обладает антимикробными свойствами, что издавна находит применение в производстве вин, при хранении овощей и фруктов. Препараты серы используют в качестве пестицидов для борьбы с болезнями и вредителями сельскохозяйственных культур (мучнистой росой и паутинным клещом).
Применение в медицине

Большое значение изучению лечебных свойств желтого порошка придавали великие врачеватели древности Авиценна и Парацельс. Позже было установлено, что человек, не получающий достаточное количество серы с пищей, слабеет, испытывает проблемы со здоровьем (к ним относятся зуд и шелушение кожи, ослабление волос и ногтей). Дело в том, что без серы нарушается синтез аминокислот, кератина, биохимических процессов в организме.
Медицинская сера включена в состав мазей для лечения заболеваний кожи: акне, экземы, псориаза, аллергии, себореи. Ванны с серой могут облегчить боли при ревматизме и подагре. Для лучшего усвоения организмом созданы водорастворимые серосодержащие препараты. Это не желтый порошок, а мелкокристаллическое вещество белого цвета. При наружном использовании этого соединения его вводят в состав косметического средства для ухода за кожей.
Гипс давно применяется при иммобилизации травмированных частей тела человека. Глауберову соль назначают как слабительное лекарство. Магнезия понижает артериальное давление, что используется в лечении гипертонии.
Сера в истории
Еще в глубокой древности неметаллическое вещество желтого цвета привлекало внимание человека. Но только в 1789 году великий химик Лавуазье установил, что порошок и кристаллы, найденные в природе, состоят из атомов серы. Считалось, что неприятный запах, возникающий при ее сжигании, отпугивает всякую нечисть. Формула оксида серы, который получается при горении, — SO2 (диоксид). Это токсичный газ, его вдыхание опасно для здоровья. Несколько случаев массового вымирания людей целыми деревнями на побережьях, в низинах ученые объясняют выделением из земли либо воды сероводорода или диоксида серы.
Изобретение черного пороха усилило интерес к желтым кристаллам со стороны военных. Многие битвы были выиграны благодаря умению мастеров соединять серу с другими веществами в процессе изготовления взрывчатых веществ. Важнейшее соединение — серную кислоту — тоже научились применять очень давно. В средние века это вещество называли купоросным маслом, а соли — купоросами. Медный купорос CuSO4 и железный купорос FeSO4 до сих пор не утратили своего значения в промышленности и сельском хозяйстве.
Химические свойства серы. Характеристика и температура кипения серы
Сера представляет собой химический элемент, который находится в шестой группе и третьем периоде таблицы Менделеева. В этой статье мы подробно рассмотрим ее химические и физические свойства, получение, использование и так далее. В физическую характеристику входят такие признаки, как цвет, уровень электропроводности, температура кипения серы и т. д. Химическая же описывает ее взаимодействие с другими веществами.
Сера с точки зрения физики
Это хрупкое вещество. При нормальных условиях оно пребывает в твердом агрегатном состоянии. Сера обладает лимонно-желтой окраской.

И в большинстве своем все ее соединения имеют желтые оттенки. В воде не растворяется. Обладает низкой тепло- и электропроводностью. Данные признаки характеризуют ее как типичный неметалл. Несмотря на то что химический состав серы совсем не сложен, данное вещество может иметь несколько вариаций. Все зависит от строения кристаллической решетки, с помощью которой соединяются атомы, молекул же они не образовывают.
Итак, первый вариант - ромбическая сера. Она является наиболее устойчивой. Температура кипения серы такого типа составляет четыреста сорок пять градусов по шкале Цельсия. Но для того чтобы данное вещество перешло в газообразное агрегатное состояние, ему сначала необходимо пройти жидкое. Итак, плавление серы происходит при температуре, которая составляет сто тринадцать градусов Цельсия.
Второй вариант - моноклинная сера. Она представляет собой кристаллы игольчатой формы с темно-желтой окраской. Плавление серы первого типа, а затем ее медленное охлаждение приводит к формированию данного вида. Эта разновидность обладает почти теми же физическими характеристиками. К примеру, температура кипения серы такого типа - все те же четыреста сорок пять градусов. Кроме того, есть такая разновидность данного вещества, как пластическая. Ее получают посредством выливания в холодную воду нагретой почти до кипения ромбической. Температура кипения серы данного вида такая же. Но вещество обладает свойством тянуться, как резина.
Еще одна составляющая физической характеристики, о которой хотелось бы сказать, - температура воспламенения серы.

Данный показатель может разниться в зависимости от типа материала и его происхождения. К примеру, температура воспламенения серы технической составляет сто девяносто градусов. Это довольно низкий показатель. В других случаях температура вспышки серы может составлять двести сорок восемь градусов и даже двести пятьдесят шесть. Все зависит от того, из какого материала была она добыта, какую имеет плотность. Но можно сделать вывод, что температура горения серы достаточно низкая, по сравнению с другими химическими элементами, это легковоспламеняющееся вещество. Кроме того, иногда сера может объединяться в молекулы, состоящие из восьми, шести, четырех либо двух атомов. Теперь, рассмотрев серу с точки зрения физики, перейдем к следующему разделу.
Химическая характеристика серы
Данный элемент обладает сравнительно низкой атомной массой, она равняется тридцати двум граммам на моль. Характеристика элемента сера включает в себя такую особенность данного вещества, как способность обладать разной степенью окисления. Этим она отличается от, скажем, водорода или кислорода. Рассматривая вопрос о том, какова химическая характеристика элемента сера, невозможно не упомянуть, что он, в зависимости от условий, проявляет как восстановительные, так и окислительные свойства. Итак, по порядку рассмотрим взаимодействие данного вещества с различными химическими соединениями.
Сера и простые вещества
Простыми являются вещества, которые имеют в своем составе только один химический элемент. Его атомы могут объединяться в молекулы, как, например, в случае с кислородом, а могут и не соединяться, как это бывает у металлов. Так, сера может вступать в реакции с металлами, другими неметаллами и галогенами.
Взаимодействие с металлами
Для осуществления подобного рода процесса необходима высокая температура. При таких условиях происходит реакция присоединения. То есть атомы металла объединяются с атомами серы, образуя при этом сложные вещества сульфиды. Например, если нагреть два моль калия, смешав их с одним моль серы, получим один моль сульфида данного металла. Уравнение можно записать в следующем виде: 2К + S = K2S.

Реакция с кислородом
Это сжигание серы. Вследствие данного процесса образуется ее оксид. Последний может быть двух видов. Поэтому сжигание серы может происходить в два этапа. Первый - это когда из одного моль серы и одного моль кислорода образуется один моль диоксида сульфура. Записать уравнение данной химической реакции можно следующим образом: S + О2 = SO2. Второй этап - присоединение к диоксиду еще одного атома оксигена. Происходит это, если добавить к двум моль диоксида серы один моль кислорода в условиях высокой температуры. В результате получим два моль триоксида сульфура. Уравнение данного химического взаимодействия выглядит таким образом: 2SO2 + О2 = 2SO3. В результате такой реакции образуется серная кислота. Так, осуществив два описанных процесса, можно пропустить полученный триоксид через струю водяного пара. И получим сульфатную кислоту. Уравнение подобной реакции записывается следующим образом: SO3 + Н2О = H2SO4.
Взаимодействие с галогенами
Химические свойства серы, как и других неметаллов, позволяют ей реагировать с данной группой веществ. К ней относятся такие соединения, как фтор, бром, хлор, йод. Сера реагирует с любым из них, за исключением последнего. В качестве примера можно привести процесс фторирования рассматриваемого нами элемента таблицы Менделеева. С помощью разогревания упомянутого неметалла с галогеном можно получить две вариации фторида. Первый случай: если взять один моль сульфура и три моль фтора, получим один моль фторида, формула которого SF6. Уравнение выглядит так: S + 3F2 = SF6. Кроме того, есть второй вариант: если взять один моль серы и два моль фтора, получим один моль фторида с химической формулой SF4. Уравнение записывается в следующем виде: S + 2F2 = SF4. Как видите, все зависит от пропорций, в которых смешать компоненты. Точно таким же образом можно провести процесс хлорирования серы (также может образоваться два разных вещества) либо бромирования.

Взаимодействие с другими простыми веществами
На этом характеристика элемента сера не заканчивается. Вещество также может вступать в химическую реакцию с гидрогеном, фосфором и карбоном. Вследствие взаимодействия с водородом образуется сульфидная кислота. В результате её реакции с металлами можно получить их сульфиды, которые, в свою очередь, также получают прямым путем взаимодействия серы с тем же металлом. Присоединение атомов гидрогена к атомам сульфура происходит только в условиях очень высокой температуры. При реакции серы с фосфором образуется ее фосфид. Он имеет такую формулу: P2S3. Для того чтобы получить один моль данного вещества, нужно взять два моль фосфора и три моль сульфура. При взаимодействии серы с углеродом образуется карбид рассматриваемого неметалла. Его химическая формула выглядит так: CS2. Для того чтобы получить один моль данного вещества, нужно взять один моль углерода и два моль серы. Все описанные выше реакции присоединения происходят только при условии нагревания реагентов до высоких температур. Мы рассмотрели взаимодействие серы с простыми веществами, теперь перейдем к следующему пункту.
Сера и сложные соединения
Сложными называются те вещества, молекулы которых состоят из двух (или более) разных элементов. Химические свойства серы позволяют ей реагировать с такими соединениями, как щелочи, а также концентрированная сульфатная кислота. Реакции ее с данными веществами довольно своеобразны. Сначала рассмотрим, что происходит при смешивании рассматриваемого неметалла со щелочью. Например, если взять шесть моль гидроксида калия и добавить к ним три моль серы, получим два моль сульфида калия, один моль сульфита данного металла и три моль воды. Такого рода реакцию можно выразить следующим уравнением: 6КОН + 3S = 2K2S + K2SO3 + 3Н2О. По такому же принципу происходит взаимодействие, если добавить гидроксид натрия. Далее рассмотрим поведение серы при добавлении к ней концентрированного раствора сульфатной кислоты. Если взять один моль первого и два моль второго вещества, получим следующие продукты: триоксид серы в количестве три моль, а также воду - два моль. Данная химическая реакция может осуществиться только при нагревании реагентов до высокой температуры.

Получение рассматриваемого неметалла
Существует несколько основных способов, с помощью которых можно добыть серу из разнообразных веществ. Первый метод - выделение ее из пирита. Химическая формула последнего - FeS2. При нагревании данного вещества до высокой температуры без доступа к нему кислорода можно получить другой сульфид железа - FeS - и серу. Уравнение реакции записывается в следующем виде: FeS2 = FeS + S. Второй способ получения серы, который часто используется в промышленности, - это сжигание сульфида серы при условии небольшого количества кислорода. В таком случае можно получить рассматриваемый неметалл и воду. Для проведения реакции нужно взять компоненты в молярном соотношении два к одному. В результате получим конечные продукты в пропорциях два к двум. Уравнение данной химической реакции можно записать следующим образом: 2H2S + О2 = 2S + 2Н2О. Кроме того, серу можно получить в ходе разнообразных металлургических процессов, к примеру, при производстве таких металлов, как никель, медь и другие.
Использование в промышленности
Самое широкое свое применение рассматриваемый нами неметалл нашел в химической отрасли. Как уже упоминалось выше, здесь он используется для получения из него сульфатной кислоты. Кроме того, сера применяется как компонент для изготовления спичек, благодаря тому, что является легковоспламеняющимся материалом. Незаменима она и при производстве взрывчатых веществ, пороха, бенгальских огней и др. Кроме того, серу используют в качестве одного из ингредиентов средств для борьбы с вредителями. В медицине ее применяют в качестве компонента при изготовлении лекарств от кожных заболеваний. Также рассматриваемое вещество используется при производстве разнообразных красителей. Кроме того, ее применяют при изготовлении люминофоров.
Электронное строение серы
Как известно, все атомы состоят из ядра, в котором находятся протоны - позитивно заряженные частицы - и нейтроны, т. е. частицы, имеющие нулевой заряд. Вокруг ядра вращаются электроны, заряд которых негативный. Чтобы атом был нейтральным, в его структуре должно быть одинаковое количество протонов и электронов. Если же последних больше, это уже отрицательный ион - анион. Если же наоборот - количество протонов больше, чем электронов - это положительный ион, или катион. Анион серы может выступать в качестве кислотного остатка. Он входит в состав молекул таких веществ, как сульфидная кислота (сероводород) и сульфиды металлов. Анион образуется в ходе электролитической диссоциации, которая происходит при растворении вещества в воде. При этом молекула распадается на катион, который может быть представлен в виде иона металла либо водорода, а также катион - ион кислотного остатка либо гидроксильной группы (ОН-).

Так как порядковый номер серы в таблице Менделеева - шестнадцать, то можно сделать вывод, что в ее ядре находится именно такое количество протонов. Исходя из этого, можно сказать, что и электронов, вращающихся вокруг, тоже шестнадцать. Количество же нейтронов можно узнать, отняв от молярной массы порядковый номер химического элемента: 32 - 16 = 16. Каждый электрон вращается не хаотично, а по определенной орбите. Так как сера - химический элемент, который относится к третьему периоду таблицы Менделеева, то и орбит вокруг ядра три. На первой из них расположено два электрона, на второй - восемь, на третьей - шесть. Электронная формула атома серы записывается следующим образом: 1s2 2s2 2p6 3s2 3p4.
Распространенность в природе
В основном рассматриваемый химический элемент встречается в составе минералов, которые являются сульфидами разнообразных металлов. В первую очередь это пирит - соль железа; также это свинцовый, серебряный, медный блеск, цинковая обманка, киноварь - сульфид ртути. Кроме того, сера может входить и в состав минералов, структура которых представлена тремя и более химическими элементами.

Например, халькопирит, мирабилит, кизерит, гипс. Можно рассмотреть каждый из них более подробно. Пирит - это сульфид феррума, или FeS2. Он обладает светло-желтой окраской с золотистым блеском. Данный минерал можно часто встретить как примесь в лазурите, который широко используется для изготовления украшений. Это связано с тем, что данные два минерала зачастую имеют общее месторождение. Медный блеск - халькоцит, или халькозин - представляет собой синевато-серое вещество, похожее на металл. Свинцовый блеск (галенит) и серебряный блеск (аргентит) имеют схожие свойства: они оба внешне напоминают металлы, имеют серую окраску. Киноварь - это коричневато-красный тусклый минерал с серыми вкраплениями. Халькопирит, химическая формула которого CuFeS2, - золотисто-желтый, его еще называют золотой обманкой. Цинковая обманка (сфалерит) может иметь окраску от янтарной до огненно-оранжевой. Мирабилит - Na2SO4x10H2O - прозрачные либо белые кристаллы. Его еще называют глауберовой солью, применяют в медицине. Химическая формула кизерита - MgSO4xH2O. Он выглядит как белый либо бесцветный порошок. Химическая формула гипса - CaSO4x2H2O. Кроме того, данный химический элемент входит в состав клеток живых организмов и является важным микроэлементом.
Имеет ли сера металлический блеск

Чистая желтая сера
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
Смотрите так же:
СТРУКТУРА
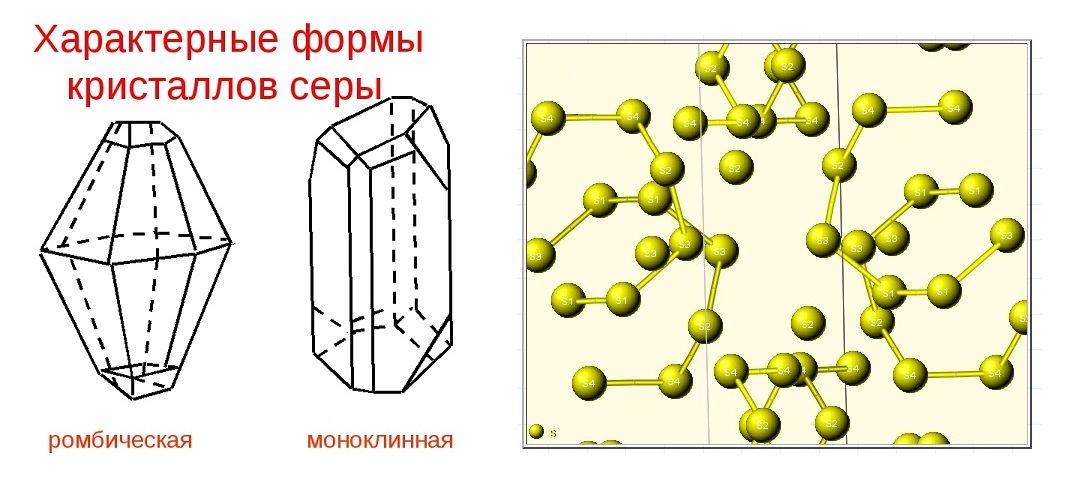
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
СВОЙСТВА

Самородная сера жёлтого цвета, при наличии примесей – жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см 3 , хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H2SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в H2SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ

Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ

Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы – вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H2S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы – кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ

Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.

Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
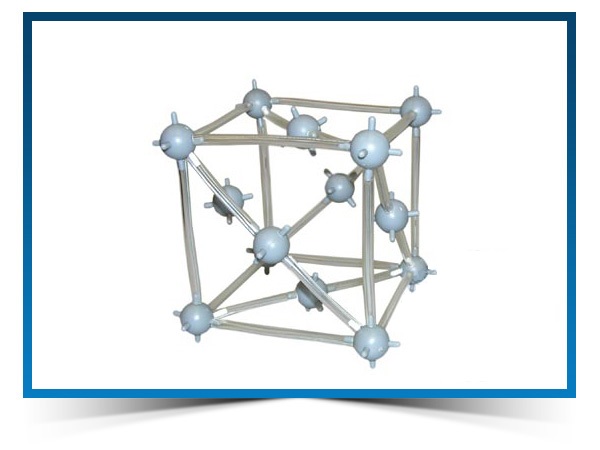
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура – кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками “медной зелени” (малахит), “медной сини” (азурит), фосфатов меди и других продуктов её вторичного изменения.
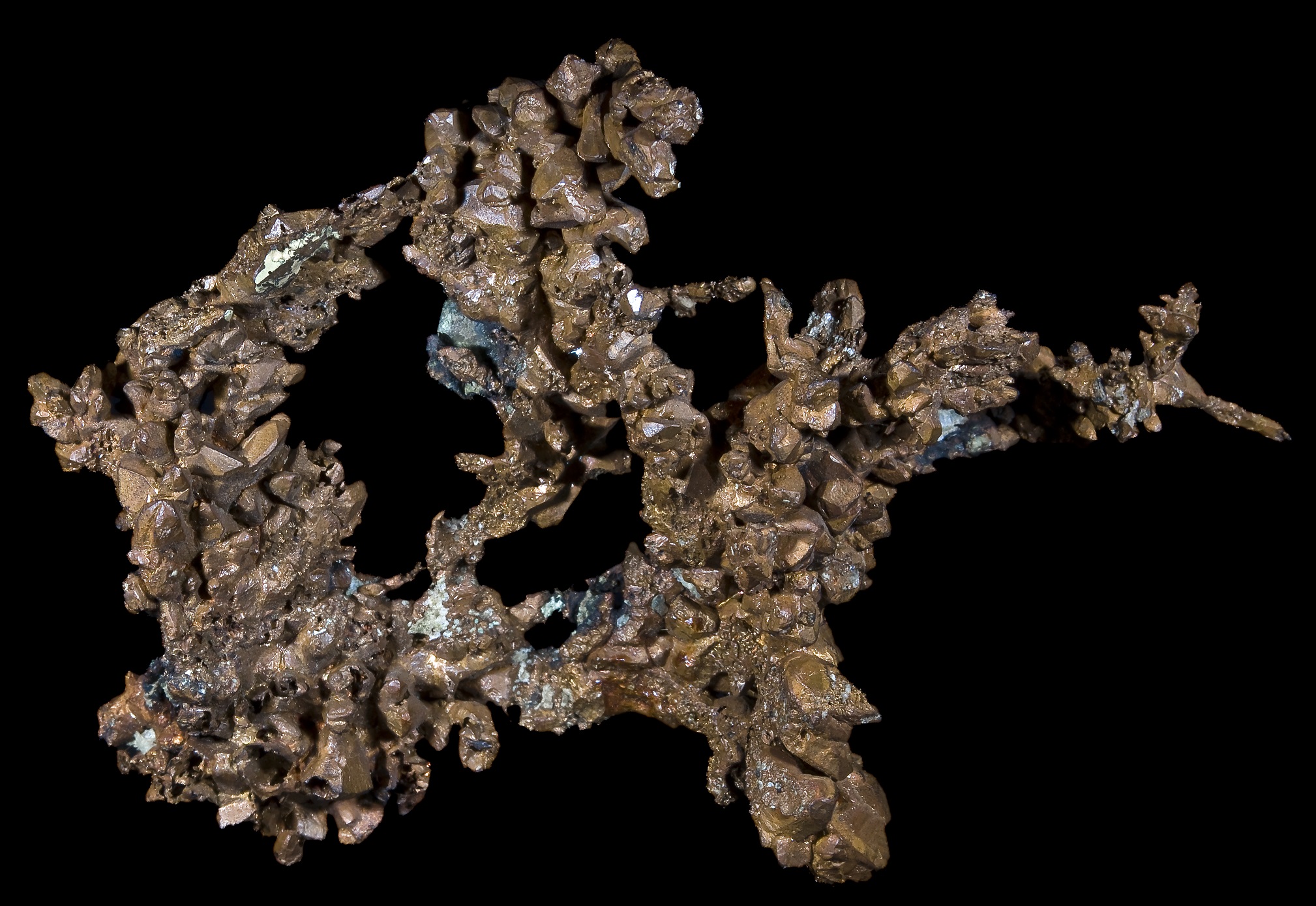
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10 −3 % (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10 −7 % и 10 −7 % (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.

Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди – Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).

Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Читайте также:
