Индий металл температура плавления
Обновлено: 04.10.2024
Индий - ценный, дорогой и редкий металл. Человек научился использовать с большой пользой для себя каждый природный материал. Но все они различаются по количеству, значимости, сложности добычи и обработки. В целом эти факторы и определяют количество инвестиций, потраченных на разработку, а также итоговую стоимость. Большее число элементов всей таблицы Менделеева относится к группе металлов, среди которых выделяются черные, драгоценные и редкие виды. Помимо последней категории существуют и особо редкие металлы. Сосчитать их можно по пальцам — всего их 3 вида:
Представляют они собой довольно-таки интересную категорию, т. к. из них только один — индий — встречается в природе, а два первых получены лабораторным методом. Стоимость первого элемента составляет 6,5-27 млн. долларов; второго 10 тыс. долларов; третьего 3,5-10 тыс. дол за грамм!
T плавления индия 156,59 ºC = 429,74 K является определяющей точкой по температурной шкале ITS-90.

Природный элемент — индий
В чистом виде 99,97-99,99 % индий представляет собой белый блестящий металл, по внешнему виду напоминающий цинк, но по техническим характеристикам стоящий по ближе всего к алюминию и галлию. При сгибании издает характерный хрустящий звук, объясняется это деформацией кристаллической решетки.
Название этот элемент приобрел в момент своего открытия: при изучении спектрального анализа цинковой обманки, была обнаружена линия цвета индиго (синий оттенок), в результате чего элемент был назван Индиго. На срезе слитка также имеет синий красивый оттенок.
История открытия
Был открыт случайно в 1863 году немецкими химиками Фердинандом Райхом и Теодором Рихтером при попытке обнаружить таллий. Способствовало такому открытию появление спектроскопического анализа, благодаря которому было сделано не одно открытие.
Так как индий был открыт при изучении цинка, то ошибочно предположили, что это его аналог и приписали ему валентность II и атомный вес 37,8. Ясность внес в 1870 году Д.И. Менделеев. С помощью периодического закона он установил, что индий аналог алюминия и относится к III группе. Таким образом индий в 1971 году занял правильное место в таблице Менделеева — 46 атомный номер с атомной массой 114,82.
Изучением этого материала занимаются и по сей день. В природе этот элемент встречается в виде 2 изотопов индия-113 и индия-115 (со слабой β-радиоактивностью), период распада которых насчитывает 6 * 10 15 лет. Всего известно 37 изотопов с различным сроком распада.
Технические характеристики
Индий очень мягкий металл (мягче золота в 20 раз), плотностью 7,362 г/см³. Его можно резать ножом, при надавливании на бумагу оставляет следы. Плавиться при температуре 156,7 ºC, закипает при 2072 ºC. Но при снижении массы до критической величины, температура плавления снижается до 40 ºC; повышение температуры до 800 ºC вступает в реакцию с кислородом, при этом можно наблюдать фиолетовое пламя. До этого температурного предела, индий не тускнеет на воздухе и не окисляется.
Инертен по отношению к щелочам, даже при их кипении. Растворим в кислотах:
- быстро реагирует с хлорной и азотной;
- медленно реагирует с соляной и серной.
Реагирует с бромом, хлором, при нагревании с серой, диоксидом серы, селеном, теллуром, йодом.
Ценность металла
Индий характеризуется высокой электропроводностью и является полупроводником: увеличивает эту характеристику даже небольшая его концентрация в сплавах с другими металлами. Поэтому основными отраслями применения являются техника, электроника, оптоэлектроника. Кроме электропроводности, индий увеличивает коррозионную стойкость и долговечность. Реже используется в ювелирных изделиях и стоматологии.
Добыча и производство
Количество природного металла индия очень ограниченно: его нахождение в земной коре определяется 1.4 * 10 -5 % по массе, а добыча исчисляется всего 500-600 тонн в год по всему миру. Основными владельцами мировых запасов являются Канада (30 %), Китай (восточные страны в сумме 60 %), США (10 %), но разработка ведется только на востоке: Китай, Южная Корея и Япония.
Индий встречается в виде собственного минерала крайне редко, тем более не образует собственных месторождений. Его относят к типичным рассеянным элементам, которые можно найти в незначительном содержании в сопутствующих минералах т рудах, некоторые из них представляют еще большую редкость, чем сам индий. Основным сырьем для получения индия являются руды свинца, цинка, олова, меди или пыли, получаемой при переработке медистых сланцев. Индий является побочным продуктом переработки свинцово–цинковых, оловянных или полиметаллических руд. Для переработки используются материалы с содержанием индия 0,1 %, не ниже.
Метод обработки индия многоступенчатый и состоит из 3 этапов:
- Получение концентрата, обогащенного индием;
- Переработка концентрата и получение неочищенного состава;
- Очистка чернового металла, т. е. рафинирование.
Осложняется производство тем, что здесь существует большое количество химических реакций, которые используются выборочно, в зависимости от состава концентрата. Кроме того, на стадии обжига концентрат обогащен цинком, свинцом, кадмием и т.д.
Технология получение и рынок индия тесно связаны между собой, т. к. количество материала ограниченно, его добыча и обработка многоступенчаты и очень затратны.
Марки и форма изготовления
Индий поставляют в виде пирамид или слитков весом 5-3000 гр., в зависимости от марки. Так, марки с минимальным суммарным содержанием сопутствующих элементов Ин0000; Ин000 поставляются весом до 1000 гр., а Ин00; Ин0; Ин2 — до 3000 гр.

Вторая форма поставки — прутки Ø 21-25 мм, длиной 50-70 мм. Цилиндрическая форма прутков Ø 22-24 мм, длиной 63-37 мм
Каждый слиток маркируется и упаковывается в полиэтиленовый пакет с ярлыком, после чего герметично запаивается.
Вторичный рынок цветных металлов
Интенсивное использование индия в современных технологиях (экраны, солнечные батареи) увеличивает и спрос на него. Неудивительно, что стоимость на него одна из самых высоких. По прогнозу объемов мирового запаса индия при сегодняшних запросах хватит всего лишь на 20 лет. Единственно правильных решением будет налаживать вторичную переработку цветных металлов.
Индий

Индий – серебристо-белый металл c сильным блеском, по внешнему виду напоминающий свежий срез цинка. Его относят к группе лёгких металлов. Он довольно мягкий, к тому же ковкий и легкоплавкий (плавится при температуре 156,5 °C). Индий без труда режется ножом, он почти в 5 раз мягче свинца. На бумаге оставляет след. Это довольно редкий, ценный и дорогой метал. По химическим свойствам индий сходен с галлием и алюминием. Его атомная масса 114,818 г/моль. Элемент состоит из двух изотопов, один из которых обладает довольно слабой β-радиоактивностью.
Смотрите так же:
ГЕОХИМИЯ И МИНЕРАЛОГИЯ

Кристаллическая структура индия
Учитывая электронную структуру атома индия, он относится к халькофильным элементам (18 электронов в предпоследнем слое). В настоящее время известно менее 10 индиевых минералов: самородный индий, рокезит CuInS2, индит FeIn2S4, кадмоиндит CdIn2S4, джалиндит In(OH)3, сакуранит (CuZnFe)3InS4 и патрукит (Cu,Fe,Zn)2(Sn,In)S4. В основном индий находится в виде изоморфной примеси в раннем высокожелезистом сфалерите, где его содержание достигает десятых долей процента. В некоторых разновидностях халькопирита и станнина содержание индия составляет сотые-десятые процента, а в касситерите и пирротине — тысячные доли процента. В пирите, арсенопирите, вольфрамите и некоторых других минералах концентрация индия — граммы на тонну. Промышленное значение для получения металла пока имеют сфалерит и другие минералы, содержащие не менее 0,1 % индия.
СВОЙСТВА

Индий – металл серебристо-белого цвета, не тускнеющий на воздухе при длительном хранении и даже в расплавленном состоянии. Плотность кристаллического индия 7310 кг/м 3 , а расплавленного – 7030 кг/м 3 . Металл плавится при 156,7° С, кипит при 2072° С. Индий очень мягок и пластичен. Его твердость по шкале Мооса чуть больше 1 (мягче только тальк), поэтому индиевый стержень, если им водить по листу бумаги, оставляет на нем серый след. Индий в 20 раз мягче чистого золота и легко царапается ногтем, а его сопротивление растяжению в 6 раз меньше, чем у свинца. Палочки из индия легко сгибаются и при этом заметно хрустят (громче, чем оловянные). Индий – диамагнетик, магнитное поле в нем ослабевает.
Индий, так же как и галлий, не образует ни с одним из металлов непрерывных твердых растворов. В индии хорошо растворяются металлы-соседи по периодической системе – галлий, таллий, олово, свинец, висмут, кадмий, ртуть, в меньшей мере цинк. Выше 800° С индий горит на воздухе сине-фиолетовым пламенем с образованием оксида индия(III).
ЗАПАСЫ И ДОБЫЧА

На сегодняшний день нет достоверных сведений о мировых ресурсах индия, так как его извлечение всегда привязано к переработке цинковых руд. По приблизительным оценкам United States Geological Surveys (по состоянию на июнь 2004) суммарный мировой запас разведанных месторождений индия составляет 2,5·10 3 тонн в пересчете на металл, а объемы резервной базы (с учетом неразведанных ресурсов) – 6·10 3 тонн металла. Мировыми лидерами по запасам индия являются Канада (30% мировых запасов), Китай и США (10% мировых запасов)
Получают индий из отходов и промежуточных продуктов производства цинка, и в меньшей степени, свинца и олова. Это сырьё содержит от 0,001 % до 0,1 % индия. Из исходного сырья производят концентрат индия, из концентрата — черновой металл, который затем рафинируют. Исходное сырьё обрабатывают серной кислотой и переводят индий в раствор, из которого гидролитическим осаждением выделяют концентрат. Из концентрата черновой металл извлекают цементацией на цинке и алюминии. Для рафинирования используются различные методы, например, зонная плавка.
Основным производителем индия является Китай (390 тонн в 2012 году), также производится Канадой, Японией и Южной Кореей (примерно по 70 тонн).
В последние годы мировое потребление индия быстро растёт и в 2005 достигло 850 тонн.
Количество используемого индия сильно зависит от мирового производства ЖК-экранов. В 2007 году в мире было добыто 475 тонн и ещё 650 тонн было получено путём переработки. На производство ЖК экранов для компьютерных дисплеев и телевизоров уходило 50-70 % доступного индия.
Стоимость индия в 2002 году составила около 100$ за кг, но рост потребности в металле привел к повышению и флуктуациям цен. В 2006—2009 годах они колебались в пределах 400—900 долларов за кг.
По современным оценкам, запасы индия будут исчерпаны в ближайшие 20 лет, если не будет повышена степень вторичного использования металла
ПРОИСХОЖДЕНИЕ

Индий самостоятельных месторождений не образует, а входит в состав руд месторождений других металлов. Наиболее высокое содержание индия установлено в рудах касситеритоносных скарнов и сульфидно-касситеритовых месторождений различных типов.
По содержанию в земной коре индий относится к типичным редким элементам, а по характеру распространения – к типичным рассеянным элементам. Кларк индия в земной коре равен 1,4·10 –5 %. Содержание индия в подавляющем большинстве минералов-носителей невелико и редко когда выходит за пределы нескольких тысячных долей процента. Количество минералов, в которых содержание индия достигает нескольких десятых долей процента (0,05–1%) чрезвычайно мало. Среди них можно отметить цилиндрит Pb3Sn4Sb2S14 (0,1–1% In) и франкеит Pb5Sn3Sb2S14(до 0,1% In), минералы класса сульфостаннанов, цинковую обманку ZnS (0,1–1% In), халькопирит CuFeS2(0,05–0,1% In) и борнит Cu3FeS3 (0,01–0,05% In). Из-за незначительного распространения в природе сульфостаннанов они не имеют значения для промышленных процессов извлечения индия. Концентрация индия в цинковых обманках тем выше, чем больше содержание в них железа и марганца, а из разнообразных по условиям своего образования обманках (марматит, сфалерит, клейофан) богаты индием ранние высокотемпературные, темноокрашенные представители – марматиты. Так, в сфалерите с высоким содержанием железа (темном сфалерите) содержание индия достигает 1%. Однако среднее содержание индия в сфалеритовых месторождениях не превышает и сотой доли процента.
В небольших концентрациях индий обнаружен в золе каменных углей, некоторых нефтяных месторождений (до 2,2·10 –6 % In), а также в морской ((0,02–7)·10 –10 % In) и дождевой ((0,002–2)·10 –7 %) воде. Содержание индия во Вселенной оценивается в 3·10 –10 %(масс.) или 3·10 –12 %(ат.).
ПРИМЕНЕНИЕ

Монета из индия
Широко применяется в производстве жидкокристаллических экранов для нанесения прозрачных плёночных электродов из оксида индия-олова.Используется в микроэлектронике как акцепторная примесь к германию и кремнию. Ранее, когда широко применялась сплавная технология производства первых полупроводниковых приборов, характерным решением было сплавление индия с германием для получения pn-перехода, например в диодах серий ДГ-Ц1, Д7 итд до сотни мг индия.
Компонент ряда легкоплавких припоев и сплавов (так, жидкий при комнатной температуре галинстан содержит 21,5 % индия).Обладает высокой адгезией ко многим материалам, позволяя спаивать, например, металл со стеклом.
Индий – уникум планеты
Название этого металла созвучно, но не связано с Индией. Его значение будет возрастать с развитием технологий. Сегодня главная область применения индия – гаджеты с жидкокристаллическими экранами. Завтра, не исключено, металл потребуется Илону Маску для марсианского проекта.

Что представляет собой
Индий – элемент таблицы Менделеева №49.
Красивое серебристое вещество относится к легким металлам.
По составу это дуэт изотопов 113 и 115. Первый стабилен, второй распадается за 6 триллионов лет. Синтезировано два десятка радиоактивных единиц, полураспад самого долгоживущего – полтора месяца.
Редкий, дорогой металл.
Международное обозначение – In (Indium).
Как был открыт и назван
История открытия вещества связана с Германией:
Сходство цвета спектральной полосы с оттенком индиго обусловило название элемента – индий.
- Результатом серии опытов стали два стержня размером с карандаш из чистого металла. Французские академики определили стоимость материала (чуть более 100 граммов) в $80 тысяч.
- На Всемирной парижской выставке 1867 года сенсацией стал слиток индия массой 500 г.
В Европе индий как металл интересовал только ученых: из-за редкости добыча промышленных масштабов не рассматривалась.
Ситуацию изменили предприимчивые американцы. В 1924 году инженер Эндрю Маррей начал обследовать недра родной страны в поисках индиевых руд. И нашел. Руды в штате Аризона оказались богатыми, что сподвигло построить завод. Здесь получили первую продукцию – один грамм вещества.
Физико-химические характеристики
Одна из характеристик индия – хруст при сгибании металлического стержня. Так разрушается структура кристаллической решетки.

У металла есть и другие интересные физические и химические свойства:
- Температура плавления определяется размерами частиц металла: мелкодисперсный порошок плавится при 40°С. Данному свойству объяснений не найдено.
- На воздухе не окисляется, сохраняя блеск.
- В воздушно-водной среде медленно ржавеет.
- Нагревшись до 810°С, воспламеняется, создавая пламя фиолетовых оттенков.
- Неохотно реагирует со щелочами, растворяется кислотами.
- Растворяет олово, ртуть, свинец, других «соседей» по таблице.
Мягкостью (1,2 по Моосу) превосходит только тальк.
Режется ножом, на бумаге оставляет серую черту. По этим признакам плюс синеватость на срезе индий можно отличить от других металлов.
Нахождение в природе
Самородный индий в природе – уникум. Находка случилась в России (Восточная Сибирь).
Чаще он рассеян в виде десятка собственных минералов. Они также редки, бедны (в большинстве индий представлен тысячными долями процента), поэтому не рассматриваются как объект добычи.
Интерес представляют породы с минимум 0,1% металла в составе:
- Ими могли бы стать собственные минералы – франкеит, цинковая обманка, халькопирит, борнит. Доля индия здесь – 0,049-0,99%, но такие руды еще более редки.
- Три четверти сырья дают свинцово-цинковые месторождения, 12-16% – оловянные. Другие источники получения металла – медные, железные рудники.
Тонна земной коры содержит четверть грамма индия, литр морской воды – 0,018 мг.
Месторождения, добыча
Запасы индия на планете аккумулированы в двух локациях:
- Северная Америка – Канада, США.
- Юго-Восточная Азия – КНР, Южная Корея, Япония.
Глобальный годовой объем производства – 500-600 тонн (добыча плюс вторичная переработка).

Динамика планетарной добычи индия, по данным USGS
По приблизительным оценкам американских геологов разведанный мировой резерв металлического индия – 25 тысяч, потенциал – 60 тысяч тонн.
Редкость в природе – главный недостаток индия. Запасы исчерпаются через пару десятилетий. Задачей номер один становится повторное эффективное использование материалов.
Технология производства
Сырьем служат отходы, полуфабрикаты производства цинка, олова, свинца.

Этапы получения металла традиционны:
- Сырье обогащают. То есть воздействуют серной кислотой, получая растворенный индий. Методом гидролиза осаждают концентрат.
- Концентрат превращают в черновой металл, цементируя на цинке и алюминии.
- Способ получения рафинированного продукта – сегментированная плавка.
Мировой производитель номер один – Китай (80%).
Где используется
Утилитарные достоинства – ковкость, легкоплавкость, прочность – обусловили сферы применения металла.
Первыми покупателями стали стоматологи и авиастроители.
Атом, космос, наука
С середины 1940-х годов характеристики металла начали использовать ядерщики и создатели космической техники:
- Уплотнитель-герметизатор космических аппаратов, ускорителей элементарных частиц.
- Оксид вещества – компонент стекла, поглощающего тепловые нейтроны.
- Связка оксид ртути-индий – материал долговечных энергоемких аккумуляторов специального назначения.
Изотопом «вычисляют» присутствие нейтрино.

Слитки индия
Другие отрасли
Еще шире ассортимент продукции гражданского сектора экономики:
- Зеркала, осветительные приборы (рефлекторы, прожекторы). Использовано свойство металла отражать предмет либо световой пучок без искажений.
- Полупроводники. Чистый (примесей не более 0,0001%) индий «превращает» в проводники другие материалы.
- Термоэлементы.
Оловянно-индиевый оксид признан незаменимым для электроники с жидкокристаллическими экранами: планшетов, мониторов, ноутбуков, смартфонов, телевизоров.
- Изотопы вещества используют фармацевты.
- Прочные нержавеющие сплавы «индий + металл» востребованы ювелирами и стоматологами.
Эстеты ценят «синее золото» – сплав благородного металла с индием (46:54, формула AuIn2).
Стоимость
Увеличение объемов добычи идет кратно, но цена не падает, а увеличивается в разы: со $110 (2002) до $990 (2019) за кг.
Индий - использование и цены
Химики Фердинанд Райх и Иероним Теодор Рихтер исследовали спектроскопически различные руды 1863 в надежде найти элемент таллий. Характерные зеленые эмиссионные линии таллия отсутствовали, но вместо этого наблюдалась голубая спектральная линия. Не было известно ни одного элемента, производящего такую линию, поэтому они правильно предположили, что их образцы содержали новый элемент. Они назвали гипотетический новый элемент индием из индиго его спектральной линии, и Рихтер выделил чистый металлический индий в следующем году.

Индий прошел очень медленный путь от своего первого открытия до коммерческой значимости. В первые семьдесят лет после его открытия это было прежде всего любопытство. Образец металла был представлен 1867 на Всемирной выставке, но к концу 1920 не произошло значительной деградации индия. Эти операции были начаты только потому, что несколько химиков были заинтересованы в использовании индия в качестве упрочняющей поверхностной обработки для черных металлов и обнаружили, что для того, чтобы экспериментировать с этой идеей, им самим пришлось разработать источник металла. Первым масштабным применением этого металла было нанесение покрытий на подшипники в высокоэффективных двигателях самолетов. Тем не менее, эти и некоторые нишевые сплавы были единственными драйверами спроса на металл, пока он не был использован в полупроводниковой технологии от 1952. После этого производство продолжало расти, так как продолжали развиваться приложения для металла как в сплавах, так и в сложных полупроводниках.
Начиная с 1992, одно полупроводниковое соединение является крупнейшим источником спроса на оксид индия-индия-олова (ITO). Когда ITO наносится на поверхность в виде тонкой пленки, он создает оптически прозрачное проводящее покрытие, которое позволяет служить прозрачным электродом в электронных устройствах. Прозрачные электроды имеют решающее значение для проектирования жидкокристаллических дисплеев (ЖК-дисплеев), плазменных экранов и устройств с сенсорным экраном. ITO также используется для покрытия ветровых стекол самолетов, которые затем можно удобно оттаивать, когда ток протекает по проводящей фольге, а также экранировать от электромагнитных помех в органических светодиодах, солнечных элементах, натриевых лампах, антистатических покрытиях, тонкопленочных тензодатчиках и т.п.
Некоторые другие полупроводники на основе индия имеют важное применение, хотя они не используются в большом объеме ITO. Большинство индийских полупроводников, включая арсенид индия, фосфид индия, нитрид индия, антимонид индия и многие их сплавы с другими полупроводниковыми соединениями, характеризуются высокой подвижностью электронов и, следовательно, встречаются в высокочастотной электронике, такой как высокочастотные транзисторы. Кроме того, эти материалы обычно имеют прямые запрещенные зоны, что делает их пригодными для оптоэлектронных устройств, таких как светодиоды, лазеры, тонкопленочные солнечные элементы, детекторы излучения и интегральные оптические схемы. Составной полупроводник медь-индий-галлий-селенид (CIGS) является одним из немногих материалов, используемых в настоящее время коммерчески для производства тонкопленочных фотоэлектрических устройств. Кроме того, многие индийские полупроводники исследуются на предмет их потенциального использования в новых нанотехнологически разработанных формах, таких как квантовые точки и нанопроволоки.
Помимо использования в полупроводниках, индий встречается главным образом в виде металла, либо отдельно, либо в сплавах, обычно в тех случаях, когда используется его низкая температура плавления. Индий можно использовать для изготовления таких сплавов, как галистан, которые являются жидкими при комнатной температуре и могут заменить ртуть в таких применениях, как термометры. Индиевые сплавы обычно используются в уплотнениях для криогенных применений, потому что они остаются пластичными и пластичными при низких температурах. Индийсодержащие припои приобрели важное значение благодаря все более строгим ограничениям на использование свинца, другого металла с низкой температурой плавления, который когда-то был найден в большинстве низкотемпературных припоев. Кроме того, индий может быть найден в литейных сплавах и в материалах термической поверхности.
Заслуживает внимания и два нишевых применения индия. При визуализации лейкоцитов индия радиоизотоп индия используется для отслеживания лейкоцитов в организме и выявления источников инфекции. Индий также является частью стержней управления, используемых в ядерных реакторах, где он поглощает избыточные нейтроны в дополнение к серебру и кадмию.
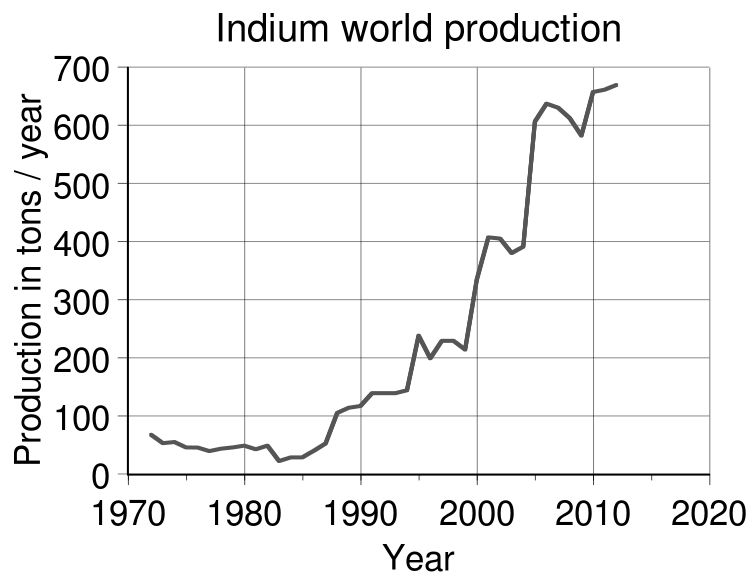
Индийское мировое производство
Индий не так уж и редок - он почти так же распространен, как ртуть, - но здесь нет экономически значимых минералов индийской руды. Поэтому металл необходимо извлекать из других металлических руд, где он может быть обнаружен в следовых количествах, и сегодня его чаще всего извлекают из побочных продуктов добычи цинка. Индий все чаще извлекается из отходов, образующихся в процессе распыления ITO, и даже непосредственно из лома ЖК-панелей. Эти усилия по переработке различаются в зависимости от эффективности процесса и текущих цен на металл с точки зрения экономической целесообразности, поэтому их использование широко варьируется от страны к стране и из года в год. Обеспокоенность по поводу истощения мировых запасов индия вызвала значительный интерес к разработке альтернативных прозрачных электродных материалов для замены ITO в электронике.
Физические свойства металлов: твердость, плотность и др.

Металлы имею такие физические свойства, как твердость, температуру плавления, плотность, пластичность, электропроводность, теплопроводность и цвет.
Твёрдость:
Все металлы, кроме ртути и, условно, франция, при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.
Таблица твёрдости металлов по шкале Мооса:
| Твёрдость | Металл |
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Температура плавления:
Температуры плавления чистых металлов лежат в диапазоне от −38,83 °C (ртуть) до 3422 °C (вольфрам).
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
В зависимости от температуры плавления металлы делятся на: легкоплавкие (до 600 °C); среднеплавкие (от 600 до 1600 °C); тугоплавкие (выше 1600 °C).
Таблица температуры плавления легкоплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Ртуть | -38,83 |
| Франций | 25 |
| Цезий | 28,44 |
| Галлий | 29,7646 |
| Рубидий | 39,3 |
| Калий | 63,5 |
| Натрий | 97,81 |
| Индий | 156,5985 |
| Литий | 180,54 |
| Олово | 231,93 |
| Полоний | 254 |
| Висмут | 271,3 |
| Таллий | 304 |
| Кадмий | 321,07 |
| Свинец | 327,46 |
| Цинк | 419,53 |
Таблица температуры плавления среднеплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Сурьма | 630,63 |
| Нептуний | 639 |
| Плутоний | 639,4 |
| Магний | 650 |
| Алюминий | 660,32 |
| Радий | 700 |
| Барий | 727 |
| Стронций | 777 |
| Церий | 795 |
| Иттербий | 824 |
| Европий | 826 |
| Кальций | 841,85 |
| Лантан | 920 |
| Празеодим | 935 |
| Германий | 938,25 |
| Серебро | 961,78 |
| Неодим | 1024 |
| Прометий | 1042 |
| Актиний | 1050 |
| Золото | 1064,18 |
| Самарий | 1072 |
| Медь | 1084,62 |
| Уран | 1132,2 |
| Марганец | 1246 |
| Бериллий | 1287 |
| Гадолиний | 1312 |
| Тербий | 1356 |
| Диспрозий | 1407 |
| Никель | 1455 |
| Гольмий | 1461 |
| Кобальт | 1495 |
| Иттрий | 1526 |
| Эрбий | 1529 |
| Железо | 1538 |
| Скандий | 1541 |
| Тулий | 1545 |
| Палладий | 1554,9 |
| Протактиний | 1568 |
Таблица температуры плавления тугоплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Лютеций | 1652 |
| Титан | 1668 |
| Торий | 1750 |
| Платина | 1768,3 |
| Цирконий | 1855 |
| Хром | 1907 |
| Ванадий | 1910 |
| Родий | 1964 |
| Технеций | 2157 |
| Гафний | 2233 |
| Рутений | 2334 |
| Иридий | 2466 |
| Ниобий | 2477 |
| Молибден | 2623 |
| Тантал | 3017 |
| Осмий | 3033 |
| Рений | 3186 |
| Вольфрам | 3422 |
Плотность:
В зависимости от плотности металлы делят на лёгкие (плотность от 0,53 до 5 г/см³) и тяжёлые (от 5 до 22,6 г/см³).
Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца ), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность:
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними.
Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты металла . Так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность:
Все металлы хорошо проводят электрический ток, обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля.
Серебро, медь и алюминий имеют наибольшую электропроводность. По этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также и натрий. В экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность:
Теплопроводность металлов зависит от подвижности свободных электронов.
Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла. Широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет у большинства металлов примерно одинаковый — светло-серый, иногда с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Металлы подразделяются на цветные и черные.
Чёрные металлы – железо и сплавы на его основе (стали, ферросплавы, чугуны). К чёрным металлам также зачастую относят марганец и, иногда, – хром и ванадий.
Цветные металлы — это особый класс нержавеющих металлов и сплавов, в составе которых нет железа. Металлы называются цветными, потому что каждый из них имеет определенный окрас. К цветным металлам относятся медь, молибден, свинец, цинк, олово, никель, кадмий, кобальт, алюминий, титан, магний, висмут, вольфрам, ртуть, золото, платину, серебро, палладий, родий, рутений, осмий, иридий.
Читайте также:
