Ионные ковалентные молекулярные и металлические кристаллы
Обновлено: 05.10.2024
Известно, что вещества в природе могут находиться в четырех агрегатных состояниях, а именно: в твердом, жидком, газообразном и плазменном. Два из этих состояний, жидкое и твердое, называются конденсированными. В этих состояниях возникают ансамбли сильно взаимодействующих частиц, а именно: атомов, ядер, электронов. При этом силы притяжения и отталкивания уравновешиваются, поэтому конденсированные вещества создают большое сопротивление к изменению объема. Те из них, которые оказывают сопротивление изменению формы, называют твердыми телами. Но ощутимой границы между твердыми телами и жидкостями не существует, на их границе имеются, так называемые, аморфные тела.
Главная особенность аморфных тел (смол, стекол, шлаков и т.д.) это отсутствие дальнего порядка во взаимном расположении атомов, т.е. строгой повторяемости одного и того же элемента структуры во всех направлениях. В аморфных телах наблюдается ближний порядок. Эта определенная согласованность расположения ближних частиц при увеличении расстояния быстро уменьшается. Отсутствие дальнего порядка - непосредственная причина полной изотропности физических свойств и отсутствия определенной точки плавления аморфных тел.
Существенной характеристикой кристаллического тела является упорядоченная периодическая внутренняя структура, простирающаяся в трех направлениях, т.е. дальний порядок. Результат этой структуры - внешняя симметрия кристаллов.
Кристаллы анизотропны: их физические свойства (тепло-, электропроводность, оптические свойства, модули упругости и т.д.) меняются в зависимости от направления. Можно отметить особые кристаллографические направления и плоскости, в которых физические свойства кристаллов оказываются вполне определенными. Но обнаружить анизотропность можно не у всяких кристаллов, а только у монокристаллов.
Большинство кристаллических тел, например металлы, являются поликристаллическими. Они представляют собой множество сросшихся мелких кристаллических зерен. Внутри зерна сохраняются неизменными направления кристаллографических осей. В поликристаллах одинаковые кристаллографические направления отдельных кристалликов оказываются повернутыми относительно друг друга на всевозможные углы. Если в ориентации зерен нет никакого порядка, то такое кристаллическое тело будет изотропным. Если же будет наблюдаться какой-то порядок (а он может возникнуть при таких методах обработки металла, как прокатка, протяжка, волочение), то этот материал называется текстурированным и обнаруживает некоторую анизотропность.
В ряде случаев дальний порядок наблюдается и в жидкой фазе. Это так называемое жидкокристаллическое состояние. В жидких кристаллах наблюдается одноосный дальний порядок: дальний порядок наблюдается только по одному направлению, а по другим перпендикулярным направлениям дальнего порядка нет (органические вещества, молекулы которых имеют нитевидную вытянутую форму или форму пластин) .
Термином"твердое тело" мы определим тела, обладающие кристаллической структурой. Следовательно, все аморфные тела, в которых наблюдается типичный для жидкости беспорядок в расположении атомов, не относятся к твердым телам, это сильно охлажденные и очень вязкие жидкости.
Твердые тела можно разделить на группы, основанные на типах связи между кристаллами. Согласно этой классификации все твердые тела условно можно разделить на металлы, ионные кристаллы, валентные кристаллы, молекулярные кристаллы, кристаллы с водородной связью. Различия между этими группами кристаллов не всегда достаточно четко выражены, поэтому, указанный способ классификации может служить для приближенного объединения кристаллов в группы. Например, полупроводники могут относиться и к ионным, и к валентным, и к молекулярным кристаллам.
Основные типы связывающих сил, в соответствии с которыми мы провели классификацию твердых тел это ионная, ковалентная, молекулярная, металлическая и водородная.
Ионная связь возникает в кристалле благодаря электростатическому взаимодействию между противоположно заряженными ионами. Ионная связь возникает, когда сближаются атомы, сильно отличающиеся по величине энергии их валентных электронов. Каждый атом подвергается сильному воздействию электростатического поля другого, при этом электроотрицательный атом отдает часть своих валентных электронов, превращаясь в положительный ион, электроположительный атом приобретает эти электроны и становится отрицательным ионом. При тесном сближении ионов возникает новая сила - сила взаимодействия (отталкивания) электронных оболочек, которая растет быстрее, чем сила электронного приближения. Ионы в кристалле распределяются в таком положении, при котором силы отталкивания уравновешиваются силами притяжения.
1-энергия связи; 2- энергия отталкивания; 3- результирующая энергия взаимодействия; r0 – расстояние между ионами в молекуле; UC – энергия связи
Типичные ионные кристаллы – это твердые тела, образовавшиеся в результате соединения сильно электроположительных металлов с сильно электроотрицательными элементами. Обычно это неорганические соединения (NaCl, KJ и т.д.). Сила ионной связи проявляется в большой твердости, относительно высокой точке плавления, малом коэффициенте теплового расширения.
Ковалентная связь.Если атомы, из которых формируется кристалл, обладают аналогичными свойствами, то невозможен переход электронов от электроположительных атомов к электроотрицательным для создания стабильных конфигураций. Однако, если каждый из двух подобных атомов имеет орбиту с одним только валентным электроном, то при сближении атомов такие орбиты могут объединяться в одну. Возникает общая орбита с двумя электронами, вращающимися вокруг обоих атомов. Эта орбита с двумя электронами более устойчива, чем две независимые орбиты с одним электроном на каждой. Взаимное притяжение двух атомов благодаря общей орбите электронов и образует ковалентную связь, которая обуславливает образование валентных кристаллов. Такая связь наблюдается в молекулах H2, N2, O2 и т.д., а также между элементами средних групп таблицы Менделеева SiC, AlN и т.д. Кристаллы с ковалентной связью наиболее важный полупроводниковый материал.
Рис.1.3. Обобществление электронов сопровождается перераспределением электронной плотности ׀Ψ׀ 2 : 1- плотность электронных облаков изолированных атомов; 2- суммарная плотность, которая получилась бы при простом наложении электронных облаков; 3 – фактически устанавливающаяся плотность.
Ковалентную связь отличает направленность: связь образуется в том направлении, в котором расположена наибольшая часть электронного облака коллективизированныхх электронов. Кроме того, эта связь характерна насыщаемостью, то есть каждый атом способен образовать ковалентную связь лишь с определенным числом соседей. Эта связь может осуществляться одной парой электронов – одинарная связь, двумя парами и т.д.
Типичный пример - углерод в форме алмаза. Любой атом углерода окружен 4-мя атомами, расположенными в вершинах тетраэдра, с каждым из которых он связан обобщенной парой валентных электронов.
Сила ковалентной связи может быть такой же, как и ионной, так что валентные и ионные кристаллы имеют близкие свойства. Однако валентные кристаллы показывают большее разнообразие своих физических свойств: твердость, точка плавления, коэффициент теплового расширения изменяются в более широких пределах, чем аналогичные характеристики ионных кристаллов.
Молекулярная связь осуществляется силами Ван-дер-Ваальса, она имеет важное значение только в том случае, когда возникает между атомами и молекулами, имеющими заполненные валентные оболочки. Многие атомы и молекулы, являясь нейтральными образованиями, обладают определенным электрическим дипольным моментом, благодаря несимметричному распределению электрических зарядов. Взаимодействие этих моментов и приводит к возникновению сил притяжения (в данном случае сил Ван-дер-Ваальса). Даже в тех атомах и молекулах, в которых дипольный момент равен нулю, возникает изменение дипольного момента, вызванное движением электронов и их мгновенным положением. Мгновенное электронное поле возбуждает дипольные моменты в окружающих атомах и между ними возникают силы Ван-дер-Ваальса. Атомы будут сближаться до тех пор, пока электронное отталкивание внешних электронных оболочек не скомпенсирует силы Ван-дер-Ваальса.
Ван-дер-ваальсова связь включает в себя:
- дисперсионное взаимодействие, возникающее вследствие согласованного движения электронов в соседних атомах. Под влиянием мгновенного электрического диполя первого атома второй атом поляризуется, в нем возникает наведенный диполь, возникает притяжение (рис. а). Оно более вероятно, чем отталкивание (рис б), т.к. энергия системы меньше.
- ориентационное взаимодействие возникает между слабо и средне полярными молекулами. Электростатическое взаимодействие стремится упорядочить расположение молекул так, чтобы энергия системы уменьшалась (рис. в). Энергия системы, определяемая ориентацией молекул, сильно зависит от температуры.
- индукционное взаимодействие - возникает между сильно полярными молекулами. У них может возникать наведенный (индуцированный) момент под действием поля постоянных диполей соседних молекул (пунктир на рис. г)
Обычно эти силы довольно слабы (в сравнении с ионной и ковалентной связью) и обуславливают низкую температуру плавления, высокую сжимаемость, низкую теплоту сублимации молекулярных кристаллов. К молекулярным кристаллам относятся большинство органических кристаллов. Эта связь возникаетмежду молекулами с насыщенными химическими связями (О2, Н2, N2, CН4…), а также между атомами инертных газов.
Металлическая связь.Металлический кристалл в некотором приближении можно представить в виде решетки из положительных ионов, между которыми могут свободно перемещаться электроны. Металлическая связь возникает благодаря взаимодействию между ионами и всей совокупностью обобществленных электронов. Электроны, находящиеся между ионами, "стягивают" их, стремясь уравновесить силы отталкивания, действующие между положительными ионами. Металлические кристаллы обладают высокой ковкостью, теплопроводностью и электропроводностью. Почти все металлы кристаллизуются в наиболее плотных структурах кубической и гексагональной решеток, с наибольшим значением координационного числа, т.е. числа атомов которые составляют ближайшее окружение данного атома.
Водородная связь.Водородная связь возникает в том случае, когда атом водорода связан с очень электроотрицательным атомом (например, атомом кислорода, фтора, натрия, хлора и т.д.). Такой атом притягивает электроны связи и приобретает отрицательный заряд. Атом водорода, от которого оттянут электрон связи, приобретает положительный заряд. Водородная связь обусловлена электростатическим притяжением этих зарядов.
Типичным примером может служить водородная связь, возникающая между молекулами воды. Связь О-Н, устанавливающаяся между атомами кислорода одной молекулы воды и атомом водорода другой, ведет себя как маленький диполь с зарядом -d на О и +d на Н. Притяжение между этими зарядами и приводит к образованию водородной связи (пунктир на рис. 1.6).
Водородная связь вызывает ассоциацию молекул жидкости: воды, кислот, спиртов и т.д., приводящую к повышению их вязкости, увеличению точки кипения, аномальному изменению объема при нагревании и т.д. Показательной в этом отношении является вода: если бы между молекулами воды не действовала водородная связь, то она кипела бы при нормальном давлении не при +100°С, а при -80°С, а ее вязкость была бы почти на порядок меньше.
Важной характеристикой межатомных связей в кристаллах является энергия связи. Под энергией связи понимают энергию необходимую для разъединения твердого тела на отдельные частицы. В зависимости от состава кристалла энергия связи принимает значения: энергия обусловленная силами Ван-дер-Ваальса » 10 4 Дж/моль; ионной связи » 10 6 Дж/моль; энергия ковалентной примерно равна энергии ионной связи.
Необходимо отметить, что обычно атомы в кристалле не связаны каким – либо одним из рассмотренных выше типов связи, большинство кристаллов объединяют в себе несколько типов связи.
§ 16. Типы кристаллических структур
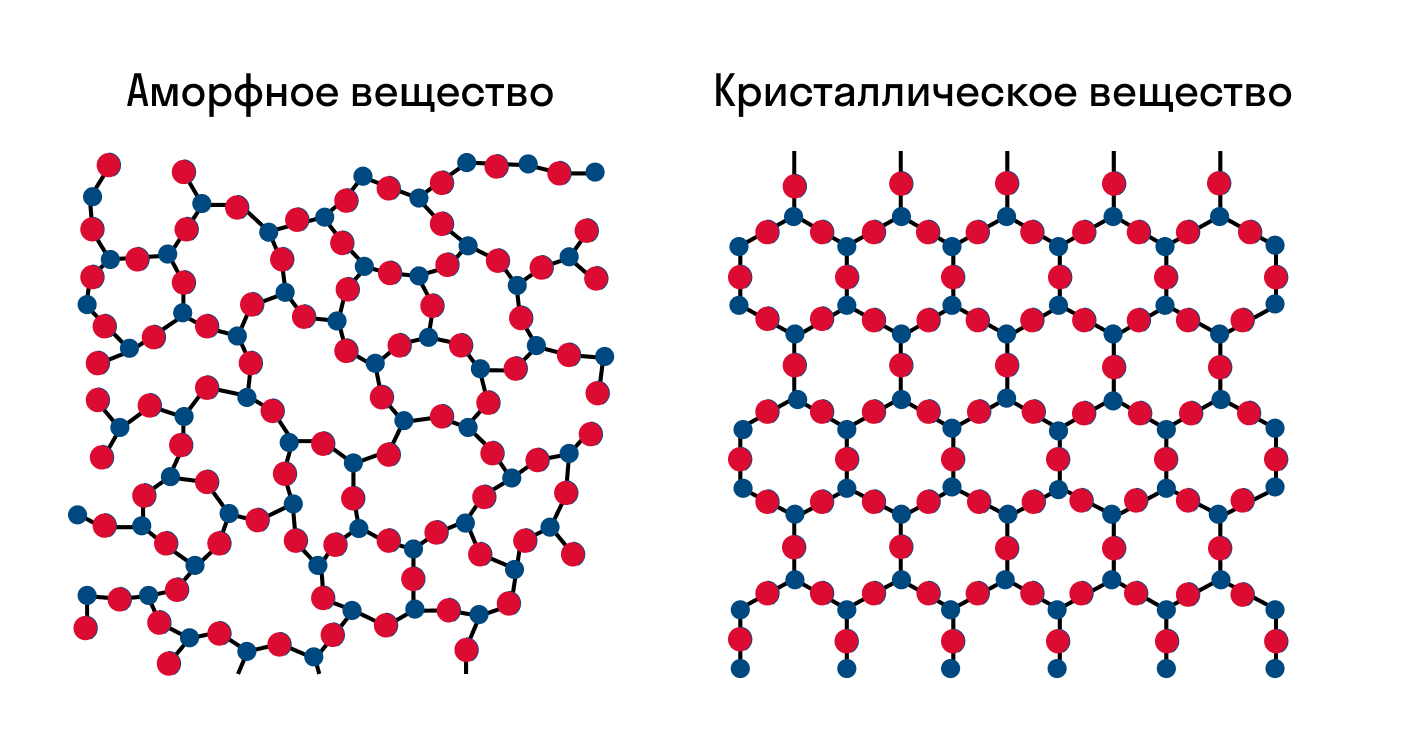
Свойства веществ в твёрдом агрегатном состоянии определяются не только составом атомов, ионов, молекул, но и их взаимным расположением.
Расположение структурных единиц может быть упорядоченным и разупорядоченным. В соответствии с этим твёрдые вещества бывают в кристаллическом и аморфном состояниях.
.jpg)
Рис. 35. Строение оксида кремния(IV)
Кристаллы — это твёрдые вещества с упорядоченным расположением структурных единиц (атомов, ионов, молекул). Кристаллы имеют естественную форму многогранников, расположение структурных единиц симметрично и многократно повторяется ( рис. 35 ).
Структурные единицы веществ молекулярного строения — это молекулы. Например, структурной единицей воды является молекула состава Н2О, которая обнаруживается в твёрдом, жидком и газообразном состояниях. Однако лишь в кристаллах льда молекулы воды расположены упорядоченно, то есть на конкретном расстоянии, под определённым углом, образуя регулярную кристаллическую структуру.
В веществах немолекулярного строения мельчайшие структурные единицы — это атомы или ионы. К таким веществам относятся металлы (Na, Cu, Fe) и неметаллы (B и Si, алмаз и графит, красный фосфор), соединения металлов с неметаллами (NaCl, NaH, Na2SO4, CuCl2, Fe2O3) и неметаллов с неметаллами (SiC, SiO2).
В аморфном состоянии упорядоченность в расположении структурных единиц отсутствует. В аморфном состоянии находятся, например, стекло, смола, парафин, полиэтилен, сажа.
Строение, свойства и способы получения кристаллических веществ изучает кристаллохимия. Каждому кристаллическому веществу присуща своя кристаллическая структура и соответствующая ей форма кристаллов ( рис. 36 ). Кристаллы галита (NaCl) имеют форму куба, кристаллы кварца (SiO2) — шестигранной призмы.

Рис. 36. Формы кристаллов различных веществ
Строение молекул показывают посредством структурных формул, а пространственное расположение атомов, ионов, молекул в кристаллах отображают с помощью кристаллической решётки.
Если соединить частицы, составляющие кристалл, условными линиями, то получится пространственный каркас, называемый кристаллической решёткой. Точки пересечения таких линий называют узлами кристаллической решётки. Положение узлов решётки моделирует расположение структурных единиц кристалла — атомов, ионов или молекул.
Химическая связь в кристаллах
В таблице 13 обобщены основные характеристики кристаллических веществ с различным типом химической связи.
Таблица 13. Типы кристаллов и их свойства
Различают атомные (ковалентная связь), ионные (ионная связь), металлические (металлическая связь) и молекулярные кристаллы. Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями, а между молекулами действуют более слабые межмолекулярные силы. Молекулярные кристаллы образуют известные вам сахар, аспирин, диоксид углерода («сухой лёд»), вода (лёд) (рис. 37).
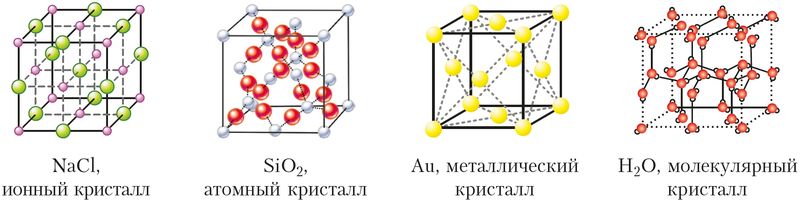
Рис. 37. Кристаллические решётки веществ с разным типом химической связи
Зависимость свойств веществ от типа кристаллической структуры
Свойства твёрдых веществ зависят от строения кристаллов и прочности в них химических связей. Например, углерод образует несколько разновидностей кристаллических структур. Одна из них — структура алмаза, в которой каждый атом углерода образует четыре равные по прочности ковалентные связи с четырьмя соседними атомами углерода, расположенными в вершинах тетраэдра ( рис. 38 ). Благодаря своему строению алмаз — самое твёрдое природное вещество ( Приложение 2 ). Аналогичные кристаллические структуры и близкую к алмазу твёрдость имеют карборунд SiC и боразон BN.
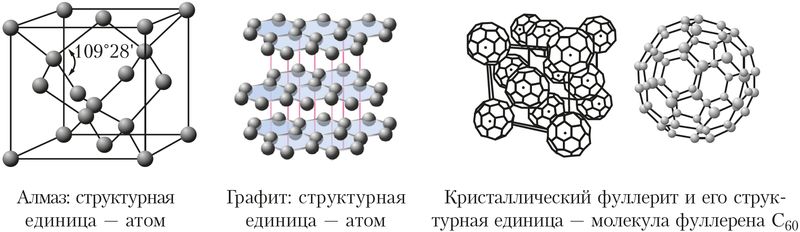
Рис. 38. Кристаллические решётки аллотропных модификаций углерода
Другая разновидность кристаллического углерода — графит. В графите атомы углерода расположены слоями. В слоях каждый атом углерода использует три своих электрона для образования трёх ковалентных связей с соседними атомами. Четвёртый электрон участвует в образовании делокализованных π-связей и может свободно перемещаться вдоль слоя. Поэтому графит обладает электропроводностью и используется для изготовления электроконтактов, проводящих смазок, электродов и др.
Расстояние между слоями графита значительно больше, чем между атомами в слое. Поэтому графит легко расслаивается. Благодаря этому свойству из графита изготавливают грифели карандашей, он входит в состав различных смазок, снижающих трение, и сам является твёрдой смазкой в формах для литья металлов.
Третья кристаллическая модификация углерода — фуллерит — образована молекулами фуллерена С60, состоящими из 60 атомов углерода.
Атомные, ионные и металлические кристаллы различаются устойчивостью к механической деформации, в результате которой происходит смещение отдельных слоёв кристаллической структуры ( рис. 39 ). При этом сцепление между слоями в атомных кристаллах (а) нарушается из-за разрыва химических связей между атомами, а в ионных — из-за отталкивания одноимённо заряженных ионов (б). В металлических кристаллах благодаря особенностям металлической связи кристаллы не разрушаются, а деформируются. Поэтому металлы пластичны (ковки), а атомные и ионные кристаллы — хрупки.
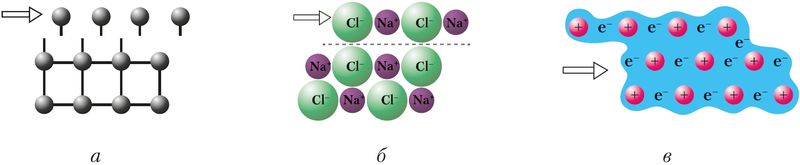
Рис. 39. Смещение атомных слоёв при деформации кристаллов:
а — атомных, б — ионных, в — металлических
Кристаллы — это твёрдые вещества с упорядоченным расположением структурных единиц (атомов, ионов, молекул).
По строению выделяют четыре типа кристаллов: атомные, ионные, молекулярные и металлические. Они отличаются своими свойствами.
Вопросы, задания, задачи
1. В чём заключаются основные отличия веществ молекулярного и немолекулярного строения? Приведите примеры.
2. Сравните свойства атомных, молекулярных, ионных и металлических кристаллов.
3. Объясните, почему ионные и молекулярные кристаллы практически не проводят электрический ток. Чем обусловлена хорошая электро- и теплопроводность металлических кристаллов?
4. Могут ли проводить ток вещества:
- а) с ионной связью;
- б) ковалентной связью?
Приведите примеры и условия проявления этими веществами электропроводности.
5. Определите типы химической связи и типы кристаллов веществ, формулы которых: SO2, SiС, CsF, K2SO4, Cu6Sn5.
6. Конструктору понадобилось очень твёрдое вещество, устойчивое к действию высоких температур и растворителей. Какое из соединений, перечисленных в задаче 5, он может использовать в своих испытаниях?
7. Объясните, почему графит обладает электропроводностью, а алмаз — нет.
8. Сплав Розе (tпл. +94 °C ) используется в плавких электрических предохранителях, а также в радиотехнике в качестве припоя. Состав сплава (по массе): свинец ( 25 % ), висмут ( 50 % ), олово ( 25 % ). Укажите тип его кристаллов. Рассчитайте массу каждого компонента, необходимого для получения сплава массой 5 кг .
9. Рассчитайте мольное соотношение компонентов в сплаве Вуда. Сплав Вуда — тяжёлый легкоплавкий сплав, изобретённый в 1860 году американским дантистом Вудом. Температура плавления — 68,5 °C . Состав (массовые доли): олово — 12,5 % , свинец — 25 % , висмут — 50 % , кадмий — 12,5 % . Какими другими физическими свойствами может, по вашему мнению, обладать этот сплав?
10. Определите число атомов в порции массой 1 г одного из самых твёрдых синтетических веществ, представляющего собой бинарное соединение бора и азота BN.
Химия. 11 класс
Кристаллическая решетка

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
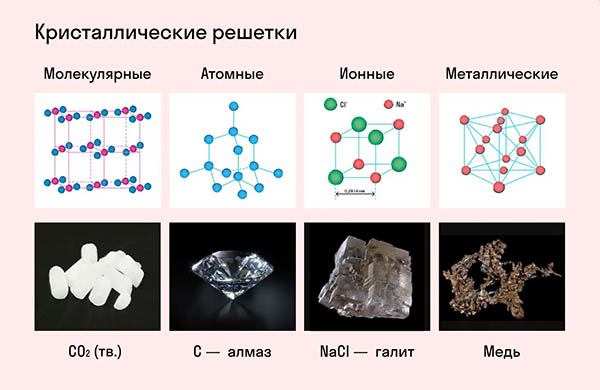
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
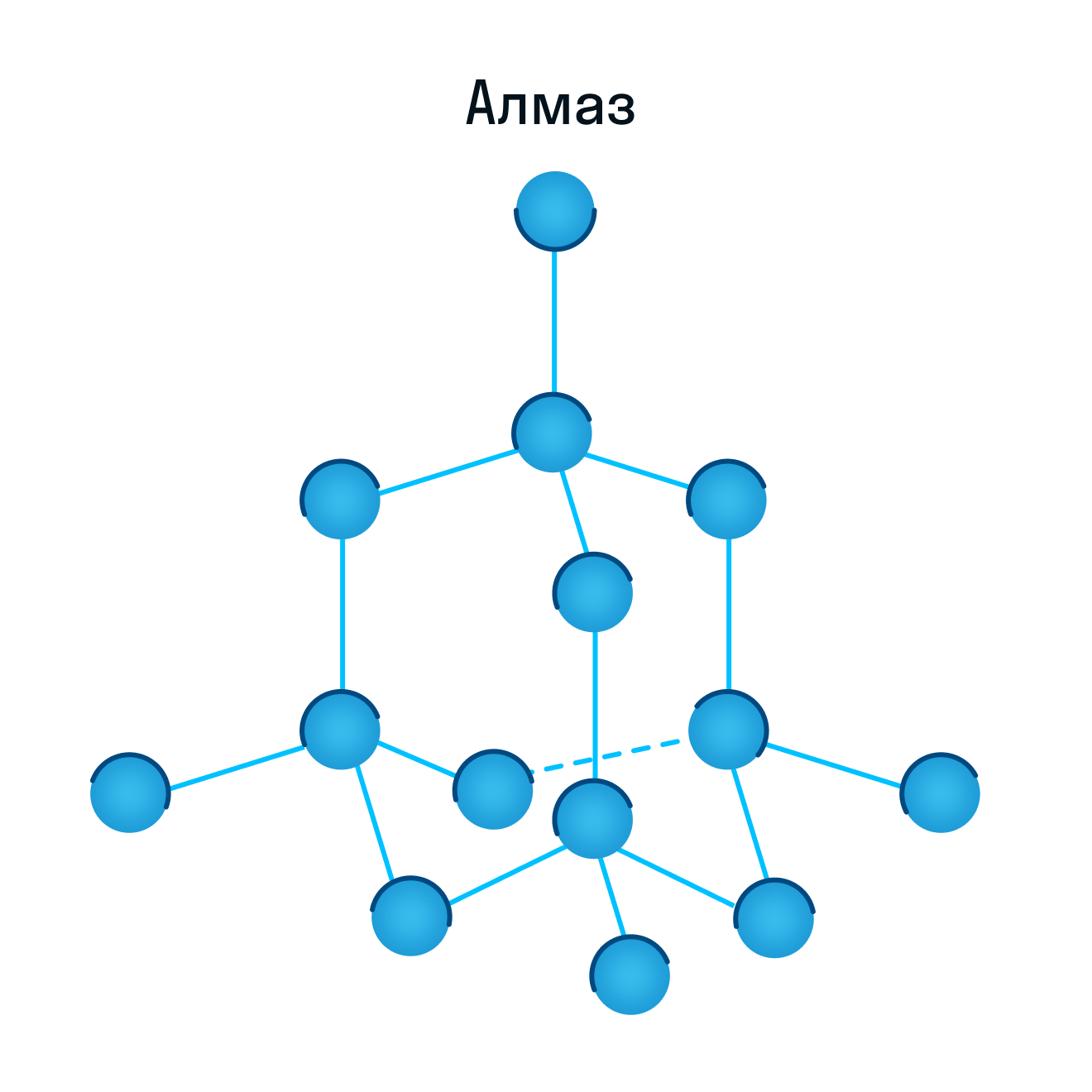
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
у некоторых — наличие запаха.
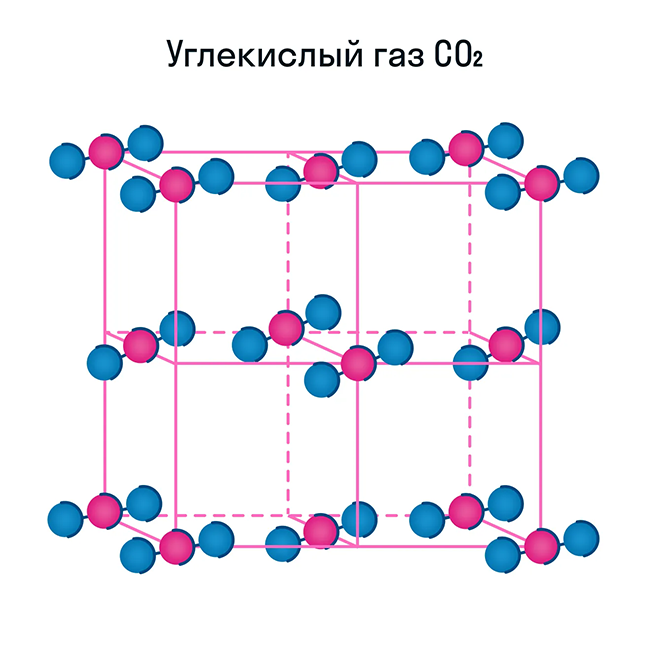
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
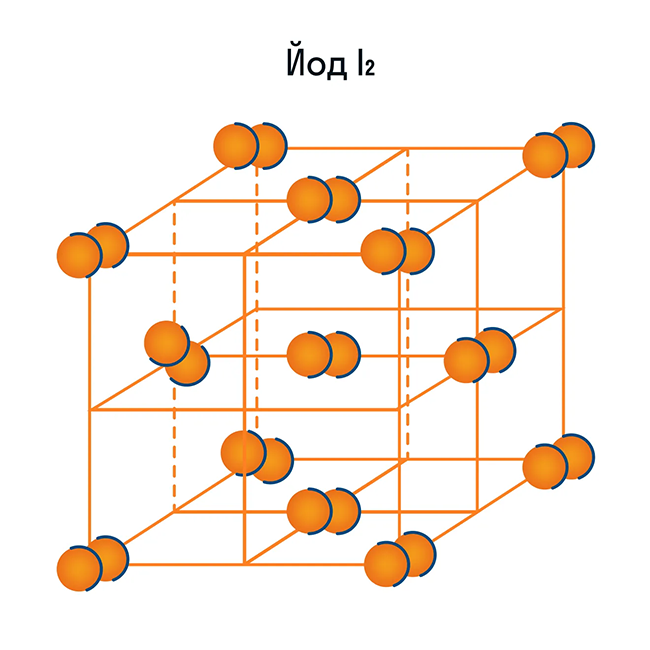
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
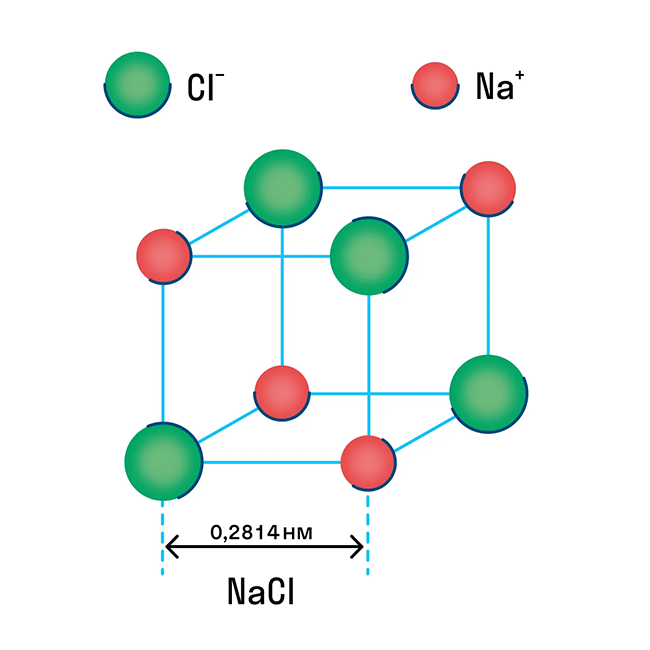
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
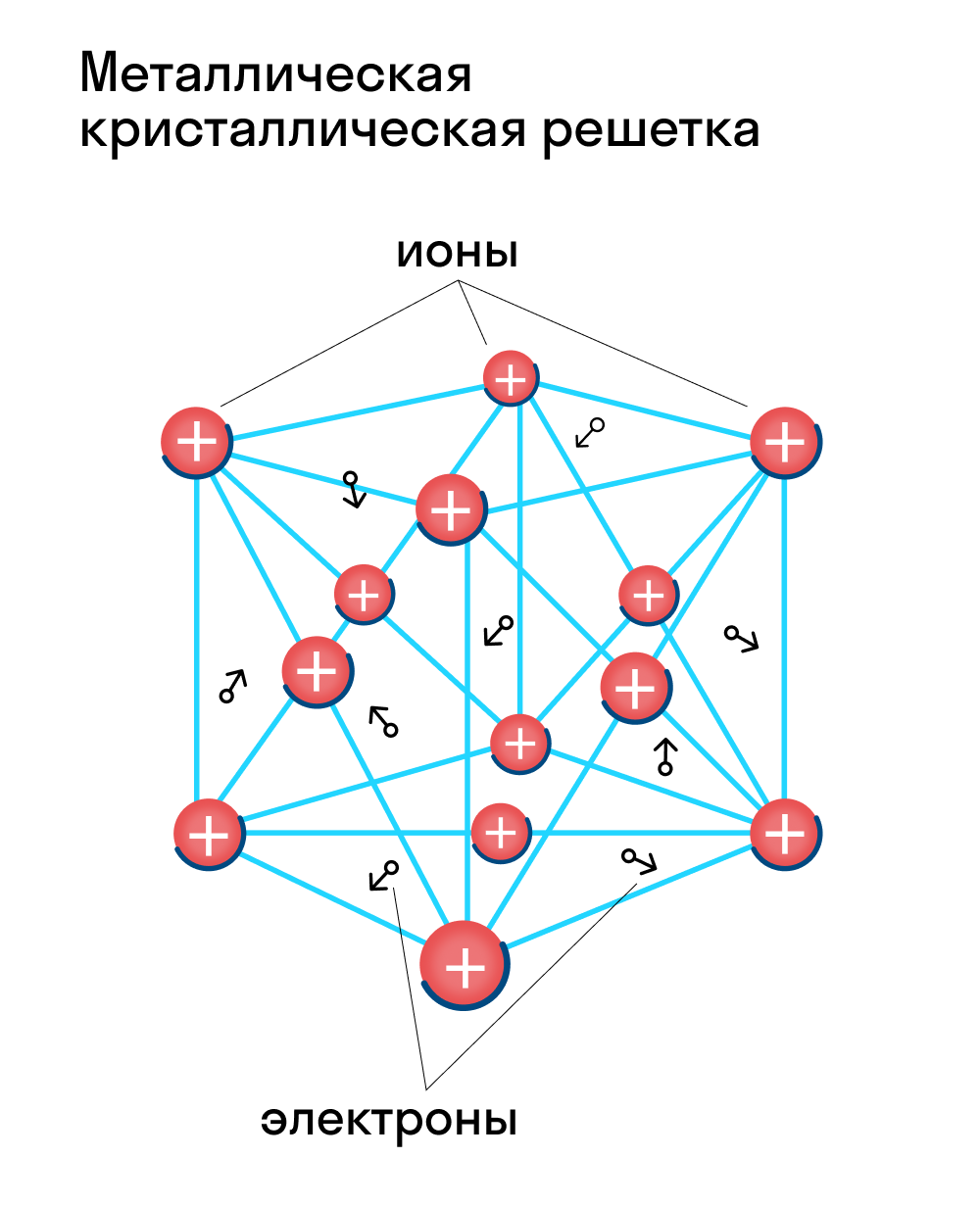
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Химическая связь

Какая сила удерживает вместе атомы в молекуле вещества и почему они не разбегаются в разные стороны? Эта сила называется химической связью, школьники узнают о ней в 8 классе. Еще Ньютон предположил, что она имеет электростатическую природу, но подробнее в этом разобрались лишь в начале ХХ века. Сейчас расскажем, что такое химическая связь и какой она бывает.
Химическая связь и строение вещества
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
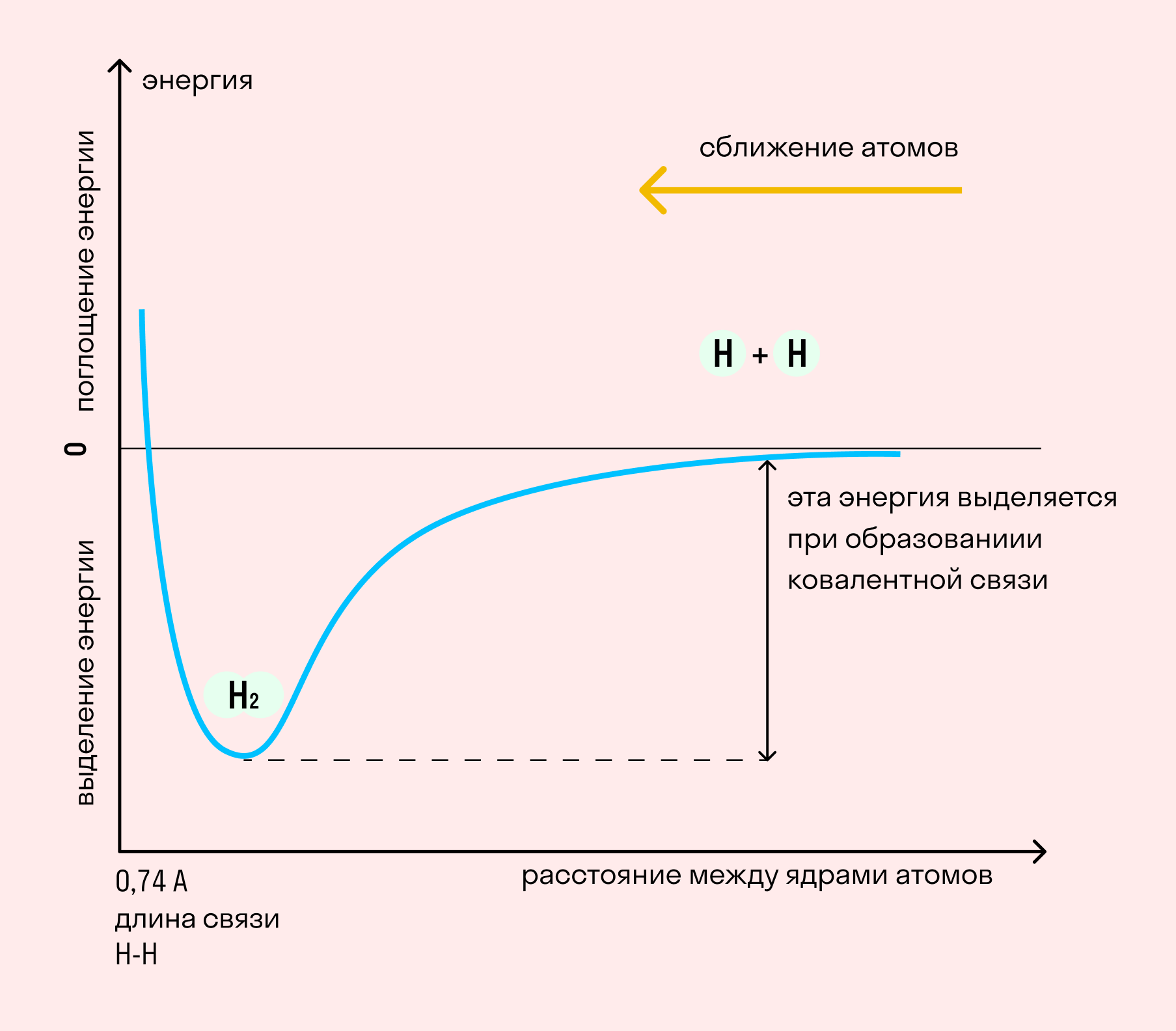
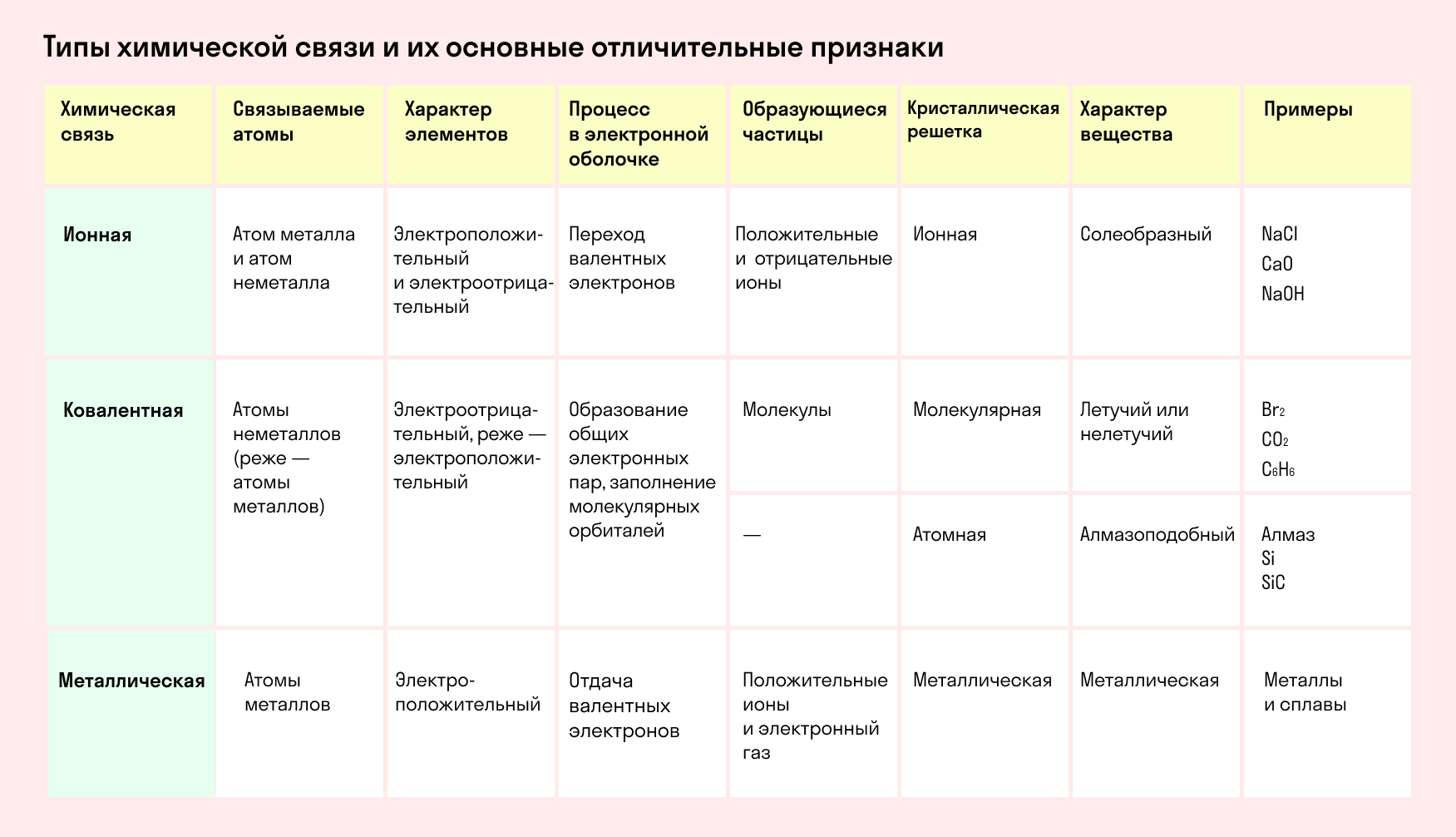
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
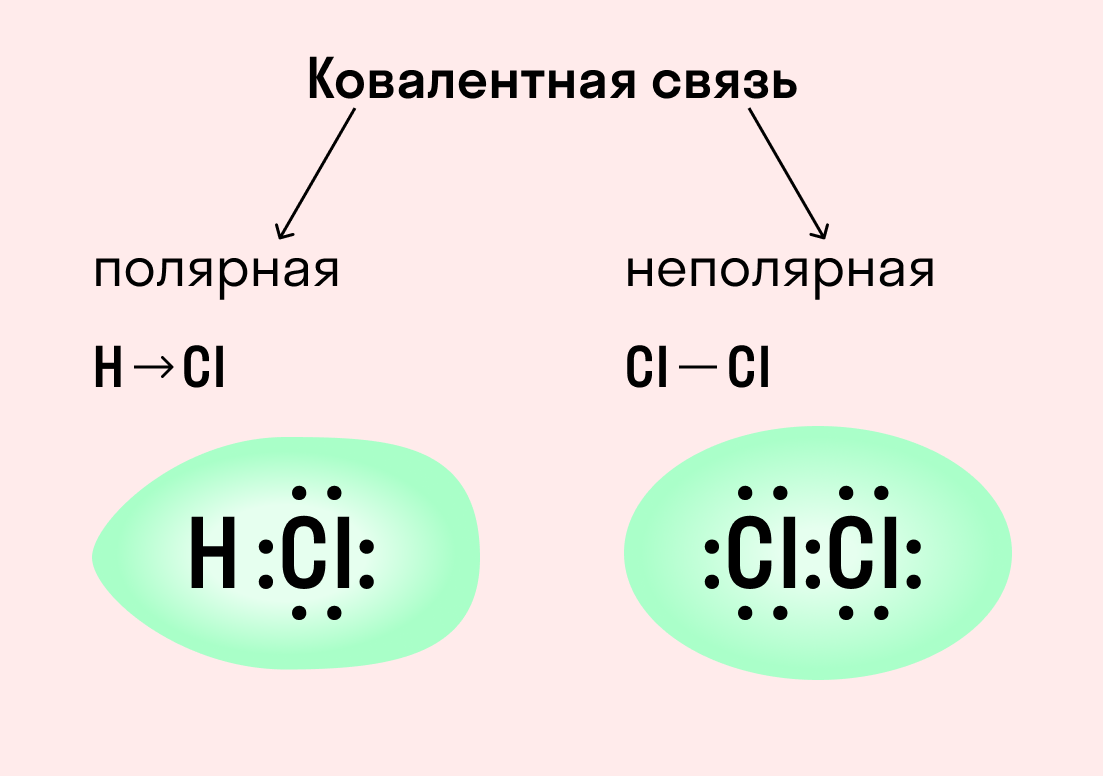
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
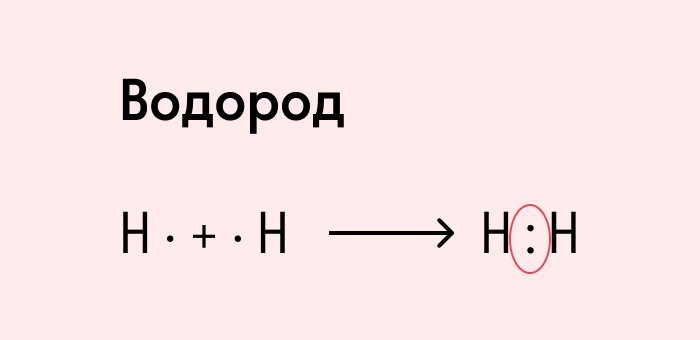
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
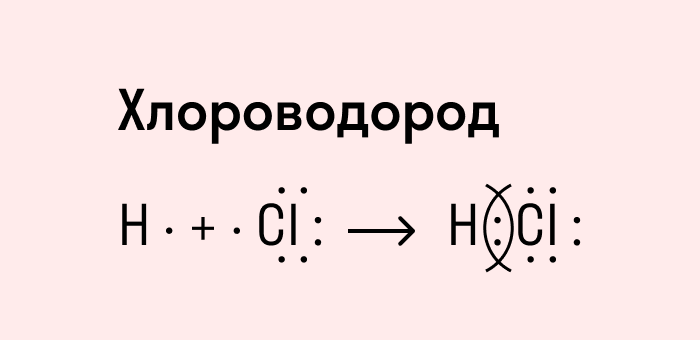
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
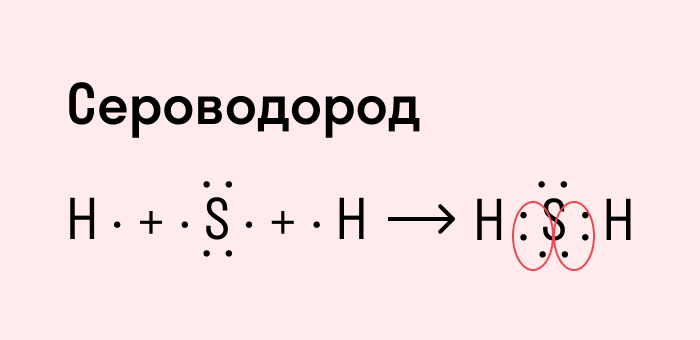
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
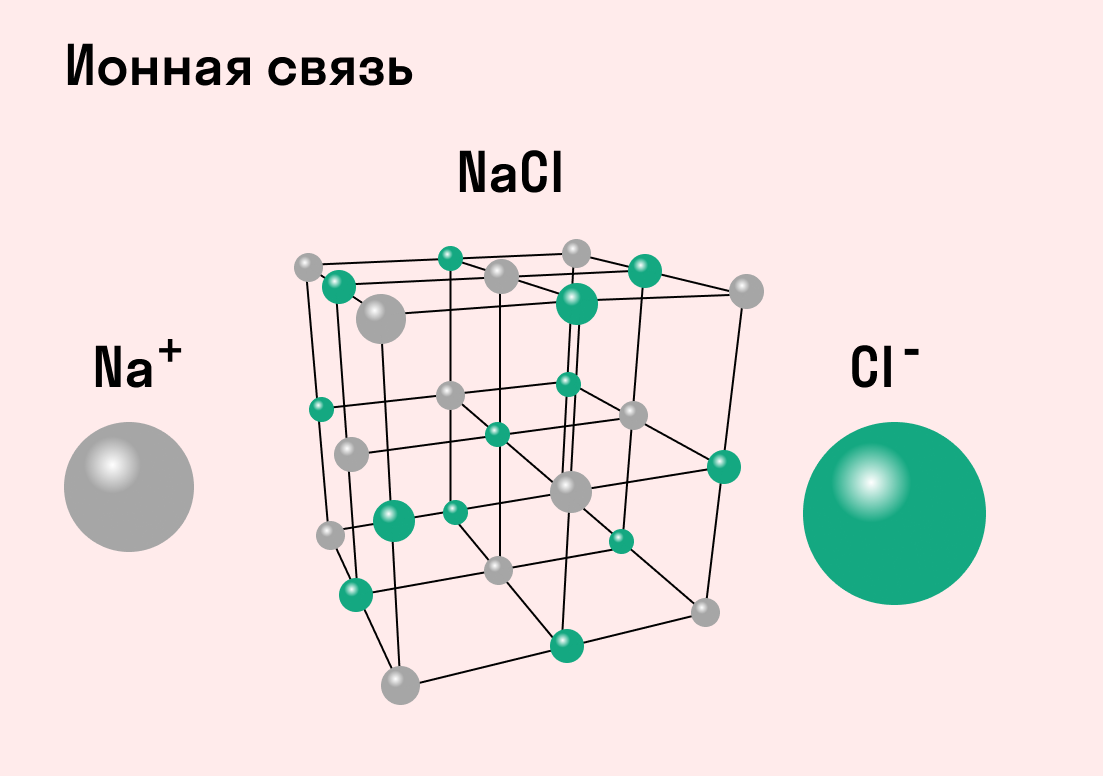
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.

Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
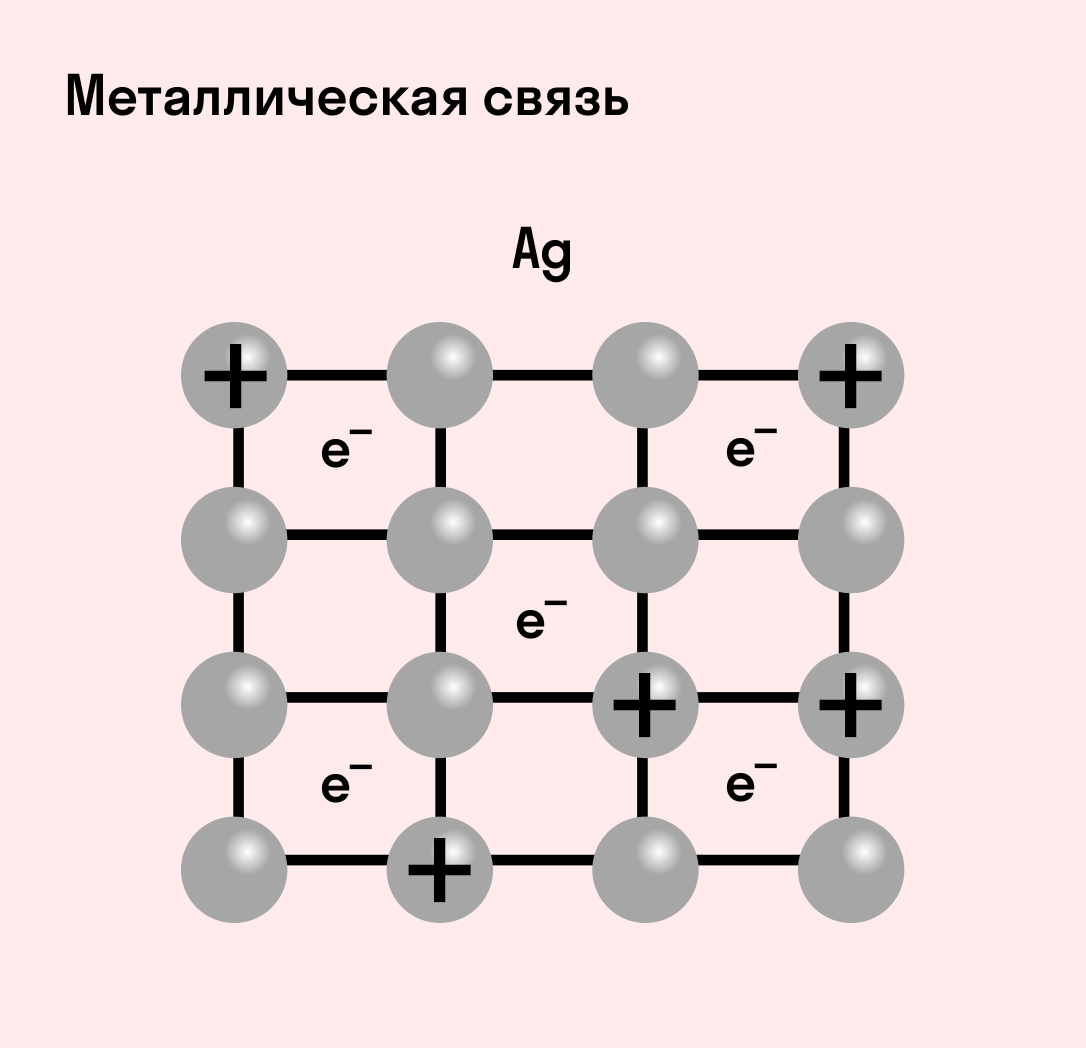
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Водородная связь
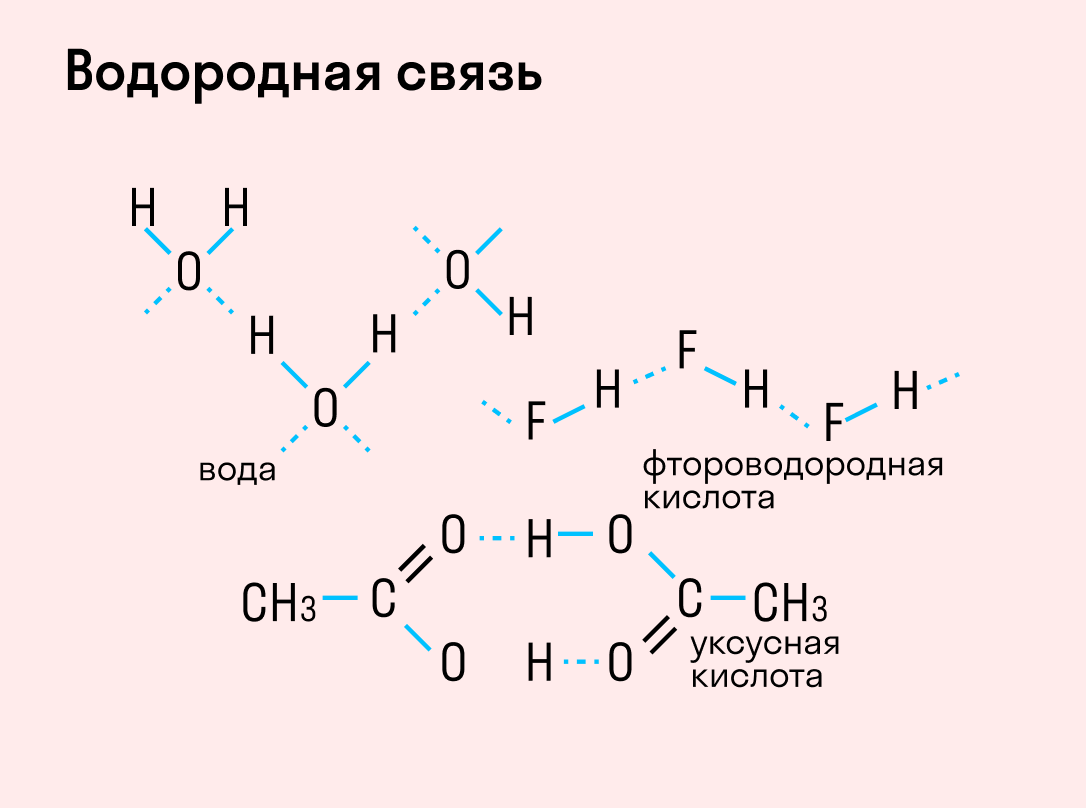
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т. д.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Читайте также:
