Ионы металла и гидроксид ионы образуются при диссоциации
Обновлено: 27.09.2024
1. Электролиты и неэлектролиты. Электролитическая диссоциация.
2. Сильные и слабые электролиты. 3. Степень электролитической диссоциации. 4. Кислоты как электролиты. 5. Основания как электролиты. 6. Соли как электролиты.
1. Электролиты и неэлектролиты. Электролитическая диссоциация.
П о способности проводить электрический ток в водном растворе или расплаве вещества подразделяют на электролиты и неэлектролиты.
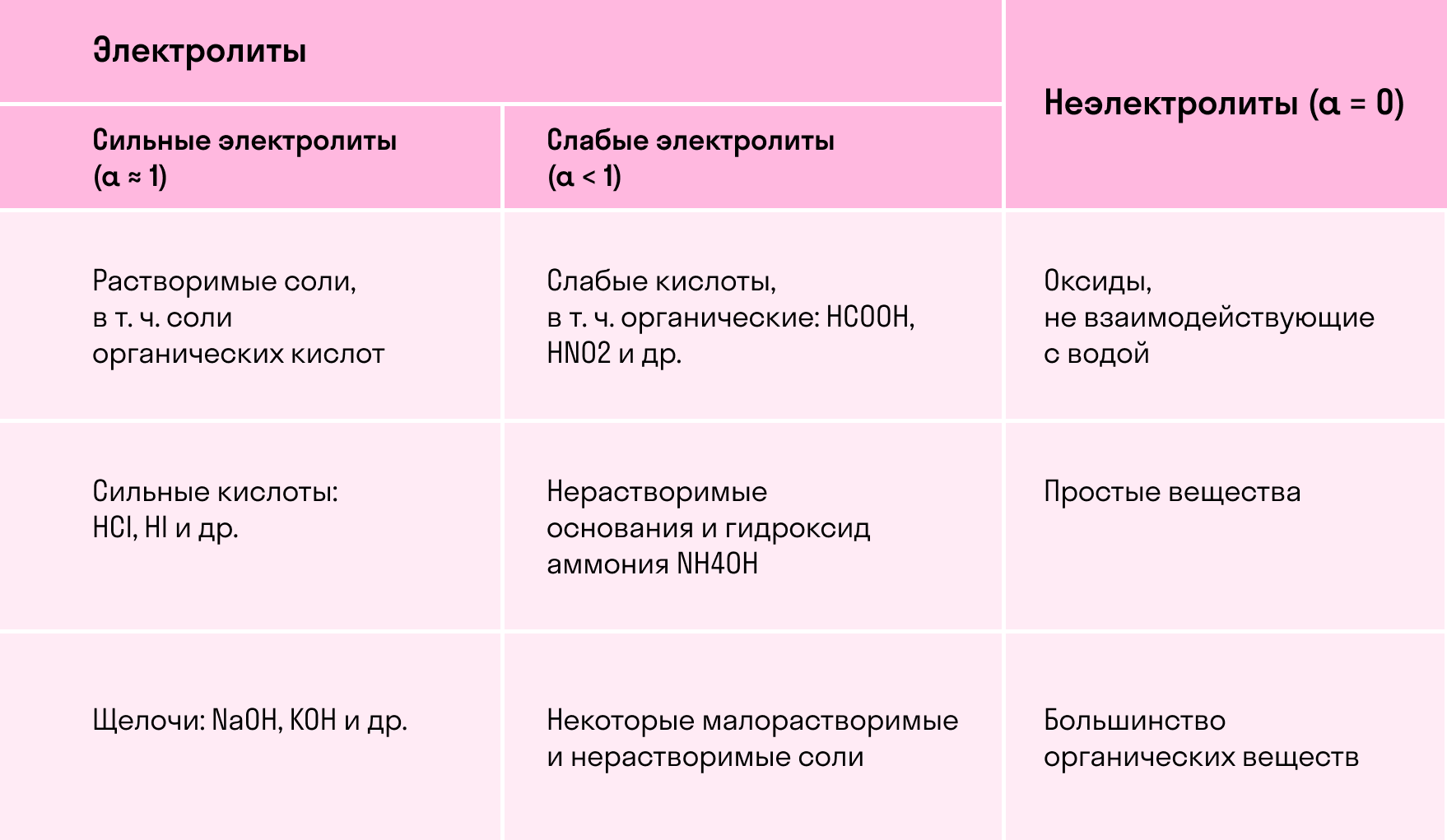
Электролиты — это вещества, растворы или расплав которых проводят электрический ток (обладают ионной проводимостью ). Это соли, кислоты, основания. В электролитах имеются ионные или ковалентные сильнополярные связи.
Неэлектролиты — это вещества, растворы и расплавы которых, не проводят электрический ток (не обладай ионной проводимостью), например простые вещества неметаллы, их оксиды, многие органические вещества (эфир, углеводы, бензол и др.). В молекулах этих веществ ковалентные неполярные или малопол яр ные связи.
Электролитическая диссоциация — это распад электролита на ионы при его растворении или расплавлении.
2. Сильные и слабые электролиты.
В зависимости от степени полярности связи в электролите, процесс электролитической диссоциации может быть необратимым или обратимым.
Диссоциация в воде ионных соединений и веществ с ковалентными сильнополярными связями является необратимым процессом (=):
Ва(ОН)2 = Ва 2+ + 2ОН - НС1 = Н + + С l - Na 2 S = 2 Na + + S 2-
Сильные электролиты – вещества, полностью (100%) диссоциирующие на ионы (в водном растворе сильного электролита находятся только его гидратированные ионы, молекул нет).
- многие неорганические кислоты : HN О 3 , H2S04, H2Se04, HClO3, НС I04 , HBr О 3 , HIO3, HMn О 4 , HCl, HBr, HI; НС 1 = Н + + С l - ; H2S04 = 2 Н + + S04 2-
- гидроксиды щелочных, щелочно-земельных металлов и таллия( I ): NaOH , Ca ( OH )2, TlOH . NaOH = Na + + OH - ; Ca ( OH )2 = Ca 2+ + 2 OH -
Диссоциация веществ с менее полярной связью является обратимым процессом:Слабые электролиты – вещества, частично диссоциирующие на ионы (раствор слабого электролита содержит как исходные молекулы, так и продукты диссоциации — гидратированные ионы).
Слабыми электролитами являются (все остальные вещества):
♦ почти все органические кислоты и вода; Н2О = Н + + ОН -
♦ некоторые неорганические кислоты: HF , НС lO , НС1O2, HNO 2 , HCN , H 2 S , HBrO , H 3 P О4, H 2 C О3, H 2 Si 03, H 2 S 03 и др.;
♦ некоторые нерастворимые гидроксиды металлов: F e (ОН)3, Zn ( OH )2 и др., а также гидрат аммиака NH 3 • Н2О.
3. Степень электролитической диссоциации.
Количественной характеристикой диссоциации слабых электролитов служит степень диссоциации электролит ( а) — отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул электролита. Степень диссоциации выражают в долях единицы или процентах:
Степень диссоциации можно выразить и через отношение количества вещества, распавшегося на ионы ( V дис ), к общему количеству вещества растворенного электролита ( Vo 6щ ):
Степень диссоциации зависит от природы электролита и растворителя, а также от концентрации. Так, при разбавлении раствора уксусной кислоты ее степень диссоциации увеличивается:
♦ с (моль/л): 1 0,1 10 -2 10 -3 10 -4
♦ а (%): 0,40% 1,36% 4,20% 12,60% 34,30%
Степень диссоциации слабых электролитов, за исключением воды, практически не зависит от температуры. Степень диссоциации воды с повышением температуры возрастает. Степень электролитической диссоциации некоторых слабых электролитов в 0,1 М водных растворах.
СН 3 СООН
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами:
CH 3 COOH H + + CH 3 COO -
4. Кислоты как электролиты.
В состав каждой кислоты входят атомы водорода и кислотные остатки. Поэтому при диссоциации любой кислоты в растворе образуются в качестве катионов только кислотных остатков: HCl = H + + Cl - Примеры кислот (наизусть).
В свете представлений об электролитической диссоциации кислоты – это электролиты, которые при диссоциации в водных растворах в качестве катионов отщепляют только ионы водорода.
Теперь запишем уравнения диссоциации этих кислот ( HCl – сильная кислота, HNO 2 - слабая кислота)
HCl = H + + Cl - HNO2 = H + + NO2 -
Многоосновные кислоты диссоциируют постепенно: сначала отщепляется один ион водорода Н + , затем второй и т.д. В результате этого первоначально образуется анион с отрицательным зарядом – 1, затем с зарядом – 2 и т.д. Такую диссоциацию называют ступенчатой и выражают несколькими уравнениями.
Например, рассмотрим диссоциацию сернистой кислоты:
Первая ступень диссоциации (отщепление одного иона водорода Н + от нейтральной молекулы и образование гидросульфит – иона):
H 2 SO 3 H + + HSO 3 -
Вторая ступень диссоциации (отщепление одного иона водорода Н + от аниона HSO 3 - и образование сульфит – иона):
HSO 3 - H + + SO 3 2-
Число ступеней диссоциации зависит от основности кислоты, т.е. от числа атомов водорода в молекуле кислоты. Задание : написать диссоциацию фосфорной кислоты.
Диссоциация кислот по первой ступени протекает сильнее, чем по второй, а по второй – сильнее, чем по третьей и т.д. Связано это с тем, что отщепление положительно заряженного иона Н + от нейтральной молекулы кислоты происходит легче, чем от отрицательно заряженных анионов. Чем выше заряд аниона, тем труднее преодолеть положительно заряженному иону Н + его притяжение.
Растворы всех кислот имеют некоторые общие свойства, обусловленные наличием в водных растворах ионов водорода (анионы в этом отношении значения не имеют). Так, кислый вкус ионов водорода Н + мы ощущаем, когда употребляем пищу, приправленную уксусом (раствор уксусной кислоты), лимоны также имеют кислый вкус за счет ионов водорода Н + , которые отщепляют молекулы лимонной кислоты. Поэтому ион водорода Н + является носителем кислотных свойств.
Следовательно, свойства кислот, которые они проявляют в водных растворах, - это свойства ионов Н + .
5. Основания как электролиты.
В состав каждого основания входят ионы металлов и гидроксид-ионы. Поэтому при диссоциации любого основания в растворе образуются в качестве катионов различные ионы металлов, а в качестве анионов только гидроксид-ионы:
NaOH = Na + + OH - KOH = K + + OH -
В свете представлений об электролитической диссоциации основания – это электролиты, которые при диссоциации в водных растворах в качестве анионов отщепляют только гидроксид-ионы.
Слабые многокислотные основания диссоциируют ступенчато . Например, составим уравнения диссоциации двухкислотного основания – гидроксида магния.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН - ):
Mg ( OH )2 MgOH + + ОН -
Вторая степень диссоциации (отщепляется гидроксид-ион от катиона MgOH + ):
MgOH + Mg 2+ + OH +
Диссоциация многокислотных оснований, как и многоосновных кислот, преимущественно протекает по первой ступени.
Число ступеней диссоциации определяется кислотностью слабого основания, т.е. числом гидроксид-ионов ОН - .Задание : написать диссоциацию гидроксида железа ( III )
Общие свойства оснований (мылкость, разъедание растительных, животных тканей и др.), проявляющиеся в водных растворах, обусловлены только гидроксид-ионами, которые образуются при диссоциации (катионы при этом значения не имеют). Поэтому гидроксид-ион является носителем основных (щелочных) свойств.
Таким образом, свойства оснований, которые они проявляют в водных растворах, - это свойства гидроксид-ионов ОН - .
6. Соли как электролиты.
В состав каждой соли входят ионы металлов и ионы кислотных остатков. Соли бывают средние, кислые и др.
Средние соли – это электролиты, которые при диссоциации образуют катионы металлов и анионы кислотных остатков.
Средние соли практически полностью диссоциируют на ионы в одну ступень, образуя в качестве катионов ионы различных металлов, а в качестве анионов – ионы различных кислотных остатков.
Составим уравнение диссоциации средних солей карбоната натрия Na 2 CO 3 и сульфата железа ( III ) Fe 2 SO 4 (сильных электролитов):
Кислые соли содержат в кислотном остатке атомы водорода Na Н CO 3 , Fe (Н SO 4 )2. В отличие от средних кислые соли диссоциируют ступенчато.
Первая ступень диссоциации сопровождается образованием катиона металла и аниона кислотного остатка, содержащего ион водорода:
Вторая ступень диссоциации (отщепление катиона водорода Н + от аниона Н CO 3 - ):
Н CO 3 - Н + + CO 3 2-
Следовательно, при диссоциации кислой соли в растворе образуются два вида положительных ионов: катионы металла и катионы водорода – и два вида отрицательных ионов: кислотные остатки, содержащие ионы водорода (Н CO 3 - ) и не содержащие их ( CO 3 2- ).
Напишите, пожалуйста, правила для уравнений диссоциации веществ. Или ссылку киньте, пожалуйста.
При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации) .
Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией) .
Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы к общему числу молекул, введенных в раствор .
Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4 → Н (+) + Н2РО4(-)(первая ступень)
Н2РО-4→ Н (+) + НРO4(2-) (вторая ступень)
НРО2-4→ Н (+) PО4(З-) (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например: KOH→ K(+) + OH(-)
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп) . Например, NН4ОН - однокислотное основание, Са (ОН) 2 - двухкислотное, Fе (ОН) 3 - трехкислотное и т. д. Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН) 2 ↔Са (ОН) + + OH(-) (первая ступень)
Ca(OH)(+) ↔Ca(2+)+OH(-) (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ.
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением
2ОН (-) + Zn(2+) + 2Н2О ↔ Zn(ОН) 2 + 2Н2О ↔ [Zn(ОН) 4](2-)+ 2Н (+)
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония NH4(+) и анионы кислотных остатков.
Кислые и основные соли диссоциируют ступенчато.
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода KHSO4 ↔ K(+) + HSO4(-) а затем: HSO4(-)↔ H(+)+SO4(2-)
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg(OH)Cl ↔ Mg(OH)(+)+Cl(-) и потом
Mg(OH)(+) ↔ Mg(2+)+OH(-)
Теорию электролитической диссоциации изложил С. Аррениус.
Удачи!
Урок" Теория электролитической диссоциации. Сильные и слабые электролиты. Константа диссоциации. Реакции ионного обмена".
Основные положения теории электролитической диссоциации. Кислоты, основания и соли с точки зрения ТЭД. Условия течения реакций ионного обмена до конца.
Писать уравнения диссоциации кислот, оснований и солей. Определять реакции ионного обмена, идущие до конца.
Оснащенность: компьютерная презентация «Теория электролитической диссоциации», таблица растворимости кислот, солей и оснований, дидактические материалы.
Оборудование: формулы веществ, опорные схемы; таблица растворимости, Na2 СО3, HС l , Na ОН, Fe 2 ( SO 4 )3, пробирки.
План проведения занятий
1. Организационный момент
2.Актуализация
• Скорость химической реакции зависит от природы реагирующих веществ.
• Скорость химической реакции зависит от концентрации реагирующих веществ.
• Скорость химической реакции зависит от температуры.
• Скорость химической реакции зависит от площади поверхности соприкосновения реагирующих веществ.
• Скорость химической реакции зависит от катализатора.
• Процесс распада электролита на ионы называется -гидротация
3.Мотивация занятия
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов. Сложные физико-химические процессы в организмах человека, животных и растений протекают в растворах. В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации.
3. Объяснение нового материала
1. Основные положения теории электролитической диссоциации
2. Кислоты, основания и соли с точки зрения ТЭД
3. Условия течения реакций ионного обмена до конца
1. Основные положения теории электролитической диссоциации
В первой половине 19 в. М. Фарадей ввел понятие об электролитах и неэлектролитах.
Электролиты – вещества, водные растворы или расплавы которых проводят электрических ток.
Неэлектролиты – вещества, водные растворы или расплавы которых не проводят электрический ток
К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи
К неэлектролитам относятся вещества, в молекулах которых имеются ковалентные неполярные или малополярные связи. Например, кислород, водород, многие органические вещества – глюкоза, сахароза, бензол, эфиры и др.
Для объяснения электропроводности растворов и расплавов солей, кислот, оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.). Представления о диссоциации электролитов получили развитие в работах русских химиков И.А.Каблукова и В.А. Кистяковского. Они применили к объяснению процесса электролитической диссоциации химическую теорию растворов Д.И. Менделеева.
1.Все вещества по их способности проводить электрический ток в растворе делятся на электролиты и неэлектролиты.
___________________________- 1.водные растворы проводят эл.ток;
2.вещества с ионной и ковалентной полярной сязью;
3.Все растворимые кислоты, основания (щёлочи) и соли
___________________________- 1. водные растворы не проводят эл. ток);
2. вещества с ковалентной неполярной и слабополярной связью.
3.Все простые вещества, все оксиды и н/р кислоты, основания и соли.
Задание №1 Убери лишнее (неэлектролиты). Работа в в парах ( каждый неэлектролит 1 балл)
2.В растворах электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
___________________________________________________- процесс распада электролита на ионы.


Механизм диссоциации электролитов:
Вещества с ионной связью Вещества с ковалентной связью
Задание №2: (каждый правильный ответ 1 балл)
1.Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам: KCl , O 2 , HNO 3 , CuO .
2.Назовите из перечня веществ электролиты (не забудьте воспользоваться таблицей растворимости !): BaCl 2 , CaO , H 2 SO 4 , NaOH , Cl 2 , Zn ( OH ) 2
2. Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
__________________- электролиты, которые при диссоциации образуют только один вид анионов - гидроксид-ионы ОН - .
___________________- электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н +
_____________________- сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Задание № 3 Закончить уравнения диссоциации. (каждое верное уравнение 1 балл)
Теория электролитической диссоциации
Раствор хлорида натрия хорошо проводит электрический ток, но в сухом виде кристаллики поваренной соли ток не проводят. Почему? На этот вопрос отвечает теория электролитической диссоциации, которую мы сейчас рассмотрим. Впервые ее описал шведский ученый Сванте Аррениус. Электролитическую диссоциацию изучают в рамках курса химии за 9 класс.
О чем эта статья:
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K + (катион) + A - (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na + + Cl - .
Иногда можно встретить выражение «теория электрической диссоциации», но так говорить не стоит. В этом случае можно подумать, что распад молекул на ионы обусловлен действием электротока. На самом деле процесс диссоциации не зависит от того, проходит ток в данный момент через раствор или нет. Все, что нужно — это контакт электролита с водой (растворителем).
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na + и анионами хлора Cl - , которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
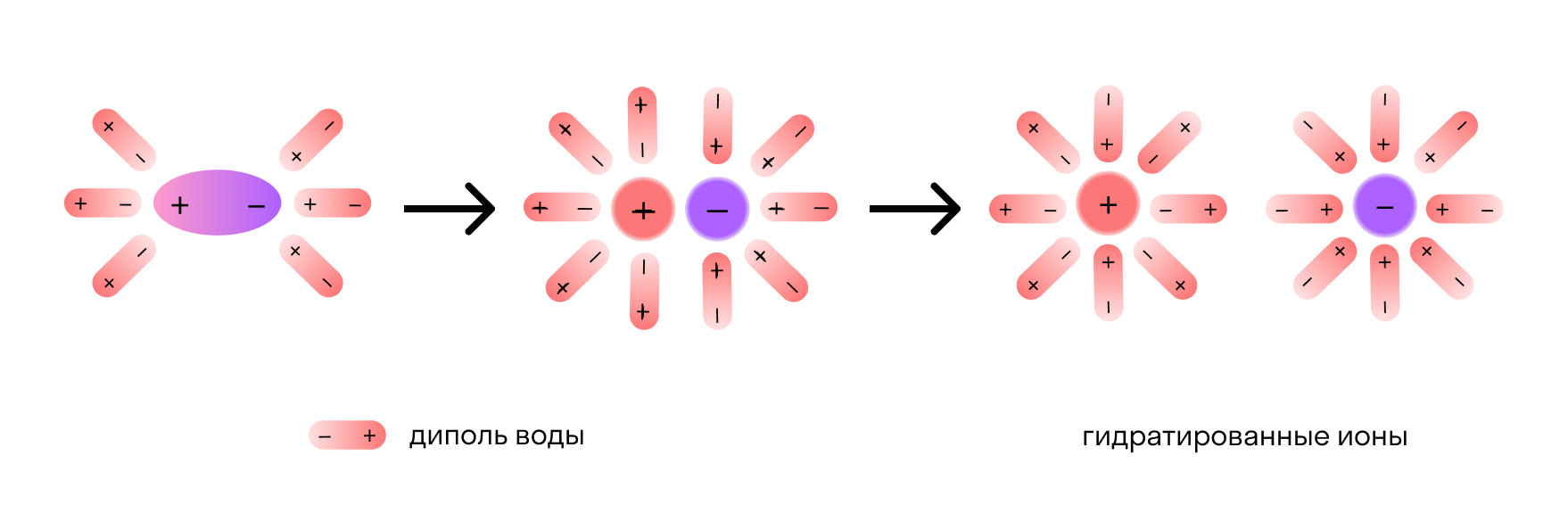
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
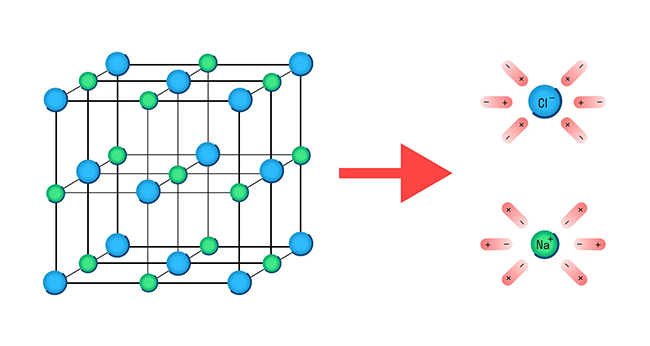
После распада хлорида натрия образовавшиеся ионы Na + и Cl - окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
Электролиты и неэлектролиты
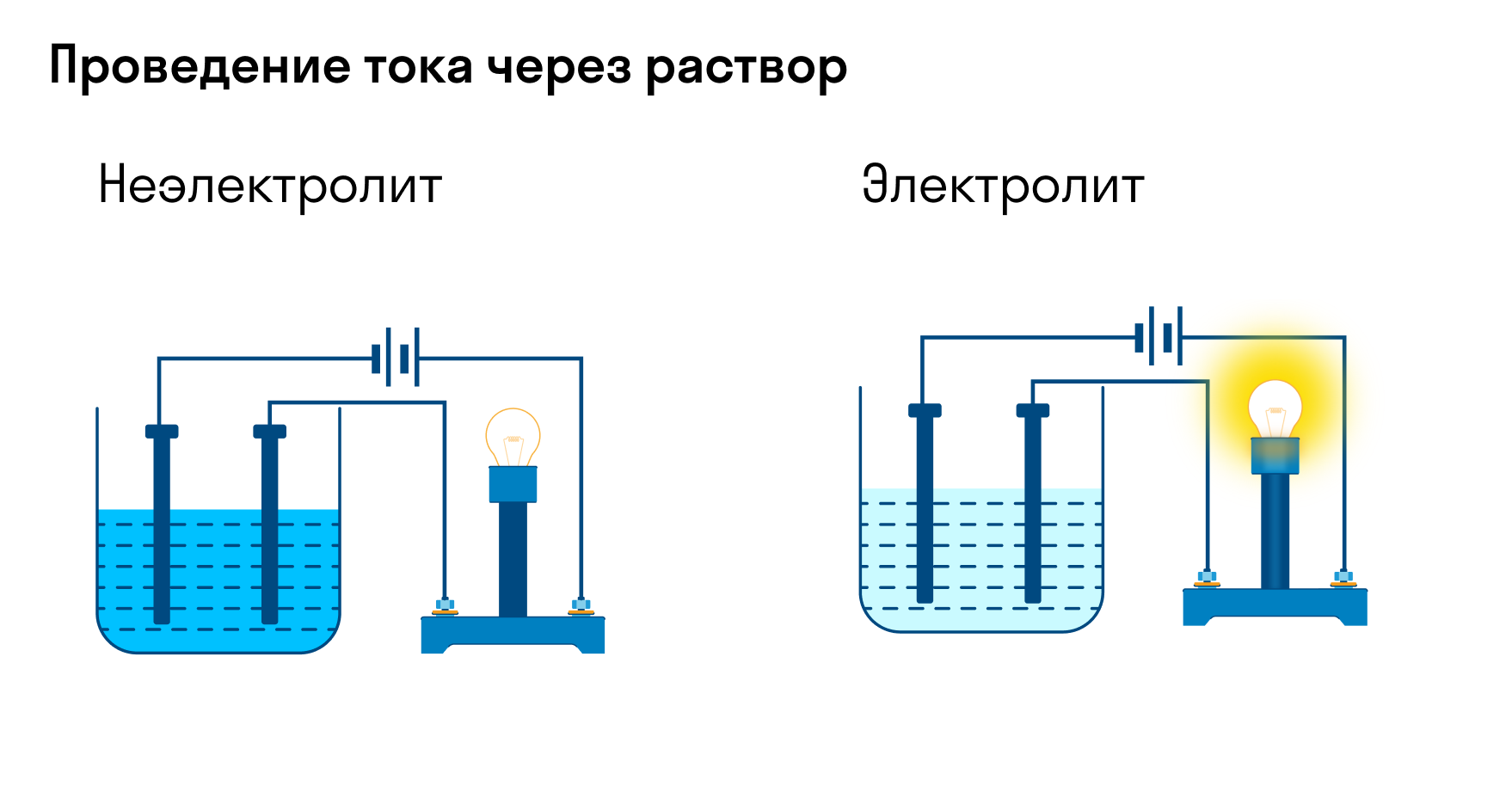
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =. Реакции со слабыми электролитами обратимы, поэтому ставится знак ⇄.
Ступенчатая диссоциация
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3 - и слабый электролит, поэтому реакция обратима.
Как диссоциируют разные группы веществ
Диссоциация кислот
Приводит к образованию катионов водорода H + и отрицательно заряженных кислотных остатков:
Многоосновные кислоты диссоциируют ступенчато:
AlOHCl2 = AlOH 2+ + 2Cl -
AlOH 2+ ⇄ Al 3+ + OH -
Диссоциация оснований
Происходит с образованием гидроксильных групп OH - и положительно заряженных ионов металла. Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные основания:
Слабые основания:
CuOH + ⇄ Cu 2+ + OH -
Диссоциация солей
Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков.
Средние соли в растворах полностью распадаются в одну ступень.
Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода.
Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH - .
MgOHBr = MgOH + + Br -
MgOH + ⇄ Mg 2+ + OH -
Молекулярное, полное и сокращенное ионные уравнения
С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы. Полные ионные уравнения отражают реакцию диссоциации, т. е. расщепление молекул на ионы. Но в таком виде расписывают только сильные электролиты.
Не раскладывают на ионы:
Рассмотрим это на примере взаимодействия между нитратом свинца и серной кислотой.
Сульфат свинца PbSO4 мы не будем раскладывать на ионы, поскольку это слабый электролит.
Полное ионное уравнение: Pb 2+ + 2NO3 - + 2H + + SO4 2- → 2H + + 2NO3 - + PbSO4↓
Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции.
Сокращенное ионное уравнение: Pb 2+ + SO4 2- → PbSO4↓
Как составить уравнение диссоциации
В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов. Между ними ставим знак =, если это сильный электролит, или знак ⇄ — если средний или слабый. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов (она всегда равна 0).

Основные положения теории электролитической диссоциации
Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:
При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.
Под действием электротока катионы перемещаются к положительно заряженному электроду, анионы — к отрицательно заряженному. Раствор электролита обладает проводимостью.
Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция.
Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
Вопросы для самопроверки
Чем электролиты отличаются от неэлектролитов? Приведите примеры тех и других веществ.
Согласно теории диссоциации что является причиной распада электролитов на ионы?
Что такое степень диссоциации и как она измеряется?
В каких случаях электролитическая диссоциация кислот бывает ступенчатой?
При каких условиях в уравнении диссоциации ставится знак =, а при каких — знак ⇄?
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)

Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В процессе развития химии понятия «кислота» и «основание» претерпели серьёзные изменения. С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых образуются ионы водорода H + , а основаниями — электролиты, при диссоциации которых образуются гидроксид-ионы OH – . Эти определения в химической литературе известны как определения кислот и оснований по Аррениусу.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Такие свойства кислот, как взаимодействие с металлами, основаниями, основными и амфотерными оксидами, способность изменять окраску индикаторов, кислый вкус и т. д., обусловлены наличием в растворах кислот ионов H + . Число катионов водорода, которые образуются при диссоциации кислоты, называют её основностью. Так, например, HCl является одноосновной кислотой, H2SO4 — двухосновной, а H3PO4 — трёхосновной.
Многоосновные кислоты диссоциируют ступенчато, например:
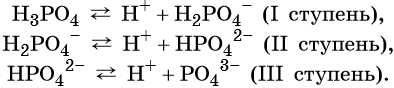
От образовавшегося на первой ступени кислотного остатка H2PO4 – последующий отрыв иона H + происходит гораздо труднее из-за наличия отрицательного заряда на анионе, поэтому вторая ступень диссоциации протекает гораздо труднее, чем первая. На третьей ступени протон должен отщепляться от аниона HPO4 2– , поэтому третья ступень протекает лишь на 0,001%.
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Такие свойства оснований, как взаимодействие с кислотами, кислотными оксидами, амфотерными гидроксидами и способность изменять окраску индикаторов, обусловлены наличием в растворах OH – -ионов.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
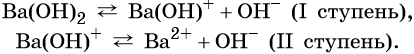
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
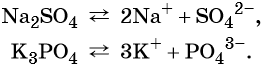
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
10. Степень диссоциации слабых электролитов
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия
Читайте также:
