Ионы металлов как кофакторы ферментов
Обновлено: 04.10.2024
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Термин. "кофермент" был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора - кофермента. Белковая часть получила название "апофермент", который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
А. Кофакторы
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn 2+ , Fe 2+ , Mn 2+ , Cu 2+ . Ионы щёлочно-земельных металлов, такие как Na + и К+ , не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза - цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
Ион Zn 2+ в результате электрофильной атаки участвует в образовании Н + и ОН - ионов из молекулы воды:
Протон и гидроксйльная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты.
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях - работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С
За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди
Фермент, содержащий ион Сu 2+ , не вступает в реакцию с молекулой кислорода. При восстановлении Си 2+ до Си + с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD + , NADP + .
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
-гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
-нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
-убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
-фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
-S-аденозилметионин (SAM) - донор метильной группы;
-глутатион, участвующий в окислительно-восстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
Водораствор витамины являются энзимовитаминами, то есть выполняют коферментные функции в составе ферментов. Проявления и механизмы гиповитаминозов по различным энзимовитаминам взаимосвязаны и перекрываются, хотя для большинства из них описаны и специфические авитаминозы. Витамин В2, рибофлавин. входит в состав двух коферментов ФМН и ФАД, являющихся компонентами таких ферментов как сукцинатдегидрогеназа, дегидрогеназы жирных кислот, оксидаз аминокислот, МАО, цитохромредуктазы.Витамин В5, РР входит в состав коферментов НАД и НАДФ,которые являются коферментами более ста дегидрогеназ, участвующих в тканевом дыхании, окислении молочной, яблочной, кетоглутаровой, изолимонной кислот, фосфоглицеринового альдегида, жирных кислот и т.п.Витамин В6, пиридоксин Этот витамин в виде коферментов ПАЛФ (пиридоксальфосфата) и ПАМФ(пиридоксаминфосфата) входит в состав ферментов переаминирования, дезаминирования и декарбоксилирования аминокислот. В реакциях с участием пиридоксина, осуществляется всасывание и транспорт аминокислот, балансируется аминокислотный состав организма.Витамин Н, биотин служит коферментом карбоксилаз, таких как пируваткарбоксилаза, ацетил-КоА-карбоксилаза, пропионил-КоА-карбоксилаза. Биотин связывает молекулу углекислого газа и включает его в органическое вещество. Как кофермент витамин Н участвует т в синтезе жирных кислот, стеринов, пуриновых оснований, мочевины, превращении пиовиноградной кислоты в щавелевоуксусную кислоту.Витамин В3, пантотеновая кислота входит в состав кофермента ацетилирования (КоА), который активирует ацетат и ацильные группы, необходимые для синтеза жирных кислот, стеролов, ацетилхолина. Пантотеновая кислота участвует в биосинтезе жирных кислот
Ионы металла - стабилизаторы активного центра фермента
1. Роль металлов в присоединении субстрата
в активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов - стабилизаторы молекулы субстрата
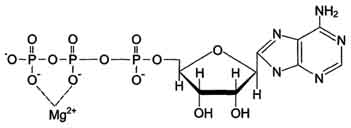
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg 2+ -ATФ. В этом случае ион Mg 2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента (см. схему на с. 84).
Схема
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е - фермент, S - субстрат, Me - ион металла.
В качестве примера можно привести расположение субстратов в активном центре гексокиназы (рис. 2-3).
Гексокиназа катализирует перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
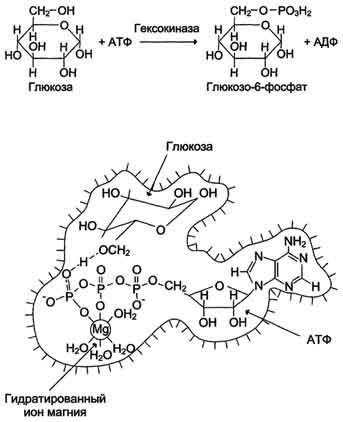
Рис. 2-3. Участие ионов магния в присоединении субстрата в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мд 2+ -АТФ. В результате ферментативной реакции происходит перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.
Ион Mg 2+ участвует в присоединении и "правильной" ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу.
Ионы металла - стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg 2+ , Mn 2+ , Zn 2+ , Co 2+ , Мо 2+ . В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
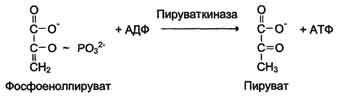
К металлоэнзимам относят, например, фермент пируват киназу (рис. 2-4), катализирующий реакцию:
2. Роль металлов в стабилизации третичной
и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие
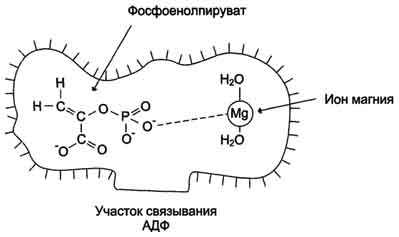
Рис. 2-4. Участие ионов магния в присоединении субстрата в активном центре пируваткиназы. Активный центр пируват-киназы имеет участки связывания для фосфоенолпирувата и АДФ. Мд 2+ участвует в стабилизации активного центра, что облегчает присоединение фосфоенолпирувата. В ходе ферментативной реакции образуется пируват и АТФ.
ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К + .
Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 кД. В состав фермента входят 4 атома Zn 2+ . Удаление Zn 2+ приводит к потере активности фермента за счёт диссоциации на 4 неактивные субъединицы с молекулярной массой 36 кД (рис. 2-5).
3. Роль металлов в ферментативном
катализе
16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере витаминов в6, рр, в2).
Кофакторывыполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур. В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SAM) - донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
Витамин РРвходит в состав кофермента НАД + и НАДФ + , который принимает участие в ферментативных реакциях по последовательному механизму. Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD+, служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода - пример последовательных реакций, продуктом - восстановленная форма NAD, для фермента Е2 - наоборот.
Витамин В5 – принимает участие в синтезе кофермента А (Ацетил-КоА). Кофермент А (КоА) —коферментацетилирования; один из важнейших коферментов; принимает участие в реакциях переносаацильных групп.МолекулаКоА состоит из остаткаадениловой кислоты, связанной пирофосфатной группой с остаткомпантотеновой кислоты, соединённой пептидной связью с остаткомβ-меркаптоэтаноламина.
С КоА связан ряд биохимических реакций, лежащих в основе окисленияисинтезажирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоА действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоА подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
Витамин В2 – принимает участие в формировании кофактора ФАД и ФМН. Флавинадениндинуклеотид —кофактор, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода. Молекула FADH2 является переносчиком энергии и восстановленныйкоферментможет быть использован каксубстратв реакцииокислительного фосфорилированиявмитохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATФ.
Читайте также:
